Method Article
Cuantificación de Acanthamoeba spp. Motilidad
En este artículo
Resumen
Este procedimiento describe cómo visualizar, rastrear y cuantificar Acanthamoeba spp. motilidad.
Resumen
La queratitis por Acanthamoeba es una infección ocular grave que plantea desafíos para el tratamiento y puede provocar ceguera. A pesar de su ubicuidad y la posible contaminación de las lentes de contacto después de la exposición al agua, el comportamiento natural de este patógeno sigue siendo difícil de alcanzar. Comprender los patrones de movimiento de Acanthamoeba puede informarnos sobre cómo coloniza las lentes de contacto y contamina la córnea del paciente. Es una suerte que Acanthamoeba spp. son visibles a través de microscopía de campo claro a partir de un aumento de 4x. Se han desarrollado técnicas previas para cuantificar la motilidad de Acanthamoeba en relación con los efectos citopáticos o la subexposición al campo eléctrico. Aquí, describimos un método para rastrear y cuantificar Acanthamoeba spp. Motilidad a largo plazo (horas a días), que es un protocolo aplicable a múltiples cepas de amebas, superficies y estado nutricional de la ameba. Este procedimiento es pertinente para determinar muchas cuantificaciones de la motilidad central, como la distancia, la velocidad, el confinamiento y la direccionalidad, que son necesarias para monitorear diferentes etapas de infección, proliferación o cambio de comportamiento.
Introducción
La investigación sobre Acanthamoeba ha aumentado drásticamente en los últimos años debido al aumento de la prevalencia de la queratitis por Acanthamoeba (AK), que es una infección parasitaria que sigue a la unión de Acanthamoeba a la córnea1. Si bien los brotes de QA pueden atribuirse a un cuidado inadecuado de las lentes de contacto o a soluciones ineficaces para el cuidado de las lentes de contacto 2,3,4,5, actualmente no existen requisitos para demostrar la eficacia de la desinfección de Acanthamoeba para ningún producto en el mercado. Sin embargo, existe un esfuerzo continuo en la comunidad científica y dentro de las organizaciones de normalización para examinar los protocolos necesarios para cuantificar la eficacia de la desinfección de los productos para el cuidado de las lentes de contacto 6,7. Además, debido a su semejanza en aspectos celulares y funcionales con los macrófagos humanos, se ha observado que Acanthamoeba tiene un papel importante en el alojamiento y la diseminación de otros patógenos humanos8, además de la patogenicidad que aporta la ameba en sí.
Se han descrito técnicas recientes que han sido capaces de cuantificar la motilidad de Acanthamoeba - que generalmente no está muy sujeta al movimiento browniano 9,10 - en lo que respecta a los efectos citopáticos o la subexposición al campo eléctrico 9,11, así como los avances en el análisis de la motilidad en la investigación de virus gigantes utilizando Acanthamoeba como vector viral rastreable 12, 13 de la Constitución. En los últimos 20 años también se han producido mejoras constantes y significativas en el seguimiento de células y partículas utilizando nuevos programas informáticos, como el software de imagen utilizado aquí, y nuevos algoritmos y tecnologías de aprendizaje profundo14. Sin embargo, este es un campo relativamente nuevo y creciente de la ciencia con respecto a la investigación de laboratorio, la aplicación clínica y los estándares industriales, y ha habido una escasez de datos publicados sobre los métodos para visualizar y rastrear esta ameba, particularmente para cuantificar los cambios de comportamiento después de la adherencia a las lentes de contacto o durante o después de la desinfección de las lentes de contacto. Otros campos que se expanden hacia el monitoreo visual a largo plazo han apoyado este esfuerzo 15,16,17. Debido a la naturaleza inherentemente desafiante de Acanthamoeba, que incluye una resistencia general a los plásmidos (que podrían conferir fluorescencia), la capacidad de la ameba para consumir y destruir tintes celulares estándar y una composición de proteína externa única, lo que dificulta el etiquetado de anticuerpos, los métodos disponibles para otras células que los hacen visibles en entornos distintos a las imágenes de campo claro han sido inutilizables en este organismo. Por lo tanto, la cuantificación de la motilidad de esta ameba ha demostrado una adición significativa al campo. Utilizando el método aquí descrito, hemos podido determinar que las amebas permanecen móviles durante al menos 12 h sin nutrientes18 y que las amebas que se enfrentan a un proceso de desinfección y cesan su motilidad durante la desinfección pueden recuperar su motilidad después de la desinfección si no están completamente lisadas19.
Este protocolo detalla cómo rastrear visualmente y cuantificar la motilidad de la ameba microscópicamente. Los pasos principales son grabar amebas en campo claro utilizando el enfoque y el tiempo adecuados entre imágenes, transformar las imágenes en binarias utilizando un software de imágenes y, a continuación, utilizar el complemento de seguimiento de un software de imágenes para establecer los parámetros experimentales y seguir a cada ameba para determinar las mediciones necesarias, como la velocidad, la distancia y el confinamiento. A continuación, es posible cuantificar la quimiotaxis de una ameba o de una población de amebas para definir la direccionalidad. La contribución clave de este método es visualizar y cuantificar el comportamiento de las amebas durante diferentes estados de soporte nutricional, adherencia a la superficie, desafío de desinfección u otras alteraciones ambientales como la cohabitación con el cultivo de células de mamíferos.
Protocolo
1. Preparación de Acanthamoeba
NOTA:Este protocolo ha sido verificado para ATCC 50655, 30872, 50702, 30010, 30461, 50370, 50703, 30137, PRA-115 y PRA-411. Este es un patógeno BSL2 y debe trabajarse dentro de una campana y un laboratorio BSL2.
- Cree un cultivo maestro a partir de un vial de muestra o un tapón20 preparado llenando un matraz T75 con 30 mL de medio AC6 y añadíle asépticamente un tapón o el contenido de un vial de muestra. Incubar el matraz durante 3-5 días a 26-30 °C hasta que el matraz tenga una confluente del 50% al 80%.
- Pasan las células el día antes de que se necesiten para crear una población homogénea de trofozoítos.
- De acuerdo con las necesidades de la cepa, agite y / o golpee enérgicamente el cultivo maestro 2 veces para desalojar los trofozoítos adheridos.
- Llene un matraz T75 con 30 mL de medio AC6. Agregue 2 mL del cultivo maestro al pasaje. Incubar el matraz durante 18-24 h a 26-30 °C.
- Antes de la cosecha, inspeccione visualmente la población de trofozoítos con un aumento de 4x en el microscopio. Asegúrese de que los trofozoítos sean adherentes y uniformes.
- Golpee enérgicamente el matraz 2 veces para desalojar los trofozoítos adheridos. Vierta el contenido en un tubo cónico de 50 ml.
- Gire el tubo a 500 x g durante 5 min en una centrífuga equilibrada para pellet la ameba. Vierta o pipetee el medio sobrenadante y deséchelo. Diluir el pellet en 2-10 mL de 1/4 de solución de Ringer.
- Vórtice la muestra. Añadir 10 μL de muestra a un hemocitómetro desechable y contar las UFC/mL de la Acanthamoeba.
- Según el recuento del hemocitómetro, diluya el pellet de ameba a una concentración de 7,5 x 103 células/ml en 1/4 de solución de Ringer.
- Siembre la ameba en una superficie, que puede ser de vidrio, plástico o agar sin nutrientes, y una variedad de formas de pocillos según las necesidades experimentales como se describe a continuación.
- Placa de 96 pocillos: Siembre cada pocillo con 200 μL de suspensión de Acanthamoeba y encierre la placa con la tapa.
- Plato de 48 pocillos: Siembre cada pocillo con 1 ml de suspensión de Acanthamoeba y encierre el plato con la tapa.
- Celda de flujo: Agregue lentamente 4 mL de suspensión de Acanthamoeba a través de los puertos estériles de una celda de flujo de aluminio estéril, evitando burbujas en la cámara. Cierre los puertos después de haber agregado la suspensión.
- Antes de la toma de imágenes, espere que la ameba se adhiera a la superficie durante al menos 30 minutos antes de iniciar el registro microscópico.
2. Visualización y grabación de Acanthamoeba
- Visualiza la ameba con un aumento de 4x en campo claro. El fondo debe aparecer de color gris claro y la ameba debe ser negra. Ajuste la luz y el enfoque para que las amebas sean ojeras sólidas en lugar de translúcidas (es decir, ligeramente desenfocadas, Figura 1).
NOTA: El aumento óptimo es de 4x para el seguimiento por varias razones: Las amebas que salen o entran en el campo de visión durante el seguimiento no deben incluirse en el análisis de datos, por lo que el aumento más bajo es el mejor para el número máximo de amebas incluidas en el análisis en un período de tiempo. Las amebas deben aparecer como círculos negros sólidos en campo claro para convertirlos en binarios para el análisis de seguimiento. Esto es más fácil de lograr con un aumento más bajo, ya que los aumentos más altos revelan fácilmente la naturaleza translúcida y las estructuras internas de la ameba. En general, se pueden capturar más amebas en un solo campo de visión con un aumento más bajo, lo que permite un análisis de datos más sólido. - Configure los programas de grabación en el software de imágenes para grabar una imagen a intervalos regulares para rastrear a la ameba. El tiempo más largo entre imágenes que permitirá un seguimiento preciso es de 30 s, el tiempo óptimo para el tamaño del archivo y el detalle de seguimiento se sugiere en 12 s o 24 s.
- Las amebas se pueden rastrear durante varios días a la vez, pero tenga en cuenta el tamaño del archivo que creará este tipo de grabación y la dificultad inherente de manipular archivos extremadamente grandes. Para evitar esto, registre las amebas por secciones de tiempo en ciertos intervalos. Por ejemplo, grabe durante 1 h cada 12 h durante 5 días.
- Si el microscopio y el programa lo permiten, registre varios pocillos en una sola sesión utilizando las coordenadas XY de los pocillos de placa o varias ubicaciones de una celda de flujo. Si es necesario, una varias secciones de un pozo o celda de flujo para crear un campo de visión más grande con un aumento de 4x.
NOTA: La única restricción sobre el número de ubicaciones que se pueden registrar es la rapidez con la que la platina del microscopio puede moverse entre ubicaciones dentro del intervalo de tiempo de la imagen (por ejemplo, tomar una imagen cada 12 s, 24 s, etc.). Sin embargo, esto no es necesario, y el seguimiento de vídeos realizados desde una única ubicación puede tener un número suficiente de pistas para un análisis estadístico sólido. En este estudio se utilizó un microscopio Nikon Eclipse Ti-U, y se utilizó la platina móvil automatizada para registrar imágenes en varios pocillos a la vez. Sin embargo, cualquier microscopio con capacidad de registro programable funcionará. El microscopio debe conectarse a una computadora y ser capaz de registrar imágenes en un programa o disco duro.
3. Análisis del tamaño de las amebas
- Abra el archivo del microscopio en el software de imágenes. Se abrirán las opciones de importación de bioformatos. En el cuadro de diálogo, asegúrese de que se cumplan las siguientes condiciones: Visualización de pilas; Ver con: Selection-Hyperstack; Administración de memoria: marque Usar pila virtual; Modo de color: Predeterminado.
- Asegúrese de que ninguno de los otros menús desplegables o casillas de verificación esté activado. Haga clic en Aceptar.
- Opciones de series de bioformatos abiertos. Elija la serie que se necesita. Si solo se registra una ubicación a la vez, es probable que solo haya una opción aquí. Haga clic en Aceptar.
- Elija Imagen > Duplicar para duplicar el único pocillo con el que se está trabajando a la vez eligiendo solo un canal C y solo un canal Z.
- A partir de aquí, solo trabaje con la imagen duplicada para su manipulación y análisis, no con la original. Elija Imagen > Escriba > 8 bits. Elija Proceso > Restar fondo.
- Establezca la bola rodante en 10.0. Compruebe el fondo claro. Compruebe el paraboloide deslizante.
- Elija Proceso > Mejorar el contraste. Establezca los píxeles saturados en 0,1 % para los trofozoítos o en 0,3 % para un grupo de células y agregados.
- Seleccione Imagen > Ajustar > umbral (por defecto > blanco y negro). Se abrirá el proceso Make Binary. Seleccione Predeterminado y marque Fondo negro (de máscaras binarias).
- Seleccione el umbral de manera agresiva para que la mayoría de las manchas de fondo no sean visibles, pero sí una parte de cada ameba.
- Si el software de imagen invirtió la imagen y el fondo es blanco y la ameba es negra, vaya a Editar > Invertir para fijarla en un fondo negro y una ameba blanca.
- Elija Proceso> Binario > Cerrar, en caso de que las células tengan un ligero espacio en la membrana externa debido a estar fuera de foco o a la motilidad de la célula.
- Elija Procesar > binario > Llenar agujeros. Elimine los artefactos que no sean de ameba utilizando las herramientas de dibujo de formas y Editar > Relleno. Si, en este punto, el fondo es blanco y la ameba es negra, elija Editar > Invertir. En este punto, la imagen debe representar las imágenes binarias de la Figura 2.
- Para registrar el tamaño de cada ameba, elija Analizar > Analizar partículas. Tamaño del conjunto: 10-infinito, circularidad: 0-1, mostrar: nada. Marque Mostrar solo resultados y resumir.
- Guarde los archivos CSV que aparecen. Elija Archivo > Guardar como > Tiff y edite el nombre según la especificación deseada.
4. Preparación de archivos de microscopio para seguimiento (análisis de motilidad)
- Abra el archivo del microscopio en el software de imágenes. Se abrirán las opciones de importación de bioformatos.
- En el cuadro de diálogo, asegúrese de que se cumplan las siguientes condiciones: Visualización de pilas; Ver con: Selección-Hyperstack. Para la administración de memoria, marque Usar pila virtual. Haga clic en Aceptar.
- Se abrirán las opciones de la serie Bio-Formats. Elija la serie que se necesita. Si solo se registra una ubicación a la vez, es probable que solo haya una opción aquí. Haga clic en Aceptar.
- Elija Imagen > duplicar. A partir de aquí, solo trabaje en la sección duplicada del video en lugar de trabajar en el archivo original.
NOTA: Duplique la sección del video que se está rastreando en ese momento. Para ello, es necesario conocer los fotogramas que corresponden a los minutos necesarios para el experimento. Por ejemplo, si se quiere realizar un seguimiento de la1ª hora y se toman imágenes cada 24 s, debe haber 150 fotogramas en la1ª hora. Por lo tanto, la1ª hora será los fotogramas 1-150, la2ª hora será 151-300, y así sucesivamente. - Elija Imagen > Tipo > 8 bits. Elija Proceso > Restar fondo. Establezca la bola rodante en 10.0.
- Compruebe el fondo claro. Compruebe el paraboloide deslizante. Elija Proceso > Mejorar contraste y establézcalo en 0.1%.
- Marque Todos los x# sectores (por ejemplo, los 150 sectores). Desmarque Normalizar. Elija Imagen > ajustar > umbral (por defecto > blanco y negro).
- Se abrirá el proceso Make Binary. Seleccione Predeterminado. Compruebe el fondo negro (de las máscaras binarias).
- Umbral agresivo, por lo que la mayoría de las manchas de fondo no son visibles, pero algunas partes de la ameba son visibles. En este paso, si el fondo es blanco y la ameba es negra, elija Editar > Invertir. El fondo debe ser negro y la ameba debe ser blanca.
- Elija Procesar > binario > cerrar. Elija Procesar > binario > Llenar agujeros. Elija Archivo > Guardar como > Tiff y edite el nombre según la especificación deseada. El archivo ya está listo para el seguimiento.
5. Análisis de la motilidad a través del seguimiento
- Desde el software de imagen con el archivo tiff que se necesita para rastrear abierto, vaya a Plugins > Seguimiento > Trackmate. Se abrirá la versión de Trackmate.
- Elija Next (Siguiente). Seleccione el detector LoG en el menú desplegable del detector. Establezca el diámetro estimado de la mancha: 35,0 micras, umbral 1,0. Desmarque Usar filtro de mediana y Realizar localización de subpíxeles.
- Haga clic en Vista previa en el primer sector, el medio y el final. Asegúrese de que todas las amebas sean capturadas por un círculo púrpura y que no se incluyan defectos o artefactos de fondo.
- Elija Next (Siguiente). Comenzará a procesarse y este paso puede tardar unos minutos en realizarse. Una barra de detección en la parte superior de la pantalla indicará qué parte del proceso se ha completado.
- Elija Next (Siguiente ) cuando se le solicite. En el umbral inicial, elija Siguiente de nuevo sin seleccionar nada. Seleccione Hyperstack Displayer al seleccionar una vista. Elija Next (Siguiente).
- Establezca el filtro en puntos y elija Siguiente sin seleccionar nada. Selecciona un rastreador; para hacerlo, seleccione LAP Tracker (en lugar de Simple LAP Tracker). Elija Next (Siguiente).
- En la vinculación fotograma a fotograma, establezca la distancia máxima en 40 μm. Cierre de brecha en el segmento de la pista: marque Permitir cierre de la brecha. Establezca la distancia máxima para esto en 100 μm y el espacio máximo entre fotogramas en 4. No seleccione nada para División de segmentos de pista o Fusión de segmentos de pista.
- Elija Next (Siguiente). El seguimiento puede tardar mucho tiempo en ejecutarse. Cuando se complete, la ventana debe decir: Seguimiento realizado en x s en la parte inferior. Elija Next (Siguiente).
- Elija Next de nuevo cuando se complete el seguimiento. Establecer filtros en pistas: selecciona el signo + en la parte inferior izquierda para agregar un filtro para el número de puntos en las pistas. Establezca el filtro en Arriba para al menos el 93% de los fotogramas (por ejemplo, 150 fotogramas necesitarían un mínimo de 140 puntos).
NOTA: Algunas versiones de este software requerirán seleccionar el equivalente opuesto, como Por debajo de al menos el 7%, lo que se puede hacer arrastrando una línea hacia la izquierda o hacia la derecha para alcanzar el número deseado. - Elija Next (Siguiente). Aparecerán las opciones de visualización. Asegúrese de que las pistas de cada fotograma no estén deformadas o sean extrañas en la forma en que se mueve la ameba antes de guardar el archivo XML de Trackmate o el archivo CSV de Tracks.
- Si es necesario eliminar una pista, haga clic en TrackScheme. TrackScheme mostrará todas las pistas y puntos de contacto de la ameba en todos los fotogramas.
NOTA: Las posibles razones para eliminar una pista son que una ameba ha caminado dentro o fuera del campo de visión durante la grabación, una pista tiene una forma inapropiada en comparación con la trayectoria real de la ameba, o por alguna razón, la pista o la ameba es un valor atípico en los datos de acuerdo con los parámetros experimentales, etc. - Haga clic en la ameba para resaltar el punto verde en la pantalla y en Trackscheme el lugar tendrá un cuadrado verde a su alrededor. Esto indicará qué pista o lugar debe eliminarse.
- Haga clic con el botón derecho en la pista que debe eliminarse y seleccione Pista completa. Presione el botón Eliminar .
- Después de revisar todas las pistas, guarde el archivo de seguimiento haciendo clic en Guardar en la parte inferior izquierda de la ventana emergente del software de seguimiento. Guarde el archivo XML con el nombre del vídeo. Haga clic en Reanudar para volver a la ventana emergente del software de seguimiento.
- Haz clic en Pistas y selecciona Pistas a la izquierda. Haga clic en Exportar a CSV y guarde el archivo CSV.
- Si la hoja de cálculo no reconoce el CSV resultante, ejecute los siguientes pasos.
- Abra el archivo CSV guardado en el Bloc de notas. Haga clic en Control + A y Control + C para copiar todo el contenido.
- Abre la hoja de cálculo y haz clic en Control + V para pegarla en la hoja de cálculo. Todos los datos estarán en una celda.
- Con las celdas con datos aún seleccionadas, vaya a Datos > texto a columnas. Elija Delimitado > Siguiente. Elija Coma > siguiente > finalizar. Guarde este archivo como el nuevo CSV.
- El CSV de seguimiento tendrá muchos parámetros disponibles para el análisis (Figura 3). Copie y pegue los parámetros deseados en un nuevo archivo CSV (Figura 4) para analizar. A continuación se describen los parámetros utilizados.
- Distancia total recorrida: distancia total recorrida por una ameba en μm.
- Distancia máxima recorrida: la distancia máxima en el camino de una ameba desde su punto de inicio, que puede no ser necesariamente el punto final.
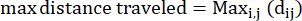
Donde dij es la distancia a cualquier punto I a cualquier punto j de la pista. - Tasa de confinamiento: La tasa de confinamiento indica qué tan eficiente fue una ameba para alejarse de su punto de partida: ¿viajó en línea recta lejos de su punto de partida (un valor cercano a 1), o se mantuvo relativamente cerca de su punto de inicio (un valor cercano a 0).
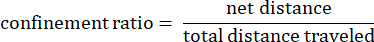
- Velocidad media de la pista: Velocidad media de la ameba sobre la distancia total recorrida en micras por segundo.
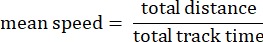
- Desplazamiento de la pista: La distancia entre el punto de inicio de una ameba y el punto final en micras.
NOTA: Todos los parámetros de análisis del software de imágenes y sus definiciones se pueden encontrar aquí: https://imagej.net/plugins/trackmate/analyzers/. Recuerda que cada archivo guardado es un resumen de los tracks analizados en ese momento. Para producir un análisis de datos robusto, será necesario combinar adecuadamente los resultados de múltiples réplicas, horas, etc., según sea adecuado para los datos (Figura 5 y Figura 6).
Resultados
Para lograr el éxito con este método, hay varias piezas generales cruciales a considerar. El primero es la configuración física de la ameba y el microscopio, el segundo es la utilización adecuada del software de imágenes y el tercero es exportar y analizar los datos de imágenes de una manera significativa.
Antes de que comience el registro microscópico, es fundamental asegurarse de que la ameba esté correctamente enfocada en la etapa del microscopio (Figura 1). En lugar de centrarse en la ameba en el plano Z más óptimo para los detalles individuales, aquí es ideal verlas muy ligeramente desenfocadas para que se conviertan en puntos negros sólidos en lugar de su estado translúcido cuando se ven en detalle. Verlos de esta manera permitirá que el software de imágenes y el software de seguimiento encuentren cada ameba individual mucho más fácilmente cuando el archivo se convierta a binario (Figura 2). Saber cuál es el objetivo en el software de imágenes, es decir, que cada ameba aparezca como un círculo blanco bien definido, puede ayudar al lector a encontrar el enfoque adecuado al tomar las imágenes originales en campo claro. Luego, con cada círculo claramente definido, el software de seguimiento podrá rastrear adecuadamente la motilidad y recopilar las métricas de motilidad individuales para cada ameba.
Después de seguir las instrucciones paso a paso en el protocolo enumerado anteriormente para el software de imágenes y el software de seguimiento y consultar el video asociado para ayudar en los primeros pasos cruciales del uso del software de imágenes, es hora de exportar los datos del software de imágenes para la cuantificación y el análisis de datos. La salida bruta del software de seguimiento será similar a la que se ve en la Figura 3. Aquí, es importante verificar que el número de puntos en las pistas que se exportaron sea correcto para lo esperado (por ejemplo, si se pide que el 93% de los fotogramas estén presentes en cada pista y se tienen 100 fotogramas en total en el vídeo, cada pista exportada debe tener más o menos de 93 puntos). Si los puntos no coinciden con los requisitos, es posible que deba volver a los pasos del software de seguimiento para asegurarse de que los parámetros requeridos se configuraron correctamente.
A partir de la exportación sin procesar, comience a crear la hoja de análisis de datos (Figura 4). Es importante recordar que cada pista representa una ameba singular dentro de una réplica singular. Por lo tanto, como se ve en la Figura 4, la Figura 5 y la Figura 6, todas las pistas de un conjunto de fotogramas o punto de tiempo deben promediarse (Figura 4), y este proceso debe realizarse para cada conjunto de fotogramas o punto de tiempo en una serie completa (es decir, si se toman un total de 3 h de video y los puntos de datos se dividen por hora, luego habrá tres conjuntos de fotogramas/horas para analizar por réplica, Figura 5). Por último, a partir de esta combinación de promedios en cada conjunto de fotogramas en cada réplica, los datos promediados deben combinarse de cada réplica en un espacio para que los datos de varias réplicas se puedan analizar para determinar el promedio real y la desviación estándar por punto de tiempo (Figura 6).
Los promedios de cada réplica se utilizarán para el análisis de datos, y el promedio combinado y la desviación estándar o el error estándar de todas las réplicas se utilizarán para la representación gráfica (como se ve en un ejemplo en la Figura 7). Si se analizan datos como lo hemos hecho aquí, que son múltiples muestras que se siguen en múltiples puntos de tiempo, lo más apropiado es analizarlos utilizando un ANOVA de medida de repetición de 2 vías con una prueba de Tukey post hoc. Esto nos permite determinar las diferencias entre las muestras en cada punto de tiempo y también determinar las diferencias dentro de cada muestra a lo largo del tiempo.

Figura 1: Las amebas aparecen como formas oscuras opacas en la microscopía de campo claro. Imagen representativa ampliada de la ameba con un aumento de 4x, ligeramente desenfocada para que parezca una ojera sólida. Barra de escala = 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
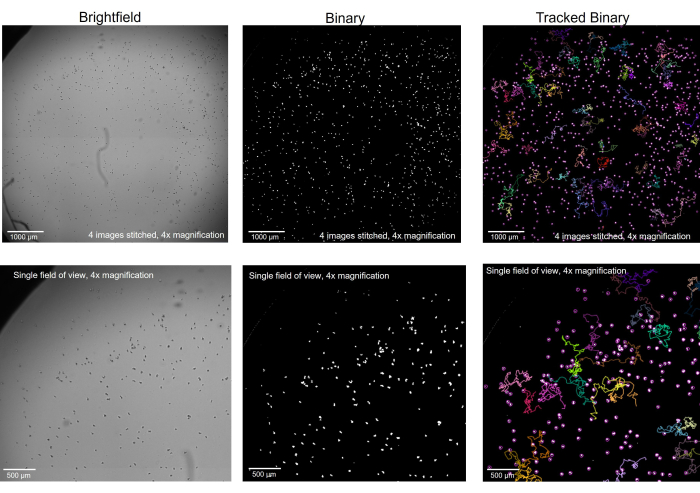
Figura 2: Ameba fotografiada en microscopía de campo claro convertida a binaria y rastreada. Amoeba con un aumento de 4x, en campo claro (izquierda), se convirtió a binario con los artefactos eliminados (centro) y, después del seguimiento, con las pistas seleccionadas (derecha). Fila superior: un pozo entero fotografiado uniendo 4 imágenes, barra de escala = 1000 μm. Fila inferior: el tamaño de una sola imagen antes de coser, barra de escala = 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
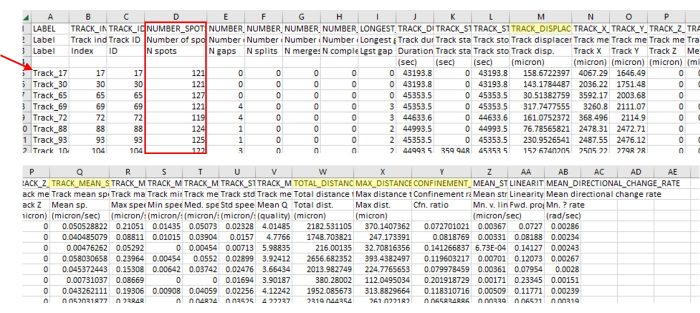
Figura 3: La salida inmediata del análisis de datos del software de imágenes y seguimiento contiene una amplia variedad de tipos de datos. La salida representativa del seguimiento se muestra en la Figura 2, que es un vídeo singular. Tenga en cuenta que los números de pista (flecha roja) omiten números, lo que indica que el software de seguimiento eliminó correctamente las pistas que no se alineaban con los parámetros. En este ejemplo, solo 71 de las 5385 pistas identificadas se alinearon con los parámetros. Esta proporción es normal, dadas pautas tan estrictas. Este número de huellas también está en línea con el número de amebas utilizadas en este protocolo (por ejemplo, si una placa de 96 pocillos se siembra con 200 μL de 7,5 x 103 UFC/mL por pocillo, entonces se debe esperar alrededor de 1.500 amebas en el pocillo y aproximadamente esa cantidad visible en un campo de visión de 4 puntos. Es probable que haya muchas más huellas que amebas, ya que las amebas caminan dentro y fuera del campo de visión, generando nuevas huellas). Este número de pista vuelve a ser evidente en la Figura 2, donde solo unas pocas pistas son visibles en comparación con un gran número de puntos. Compruebe siempre el número de puntos en la pista (cuadro rojo) para asegurarse de que solo se incluyen las longitudes de pista correctas. Por ejemplo, aquí, incluimos más del 93% de los fotogramas, y había 127 fotogramas en esta sección, por lo que todos los números de puntos deben estar por encima de 118. Resaltadas en amarillo están las medidas que se mencionaron en el protocolo. Haga clic aquí para ver una versión más grande de esta figura.
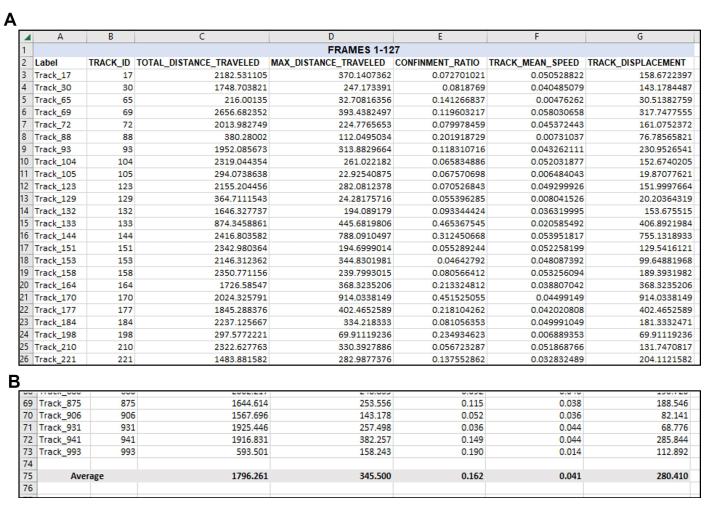
Figura 4: Datos reorganizados según sea necesario después de la salida de datos inicial. Organización de los datos deseados después de la exportación. (A) Las mediciones pertinentes elegidas para cuantificar se copiaron de la exportación del software de seguimiento (Figura 3) y se pegaron en una nueva hoja de cálculo. (B) Después de que las mediciones deseadas se hayan organizado en la nueva hoja de cálculo, se debe calcular el promedio de cada pista. Por lo tanto, en este ejemplo representativo, la distancia total, la distancia máxima, el confinamiento, la velocidad media y el desplazamiento de cada pista utilizable en este video singular se han promediado a un número singular para cada medición. Nótese de nuevo aquí que un total de 71 pistas cumplían los parámetros de los fotogramas 1-127. Es probable que haya un número diferente de pistas adecuadas de cada vídeo o conjunto de fotogramas analizado, como se evidencia en la Figura 5. Haga clic aquí para ver una versión más grande de esta figura.
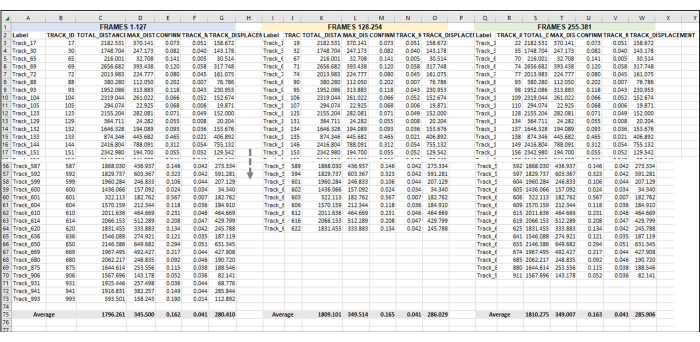
Figura 5: Fotogramas secuenciales establecidos para el análisis de una serie completa de imágenes o vídeo. Esta es una imagen representativa de la adición de videos secuenciales al análisis de datos. Suponiendo que los fotogramas 1-127 constituyen la Hora 1 del vídeo (aquí, 1 h se compone de tomar una imagen una vez cada 28 s). Los fotogramas 128 a 254 serán la hora 2 de vídeo y los fotogramas 255 a 381 serán la hora 3 de vídeo. Combine los datos exportados (como se exportó en la Figura 3) de todas las horas en una hoja para trabajar con todos a la vez. Como se hizo en la Figura 4, se promediarán los datos de todas las pistas utilizables para cada conjunto de fotogramas/h. Todo lo que se muestra en la Figura 5 son los datos de una réplica o una muestra. Si hay 3 réplicas, habrá 3 pestañas de hoja de cálculo separadas dispuestas de manera idéntica, y los datos de estas se introducirán en una nueva pestaña, como se muestra en la figura 6. Haga clic aquí para ver una versión más grande de esta figura.
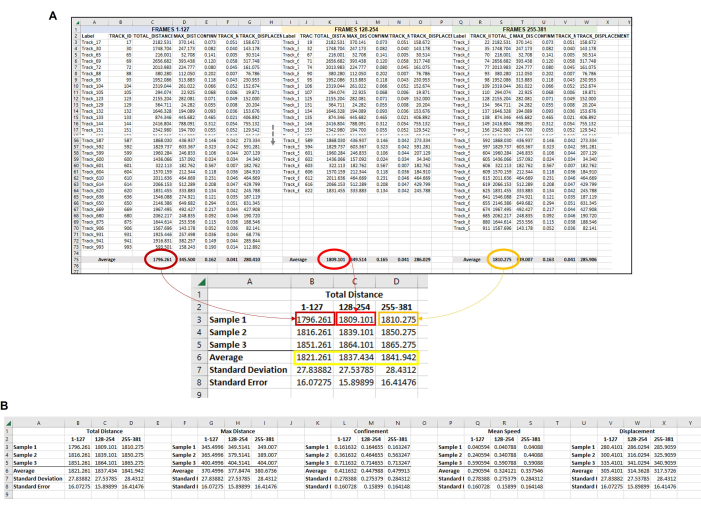
Figura 6: Datos compuestos de todas las amebas de cada conjunto de fotogramas utilizados para representar una sola réplica. (A) Todos los promedios de cada cuadro establecido en la Figura 5 deben recopilarse en una ubicación central para que se pueda completar el análisis final de los datos. En esta imagen representativa, se muestran los promedios de distancia total de los tres primeros conjuntos de fotogramas (u horas). Esto se debe repetir para cada muestra/condición/réplica que se esté ejecutando. A continuación, se deben promediar los promedios de cada muestra de cada conjunto de fotogramas (cuadro amarillo). Este es el punto de datos final a partir del cual se pueden calcular la desviación estándar y el error estándar. Los promedios individuales de cada muestra (aquí, los números en B3, B4 y B5 para la muestra de distancia total 1; C3, C4 y C5 para la muestra de distancia total 2, etc.) se utilizará para ejecutar el análisis estadístico. Este proceso se repetirá para todas las mediciones requeridas (distancia máxima, confinamiento, velocidad media, desplazamiento, etc.) (B) Para hacer una representación gráfica de la cuantificación, use los números en el cuadro amarillo como puntos de datos para usar en el gráfico final. Haga clic aquí para ver una versión más grande de esta figura.
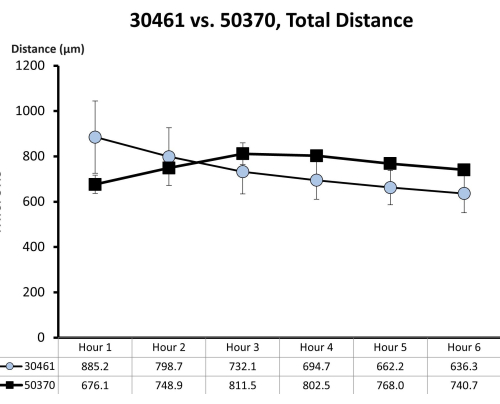
Figura 7: Datos brutos de motilidad para ATCC 30461 y ATCC 50370. Los datos brutos (representados aquí como media ± SE por hora) fueron recolectados previamente y no publicados para estudios previos18,19. Esta cuantificación de la motilidad demuestra que estas dos amebas son similares en sus primeras 6 h de motilidad (medida por la distancia total en micras recorrida en esa hora) en la solución de 1/4 de Ringer sobre una superficie de vidrio. Cada punto de tiempo representa tres réplicas separadas, cada una compuesta por 20-200 pistas de ameba. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Ser capaz de rastrear y cuantificar la motilidad de amebas como Acanthamoeba, que son organismos microscópicos adherentes que no se ven afectados por el movimiento browniano de baja velocidad 9,10, revela una cantidad sustancial de información sobre el comportamiento de las amebas y puede mejorar en gran medida el esclarecimiento sobre los métodos de prevención de la AK. Este protocolo ha sido detallado en publicaciones recientes, y los datos han sido confirmados o combinados con otros análisis de datos similares 18,19. Observamos aquí que la velocidad de la ameba detallada utilizando este método es similar a lo que ha sido publicado por otros grupos. Este protocolo es notable por su capacidad para usarse básicamente en cualquier superficie o tratamiento de ameba, que es transparente a la luz, pero es importante tener en cuenta que, si bien este protocolo podría modificarse para funcionar con otros organismos, hasta ahora solo se ha optimizado para Acanthamoeba. El protocolo anterior siempre ha funcionado bien en el laboratorio, pero se proporcionan las siguientes modificaciones para cambiar el método para adaptarlo a otras necesidades o solucionar situaciones difíciles.
Determinación de los parámetros de seguimiento: En el protocolo anterior, se han enumerado la vinculación de fotograma a fotograma, el cierre de la brecha, la brecha máxima de fotograma y el número de puntos en la pista, que fueron los más aplicables para las publicaciones recientes. Sin embargo, es posible que otros parámetros sean más adecuados para otras necesidades. Además, puede haber parámetros que a otros les gustaría usar pero que no se usaron aquí (como la distancia máxima de una pista en los filtros de pista). Se puede acceder a más información sobre cada parámetro y lo que describen aquí en el sitio web (ver referencia21). Al decidir qué parámetros y filtros son más relevantes para otros experimentos y cómo deben establecerse, piense en lo que es estadísticamente racional para un proyecto específico; Por ejemplo, ¿querría uno datos de una ameba que se aleja y luego regresa al campo de visión? ¿O querría uno conservar los datos de una ameba que no se movió mucho pero que aún así fue etiquetada como una huella? y lo que tiene sentido para el número de fotogramas y el tiempo entre fotogramas en el que se grabaron las imágenes.
Cambiar el tamaño de la mancha: Descubrimos que es extremadamente difícil con cualquier software o configuración de microscopio, basada en las tecnologías actuales y el software disponible para los laboratorios estándar, rastrear con precisión el número de amebas en un agregado a medida que cambia con el tiempo. Si realiza un seguimiento del tamaño de una mancha y trata de correlacionar ese tamaño con el número de organismos que contiene, utilice una curva estándar generada después de experimentos repetidos para predecir matemáticamente el tamaño de un agregado. Por ejemplo, los agregados se crearon sembrando pozos con un rango de números de ameba, como 8, 16, 32, 125, 250, 500, 1,000 y 2,000 células por pocillo. Se generaron imágenes timelapse en varios puntos temporales de cada pozo durante 24 h. Cada esferoide (que era de un número conocido de amebas) se analizó para un área bidimensional, y se generó una curva estándar en función del recuento de amebas frente al tamaño del esferoide a lo largo del tiempo. Este experimento se repitió al menos por triplicado para obtener una desviación estándar adecuada de cualquier curva generada.
Determinación de la direccionalidad de la ameba: Si bien esto puede no ser necesario para estudios particulares, puede ser útil comprender la direccionalidad de la ameba. Esto proporcionaría datos sobre los efectos quimiotácticos del tratamiento o experimento. Estos datos también se pueden utilizar para crear datos visuales (gráficos) y cuantitativos. Esto está disponible a través de Chemotaxis and Migration Tool, que es un complemento gratuito para software de imágenes. Está disponible en el sitio web junto con la guía de aplicación y muestras de imágenes y películas (ver Tabla de Materiales).
Dinámica de movimiento detallada: otros grupos han examinado la dinámica de propagación y las trayectorias difusivas con análisis estadísticos muy avanzados y desarrollados más allá de lo que aquí se discute 9,10,22. Estos podrían considerarse en función de las necesidades del usuario.
Al igual que con cualquier método exitoso, el protocolo detallado en este manuscrito ha pasado por muchas rondas de solución de problemas para lograr la consistencia. Si bien se pueden hacer excelentes videos rastreables de alta calidad tomando una imagen cada segundo (o tan rápido como lo pueda el microscopio, podría ser menos de un segundo), esto crea archivos extremadamente grandes, con los que puede ser difícil trabajar. Esto solo es adecuado de manera realista para videos a muy corto plazo grabados durante un máximo de unos minutos. Por el contrario, al tomar una imagen cada pocos segundos, hemos descubierto que el comportamiento de las amebas sigue siendo muy rastreable en función de la velocidad de esta especie, y es posible crear videos viables durante horas o días. Hemos descubierto que la cantidad máxima de tiempo entre imágenes es de 30 s, que es el tiempo que se requiere para que el software de imágenes rastree con precisión las amebas. El intervalo de tiempo que elija el usuario debe considerarse utilizando las restricciones conocidas de la rapidez con la que el microscopio puede registrar imágenes, cuántas imágenes por pocillo se necesitan y cuántos pocillos se registran en cada intervalo. Del mismo modo, los parámetros mencionados en este protocolo con respecto al desplazamiento máximo, los espacios de fotogramas permitidos, los fotogramas mínimos necesarios, etc., han sido determinados a través de prueba y error por este laboratorio para crear información de pista que incluye las pistas de ameba más completas e ignora el ruido creado por pistas incompletas, amebas que se unen o abandonan el escenario a mitad de video, o errores creados por la confusión del software de imágenes, como cuando dos amebas se encuentran a mitad de la pista y luego se separan. Este tipo de errores y pistas incompletas son comprensiblemente altas cuando se crean videos extremadamente largos (horas o días) de organismos biológicos microscópicos que interactúan constantemente entre sí y son la razón por la que una gran parte de las pistas erróneas deben ser rechazadas. Cabe señalar que el paso de llenado de agujeros en el protocolo es, según la experiencia de este laboratorio, importante para reducir el error en la forma en que el software de imágenes rastrea la ameba. Al asegurarse de que cada ameba sea un círculo sólido en lugar de, a veces, una rosquilla o una forma de c, es mucho más probable que el software pueda rastrear cada ameba con éxito.
Además, como se ha comentado, hay muchos parámetros disponibles para un usuario para analizar una imagen o un vídeo. Basándonos en las necesidades experimentales, nos hemos beneficiado sistemáticamente al máximo del análisis de la distancia total, la distancia máxima, la velocidad y el desplazamiento. Estos se discuten en profundidad (incluyendo el uso de diferentes deformaciones y superficies) con interpretaciones gráficas en publicaciones anteriores18,19. Estos cuatro parámetros permiten al usuario extrapolar la capacidad de una ameba para recorrer distancias lineales y el tiempo que tarda en hacerlo, lo que ayuda a comprender su comportamiento en relación con la contaminación de las lentes de contacto. Recuperar y analizar estos parámetros es un trabajo de gran envergadura, como se detalla en nuestras figuras. Al trabajar con hojas de cálculo grandes y numerosas de la salida del software de imágenes, limitamos los errores involuntarios mediante la creación de plantillas de hojas de cálculo bloqueadas que calcularon automáticamente todos los análisis requeridos. Sin embargo, una posible mejora de este método sería escribir un script que pueda manejar estos datos y ordenarlos y analizarlos.
En conclusión, aquí se describe un método accesible y preciso para medir el tamaño y la motilidad de Acanthamoeba en muchas condiciones diferentes. Hemos demostrado que este método se puede aplicar a muchas cepas diferentes de ameba y hemos señalado que, si bien puede haber parámetros sencillos para obtener información sobre la motilidad, esta configuración experimental puede adaptarse en gran medida a cualquier necesidad específica.
Divulgaciones
Todos los autores son empleados de Alcon Research, LLC.
Agradecimientos
Este trabajo fue financiado por Alcon Research, LLC.
Materiales
| Name | Company | Catalog Number | Comments |
| ¼ Ringer’s solution | ThermoFisher Scientific | BR0052G | Oxoid Ringers Solution Tablets. Follow directions to make one-quarter strength instead of full strength Ringers. |
| 10 µL pipette | Eppendorf Research | 3123000039 | 2 µL-20 µL single channel |
| 10 µL pipette tips | Neptune Scientific, San Diego, CA, USA | BT10.N | 10 µL Universal Barrier Tip |
| 48 well plate | Millipore Sigma, | CLS3548 | Corning Costar TC-Treated Multiple Well Plate: polystyrene plate, flat bottom wells, sterile, with lid |
| 50 mL conical tubes (1 for each sample, 1 for each pass 2 sample) | Fisher Scientific | Falcon 352098 | Falcon 50 mL High Clarity Conical Centrifuge Tubes, polypropylene |
| 96-well plate | Millipore Sigma, Burlington, MA, USA | CLS3596 | Corning Costar TC-Treated Multiple Well Plate: polystyrene plate, flat bottom wells, sterile, with lid |
| Acanthamoeba | American Type Culture Collection, Manassas, VA, USA | ATCC 30461 | This protocol has been verified for ATCC 50655, 30872, 50702, 30010, 30461, 50370, 50703, 30137, PRA-115, and PRA-411 |
| Axenic culture media (AC6) | Made in house | n/a | Containing 20 g biosate peptone, 5 g glucose, 0.3 g KH2PO4, 10 µg vitamin B12, and 1 glass5 mg l-methionine per liter of distilled deionized water. Adjust pH to 6.6-6.95 with 1 M NaOH and autoclave at 121 °C for 20 min, store at room temperature for up to 3 months. |
| Centrifuge and appropriate rotor | Thermo Scientific, Waltham, MA, USA | Sorvall ST 40R | Any equivalent centrifuge and rotor are acceptable so long as it can spin 50 mL conical tubes at 500 x g for 5 min |
| Chemotaxis and Migration Tool | Free software based on ImageJ, available at https://ibidi.com/chemotaxis-analysis/171-chemotaxis-and-migration-tool.html | ||
| Disposable hemocytometer | Bulldog Bio, Portsmouth, NH, USA | DHC-N01 | Neubauer Improved 2-Chip Disposable Hemocytometer, Individually packaged, Nonpyrogenic |
| ImageJ software with Trackmate plugin (this protocol written with Trackmate version 6.0.2.) | Free software developed by the National Institutes of Health, available at imagej.net. Trackmate plugin available at https://imagej.net/plugins/trackmate/ | ||
| Microscope, preferably with automated moveable stage | Nikon, Tokyo, Japan | A Nikon Eclipse Ti-U Microscope was used in this study and the automated moveable stage was utilized to be able to record images in multiple wells at a time. | |
| NIS-Elements software | Nikon | ||
| Serological pipette | Fisher Scientific, Hampton, NH, USA | BrandTech 26331 | BrandTech accu-jet pro Pipet Controller |
| Serological pipette tips | VWR | 5 mL: 76201-710 10 mL: 170356 25 mL: 89130-900 50 mL: 75816-088 | VWR Serological Pipette, Non-Pyrogenic |
| Sterile aluminum transmission flow cell | Biosurface Technologies Corporation, Bozeman, MT, USA | FC 81-AL | Anodized aluminum single channel transmission flow cell with 96-well plate footprint for use with an inverted microscope |
| T75 Flasks | VWR, Radnor, PA, USA | 734-2316 | VWR Tissue Culture Flask, 182.5 cm, Surface treated, Plug seal cap, Sterile |
Referencias
- Randag, A. C., et al. The rising incidence of Acanthamoeba keratitis: A 7-year nationwide survey and clinical assessment of risk factors and functional outcomes. PLoS One. 14 (9), e0222092 (2019).
- Szentmary, N., et al. Acanthamoeba keratitis - Clinical signs, differential diagnosis and treatment. J Curr Ophthalmol. 31 (1), 16-23 (2019).
- Carnt, N., et al. Acanthamoeba keratitis: confirmation of the UK outbreak and a prospective case-control study identifying contributing risk factors. Br J Ophthalmol. 102 (12), 1621-1628 (2018).
- Verani, J. R., et al. National outbreak of Acanthamoeba keratitis associated with use of a contact lens solution, United States. Emerg Infect Dis. 15 (8), 1236-1242 (2009).
- Tu, E. Y., Joslin, C. E. Recent outbreaks of atypical contact lens-related keratitis: what have we learned. Am J Ophthalmol. 150 (5), 602-608 (2010).
- International Organization for Standardization. ISO 14729:2001/A1. Ophthalmic optics-Contact lens care products-Microbiological requirements and test methods for products and regimens for hygienic management of contact lenses. International Organization for Standardization. , (2010).
- . ASC Z80, Parent Committee Meeting Available from: https://www.thevisioncouncil.org/sites/default/files/ASCZ80_ParentCommitteeMinutes_February_27_2018_FINALMar19-2018.pdf (2023)
- Rayamajhee, B., et al. Acanthamoeba, an environmental phagocyte enhancing survival and transmission of human pathogens. Trends Parasitol. 38 (11), 975-990 (2022).
- Reverey, J. F., et al. Superdiffusion dominates intracellular particle motion in the supercrowded cytoplasm of pathogenic Acanthamoeba castellanii. Sci Rep. 5, 11690 (2015).
- Thapa, S., Lukat, N., Selhuber-Unkel, C., Cherstvy, A. G., Metzler, R. Transient superdiffusion of polydisperse vacuoles in highly motile amoeboid cells. J Chem Phys. 150 (14), 144901 (2019).
- Rudell, J. C., et al. Acanthamoeba migration in an electric field. Invest Ophthalmol Vis Sci. 54 (6), 4225-4233 (2013).
- Fukaya, S., Aoki, K., Kobayashi, M., Takemura, M. Kinetic analysis of the motility of giant virus-infected amoebae using phase-contrast microscopic images. Front Microbiol. 10, 3014 (2019).
- Fukaya, S., Takemura, M. Kinetic analysis of Acanthamoeba castellanii infected with giant viruses quantitatively revealed process of morphological and behavioral changes in host cells. Microbiol Spectr. 9 (1), 0036821 (2021).
- Cheng, H. J., Hsu, C. H., Hung, C. L., Lin, C. Y. A review for cell and particle tracking on microscopy images using algorithms and deep learning technologies. Biomed J. 45 (3), 465-471 (2022).
- Mathieu, E., et al. Time-lapse lens-free imaging of cell migration in diverse physical microenvironments. Lab Chip. 16 (17), 3304-3316 (2016).
- Svensson, C. M., Medyukhina, A., Belyaev, I., Al-Zaben, N., Figge, M. T. Untangling cell tracks: Quantifying cell migration by time lapse image data analysis. Cytometry A. 93 (3), 357-370 (2018).
- Piltti, K. M., et al. Live-cell time-lapse imaging and single-cell tracking of in vitro cultured neural stem cells - Tools for analyzing dynamics of cell cycle, migration, and lineage selection. Methods. 133, 81-90 (2018).
- Campolo, A., et al. Continuous real-time motility analysis of Acanthamoeba reveals sustained movement in absence of nutrients. Pathogens. 10 (8), 995 (2021).
- Campolo, A., Patterson, B., Lara, E., Shannon, P., Crary, M. Complete recovery of Acanthamoeba motility among surviving organisms after contact lens care disinfection. Microorganisms. 11 (2), 299 (2023).
- Crary, M. J., Walters, R., Shannon, P., Gabriel, M. M. Variables affecting the recovery of Acanthamoeba trophozoites. Pathogens. 10 (2), 221 (2021).
- . imagej Available from: https://imagej.net/plugins/trackmate/tutorials/getting-started (2024)
- Cherstvy, A. G., Nagel, O., Beta, C., Metzler, R. Non-Gaussianity, population heterogeneity, and transient superdiffusion in the spreading dynamics of amoeboid cells. Phys Chem Chem Phys. 20 (35), 23034-23054 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados