Method Article
Quantificazione di Acanthamoeba spp. Motilità
In questo articolo
Riepilogo
Questa procedura descrive come visualizzare, tracciare e quantificare Acanthamoeba spp. motilità.
Abstract
La cheratite da Acanthamoeba è una grave infezione oculare che pone sfide terapeutiche e può portare alla cecità. Nonostante la sua ubiquità e la potenziale contaminazione delle lenti a contatto dopo l'esposizione all'acqua, il comportamento naturale di questo agente patogeno rimane sfuggente. Comprendere i modelli di movimento dell'Acanthamoeba può informarci su come colonizza le lenti a contatto e contamina la cornea del paziente. È una fortuna che Acanthamoeba spp. sono visibili tramite microscopia in campo chiaro a partire da un ingrandimento 4x. Precedenti tecniche sono state sviluppate per quantificare la motilità di Acanthamoeba in relazione agli effetti citopatici o alla sottoesposizione al campo elettrico. Qui, descriviamo un metodo per tracciare e quantificare Acanthamoeba spp. Motilità a lungo termine (da ore a giorni), che è un protocollo applicabile a più ceppi di ameba, superfici e stato nutrizionale dell'ameba. Questa procedura è fondamentale per determinare molte quantificazioni della motilità del nucleo, come la distanza, la velocità, il confinamento e la direzionalità, necessarie per monitorare le diverse fasi dell'infezione, della proliferazione o del cambiamento comportamentale.
Introduzione
La ricerca sull'Acanthamoeba è aumentata notevolmente negli ultimi anni a causa dell'aumento della prevalenza della cheratite da Acanthamoeba (AK), che è un'infezione parassitaria a seguito dell'attaccamento di Acanthamoeba alla cornea1. Sebbene i focolai di AK possano essere attribuiti a una cura inappropriata delle lenti a contatto o a soluzioni inefficaci per la cura delle lenti a contatto 2,3,4,5, attualmente non ci sono requisiti per dimostrare l'efficacia della disinfezione di Acanthamoeba per qualsiasi prodotto sul mercato. Tuttavia, c'è uno sforzo continuo nella comunità scientifica e all'interno delle organizzazioni di standardizzazione per esaminare i protocolli necessari per quantificare l'efficacia della disinfezione dei prodotti per la cura delle lenti a contatto 6,7. Inoltre, a causa della sua somiglianza negli aspetti cellulari e funzionali con i macrofagi umani, l'Acanthamoeba è stata notata per avere un ruolo significativo nell'ospitare e diffondere altri patogeni umani8, oltre alla patogenicità che l'ameba stessa apporta.
Sono state descritte tecniche recenti che sono state in grado di quantificare la motilità di Acanthamoeba - che generalmente non è altamente soggetta al movimento browniano 9,10 - per quanto riguarda gli effetti citopatici o la sottoesposizione al campo elettrico 9,11, così come i progressi nell'analisi della motilità nella ricerca sui virus giganti utilizzando Acanthamoeba come vettore virale tracciabile 12, 13. Negli ultimi 20 anni ci sono stati anche miglioramenti costanti e significativi nel tracciamento di cellule e particelle utilizzando nuovi programmi software come il software di imaging utilizzato qui, e nuovi algoritmi e tecnologie di deep learning14. Tuttavia, questo è un campo scientifico relativamente nuovo e in crescita per quanto riguarda la ricerca da banco, l'applicazione clinica e gli standard industriali, e c'è stata una scarsità di dati pubblicati riguardo ai metodi per visualizzare e tracciare questa ameba, in particolare al fine di quantificare i cambiamenti comportamentali in seguito all'aderenza alle lenti a contatto o durante o dopo la disinfezione delle lenti a contatto. Altri campi che si espandono nel monitoraggio visivo a lungo termine hanno sostenuto questo sforzo 15,16,17. A causa della natura intrinsecamente impegnativa dell'Acanthamoeba - tra cui una resistenza generale ai plasmidi (che potrebbe conferire fluorescenza), la capacità dell'ameba di consumare e distruggere i coloranti cellulari standard e una composizione proteica esterna unica - che rende difficile la marcatura degli anticorpi - i metodi disponibili per altre cellule che li rendono visibili in contesti diversi dall'imaging in campo chiaro sono stati inutilizzabili in questo organismo. Pertanto, la quantificazione della motilità di questa ameba ha dimostrato un'aggiunta significativa al campo. Utilizzando il metodo qui descritto, siamo stati in grado di accertare che l'ameba rimane mobile per almeno 12 ore senza nutrienti18 e che l'ameba che viene sfidata con un processo di disinfezione e cessa la motilità durante la disinfezione può recuperare la propria motilità dopo la disinfezione se non viene completamente lisata19.
Questo protocollo descrive in dettaglio come tracciare e quantificare visivamente la motilità dell'ameba al microscopio. I passaggi principali consistono nel registrare l'ameba in campo chiaro utilizzando la messa a fuoco e la tempistica appropriate tra le immagini, trasformare le immagini in binarie utilizzando il software di imaging e quindi utilizzare il plug-in di tracciamento di un software di imaging per impostare i parametri sperimentali e seguire ogni ameba per determinare le misure richieste come velocità, distanza e confinamento. Successivamente, è possibile quantificare la chemiotassi di un'ameba o di una popolazione di ameba al fine di definire la direzionalità. Il contributo chiave di questo metodo è quello di visualizzare e quantificare il comportamento dell'ameba durante diversi stati di supporto nutrizionale, aderenza superficiale, sfida di disinfezione o altre alterazioni ambientali come la coabitazione con colture cellulari di mammifero.
Protocollo
1. Preparazione dell'acanthamoeba
NOTA:Questo protocollo è stato verificato per ATCC 50655, 30872, 50702, 30010, 30461, 50370, 50703, 30137, PRA-115 e PRA-411. Questo è un agente patogeno BSL2 e dovrebbe essere lavorato all'interno di una cappa e di un laboratorio BSL2.
- Creare una coltura master da una fiala di campione o da un tappo20 preparato riempiendo un pallone T75 con 30 ml di terreno AC6 e aggiungervi in modo asettico un tappo o il contenuto di una fiala di campione. Incubare il matraccio per 3-5 giorni a 26-30 °C fino a quando il pallone è confluente dal 50% all'80%.
- Il passaggio delle cellule il giorno prima è necessario per creare una popolazione omogenea di trofozoiti.
- A seconda delle esigenze del ceppo, agitare e/o colpire energicamente la coltura master 2 volte per rimuovere i trofozoiti aderiti.
- Riempire un matraccio T75 con 30 mL di terreno AC6. Aggiungere 2 ml di coltura master al passaggio. Incubare il matraccio per 18-24 ore a 26-30 °C.
- Prima del raccolto, ispezionare visivamente la popolazione di trofozoiti con un ingrandimento di 4x al microscopio. Assicurarsi che i trofozoiti siano aderenti e uniformi.
- Colpisci energicamente la fiaschetta 2 volte per rimuovere i trofozoiti aderenti. Versare il contenuto in una provetta conica da 50 mL.
- Centrifugare la provetta a 500 x g per 5 minuti in una centrifuga bilanciata per pellettare l'ameba. Versare o pipettare il mezzo surnatante e gettarlo. Diluire il pellet in 2-10 mL di 1/4 di soluzione di Ringer.
- Agitare il campione. Aggiungere 10 μL di campione a un emocitometro monouso e contare le CFU/mL dell'Acanthamoeba.
- Sulla base della conta dell'emocitometro, diluire il pellet di ameba a una concentrazione di 7,5 x 103 cellule/mL in 1/4 di soluzione di Ringer.
- Seme l'ameba su una superficie, che può essere di vetro, plastica o agar non nutriente, e una varietà di forme di pozzetti a seconda delle esigenze sperimentali come descritto di seguito.
- Piastra a 96 pozzetti: seminare ogni pozzetto con 200 μl di sospensione di Acanthamoeba e racchiudere la piastra con il coperchio.
- Piastra a 48 pozzetti: seminare ogni pozzetto con 1 mL di sospensione di Acanthamoeba e racchiudere la piastra con il coperchio.
- Cella a flusso: aggiungere lentamente 4 mL di sospensione di Acanthamoeba attraverso le porte sterili di una cella a flusso sterile in alluminio, evitando la formazione di bolle nella camera. Bloccare le porte chiuse dopo che la sospensione è stata aggiunta.
- Prima dell'imaging, lasciare che l'ameba aderisca alla superficie per almeno 30 minuti prima di iniziare la registrazione microscopica.
2. Visualizzazione e registrazione di Acanthamoeba
- Visualizza l'ameba con un ingrandimento 4x in campo chiaro. Lo sfondo dovrebbe apparire grigio chiaro e l'ameba dovrebbe essere nera. Regolare la luce e la messa a fuoco in modo che le amebe siano occhiaie solide invece che traslucide (quindi, leggermente sfocate, Figura 1.).
NOTA: L'ingrandimento ottimale è 4x per l'inseguimento per diversi motivi: Le amebe che escono o entrano nel campo visivo durante l'inseguimento non devono essere incluse nell'analisi dei dati, quindi l'ingrandimento inferiore supporta al meglio il numero massimo di ameba incluse nell'analisi in un periodo di tempo. L'ameba dovrebbe apparire come cerchi neri solidi in campo chiaro per convertirli in binari per l'analisi di tracciamento. Questo è più facile da ottenere con un ingrandimento inferiore, poiché ingrandimenti più elevati rivelano facilmente la natura traslucida e le strutture interne dell'ameba. In generale, è possibile catturare più ameba in un singolo campo visivo con un ingrandimento inferiore, supportando un'analisi dei dati più robusta. - Impostare i programmi di registrazione nel software di imaging per registrare un'immagine a intervalli regolari per tracciare l'ameba. Il tempo più lungo tra le immagini che consentirà un tracciamento accurato è di 30 s, il tempo ottimale per le dimensioni del file e i dettagli di tracciamento è suggerito a 12 s o 24 s.
- Le amebe possono essere monitorate per più giorni alla volta, ma fai attenzione alle dimensioni del file che questo tipo di registrazione creerà e alla difficoltà intrinseca di manipolare file estremamente grandi. Per evitare ciò, registra le amebe per tratti di tempo a determinati intervalli. Ad esempio, registra per 1 ora ogni 12 ore per 5 giorni.
- Se il microscopio e il programma lo consentono, registrare più pozzetti in un'unica sessione utilizzando le coordinate XY dei pozzetti della piastra o più posizioni di una cella di flusso. Se necessario, unire più sezioni di un pozzetto o di una cella di flusso per creare un campo visivo più ampio con un ingrandimento di 4x.
NOTA: L'unico vincolo sul numero di posizioni che possono essere registrate è la velocità con cui il tavolino del microscopio può spostarsi tra le posizioni entro l'intervallo di tempo dell'immagine (ad esempio, scattando un'immagine ogni 12 s, 24 s, ecc.). Tuttavia, questo non è necessario e il monitoraggio dei video realizzati da un'unica posizione può comunque avere un numero sufficiente di tracce per un'analisi statistica affidabile. In questo studio è stato utilizzato un microscopio Nikon Eclipse Ti-U e il tavolino mobile automatizzato è stato utilizzato per registrare immagini in più pozzetti alla volta. Tuttavia, qualsiasi microscopio con una capacità di registrazione programmabile funzionerà. Il microscopio deve essere collegato a un computer ed essere in grado di registrare immagini su un programma o su un disco rigido.
3. Analisi delle dimensioni dell'ameba
- Aprire il file del microscopio nel software di imaging. Si apriranno le opzioni di importazione dei bioformati. Nella finestra di dialogo, assicurati che siano soddisfatte le seguenti condizioni: Visualizzazione in pila; Visualizza con: Selection-Hyperstack; Gestione della memoria: selezionare Usa stack virtuale; Modalità colore: predefinita.
- Assicurarsi che nessuno degli altri menu a discesa o caselle di controllo sia attivato. Fare clic su OK.
- Apri le opzioni della serie di bioformati. Scegli la serie necessaria. Se viene registrata una sola posizione alla volta, probabilmente ci sarà solo un'opzione qui. Fare clic su OK.
- Scegliete Immagine > Duplica per duplicare il singolo pozzetto con cui si sta lavorando alla volta scegliendo un solo canale C e un solo canale Z.
- Da qui in poi, lavora solo con l'immagine duplicata per la manipolazione e l'analisi, non con l'originale. Scegli Tipo di > immagine > 8 bit. Scegli Elabora > Sottrai sfondo.
- Imposta la palla che rotola su 10.0. Controlla lo sfondo chiaro. Controllare il paraboloide scorrevole.
- Scegli Elabora > migliora il contrasto. Imposta i pixel saturi su 0,1% per i trofozoiti o 0,3% per un gruppo di cellule e aggregati.
- Scegliete Immagine > Regola > soglia (predefinito > bianco e nero). Si aprirà il processo Make Binary. Seleziona Predefinito e seleziona Sfondo nero (delle maschere binarie).
- Seleziona la soglia in modo aggressivo in modo che la maggior parte delle macchie di sfondo non siano visibili, ma sia visibile una parte di ciascuna ameba.
- Se il software di imaging ha invertito l'immagine e lo sfondo è bianco e l'ameba è nera, vai su Modifica > Inverti per fissarla su uno sfondo nero e un'ameba bianca.
- Scegliere Processo> Binario > Chiudi, nel caso in cui le cellule abbiano un leggero spazio nella membrana esterna a causa dell'essere fuori fuoco o della motilità della cellula.
- Scegliete Elabora > binario > Riempi buchi. Rimuovi gli artefatti non amebani utilizzando gli strumenti di disegno delle forme e Modifica > Riempi. Se, a questo punto, lo sfondo è bianco e l'ameba è nera, scegli Modifica > Inverti. A questo punto, l'immagine dovrebbe rappresentare le immagini binarie nella Figura 2.
- Per registrare le dimensioni di ciascuna ameba, scegliere Analizza > Analizza particelle. Dimensione del set: 10-Infinitiy, Circolarità: 0-1, Spettacolo: Niente. Selezionare Solo Visualizza risultati e Riepiloga.
- Salva i file CSV visualizzati. Scegliete File > Salva con nome > Tiff e modificate il nome in base alla specifica desiderata.
4. Preparazione di file per microscopio per l'inseguimento (analisi della motilità)
- Aprire il file del microscopio nel software di imaging. Si apriranno le opzioni di importazione dei bioformati.
- Nella finestra di dialogo, assicurati che siano soddisfatte le seguenti condizioni: Visualizzazione in pila; Visualizza con: Selection-Hyperstack. Per la gestione della memoria, selezionare Usa stack virtuale. Fare clic su OK.
- Si apriranno le opzioni della serie Bio-Formats. Scegli la serie necessaria. Se viene registrata una sola posizione alla volta, probabilmente ci sarà solo un'opzione qui. Fare clic su OK.
- Scegli Immagine > Duplica. Da qui in poi, lavora solo sulla sezione duplicata del video invece di lavorare sul file originale.
NOTA: Duplica la sezione del video che viene tracciata in quel momento. Per fare ciò, è necessario conoscere i fotogrammi che corrispondono ai minuti necessari per l'esperimento. Ad esempio, se si desidera tenere traccia dellaprima ora e scattare immagini ogni 24 secondi, dovrebbero esserci 150 fotogrammi nellaprima ora. Pertanto, la1a ora sarà i fotogrammi 1-150, la2a ora sarà 151-300 e così via. - Scegli Tipo di immagine > > 8 bit. Scegli Elabora > Sottrai sfondo. Imposta la palla che rotola su 10.0.
- Controlla lo sfondo chiaro. Controllare il paraboloide scorrevole. Scegli Elabora > migliora contrasto e impostalo su 0,1%.
- Selezionare Tutte le sezioni x# (ad esempio, tutte le 150 sezioni). Deseleziona Normalizza. Scegliete Immagine > Regola > soglia (impostazione predefinita > bianco e nero).
- Si aprirà il processo Make Binary. Seleziona Predefinito. Controlla lo sfondo nero (delle maschere binarie).
- Soglia in modo aggressivo, quindi la maggior parte delle macchie di sfondo non sono visibili, ma alcune parti dell'ameba sono visibili. A questo punto, se lo sfondo è bianco e l'ameba è nera, scegli Modifica > Inverti. Lo sfondo dovrebbe essere nero e l'ameba dovrebbe essere bianca.
- Scegliere Elabora > binario > Chiudi. Selezionate Processo > binario > Riempi buchi (Fill Holes). Scegliete File > Salva con nome > Tiff e modificate il nome con la specifica desiderata. Il file è ora pronto per il tracciamento.
5. Analisi della motilità attraverso il tracciamento
- Dal software di imaging con il file tiff necessario per la traccia, vai su Plug-in > Tracking > Trackmate. Si aprirà la versione di Trackmate.
- Scegliere Successivo. Selezionare il rilevatore LoG dal menu a discesa del rilevatore. Impostare il diametro stimato del blob: 35,0 micron, soglia 1,0. Deseleziona Usa filtro mediano ed Esegui localizzazione sub-pixel.
- Fate clic su Anteprima in corrispondenza della prima, della parte centrale e della fine. Assicurati che tutte le amebe siano catturate da un cerchio viola e che i difetti di sfondo o gli artefatti non siano inclusi.
- Scegliere Successivo. Inizierà l'elaborazione e questo passaggio potrebbe richiedere alcuni minuti. Una barra di rilevamento nella parte superiore dello schermo indicherà la parte del processo completata.
- Scegliere Avanti quando richiesto. Nella soglia iniziale scegliere di nuovo Avanti senza selezionare alcun elemento. Selezionare Hyperstack Displayer quando si seleziona una visualizzazione. Scegliere Successivo.
- Imposta il filtro sui punti e scegli Avanti senza selezionare nulla. Seleziona un tracker; a tale scopo, selezionare LAP Tracker (anziché LAP Tracker semplice). Scegliere Successivo.
- Durante il collegamento da fotogramma a fotogramma, impostare la distanza massima su 40 μm. Sulla chiusura del segmento di binario, selezionare Consenti chiusura gap. Impostare la distanza massima a 100 μm e la distanza massima tra i fotogrammi a 4. Non selezionare alcun elemento per Suddivisione segmento traccia o Unione segmento traccia.
- Scegliere Successivo. L'esecuzione del tracciamento può richiedere molto tempo. Al termine, la finestra dovrebbe dire: Tracciamento fatto in x s in basso. Scegliere Successivo.
- Al termine del monitoraggio, selezionare nuovamente Avanti . Imposta filtri sulle tracce: seleziona il segno + in basso a sinistra per aggiungere un filtro per il numero di punti nelle tracce. Imposta il filtro su Sopra per almeno il 93% dei fotogrammi (ad esempio, 150 fotogrammi richiederebbero un minimo di 140 punti).
NOTA: Alcune versioni di questo software richiedono la selezione dell'equivalente opposto, ad esempio Inferiore ad almeno il 7%, che può essere eseguita trascinando una riga a sinistra o a destra per raggiungere il numero desiderato. - Scegliere Successivo. Verranno visualizzate le opzioni di visualizzazione. Assicurati che le tracce in ogni fotogramma non siano deformate o strane nel modo in cui si muove l'ameba prima di salvare il file XML di Trackmate o il file CSV di Trackmate.
- Se è necessario eliminare una traccia, fare clic su TrackScheme. TrackScheme mostrerà tutte le tracce e i punti di contatto per l'ameba in tutti i fotogrammi.
NOTA: I possibili motivi per eliminare una traccia sono un'ameba che ha camminato dentro/fuori dal campo visivo durante la registrazione, una traccia è sagomata in modo inappropriato rispetto al percorso effettivo dell'ameba, o per qualche motivo, la traccia o l'ameba è un valore anomalo nei dati secondo i parametri sperimentali, ecc. - Fare clic sull'ameba per evidenziare il punto verde sullo schermo e in Trackscheme il punto avrà un quadrato verde che lo circonda. Questo indicherà quale traccia o punto deve essere rimosso.
- Fare clic con il pulsante destro del mouse sulla traccia che deve essere rimossa e selezionare Traccia intera. Premere il pulsante Elimina .
- Dopo aver esaminato tutte le tracce, salva il file di tracciamento facendo clic su Salva in basso a sinistra nel popup del software di tracciamento. Salva il file XML utilizzando il nome del video. Fare clic su Riprendi per tornare al popup del software di tracciamento.
- Fai clic su Tracce e seleziona Tracce a sinistra. Fai clic su Esporta in CSV e salva il file CSV.
- Se il foglio di calcolo non riconosce il file CSV risultante, eseguire la procedura seguente.
- Apri il file CSV salvato in Blocco note. Fare clic su Ctrl + A e Ctrl + C per copiare tutto il contenuto.
- Apri il foglio di calcolo e fai clic su Ctrl + V per incollarlo nel foglio di calcolo. Tutti i dati saranno in una cella.
- Con le celle con i dati ancora selezionati, vai su Dati > Testo in colonne. Scegliere Delimitato > successivo. Selezionate Virgola > Successivo > Fine. Salvare questo file come nuovo file CSV.
- Il CSV di tracciamento avrà molti parametri disponibili per l'analisi (Figura 3). Copiare e incollare i parametri desiderati in un nuovo file CSV (Figura 4) da analizzare. I parametri utilizzati qui sono descritti di seguito.
- Distanza totale percorsa: distanza totale percorsa da un'ameba in μm.
- Distanza massima percorsa: la distanza massima sul percorso di un'ameba dal suo punto di partenza - questo potrebbe non essere necessariamente il punto finale
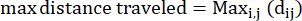
Dove dij è la distanza da qualsiasi punto I a qualsiasi punto j sulla pista. - Rapporto di confinamento: il rapporto di confinamento indica l'efficienza di un'ameba nell'allontanarsi dal suo punto di partenza: ha viaggiato in linea retta lontano dal suo punto di partenza (un valore vicino a 1) o è rimasta relativamente vicina al suo punto di partenza (un valore vicino a 0).
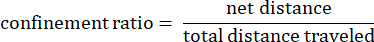
- Velocità media della traccia: Velocità media dell'ameba sulla distanza totale percorsa in micron al secondo.
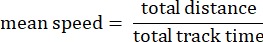
- Spostamento della traccia: la distanza tra il punto iniziale di un'ameba e il punto finale in micron.
NOTA: Tutti i parametri di analisi del software di imaging e le relative definizioni sono disponibili qui: https://imagej.net/plugins/trackmate/analyzers/. Ricorda che ogni file salvato è un riepilogo delle tracce analizzate in quel momento. Per produrre un'analisi dei dati robusta, sarà necessario combinare in modo appropriato i risultati di più repliche, ore, ecc., come è adatto ai dati (Figura 5 e Figura 6).
Risultati
Per raggiungere il successo utilizzando questo metodo, ci sono diversi elementi cruciali da considerare. Il primo è la configurazione fisica dell'ameba e del microscopio, il secondo è l'utilizzo corretto del software di imaging e il terzo è l'esportazione e l'analisi dei dati di imaging in modo significativo.
Prima di iniziare la registrazione microscopica, è fondamentale assicurarsi che l'ameba sia correttamente messa a fuoco sul tavolino del microscopio (Figura 1). Piuttosto che concentrarsi sull'ameba sul piano Z ottimale per i singoli dettagli, qui è ideale vederli leggermente sfocati in modo che diventino punti neri solidi invece del loro stato traslucido quando visti in dettaglio. Visualizzarli in questo modo consentirà al software di imaging e al software di tracciamento di trovare ogni singola ameba molto più facilmente quando il file viene convertito in binario (Figura 2). Sapere qual è l'obiettivo nel software di imaging, ovvero che ogni ameba appaia come un cerchio bianco ben definito, può aiutare il lettore a trovare la messa a fuoco corretta quando scatta le immagini originali in campo chiaro. Quindi, con ogni cerchio chiaramente definito, il software di tracciamento sarà in grado di tracciare correttamente la motilità e raccogliere le metriche di motilità individuali per ciascuna ameba.
Dopo aver seguito le istruzioni dettagliate nel protocollo sopra elencato per il software di imaging e il software di tracciamento e aver fatto riferimento al video associato per assistere nei primi passaggi cruciali dell'utilizzo del software di imaging, è il momento di esportare i dati del software di imaging per la quantificazione e l'analisi dei dati. L'output grezzo del software di tracciamento sarà simile a quello mostrato nella Figura 3. Qui, è importante verificare che il numero di spot nelle tracce esportate sia corretto per ciò che ci si aspetta (ad esempio, se si chiede che il 93% dei fotogrammi sia presente in ogni traccia e si hanno 100 fotogrammi totali nel video, ogni traccia esportata dovrebbe avere un numero maggiore o uguale a 93 spot). Se i punti non soddisfano i requisiti, potrebbe essere necessario tornare indietro attraverso i passaggi del software di tracciamento per assicurarsi che i parametri richiesti siano stati impostati correttamente.
Dall'esportazione non elaborata, iniziare a creare il foglio di analisi dei dati (Figura 4). È importante ricordare che ogni traccia rappresenta una singola ameba all'interno di una singola replica. Pertanto, come mostrato nella Figura 4, Figura 5 e Figura 6, è necessario calcolare la media di tutte le tracce per un set di fotogrammi o un punto temporale (Figura 4) e questo processo deve essere eseguito per ogni set di fotogrammi o punto temporale in un'intera serie (ad esempio, se vengono riprese un totale di 3 ore di video e i punti dati vengono divisi per l'ora, quindi ci saranno tre set di fotogrammi/ora da analizzare per replica, Figura 5). Infine, da questa combinazione di medie in ogni set di frame in ogni replica, i dati medi devono essere combinati da ogni replica in un unico spazio in modo che i dati di più repliche possano essere analizzati per determinare la media reale e la deviazione standard per punto temporale (Figura 6).
Le medie di ciascuna replica verranno utilizzate per l'analisi dei dati e la media combinata e la deviazione standard o l'errore standard di tutte le repliche verranno utilizzate per la rappresentazione grafica (come mostrato in un esempio nella Figura 7). Se si analizzano i dati come abbiamo fatto qui, che sono più campioni seguiti su più punti temporali, è più appropriato analizzarli utilizzando un'ANOVA di misura ripetuta a 2 vie con un test di Tukey post hoc. Questo ci permette di determinare le differenze tra i campioni in ogni punto temporale e anche di determinare le differenze all'interno di ciascun campione nel tempo.

Figura 1: L'ameba appare come forme scure opache nella microscopia a campo chiaro. Ingrandita l'immagine rappresentativa dell'ameba con ingrandimento 4x, leggermente sfocata per apparire come occhiaie solide. Barra della scala = 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
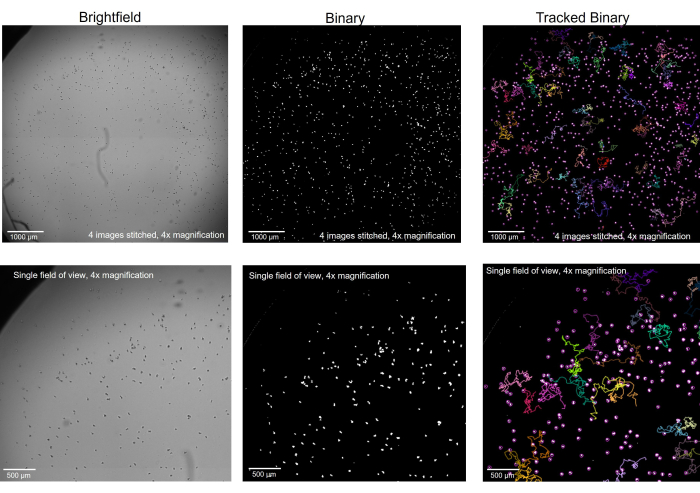
Figura 2: Ameba ripresa al microscopio in campo chiaro convertita in binaria e tracciata. L'ameba con ingrandimento 4x, in campo chiaro (a sinistra), è stata convertita in binaria con gli artefatti rimossi (al centro) e, dopo l'inseguimento, con tracce selezionate visualizzate (a destra). Riga superiore: un intero pozzetto ripreso unendo insieme 4 immagini, barra di scala = 1000 μm. Riga inferiore: la dimensione di una singola immagine prima della cucitura, barra della scala = 500 μm. Clicca qui per visualizzare una versione più grande di questa figura.
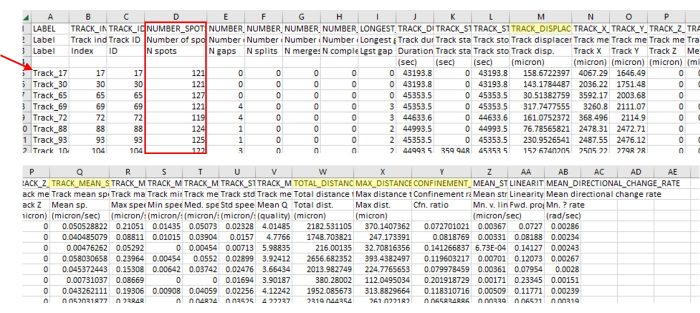
Figura 3: L'output dell'analisi immediata dei dati del software di imaging e tracciamento contiene un'ampia varietà di tipi di dati. L'output rappresentativo del tracciamento è mostrato nella Figura 2, che è un singolo video. Prendere nota dei numeri di traccia (freccia rossa) che indicano che il software di tracciamento ha rimosso correttamente le tracce che non erano allineate con i parametri. In questo esempio, solo 71 delle 5385 tracce identificate sono allineate ai parametri. Questo rapporto è normale, date linee guida così rigide. Questo numero di tracce è anche in linea con il numero di amebe utilizzate in questo protocollo (ad esempio, se una piastra da 96 pozzetti viene seminata con 200 μL di 7,5 x 103 CFU/mL per pozzetto, allora ci si dovrebbe aspettare circa 1.500 amebe nel pozzetto e all'incirca altrettante visibili in un campo visivo di 4 punti. Probabilmente ci saranno molte più tracce di quante siano le amebe poiché l'ameba cammina dentro e fuori dal campo visivo, generando nuove tracce). Questo numero di traccia è di nuovo evidente nella Figura 2, dove sono visibili solo poche tracce rispetto a un gran numero di punti. Controllare sempre il numero di punti nel binario (riquadro rosso) per assicurarsi che siano incluse solo le lunghezze corrette del binario. Ad esempio, qui, includiamo più del 93% dei fotogrammi e c'erano 127 fotogrammi in questa sezione, quindi tutti i numeri di spot dovrebbero essere superiori a 118. Evidenziate in giallo sono le misure menzionate nel protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
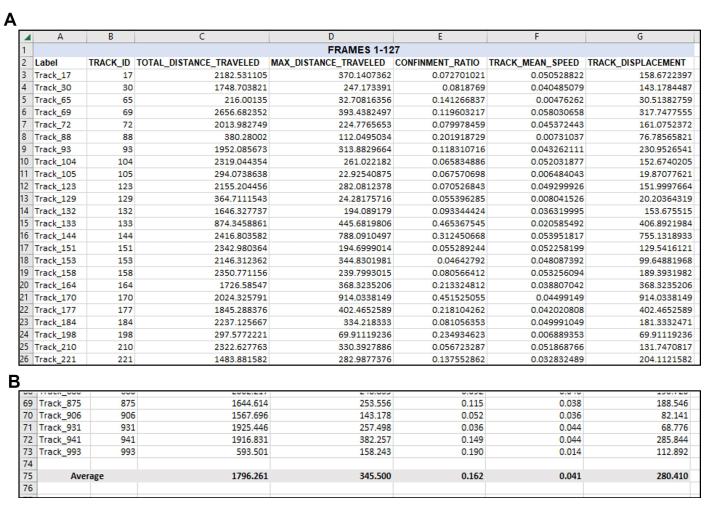
Figura 4: Dati riorganizzati secondo necessità dopo l'output iniziale dei dati. Organizzazione dei dati desiderati dopo l'esportazione. (A) Le misurazioni pertinenti scelte per la quantificazione sono state copiate dall'esportazione del software di tracciamento (Figura 3) e incollate in un nuovo foglio di calcolo. (B) Dopo che le misurazioni desiderate sono state organizzate nel nuovo foglio di calcolo, dovrebbe essere calcolata la media di ciascuna traccia. Pertanto, in questo esempio rappresentativo, la distanza totale, la distanza massima, il confinamento, la velocità media e lo spostamento di ogni traccia utilizzabile in questo singolo video sono stati mediati a un numero singolare per ogni misurazione. Si noti ancora una volta che un totale di 71 tracce ha soddisfatto i parametri per i fotogrammi 1-127. Probabilmente ci sarà un numero diverso di tracce adatte da ogni video o set di fotogrammi analizzato, come evidente nella Figura 5. Clicca qui per visualizzare una versione più grande di questa figura.
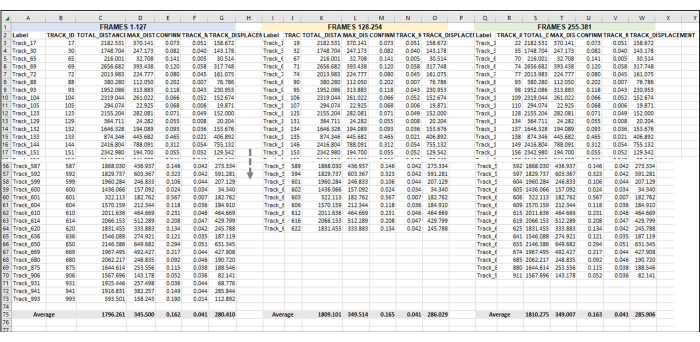
Figura 5: Fotogrammi sequenziali impostati per l'analisi di un'intera serie di immagini o video. Questa è un'immagine rappresentativa dell'aggiunta di video sequenziali all'analisi dei dati. Supponendo che i fotogrammi 1-127 costituiscano l'ora 1 del video (qui, 1 ora è composta dallo scattare un'immagine una volta ogni 28 s). I fotogrammi 128-254 saranno l'ora 2 del video e i fotogrammi 255-381 saranno l'ora 3 del video. Combinare i dati esportati (come è stato esportato nella Figura 3) da tutte le ore in un unico foglio per lavorare tutti in una volta. Come è stato fatto nella Figura 4, verrà calcolata la media dei dati di tutte le tracce utilizzabili per ogni set di fotogrammi/h. Tutto ciò che è riportato nella Figura 5 è costituito dai dati di una replica o di un campione. Se sono presenti 3 repliche, ci saranno 3 schede di fogli di calcolo separate disposte in modo identico e i dati di queste verranno inseriti in una nuova scheda, come illustrato nella Figura 6. Clicca qui per visualizzare una versione più grande di questa figura.
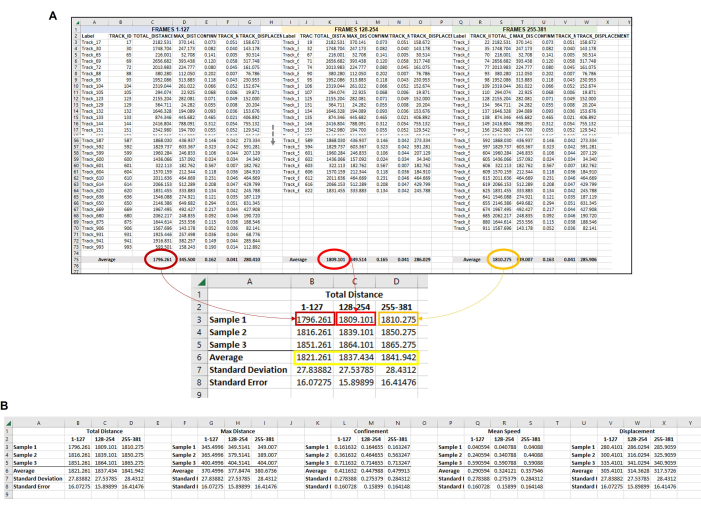
Figura 6: Dati compositi di tutte le ameba in ciascun set di telai utilizzati per rappresentare una singola replica. (A) Tutte le medie di ciascun fotogramma di cui alla Figura 5 devono essere raccolte in una posizione centrale in modo che l'analisi finale dei dati possa essere completata. In questa immagine rappresentativa, vengono mostrate le medie della distanza totale dei primi tre set di fotogrammi (o ore). Questa operazione deve essere ripetuta per ogni campione/condizione/replica in esecuzione. Quindi, è necessario calcolare la media delle medie di ciascun campione di ciascun set di fotogrammi (riquadro giallo). Questo è il punto dati finale da cui è possibile calcolare la deviazione standard e l'errore standard. Le medie individuali di ciascun campione (qui, i numeri in B3, B4 e B5 per il campione di distanza totale 1; C3, C4 e C5 per il campione di distanza totale 2, ecc.) verrà utilizzato per eseguire l'analisi statistica. Questo processo verrà ripetuto per tutte le misurazioni richieste (distanza massima, confinamento, velocità media, spostamento, ecc.) (B) Per fare una rappresentazione grafica della quantificazione, utilizzare i numeri nella casella gialla come punti dati da utilizzare per il grafico finale. Clicca qui per visualizzare una versione più grande di questa figura.
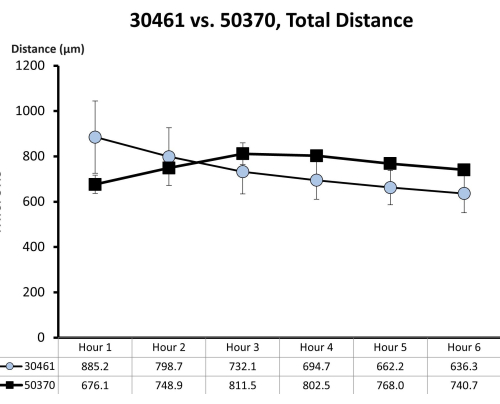
Figura 7: Dati grezzi sulla motilità per ATCC 30461 e ATCC 50370. I dati grezzi (qui rappresentati come media ± SE per ogni ora) sono stati precedentemente raccolti e non pubblicati per studi precedenti 18,19. Questa quantificazione della motilità dimostra che queste due amebe sono simili nelle loro prime 6 ore di motilità (misurata dalla distanza totale in micron percorsa in quell'ora) in 1/4 della soluzione di Ringer su una superficie di vetro. Ogni punto temporale rappresenta tre repliche separate, ciascuna composta da 20-200 tracce di ameba. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Essere in grado di tracciare e quantificare la motilità di amebe come Acanthamoeba, che sono organismi microscopici aderenti non influenzati dal movimento browniano a bassa velocità 9,10, rivela una notevole quantità di informazioni sul comportamento dell'ameba e può migliorare notevolmente l'illuminazione riguardo ai metodi di prevenzione dell'AK. Questo protocollo è stato dettagliato in recenti pubblicazioni e i dati sono stati confermati o combinati con altre analisi di dati simili18,19. Notiamo qui che la velocità dell'ameba descritta con questo metodo è simile a quella che è stata pubblicata da altri gruppi. Questo protocollo è notevole per la sua capacità di essere utilizzato praticamente su qualsiasi trattamento di superficie o ameba, che è trasparente alla luce, ma è importante notare che mentre questo protocollo potrebbe potenzialmente essere modificato per funzionare con altri organismi, è stato finora ottimizzato solo per Acanthamoeba. Il protocollo di cui sopra ha sempre funzionato bene in laboratorio, ma vengono fornite le seguenti modifiche per modificare il metodo in base ad altre esigenze o risolvere situazioni difficili.
Determinazione dei parametri di tracciamento: Nel protocollo di cui sopra, sono stati elencati il collegamento frame-to-frame, la chiusura del gap, il gap massimo di frame e il numero di punti sulla traccia, che erano i più applicabili per le pubblicazioni recenti. Tuttavia, è possibile che altri parametri siano più adatti ad altre esigenze. Inoltre, potrebbero esserci parametri che altri utenti vorrebbero utilizzare ma che non sono stati utilizzati qui (come la distanza massima di una traccia sotto i filtri della traccia). Ulteriori informazioni su ciascun parametro e su ciò che descrivono sono disponibili qui sul sito Web (vedi riferimento21). Quando decidi quali parametri e filtri sono più rilevanti per altri esperimenti e come dovrebbero essere impostati, pensa a ciò che è statisticamente razionale per un progetto specifico; Ad esempio, si vorrebbero i dati di un'ameba che si allontana e poi torna nel campo visivo? O si vorrebbero conservare i dati di un'ameba che non si è mossa molto ma è stata comunque etichettata come una traccia? e cosa ha senso per il numero di fotogrammi e il periodo di tempo tra i fotogrammi in cui le immagini sono state registrate.
Cambiamento delle dimensioni dei blob: abbiamo scoperto che è estremamente difficile con qualsiasi software o configurazione del microscopio - basata sulle tecnologie attuali e sui software disponibili per i laboratori standard - tracciare con precisione il numero di amebe in un aggregato mentre cambia nel tempo. Se si tiene traccia della dimensione di un blob e si cerca di correlare tale dimensione con il numero di organismi in esso contenuti, utilizzare una curva standard generata dopo esperimenti ripetuti per prevedere matematicamente la dimensione di un aggregato. Ad esempio, gli aggregati sono stati creati seminando pozzi con un intervallo di numeri di amebe, come 8, 16, 32, 125, 250, 500, 1.000 e 2.000 cellule per pozzetto. Sono state generate immagini timelapse in vari punti temporali di ciascun pozzo per 24 ore. Ogni sferoide (che era di un numero noto di amebe) è stato analizzato per un'area bidimensionale ed è stata generata una curva standard in funzione del conteggio delle amebe rispetto alle dimensioni degli sferoidi nel tempo. Questo esperimento è stato ripetuto almeno in triplice copia per darci una deviazione standard appropriata di qualsiasi curva generata.
Determinare la direzionalità dell'ameba: anche se questo potrebbe non essere necessario per studi particolari, può essere utile comprendere la direzionalità dell'ameba. Ciò fornirebbe dati sugli effetti chemiotattici del trattamento o dell'esperimento. Questi dati possono essere utilizzati anche per creare dati visivi (grafici) e quantitativi. Questo è disponibile tramite lo strumento Chemiotassi e migrazione, che è un plug-in gratuito per il software di imaging. È disponibile sul sito Web insieme alla guida all'applicazione e alle immagini e ai filmati di esempio (vedere la tabella dei materiali).
Dinamiche di movimento dettagliate: altri gruppi hanno esaminato le dinamiche di diffusione e le traiettorie diffusive con analisi statistiche altamente avanzate e sviluppate oltre a quanto discusso qui 9,10,22. Questi potrebbero essere presi in considerazione in base alle esigenze dell'utente.
Come per ogni metodo di successo, il protocollo descritto in questo manoscritto è stato sottoposto a molti cicli di risoluzione dei problemi per raggiungere la coerenza. Sebbene sia possibile realizzare eccellenti video tracciabili di alta qualità scattando un'immagine ogni secondo (o alla velocità massima consentita dal microscopio, potrebbe essere inferiore a un secondo), questo crea file estremamente grandi, con cui può essere difficile lavorare. Questo è realisticamente adatto solo per video a brevissimo termine registrati per un massimo di pochi minuti. Al contrario, scattando un'immagine ogni pochi secondi, abbiamo scoperto che il comportamento dell'ameba è ancora molto tracciabile in base alla velocità di questa specie, ed è possibile creare video praticabili nell'arco di ore o giorni. Abbiamo scoperto che la quantità massima di tempo tra le immagini è di 30 s, che è il tempo necessario affinché l'ameba venga tracciata con precisione dal software di imaging. L'intervallo di tempo scelto dall'utente deve essere considerato utilizzando i vincoli noti della velocità con cui il microscopio può registrare le immagini, quante immagini per pozzetto sono necessarie e quanti pozzetti vengono registrati ad ogni intervallo. Allo stesso modo, i parametri menzionati in questo protocollo riguardanti lo spostamento massimo, gli spazi tra i fotogrammi consentiti, i fotogrammi minimi necessari e così via, sono stati determinati attraverso tentativi ed errori da questo laboratorio per creare informazioni sulla traccia che includono le tracce di ameba più complete e ignorano il rumore creato da tracce incomplete, ameba che si unisce o lascia il palco a metà video o errori creati dalla confusione del software di imaging come quando due ameba si incontrano a metà traccia e poi si separano. Questi tipi di errori e tracce incomplete sono comprensibilmente alti quando si creano video estremamente lunghi (da ore a giorni) di organismi biologici microscopici che interagiscono costantemente tra loro e sono la ragione per cui una parte molto grande delle tracce errate deve essere rifiutata. Va notato che la fase di riempimento dei fori nel protocollo è, secondo l'esperienza di questo laboratorio, importante per ridurre l'errore nel modo in cui il software di imaging traccia l'ameba. Assicurandosi che ogni ameba sia un cerchio pieno anziché, a volte, una ciambella o una forma a c, è molto più probabile che il software sia in grado di tracciare con successo ogni ameba.
Inoltre, come discusso, ci sono molti parametri disponibili per un utente per analizzare un'immagine o un video. Sulla base delle esigenze sperimentali, abbiamo costantemente beneficiato al massimo dall'analisi della distanza totale, della distanza massima, della velocità e dello spostamento. Questi sono discussi in profondità (incluso l'uso di diverse deformazioni e superfici) con interpretazioni grafiche in precedenti pubblicazioni18,19. Questi quattro parametri consentono a un utente di estrapolare la capacità di un'ameba di percorrere distanze lineari e quanto tempo impiega per farlo, il che aiuta a comprendere il suo comportamento in relazione alla contaminazione delle lenti a contatto. Il recupero e l'analisi di questi parametri è un lavoro impegnativo, come descritto in dettaglio nelle nostre cifre. Mentre lavoravamo con fogli di calcolo di grandi dimensioni e numerosi dall'output del software di imaging, abbiamo limitato gli errori involontari creando modelli di fogli di calcolo bloccati che calcolavano automaticamente tutte le analisi richieste. Tuttavia, un possibile miglioramento di questo metodo consiste nello scrivere uno script in grado di gestire questi dati, ordinarli e analizzarli.
In conclusione, qui viene descritto un metodo accessibile e accurato per misurare le dimensioni e la motilità di Acanthamoeba in molte condizioni diverse. Abbiamo dimostrato che questo metodo può essere applicato a molti ceppi diversi di ameba e abbiamo sottolineato che, sebbene possano esserci parametri semplici per ottenere informazioni sulla motilità, questa configurazione sperimentale può essere altamente adattata a qualsiasi esigenza specifica.
Divulgazioni
Tutti gli autori sono dipendenti di Alcon Research, LLC.
Riconoscimenti
Questo lavoro è stato finanziato da Alcon Research, LLC.
Materiali
| Name | Company | Catalog Number | Comments |
| ¼ Ringer’s solution | ThermoFisher Scientific | BR0052G | Oxoid Ringers Solution Tablets. Follow directions to make one-quarter strength instead of full strength Ringers. |
| 10 µL pipette | Eppendorf Research | 3123000039 | 2 µL-20 µL single channel |
| 10 µL pipette tips | Neptune Scientific, San Diego, CA, USA | BT10.N | 10 µL Universal Barrier Tip |
| 48 well plate | Millipore Sigma, | CLS3548 | Corning Costar TC-Treated Multiple Well Plate: polystyrene plate, flat bottom wells, sterile, with lid |
| 50 mL conical tubes (1 for each sample, 1 for each pass 2 sample) | Fisher Scientific | Falcon 352098 | Falcon 50 mL High Clarity Conical Centrifuge Tubes, polypropylene |
| 96-well plate | Millipore Sigma, Burlington, MA, USA | CLS3596 | Corning Costar TC-Treated Multiple Well Plate: polystyrene plate, flat bottom wells, sterile, with lid |
| Acanthamoeba | American Type Culture Collection, Manassas, VA, USA | ATCC 30461 | This protocol has been verified for ATCC 50655, 30872, 50702, 30010, 30461, 50370, 50703, 30137, PRA-115, and PRA-411 |
| Axenic culture media (AC6) | Made in house | n/a | Containing 20 g biosate peptone, 5 g glucose, 0.3 g KH2PO4, 10 µg vitamin B12, and 1 glass5 mg l-methionine per liter of distilled deionized water. Adjust pH to 6.6-6.95 with 1 M NaOH and autoclave at 121 °C for 20 min, store at room temperature for up to 3 months. |
| Centrifuge and appropriate rotor | Thermo Scientific, Waltham, MA, USA | Sorvall ST 40R | Any equivalent centrifuge and rotor are acceptable so long as it can spin 50 mL conical tubes at 500 x g for 5 min |
| Chemotaxis and Migration Tool | Free software based on ImageJ, available at https://ibidi.com/chemotaxis-analysis/171-chemotaxis-and-migration-tool.html | ||
| Disposable hemocytometer | Bulldog Bio, Portsmouth, NH, USA | DHC-N01 | Neubauer Improved 2-Chip Disposable Hemocytometer, Individually packaged, Nonpyrogenic |
| ImageJ software with Trackmate plugin (this protocol written with Trackmate version 6.0.2.) | Free software developed by the National Institutes of Health, available at imagej.net. Trackmate plugin available at https://imagej.net/plugins/trackmate/ | ||
| Microscope, preferably with automated moveable stage | Nikon, Tokyo, Japan | A Nikon Eclipse Ti-U Microscope was used in this study and the automated moveable stage was utilized to be able to record images in multiple wells at a time. | |
| NIS-Elements software | Nikon | ||
| Serological pipette | Fisher Scientific, Hampton, NH, USA | BrandTech 26331 | BrandTech accu-jet pro Pipet Controller |
| Serological pipette tips | VWR | 5 mL: 76201-710 10 mL: 170356 25 mL: 89130-900 50 mL: 75816-088 | VWR Serological Pipette, Non-Pyrogenic |
| Sterile aluminum transmission flow cell | Biosurface Technologies Corporation, Bozeman, MT, USA | FC 81-AL | Anodized aluminum single channel transmission flow cell with 96-well plate footprint for use with an inverted microscope |
| T75 Flasks | VWR, Radnor, PA, USA | 734-2316 | VWR Tissue Culture Flask, 182.5 cm, Surface treated, Plug seal cap, Sterile |
Riferimenti
- Randag, A. C., et al. The rising incidence of Acanthamoeba keratitis: A 7-year nationwide survey and clinical assessment of risk factors and functional outcomes. PLoS One. 14 (9), e0222092 (2019).
- Szentmary, N., et al. Acanthamoeba keratitis - Clinical signs, differential diagnosis and treatment. J Curr Ophthalmol. 31 (1), 16-23 (2019).
- Carnt, N., et al. Acanthamoeba keratitis: confirmation of the UK outbreak and a prospective case-control study identifying contributing risk factors. Br J Ophthalmol. 102 (12), 1621-1628 (2018).
- Verani, J. R., et al. National outbreak of Acanthamoeba keratitis associated with use of a contact lens solution, United States. Emerg Infect Dis. 15 (8), 1236-1242 (2009).
- Tu, E. Y., Joslin, C. E. Recent outbreaks of atypical contact lens-related keratitis: what have we learned. Am J Ophthalmol. 150 (5), 602-608 (2010).
- International Organization for Standardization. ISO 14729:2001/A1. Ophthalmic optics-Contact lens care products-Microbiological requirements and test methods for products and regimens for hygienic management of contact lenses. International Organization for Standardization. , (2010).
- . ASC Z80, Parent Committee Meeting Available from: https://www.thevisioncouncil.org/sites/default/files/ASCZ80_ParentCommitteeMinutes_February_27_2018_FINALMar19-2018.pdf (2023)
- Rayamajhee, B., et al. Acanthamoeba, an environmental phagocyte enhancing survival and transmission of human pathogens. Trends Parasitol. 38 (11), 975-990 (2022).
- Reverey, J. F., et al. Superdiffusion dominates intracellular particle motion in the supercrowded cytoplasm of pathogenic Acanthamoeba castellanii. Sci Rep. 5, 11690 (2015).
- Thapa, S., Lukat, N., Selhuber-Unkel, C., Cherstvy, A. G., Metzler, R. Transient superdiffusion of polydisperse vacuoles in highly motile amoeboid cells. J Chem Phys. 150 (14), 144901 (2019).
- Rudell, J. C., et al. Acanthamoeba migration in an electric field. Invest Ophthalmol Vis Sci. 54 (6), 4225-4233 (2013).
- Fukaya, S., Aoki, K., Kobayashi, M., Takemura, M. Kinetic analysis of the motility of giant virus-infected amoebae using phase-contrast microscopic images. Front Microbiol. 10, 3014 (2019).
- Fukaya, S., Takemura, M. Kinetic analysis of Acanthamoeba castellanii infected with giant viruses quantitatively revealed process of morphological and behavioral changes in host cells. Microbiol Spectr. 9 (1), 0036821 (2021).
- Cheng, H. J., Hsu, C. H., Hung, C. L., Lin, C. Y. A review for cell and particle tracking on microscopy images using algorithms and deep learning technologies. Biomed J. 45 (3), 465-471 (2022).
- Mathieu, E., et al. Time-lapse lens-free imaging of cell migration in diverse physical microenvironments. Lab Chip. 16 (17), 3304-3316 (2016).
- Svensson, C. M., Medyukhina, A., Belyaev, I., Al-Zaben, N., Figge, M. T. Untangling cell tracks: Quantifying cell migration by time lapse image data analysis. Cytometry A. 93 (3), 357-370 (2018).
- Piltti, K. M., et al. Live-cell time-lapse imaging and single-cell tracking of in vitro cultured neural stem cells - Tools for analyzing dynamics of cell cycle, migration, and lineage selection. Methods. 133, 81-90 (2018).
- Campolo, A., et al. Continuous real-time motility analysis of Acanthamoeba reveals sustained movement in absence of nutrients. Pathogens. 10 (8), 995 (2021).
- Campolo, A., Patterson, B., Lara, E., Shannon, P., Crary, M. Complete recovery of Acanthamoeba motility among surviving organisms after contact lens care disinfection. Microorganisms. 11 (2), 299 (2023).
- Crary, M. J., Walters, R., Shannon, P., Gabriel, M. M. Variables affecting the recovery of Acanthamoeba trophozoites. Pathogens. 10 (2), 221 (2021).
- . imagej Available from: https://imagej.net/plugins/trackmate/tutorials/getting-started (2024)
- Cherstvy, A. G., Nagel, O., Beta, C., Metzler, R. Non-Gaussianity, population heterogeneity, and transient superdiffusion in the spreading dynamics of amoeboid cells. Phys Chem Chem Phys. 20 (35), 23034-23054 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon