Method Article
Medición del potencial de biometano de los residuos de restos de comida codigeridos anaeróbicamente con lodos activados por residuos mediante respirometría
En este artículo
Resumen
Este protocolo describe una buena práctica para determinar la producción de metano y los parámetros cinéticos microbianos mediante respirometría para la microbiota anaeróbica que codigiere los residuos de restos de alimentos y los lodos activados por residuos.
Resumen
El uso de la respirometría para estudiar la biocinética de la microbiota en el tratamiento de aguas residuales o en la digestión de lodos de aguas residuales se ha vuelto más frecuente en las últimas décadas. El uso de la respirometría para examinar la biocinética de la microbiota anaeróbica que co-digiere flujos de residuos orgánicos, como aguas residuales, lodos y restos de comida, es un área de investigación activa. Hasta la fecha, no se ha publicado ningún protocolo visualizado sobre el tema. En consecuencia, en este protocolo, configuramos un respirómetro para medir la producción y el caudal de metano a lo largo del tiempo utilizando tres proporciones diferentes de alimentos a microorganismos (F:M) y residuos de restos de alimentos y lodos activados por residuos como sustratos. Los datos resultantes, junto con las mediciones de la utilización del sustrato, proporcionan la base para comprender cómo las diferentes concentraciones de sustrato influyen en la velocidad a la que la microbiota anaeróbica produce metano. Además, este protocolo presenta un método para desarrollar parámetros biocinéticos (por ejemplo, tasa de producción de metano, constante y rendimiento). Otros pueden utilizar este protocolo de respirometría para examinar la degradación orgánica en condiciones anaeróbicas y desarrollar parámetros microbianos.
Introducción
Los investigadores estudian la actividad microbiana a escala de laboratorio utilizando una variedad de enfoques, incluidos estudios por lotes, microcosmos y respirometría, entre otros. Los respirómetros se pueden utilizar para medir la respiración celular a través de las fases de crecimiento y/o descomposición de una comunidad microbiana mediante la observación del consumo de sustrato y la producción del producto finalen condiciones controladas. Los resultados de los estudios con respirómetros a escala de banco también se pueden utilizar para estimar los parámetros biocinéticos para la construcción de modelos de proceso2. Los respirómetros se han utilizado para examinar la actividad microbiana aeróbica y anaeróbica; Sin embargo, los estudios que utilizan la respirometría para medir el potencial de biometano (BMP), especialmente de sustratos orgánicos mixtos, es un área de investigación en curso 3,4.
Los compuestos orgánicos de las aguas residuales domésticas son reconocidos como una fuente renovable viable de energía química5. La digestión anaeróbica de lodos de aguas residuales (es decir, lodos primarios y lodos activados por residuos, WAS) se ha utilizado para producir biogás rico en metano en plantas de tratamiento de aguas residuales (EDAR) durante más de un siglo6. Sin embargo, la digestión de múltiples flujos de residuos orgánicos, como los residuos de restos de comida con WAS, se ha vuelto frecuente solo en los últimos años y sigue siendo un área activa de investigación. Los residuos de restos de alimentos son un flujo constante de residuos de material orgánico de alta densidad en muchos países desarrollados, que representa aproximadamente el 25% de la masa de los vertederos en los Estados Unidos7. Además de desviar una parte de los restos de comida de la eliminación en los vertederos, la combinación de restos de comida y WAS en un escenario de codigestión es ventajosa debido al mayor volumen de biogás producido (en relación con un solo flujo de residuos orgánicos). El biogás suele contener entre un 60 % y un 70 % de metano, entre un 30 % y un 40 % de dióxido de carbono y trazas de otros gases (por ejemplo, sulfuro de hidrógeno)8. El biogás puede limpiarse y quemarse in situ en las EDAR utilizando una tecnología combinada de calor y electricidad para compensar algunas de las necesidades de energía eléctrica y térmica9.
Varios estudios han examinado el potencial de biometanización y los parámetros biocinéticos de la microbiota anaeróbica que co-digiere residuos orgánicos1. Los estudios disponibles en la literatura han utilizado ensayos por lotes en frascos de suero donde la producción de metano se mide en puntos discretos a lo largo del experimento, mientras que otros han medido la producción de metano utilizando caudalímetros conectados directamente a biorreactores de banco o a escala piloto 2,10,11. La medición continua de la producción de metano utilizando un respirómetro, como el descrito en este protocolo, puede proporcionar mediciones continuas y precisas de metano a partir de un gran número de muestras realizadas en una variedad de condiciones experimentales 1,12. Si bien varios estudios han medido la producción de metano a partir de la co-digestión de WAS junto con otros sustratos orgánicos, como biorresiduos, grasas, aceites, grasas y desechos agrícolas 10,13,14, aún queda un trabajo significativo para identificar las tasas de producción de metano a partir de la gran variedad de escenarios de co-digestión. Además, hasta la fecha, no hay ningún protocolo disponible que proporcione un enfoque detallado, paso a paso, utilizando representaciones visuales para la medición de la producción de metano a partir de la codigestión de restos de alimentos y WAS. En consecuencia, este estudio presenta un protocolo de respirómetro para medir la producción de metano y derivar parámetros biocinéticos utilizando una mezcla de aguas residuales diluidas, WAS y residuos de restos de alimentos como sustratos. Se utilizaron diferentes proporciones de alimento a microorganismo (F:M) para ayudar a dilucidar los cambios en la producción de metano. Otras mediciones incluyen sólidos suspendidos volátiles (VSS), demanda química de oxígeno (DQO) y pH de cada muestra. Este protocolo describe la configuración del respirómetro, la creación de muestras y las mediciones críticas.
Protocolo
1. Preparación del sustrato
- Recoja ~ 1,5 L de efluente primario, ~ 1 L de lodo activado por residuos (WAS).
NOTA: Las muestras de WAS deben tomarse inmediatamente antes del experimento; sin embargo, el WAS puede almacenarse hasta 48 h a 4 °C antes del experimento sin ningún impacto perceptible en su uso como sustrato 15,16,17. - Adquiera 2 L de cultivo anaeróbico inmediatamente antes del experimento y mantenga el cultivo a 35 °C. Limite el contacto con el aire tanto como sea posible durante la transferencia del digestor anaeróbico a la botella de recolección.
NOTA: El cultivo anaeróbico utilizado en este estudio se obtuvo de una PTAR que trata 8.5 MGD (38,640 m3/d) con digestión anaeróbica de lodos primarios de aguas residuales. Una buena práctica es mantener las condiciones anaeróbicas enjuagando el frasco de recolección con gas nitrógeno antes de adquirir un cultivo anaeróbico13 y mantener las condiciones anaeróbicas durante el transporte y el almacenamiento. - Recoja los residuos de alimentos y guárdelos hasta 48 horas antes del experimento a 4 °C.
NOTA: dependiendo del diseño experimental, se debe tener cuidado de identificar los desechos de alimentos con las proporciones objetivo de carbohidratos, proteínas, etcétera. Es probable que las proporciones objetivo de compuestos orgánicos en el desperdicio de alimentos varíen según el experimento. La fracción de carbohidratos, proteínas y grasas en los alimentos recolectados puede estimarse a partir de la literatura publicada o evaluarse utilizando protocolos establecidos (por ejemplo, cromatografía de gases).
2. Preparación de suplementos nutricionales
- Prepare la solución de base mineral #1 mezclando 800 mL de agua desionizada (DI) con CoCl2·6H2O (0,25 g), FeCl3·6H2O (5 g), MnCl2·4H2O (0,05 g), NaMoO4·2H2O (0,005 g), NiCl2·6H2O (0,025 g), CuCl2·2H2O (0,007 g), ZnCl2 (0,025 g), H3BO3 (0,025 g) y Na2SeO4 (0,025 g). Diluir hasta 1 L con agua desionizada (DI).
- Prepare la solución de base mineral #2 mezclando 800 mL de agua desionizada con CaCl2 (27.7 g) y MgCl2·4H2O (101 g). Diluir hasta 1 L con agua desionizada.
- Prepare una base de nutrientes mezclando 800 mL de agua desionizada con NH4Cl (38,2 g) y Na2SO4 (15 g). Ajuste el pH a 7,0 utilizando 3,64 N de NaOH en agua desionizada y diluya hasta 1 L con agua desionizada.
3. Preparación de la muestra
- Combine los desechos de alimentos (Tabla 2) en una licuadora (Figura 1) para crear una mezcla. Asegúrese de que la mezcla esté libre de partículas grandes de desperdicio de alimentos. Diluya los desechos de alimentos con agua desionizada para ayudar a mezclar. Anote la cantidad de agua de dilución que se utilizará al calcular las mediciones de la demanda química de oxígeno (DQO). Este desperdicio de alimentos diluido se conoce como "residuo de trabajo". Coloque los residuos de trabajo en una botella de plástico de 1 L y guárdela a 4 °C.
- Etiquete cuatro vasos de precipitados de 2 L de acuerdo con la Tabla 1. Coloque los vasos de precipitados en un plato para remover y agregue una barra para remover grande. Combine el desperdicio de alimentos, el WAS y la dilución (agua desionizada para el control y efluente primario para los tratamientos) de acuerdo con la Tabla 1 en los vasos de precipitados de 2 L.
- Agregue 12 ml de solución base mineral # 1, solución base mineral # 2 y base nutritiva.
- Añadir 2,4 g de NaHCO3 (en polvo) a cada vaso de precipitados y agitar durante 30 s. Etiquete ocho frascos de respirometría de acuerdo con la Tabla 1 y agregue una barra agitadora magnética.
NOTA: Esto creará duplicados del control y tres tratamientos en diferentes proporciones F:M. - Añada cultivo anaeróbico a cada vaso de precipitados de 2 L de acuerdo con la Tabla 1 y revuelva. Mida inmediatamente 500 ml de una mezcla del vaso de precipitados con un cilindro graduado y transfiérala a una botella de respirómetro etiquetada, enjuáguela con gas nitrógeno y luego táptela inmediatamente.
NOTA: Se debe tener cuidado de limitar el contacto de la microbiota anaeróbica con el oxígeno atmosférico (si se dispone de ella, se debe utilizar una cámara anaeróbica para la transferencia).
4. Cuantificación de las condiciones iniciales
- Utilice la muestra restante de la sección 3 (~200 mL) para medir el pH, la DQO total (dqoT), la DQO soluble (dqo), los sólidos suspendidos totales (SST) y los sólidos suspendidos volátiles (VSS) para cada muestra18.
- Si es necesario, diluya las muestras con agua desionizada en función de los límites de detección del equipo de medición.
NOTA: Se utilizaron los procedimientos del fabricante para las mediciones de DQO.
- Si es necesario, diluya las muestras con agua desionizada en función de los límites de detección del equipo de medición.
5. Configuración del respirómetro
- Ajuste el respirómetro (Figura 2) a la configuración anaeróbica baja.
- Presione el botón de reinicio y el botón de encendido simultáneamente.
NOTA: Esto es específico del modelo utilizado en este estudio. - Ajuste el enfriador (Figura 3) a 35,5 °C.
- Llene cada depurador deCO2 y humedad (Figura 4 y Figura 5) con una mezcla 50/50 de gránulos de CaSO4 y KOH en el centro, rodeados de lana de vidrio a cada lado.
- Conecte los tubos y las agujas de los frascos de muestra al depurador y luego del depurador a la entrada de gas (Figura 6).
- En la computadora portátil con respirómetro, ejecute el programa de respirómetro RSA-8-v2.0.
NOTA: Este paso es específico del modelo utilizado en este estudio. - Seleccione todas las botellas en el programa y seleccione Editar > etiquetas de datos. Nombra todas las botellas.
NOTA: Este paso es específico del modelo utilizado en este estudio. - Comience a medir la producción de gas activando el botón de inicio en el programa. Configure el programa para medir los datos al final de cada media hora. Supervise la producción de gas seleccionando Gráfico de tarifas o Gráfico de volúmenes.
NOTA: Este paso es específico del modelo utilizado en este estudio. - Después del experimento (~ 7 días), detenga la ejecución en el programa, apague el enfriador y apague el módulo RSPF. Guarde el archivo de datos como un archivo CSV y, a continuación, conviértalo en un documento de MS Excel.
NOTA: Este paso es específico del modelo utilizado en este estudio.
6. Mediciones posteriores a la respiración
- Mida el pH, EL TSS, EL VSS y la DQO en las muestras finales como se hace en la sección 4.
Resultados
Composición de los residuos alimentarios
El desperdicio de alimentos utilizado en este estudio consistió en cinco tipos diferentes de alimentos que normalmente se sirven en un comedor universitario. Cada muestra de alimento tenía cantidades variables de grasas, carbohidratos y proteínas, que se enumeran en la Tabla 2. 19 Los residuos de restos de comida mezclados tenían un 44% de carbohidratos, un 36% de proteínas, un 16% de grasas y un 4% de otros materiales. Se utilizó una masa aproximadamente igual de cada tipo de alimento (56 g a 86 g) para proporcionar un sustrato orgánico representativo para la co-digestión anaeróbica. Posteriormente, se varió la masa de residuos de restos de alimentos para lograr la relación F:M deseada para cada escenario examinado (0,3, 0,7 y 1,1).
Mediciones volátiles, sólidas, orgánicas y en suspensión
En la Tabla 3 se encuentran los resultados de la VSS inicial y final y de la demanda inicial y final de oxígeno. La demanda de oxígeno se presenta como DBO5, que se convirtió a partir de DQO utilizando la relación de conversión aceptada (DQO = 1,6 DBO5)8. Como se muestra, las concentraciones iniciales de VSS (también representadas por la masa en la Tabla 3) aumentaron desde el control hasta la relación F:M más grande (1.1). Cada F:M examinado mostró destrucción de VSS, o conversión anaeróbica de compuestos orgánicos en productos finales gaseosos de metano y dióxido de carbono. Debido a la conversión, la concentración de VSS disminuyó desde las mediciones iniciales hasta las mediciones finales tomadas al final del experimento. La cantidad de VSS destruidos aumentó desde el control a relaciones F:M más grandes. Inesperadamente, la destrucción del VSS para el escenario F:M = 0,7 superó el escenario F:M = 1,1, tal vez debido a la inhibición en el escenario F:M de 1,1.
Las concentraciones iniciales de demanda de oxígeno medidas siguieron la misma tendencia que la VSS, es decir, aumentaron desde el control hasta la relación F:M más grande (Tabla 3). De manera similar a la destrucción de VSS, las concentraciones deDBO5 disminuyeron entre las concentraciones inicial y final, con la excepción del control. La demanda de oxígeno aumentó en el control, probablemente debido a la descomposición endógena. A diferencia de la destrucción de VSS, la reducción de la demanda de oxígeno desde la medición inicial hasta la final fue relativamente baja para cada muestra, oscilando entre el 1 y el 3%, y no mostrando tendencia en la relación F:M. Una posible razón de esta tendencia es la conversión de materia orgánica particulada en orgánica soluble, que tiene lugar durante largos períodos de tiempo y es a menudo un paso limitante de la tasa en el metabolismo de los consorcios microbianos anaeróbicos20.
Producción de metano
Las cantidades y tasas de producción de metano variaron en el rango de relaciones F:M durante el período de estudio de 190 horas. Los resultados experimentales revelaron que las proporciones F:M más altas produjeron mayores volúmenes generales de metano (Figura 7). El control, al que no se le añadió sustrato, produjo una pequeña cantidad de metano (~72 mL) probablemente debido a la cantidad relativamente pequeña de DBO5 soluble en el lodo y/o a la descomposición endógena. Como se anticipó, la adición de sustrato en otros escenarios aumentó la producción de metano en relación con el control. El escenario F:M de 0,3 produjo cinco veces más metano, por volumen (~354 mL), que el control. El aumento de la relación F:M a 0,7 produjo 1,6 veces más metano (~574 mL) que el escenario F:M de 0,3. Del mismo modo, el aumento de la relación F:M a 1,1 produjo 1,9 veces más metano (~1098 mL) que el escenario F:M de 0,7. En el Cuadro 4 se enumeran los valores máximos observados de producción volumétrica de metano (Ymax) para cada relación F:M examinada. La tasa de metano producido a lo largo del tiempo también cambió con las relaciones F:M examinadas. Como se muestra en la Figura 8, la tasa de producción de metano, así como el tiempo durante el estudio que se produjo el metano, aumentaron a medida que aumentaba el F:M. Por ejemplo, en el escenario F:M de 0,3, no se observó producción de metano después de 129 h de estudio (con un máximo de 354 mL), mientras que el escenario F:M de 1,1 todavía producía una pequeña cantidad de metano al final del estudio. En todos los escenarios, la tasa de producción de metano disminuyó con el tiempo debido a la menor disponibilidad de sustrato. Si bien al final del estudio todavía había una abundante demanda de oxígeno disponible (Tabla 3), es posible que no estuviera en una forma biodisponible, o que el aceptor de electrones restante (por ejemplo, dióxido de carbono) para la microbiota anaeróbica haya sido limitado. Por último, una comparación del metano producido (mL) por VSS destruido observado (mg) muestra que los valores de F:M de 0,3 y 0,7 proporcionaron un rango de 1,3 a 1,6 mL/mg, mientras que el F:M de 1,1 produjo más metano por unidad de VSS destruido (3,7 mL/mg) (Tabla 4). Tchobanoglous et al. (2014) proporcionan rangos típicos para el rendimiento de gas por unidad de sólidos destruidos para materias primas comunes, que incluyen grasas (~1,4 mL/mg), grasa (~1,1 mL/mg) y proteínas (~0,7 mL/mg)8. Mata-Álvarez et al. (2014) revisaron estudios en los que se co-digerían lodos de aguas residuales con una variedad de sustratos, y diferentes proporciones de sustrato (por ejemplo, diferentes proporciones de WAS y FOG), en biorreactores a escala de banco y a escala piloto10. Descubrieron que la producción de metano reportada por unidad de VSS destruida variaba sustancialmente con los sustratos codigeridos, así como la proporción de sustratos, que oscilaba entre 0,2 mL y 1,1 mL de biogás por mg VS destruido. Los resultados representativos de este estudio, especialmente para F:M de 0,3 y 0,7, se comparan favorablemente con los resultados de los estudios comparativos.
Parámetros biocinéticos
La producción de metano a lo largo del tiempo se puede utilizar para determinar varios parámetros biocinéticos importantes. Estos parámetros biocinéticos se pueden aprovechar aún más para predecir la producción de metano en escenarios similares sin el uso del respirómetro. La constante de la tasa de producción de metano, k, se puede derivar utilizando un ajuste logarítmico de mínimos cuadrados a los datos del respirómetro observados para cada relación F:M examinada (es decir, los que se muestran en la Figura 8). Una función logarítmica representativa para el escenario F:M de 0,3 es y = 93,465ln(X) - 175,91. Aquí, el valor de 93,465 está en unidades de horas, que deben convertirse a días y luego invertirse, dando un k = 0,257. En la Tabla 4 se encuentran las constantes de velocidad (k) y el coeficiente de determinación (R2) para cada relación F:M examinada.
La constante de velocidad se puede aprovechar para determinar el rendimiento de metano en un momento dado para cada relación F:M. La tasa de metano producido a lo largo del tiempo a partir del sustrato orgánico se puede modelar utilizando la siguiente ecuación [1]21:
(1)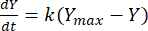
Integrando la ecuación anterior entre los límites t = 0 a t = t, se obtiene lo siguiente [2]:
(2)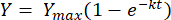
Donde, Y = rendimiento de metano en cualquier momento [mL]; Ymax = rendimiento máximo de metano observado en el estudio del respirómetro [mL]; k = tasa de producción de metano constante [d-1]; t = tiempo [d]
Si bien el enfoque de primer orden utilizado para desarrollar los parámetros biocinéticos presentados anteriormente proporciona un ajuste muy razonable a los datos experimentales (como lo indican los valores de R2 en la Tabla 4), otros estudios han informado el uso de otros modelos para ajustar los datos de producción de metano, para incluir el modelo de Gompertz modificado, el modelo de dos sustratos y el modelo de cono2.

Figura 1: Mezclador de desperdicios de alimentos. Licuadora estándar utilizada para combinar desperdicios de alimentos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Respirómetro. Configuración completa del respirómetro para medir la producción de metano. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Frasco de muestra en el enfriador del respirómetro. Vista interior del enfriador de respirómetro con ocho frascos de muestra. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Depurador de respirómetro. Vista cercana del depurador del respirómetro. Haga clic aquí para ver una versión más grande de esta figura.
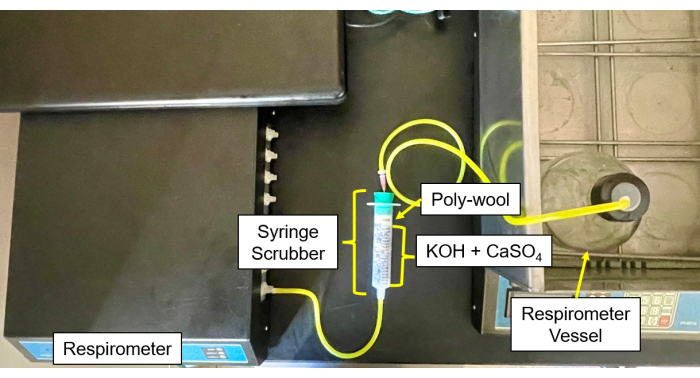
Figura 5: Depurador del respirómetro al módulo de control. Imagen del respirómetro del módulo de control y de la configuración del depurador. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Configuración de la línea de depuración del respirómetro. Vista cercana de la configuración de la línea de depuración entre los frascos de muestra y el respirómetro. Haga clic aquí para ver una versión más grande de esta figura.
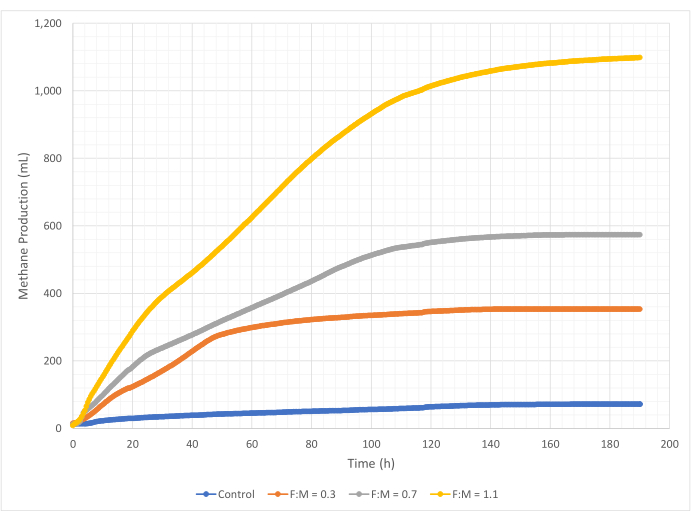
Figura 7: Producción total de metano utilizando diferentes relaciones F:M. La producción de metano para cada F:M (0,3, 0,7, 1,1) se representa a lo largo del tiempo (0 h a 190 h). Haga clic aquí para ver una versión más grande de esta figura.
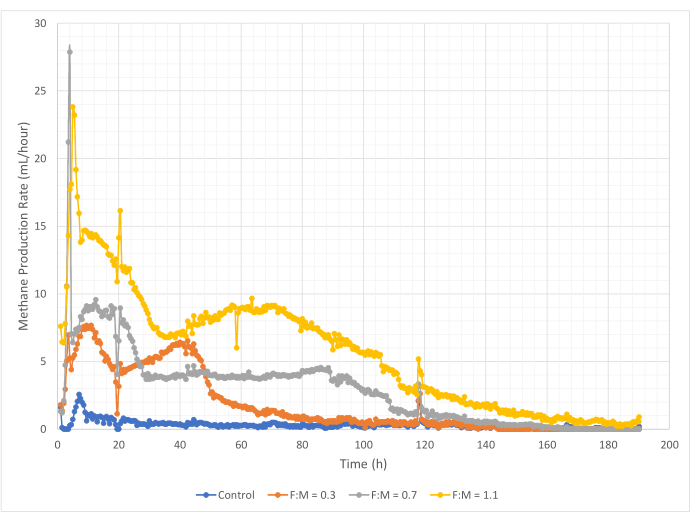
Figura 8: Tasa de producción de metano utilizando diferentes relaciones F:M. La tasa de producción de metano para cada F:M (0,3, 0,7, 1,1) se representa a lo largo del tiempo (0 h a 190 h). Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Componentes de la botella de muestra con proporciones de alimentos a microbios. Masa constituyente, concentración y volumen para cada F:M (0,3, 0,7, 1,1) y las botellas en blanco. Haga clic aquí para descargar esta tabla.
Tabla 2: Muestra de composición del sustrato orgánico. Masa de desperdicio de alimentos y composición porcentual por alimento y proporción de carbohidratos, proteínas y grasas. Haga clic aquí para descargar esta tabla.
Tabla 3: Resultado de la demanda de oxígeno y sólidos volátiles suspendidos de la muestra (desviación estándar ±). VSS y COD para cada F:M (0,3, 0,7, 1,1). Haga clic aquí para descargar esta tabla.
Tabla 4: Ejemplo de parámetros cinéticos. Parámetros cinéticos calculados en función del rendimiento de metano. Haga clic aquí para descargar esta tabla.
Discusión
Los métodos proporcionados en este protocolo pueden ayudar a los investigadores y profesionales a determinar el potencial biometano de la digestión anaeróbica de flujos de residuos orgánicos mediante respirometría. En este protocolo, demostramos la generación de metano a partir de la codigestión de un flujo típico de residuos de restos de comida junto con WAS de una EDAR en un rango de proporciones F:M. Este protocolo se suma a la literatura al proporcionar un enfoque de respirometría paso a paso para la medición continua de la producción de metano y la determinación de parámetros biocinéticos mediante modelos cinéticos de primer orden. Varios otros estudios han empleado experimentos de microcosmos que miden la producción de metano en puntos discretos en el tiempo10,22, mientras que otros han medido el metano utilizando caudalímetros conectados a biorreactores de banco de flujo continuo de larga duración o a escala piloto14,23. La respirometría ofrece la ventaja de medir la producción de metano de forma continua en una variedad de condiciones experimentales. Como los experimentos de respirometría no requieren la construcción de un biorreactor, las condiciones experimentales pueden modificarse con frecuencia relativa en comparación con algunos experimentos a escala de laboratorio o piloto. Debido a esta ventaja, los experimentos de respirometría se pueden utilizar para determinar la producción de metano a partir de la co-digestión de numerosas combinaciones de desechos orgánicos en un período de tiempo relativamente corto. Por ejemplo, como siguiente paso al protocolo presentado en este estudio, las grasas, aceites y grasas, que son muy densos en energía química en relación con el WAS, podrían ser co-digeridos con restos de comida para cuantificar los probables aumentos en la generación de metano a lo largo del tiempo. La aplicación de este enfoque puede continuar construyendo el cuerpo de literatura sobre las tasas de generación de metano y los parámetros biocinéticos en múltiples combinaciones de sustratos en esquemas de co-digestión. Además, además de determinar las combinaciones óptimas de sustratos, los resultados de producción de metano y los parámetros biocinéticos se pueden utilizar para informar el modelado del rendimiento en los programas existentes, como los diseñados para el tratamiento de aguas residuales, o para predecir cómo se comportarán los esquemas de codigestión cuando se amplíen desde la escala de laboratorio o piloto hasta la escala completa24,25.
Además, este protocolo podría modificarse para aplicar una alimentación de sustrato a medida para el consorcio microbiano anaeróbico. Por ejemplo, si un investigador quisiera examinar los efectos de proporcionar solo carbohidratos o solo proteínas a la microbiota anaeróbica, entonces la materia prima de este protocolo podría modificarse en consecuencia. Alternativamente, si un investigador quisiera probar el impacto de agregar una fracción específica de DQO (por ejemplo, solo DQO soluble o solo DQO particulado) o altas concentraciones de un sustrato particular (por ejemplo, acetato, ácido graso volátil y producto intermedio del metabolismo anaeróbico) en la producción de metano, se podría utilizar una variación de este protocolo. Una de las mejores prácticas observadas al modificar el sustrato o alternar la relación F:M de un sustrato en particular es mantener la misma masa de microbiota anaeróbica para cada muestra, ajustando solo la masa del sustrato (se deben emplear relaciones masa-masa). Además de modificar los sustratos, los investigadores pueden utilizar este protocolo con otros análisis para obtener una mejor comprensión del uso del sustrato y la producción de metano. Por ejemplo, un investigador podría utilizar este protocolo junto con análisis de comunidades microbianas (por ejemplo, secuenciación del gen 16S rRNA o metagenómica) para relacionar mejor la estructura de la comunidad con la función.
A pesar de la utilidad de esta metodología, existen varias limitaciones. Los respirómetros y las pruebas de potencial de biometano se configuran con mayor frecuencia como reactores discontinuos; Sin embargo, los codigestores anaeróbicos a gran escala normalmente funcionan como sistemas de flujo continuo con tiempos de retención de lodos de más de 10 días1. En consecuencia, los datos obtenidos de los experimentos de respirometría son útiles para estimar las tasas de generación de metano y desarrollar parámetros biocinéticos, pero estos datos deben validarse en el campo utilizando digestores a mayor escala operados a lo largo del tiempo cuando sea posible.
Además, se debe tener cuidado al seleccionar y preparar las muestras antes de la respirometría. Las partículas grandes de restos de comida sesgarán las mediciones de VSS y DQO y pueden proporcionar resultados inexactos. Si se utilizan residuos de restos de comida como sustrato, la mezcla debe estar bien macerada y libre de partículas grandes de alimentos, un enfoque similar a la maceración en los pozos de recepción de restos de comida en los digestores a gran escala. La dilución con agua desionizada puede ayudar con el proceso de mezcla y es similar a la adición de agua que se usa comúnmente cuando los restos de comida se maceran a mayor escala. Sin embargo, se debe hacer todo lo posible para garantizar que las diluciones se midan correctamente y que se alcance el contenido de humedad objetivo. La dilución puede ser fácilmente una fuente de error, especialmente si los estudiantes sin experiencia están ejecutando este protocolo.
Dado que los consorcios microbianos existentes en la co-digestión contienen anaerobios obligados, se debe tener especial cuidado en eliminar (o reducir en gran medida) la exposición al oxígeno durante los procesos de transferencia y preparación de la muestra. El oxígeno se puede eliminar de los frascos de muestra mediante lavado con nitrógeno. Además, si está disponible, el trabajo de transferencia de cultivo anaeróbico entre los frascos de recolección y los frascos de muestra del respirómetro debe realizarse en una cámara anaeróbica. Dado que el respirómetro proporciona resultados consistentes (volúmenes y tasas de producción de metano), cualquier desviación de los resultados esperados, por ejemplo, un consorcio microbiano inviable, se puede identificar fácilmente hacia el comienzo de la prueba. El uso de una muestra duplicada o triplicada puede ayudar aún más a identificar pruebas defectuosas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al Dr. Jim Young de Respirometer Systems and Applications por la discusión sobre el desarrollo de este protocolo.
Materiales
| Name | Company | Catalog Number | Comments |
| 103 °C Oven Isotemp | Fisher Scientific | 13-247-737F | Model: 737F, Force Air Oven |
| 550 °C Vulcan Oven | Neytech (Manufacturer) / Cole Palmer (Vendor) | 9493308 | Model: 3-550 |
| Aerobic/Anaerobic Respirometer | Respirometer System and Applications (RSA) | PF-8000 | Model: PF-8000 |
| Analytical Balance | Mettler Toledo | 30029075 | Model: ME204E, Detection Limit: 0.1 mg |
| Smoothie Blender with 56 oz Plastic Jar | Hamilton Beach | 50190F | Model: 50190F |
| COD Vials TNT Plus Vial Test | HACH | TNT821 | TNT 821, 3–150 mg/L COD |
| COD Vials TNT Plus Vial Test | HACH | TNT822 | TNT 822, 20–1500 mg/L COD |
| Dessicator | SP Bel-Art | 942070050 | Model: SP Scienceware |
| Dionized Water System | Milli-Q | ZIQ7010T0C | IQ 7010 Pure & Ultrapure Water Purification System |
| Anhydrous CaSO4 | W.A. Hammond Drierite Company | 13001 | 8 Mesh, 1 lb |
| Glass Fiber Filters | Whatman (Manufacturer) / Cole-Parmer (Vendor) | 1827-150 | Model: 934-AH |
| Heat Digestor Block | HACH | DRB200-02 | DRB 200 |
| Hot Plate Stirrer | Corning | 6795-620D | Model: PC-620D |
| Industrial-Grade Nitrogen (Compressed Cylinder) | Air Gas | NI UHP300 | 300 cubic feet |
| Pellets (KOH) | Fisher Scientific | AC134062500 | 500 g |
| pH Meter | Fisher Scientific | 13-636-AP115 | AP115, Accumet pH meter |
| UV Spectrophotometer | HACH | LPV400.99.00012 | DR 3900 |
| Vaccum Pump | GAST | 1HAB-25-M100X |
Referencias
- Mainardis, M., Buttazzoni, M., Cottes, M., Moretti, A., Goi, D. Respirometry tests in wastewater treatment: Why and how? A critical review. Sci Total Environ. 793, 148607 (2021).
- Pan, Y., et al. Synergistic effect and biodegradation kinetics of sewage sludge and food waste mesophilic anaerobic co-digestion and the underlying stimulation mechanisms. Fuel. 253, 40-49 (2019).
- Argiz, L., et al. Assessment of a fast method to predict the biochemical methane potential based on biodegradable COD obtained by fractionation respirometric tests. J Environ Manage. 269, 110695 (2020).
- Carucci, A., et al. Aerobic storage by activated sludge on real wastewater. Water Res. 35 (16), 3833-3844 (2001).
- McCarty, P. L., Bae, J., Kim, J. Domestic wastewater treatment as a net energy producer-Can this be achieved. Environ Sci Technol. 45 (17), 7100-7106 (2011).
- McCarty, P. The development of anaerobic treatment and its future. Water Sci Technol. 44 (8), 149-156 (2001).
- From farm to kitchen: The environmental impacts of U.S. food waste Part 1. United States Environmental Protection Agency Available from: https://www.epa.gov/system/files/documents/2021-11/from-farm-to-kitchen-the-environmental-impacts-of-u.s.-food-waste_508-tagged.pdf (2021)
- Tchobanoglous, G., Burton, F. L., Stensel, H. D. . WastewaterEngineering:TreatmentandReuse. 5th ed. , (2014).
- Pfluger, A., et al. Anaerobic digestion and biogas beneficial use at municipal wastewater treatment facilities in Colorado: A case study examining barriers to widespread implementation. J Clean Prod. 206, 97-107 (2019).
- Mata-Alvarez, J., Dosta, J., Romero-Güiza, M. S., Fonoll, X., Peces, M., Astals, S. A critical review on anaerobic co-digestion achievements between 2010 and 2013. Renew Sust Energ Rev. 36, 412-427 (2014).
- Pfluger, A. R., Hahn, M. J., Hering, A. S., Munakata-Marr, J., Figueroa, L. Statistical exposé of a multiple-compartment anaerobic reactor treating domestic wastewater. Water Environ Res. 90 (6), 530-542 (2018).
- Razaviarani, V., Buchanan, I. D. Calibration of the Anaerobic Digestion Model No. 1 (ADM1) for steady-state anaerobic co-digestion of municipal wastewater sludge with restaurant grease trap waste. Chem Eng J. 266, 91-99 (2015).
- Zhu, H., et al. Biohydrogen production by anaerobic co-digestion of municipal food waste and sewage sludges. Int J Hydrog Energy. 33 (14), 3651-3659 (2008).
- Serna-García, R., Ruiz-Barriga, P., Noriega-Hevia, G., Serralta, J., Pachés, M., Bouzas, A. Maximising resource recovery from wastewater grown microalgae and primary sludge in an anaerobic membrane co-digestion pilot plant coupled to a composting process. J Environ Manage. 281, 111890 (2021).
- Gossett, J. M., Belser, R. L. Anaerobic digestion of waste activated sludge. J Environ. 108 (6), 1101-1120 (1982).
- Yi, H., Han, Y., Zhuo, Y. Effect of combined pretreatment of waste activated sludge for anaerobic digestion process. Procedia Environ Sci. 18, 716-721 (2013).
- Nah, I. W., Kang, Y. W., Hwang, K. Y., Song, W. K. Mechanical pretreatment of waste activated sludge for anaerobic digestion process. Water Res. 34 (8), 2362-2368 (2000).
- American Public Health Association. . Standard Methods for the Examination of Water and Wastewater. Vol. 10. American Public Health Association. , (2012).
- Food Data Central. US Department of Agriculture Available from: https://fdc.nal.usda.gov/ (2024)
- Vanzin, G., Pfluger, A., Almstrand, R., Figueroa, L., Munakata-Marr, J. Succession of founding microbiota in an anaerobic baffled bioreactor treating low-temperature raw domestic wastewater. Environ Sci Water Res Technol. 8 (4), 792-806 (2022).
- Negi, S., Dhar, H., Hussain, A., Kumar, S. Biomethanation potential for co-digestion of municipal solid waste and rice straw: a batch study. Bioresour Technol. 254, 139-144 (2018).
- Rostkowski, K. H., Pfluger, A. R., Criddle, C. S. Stoichiometry and kinetics of the PHB-producing Type II methanotrophs Methylosinus trichosporium OB3b and Methylocystis parvus OBBP. Bioresour Technol. 132, 71-77 (2014).
- Pfluger, A., Vanzin, G., Munakata-Marr, J., Figueroa, L. An anaerobic hybrid bioreactor for biologically enhanced primary treatment of domestic wastewater under low temperatures. Environ Sci Water Res Technol. 4 (11), 1851-1866 (2018).
- Callahan, J. L., Pfluger, A. R., Figueroa, L. A., Munakata-Marr, J. BioWin® modeling of anaerobic sludge blanket treatment of domestic wastewater. Bioresour Technol Rep. 20, 101231 (2022).
- Linvill, C., Butkus, M., Bennett, E., Wait, M., Pytlar, A., Pfluger, A. Energy balances for proposed complete full-scale anaerobic wastewater treatment facilities. Environ Eng Sci. 40 (11), 482-493 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados