Method Article
Messung des Biomethanpotenzials von Lebensmittelabfällen, die anaerob mit Müllbelebtem Schlamm kofermentiert werden, mittels Respirometrie
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine bewährte Methode zur Bestimmung der Methanproduktion und der mikrobiellen kinetischen Parameter mittels Respirometrie für anaerobe Mikrobiota, die Lebensmittelabfälle und Abfallbelebtschlamm mitvergärt.
Zusammenfassung
Der Einsatz der Respirometrie zur Untersuchung der Biokinetik von Mikrobiota, der Abwasserbehandlung oder der Faulung von Klärschlamm hat in den letzten Jahrzehnten immer mehr an Bedeutung gewonnen. Der Einsatz der Respirometrie zur Untersuchung der Biokinetik anaerober Mikrobiota, die organische Abfallströme wie Klärschlamm und Lebensmittelabfälle mitvergärt, ist ein Bereich aktiver Forschung. Bisher wurde kein visualisiertes Protokoll zu diesem Thema veröffentlicht. Dementsprechend haben wir in diesem Protokoll ein Respirometer konfiguriert, um die Methanproduktion und die Durchflussrate im Laufe der Zeit unter Verwendung von drei verschiedenen Lebensmittel-Mikroorganismen-Verhältnissen (F:M) sowie Lebensmittelabfällen und abfallaktiviertem Schlamm als Substrate zu messen. Die daraus resultierenden Daten, gekoppelt mit Messungen der Substratausnutzung, bilden die Grundlage für das Verständnis, wie unterschiedliche Substratkonzentrationen die Geschwindigkeit beeinflussen, mit der anaerobe Mikrobiota Methan produziert. Darüber hinaus stellt dieses Protokoll eine Methode zur Entwicklung biokinetischer Parameter (z. B. konstante Methanproduktionsrate und Ausbeute) vor. Andere können dieses Respirometrie-Protokoll verwenden, um den organischen Abbau unter anaeroben Bedingungen zu untersuchen und mikrobielle Parameter zu entwickeln.
Einleitung
Die Forscher untersuchen die mikrobielle Aktivität auf Laborebene mit einer Vielzahl von Ansätzen, darunter Batch-Studien, Mikrokosmen und Respirometrie. Respirometer können verwendet werden, um die Zellatmung während der Wachstums- und/oder Zerfallsphasen einer mikrobiellen Gemeinschaft zu messen, indem der Substratverbrauch und die Endproduktproduktion unter kontrollierten Bedingungen beobachtetwerden 1. Die Ergebnisse aus Respirometerstudien im Labormaßstab können auch zur Abschätzung biokinetischer Parameter für die Konstruktion von Prozessmodellen verwendet werden2. Respirometer wurden verwendet, um sowohl die aerobe als auch die anaerobe mikrobielle Aktivität zu untersuchen. Studien mit Hilfe der Respirometrie zur Messung des Biomethanpotenzials (BMP), insbesondere von gemischten organischen Substraten, sind jedoch ein Bereich der laufenden Forschung 3,4.
Organische Stoffe im häuslichen Abwasser gelten als praktikable erneuerbare Quelle für chemische Energie5. Die anaerobe Vergärung von Klärschlämmen (d. h. Primärschlamm und abfallaktivierte Schlämme, WAS) wird seit weit über einem Jahrhundert zur Erzeugung von methanreichem Biogas in Kläranlagen (ARA) eingesetzt6. Die Vergärung mehrerer organischer Abfallströme, wie z. B. Lebensmittelabfälle mit WAS, hat sich jedoch erst in den letzten Jahren durchgesetzt und ist nach wie vor ein aktives Forschungsgebiet. Lebensmittelabfälle sind in vielen Industrieländern ein konstanter Abfallstrom aus organischem Material mit hoher Dichte, der in den USA etwa 25 % der Deponiemasse ausmacht7. Abgesehen davon, dass ein Teil der Lebensmittelabfälle von der Entsorgung auf Deponien abgezogen wird, ist die Kombination von Lebensmittelabfällen und WAS in einem Co-Vergärungsszenario aufgrund der erhöhten Menge an produziertem Biogas (im Verhältnis zu einem einzelnen organischen Abfallstrom) vorteilhaft. Biogas enthält in der Regel 60 % bis 70 % Methan, 30 % bis 40 % Kohlendioxid und Spuren anderer Gase (z. B. Schwefelwasserstoff)8. Das Biogas kann vor Ort in Kläranlagen mit einer Kraft-Wärme-Kopplungstechnologie gereinigt und verbrannt werden, um einen Teil des Strom- und Wärmeenergiebedarfs auszugleichen9.
In mehreren Studien wurden das Biomethanisierungspotenzial und die biokinetischen Parameter von anaeroben Mikrobiota untersucht, die organische Abfälle mitverdauen1. Verfügbare Studien in der Literatur haben Batch-Assays in Serumflaschen verwendet, bei denen die Methanproduktion während des gesamten Experiments an diskreten Punkten gemessen wurde, während andere die Methanproduktion mit Durchflussmessern gemessen haben, die direkt an Bioreaktoren im Labor- oder Pilotmaßstab angeschlossen sind 2,10,11. Die kontinuierliche Messung der Methanproduktion mit einem Respirometer, wie dem in diesem Protokoll beschriebenen, kann kontinuierliche und präzise Methanmessungen an einer großen Anzahl von Proben liefern, die unter einer Vielzahl von Versuchsbedingungen durchgeführt werden 1,12. Obwohl in mehreren Studien die Methanproduktion aus der Co-Vergärung von WAS in Verbindung mit anderen organischen Substraten wie Bioabfällen, Fetten, Ölen, Fetten und landwirtschaftlichen Abfällen gemessen wurde 10,13,14, bleibt jedoch noch viel zu tun, um die Methanproduktionsraten aus der Vielzahl von Co-Fermentationsszenarien zu identifizieren. Darüber hinaus bietet bisher kein verfügbares Protokoll einen detaillierten Schritt-für-Schritt-Ansatz unter Verwendung visueller Darstellungen zur Messung der Methanproduktion aus der Co-Vergärung von Lebensmittelabfällen und WAS. Dementsprechend wird in dieser Studie ein Respirometer-Protokoll zur Messung der Methanproduktion und zur Ableitung biokinetischer Parameter unter Verwendung einer Mischung aus verdünntem Abwasser, WAS und Lebensmittelabfällen als Substrate vorgestellt. Unterschiedliche Verhältnisse von Lebensmitteln zu Mikroorganismen (F:M) wurden verwendet, um Veränderungen in der Methanproduktion aufzuklären. Weitere Messungen umfassen flüchtige Schwebstoffe (VSS), den chemischen Sauerstoffbedarf (CSB) und den pH-Wert jeder Probe. Dieses Protokoll beschreibt die Einrichtung des Respirometers, die Probenerstellung und kritische Messungen.
Protokoll
1. Vorbereitung des Untergrundes
- Sammeln Sie ~1,5 l Primärabwasser, ~1 l Abfallbelebtschlamm (WAS).
HINWEIS: WAS-Proben sollten unmittelbar vor dem Versuch entnommen werden; WAS kann jedoch vor dem Experiment bis zu 48 h bei 4 °C gelagert werden, ohne dass erkennbare Auswirkungen auf seine Verwendung als Substrat erkennbar sind 15,16,17. - Unmittelbar vor dem Experiment werden 2 l anaerobe Kultur erworben und die Kultur bei 35 °C gehalten. Beschränken Sie den Kontakt mit Luft während des Transfers vom anaeroben Fermenter in die Auffangflasche so weit wie möglich.
HINWEIS: Die in dieser Studie verwendete anaerobe Kultur wurde aus einer Kläranlage gewonnen, in der 8,5 MGD (38.640 m3/d) mit anaerober Vergärung von Primärschlamm aus Abwasser behandelt wurden. Eine bewährte Methode besteht darin, anaerobe Bedingungen aufrechtzuerhalten, indem die Auffangflasche vor dem Erwerb einer anaeroben Kultur13 mit Stickstoffgas gespült wird und während des Transports und der Lagerung anaerobe Bedingungen aufrechterhalten werden. - Sammeln Sie Lebensmittelabfälle und lagern Sie sie bis zu 48 Stunden vor dem Experiment bei 4 °C.
HINWEIS: Je nach Versuchsdesign sollte darauf geachtet werden, Lebensmittelabfälle mit den Zielanteilen an Kohlenhydraten, Proteinen usw. zu identifizieren. Der angestrebte Anteil organischer Stoffe in Lebensmittelabfällen wird wahrscheinlich je nach Experiment variieren. Der Anteil von Kohlenhydraten, Proteinen und Fetten in den gesammelten Lebensmitteln kann aus der veröffentlichten Literatur geschätzt oder mit etablierten Protokollen (z. B. Gaschromatographie) bewertet werden.
2. Zubereitung von Nahrungsergänzungsmitteln
- Bereiten Sie die mineralische Basislösung #1 vor, indem Sie 800 mL deionisiertes (DI) Wasser mit CoCl2,6H 2O (0,25 g), FeCl3·6H2O (5 g), MnCl2·4H2Ω (0,05 g), NaMoO4·2H2Ω (0,005 g), NiCl2·6H2O (0,025 g), CuCl2·2H2O (0,007 g), ZnCl2 (0,025 g), H3BO3 (0,025 g) und Na2SeO4 (0,025 g). Verdünnen Sie bis zu 1 l mit entionisiertem (DI) Wasser.
- Bereiten Sie die mineralische Basislösung #2 vor, indem Sie 800 mL DI-Wasser mit CaCl2 (27,7 g) und MgCl2 mischen.4H2O (101 g). Bis zu 1 L mit DI-Wasser verdünnen.
- Bereiten Sie eine Nährstoffbasis vor, indem Sie 800 mL DI-Wasser mit NH4Cl (38,2 g) und Na2SO4 (15 g) mischen. Stellen Sie den pH-Wert mit 3,64 N NaOH in DI-Wasser auf 7,0 ein und verdünnen Sie es auf bis zu 1 l mit DI-Wasser.
3. Vorbereitung der Probe
- Kombinieren Sie Lebensmittelabfälle (Tabelle 2) in einem Mixer (Abbildung 1), um eine Mischung herzustellen. Stellen Sie sicher, dass die Mischung frei von großen Partikeln von Lebensmittelabfällen ist. Verdünnen Sie die Lebensmittelabfälle mit DI-Wasser, um das Mixen zu erleichtern. Kommentieren Sie die Menge des Verdünnungswassers, die bei der Berechnung des chemischen Sauerstoffbedarfs (CSB) verwendet werden soll. Diese verdünnten Lebensmittelabfälle werden als "Arbeitsabfälle" bezeichnet. Arbeitsabfälle in eine 1-Liter-Plastikflasche geben und bei 4 °C lagern.
- Beschriften Sie vier 2-Liter-Becher gemäß Tabelle 1. Becher auf eine Rührplatte legen und einen großen Rührstab hinzufügen. Kombinieren Sie Lebensmittelabfälle, WAS und Verdünnung (DI-Wasser zur Kontrolle und Primärablauf für die Behandlung) gemäß Tabelle 1 in den 2-Liter-Bechern.
- Fügen Sie jeweils 12 ml mineralische Basislösung #1, mineralische Basislösung #2 und Nährstoffbasis hinzu.
- 2.4 g NaHCO3 (Pulver) in jedes Becherglas geben und 30 s rühren. Beschriften Sie acht Respirometrie-Flaschen gemäß Tabelle 1 und fügen Sie einen magnetischen Rührstab hinzu.
HINWEIS: Dadurch werden Duplikate der Steuerung und drei Behandlungen mit unterschiedlichen F:M-Verhältnissen erstellt. - In jedes 2-Liter-Becherglas gemäß Tabelle 1 eine anaerobe Kultur geben und umrühren. Messen Sie sofort 500 mL eines Gemisches aus dem Becherglas mit einem Messzylinder ab und füllen Sie es in eine beschriftete Respirometerflasche, spülen Sie sie mit Stickstoffgas und verschließen Sie sie sofort.
HINWEIS: Es sollte darauf geachtet werden, den Kontakt der anaeroben Mikrobiota mit Luftsauerstoff zu begrenzen (falls vorhanden, sollte eine anaerobe Kammer für den Transfer verwendet werden).
4. Quantifizierung der Ausgangsbedingungen
- Verwenden Sie die verbleibende Probe aus Abschnitt 3 (~200 mL), um den pH-Wert, den Gesamt-CSB (tCOD), den löslichen CSB (sCOD), den gesamten Schwebstoffen (TSS) und den flüchtigen Schwebstoffen (VSS) für jede Probezu messen 18.
- Falls erforderlich, verdünnen Sie die Proben mit DI-Wasser basierend auf den Nachweisgrenzen der Messgeräte.
HINWEIS: Für CSB-Messungen wurden die Verfahren des Herstellers verwendet.
- Falls erforderlich, verdünnen Sie die Proben mit DI-Wasser basierend auf den Nachweisgrenzen der Messgeräte.
5. Einrichtung des Respirometers
- Stellen Sie das Respirometer (Abbildung 2) auf die niedrige anaerobe Einstellung ein.
- Drücken Sie gleichzeitig die Reset-Taste und die Einschalttaste.
HINWEIS: Dies gilt speziell für das in dieser Studie verwendete Modell. - Stellen Sie den Kühler (Abbildung 3) auf 35,5 °C ein.
- Füllen Sie jeden CO2 - und Feuchtigkeitswäscher (Abbildung 4 und Abbildung 5) mit einer 50/50-Mischung aus CaSO4 - und KOH-Pellets in der Mitte, umgeben von Glaswolle auf jeder Seite.
- Verbinden Sie die Schläuche und Nadeln von den Probenflaschen mit dem Wäscher und dann vom Wäscher mit dem Gaseinlass (Abbildung 6).
- Führen Sie auf dem Respirometer-Laptop das Respirometer-Programm RSA-8-v2.0 aus.
HINWEIS: Dieser Schritt ist spezifisch für das Modell, das in dieser Studie verwendet wird. - Markieren Sie alle Flaschen im Programm und wählen Sie > Datenetiketten bearbeiten. Benenne alle Flaschen.
HINWEIS: Dieser Schritt ist spezifisch für das Modell, das in dieser Studie verwendet wird. - Beginnen Sie mit der Messung der Gasproduktion, indem Sie die Starttaste im Programm aktivieren. Stellen Sie das Programm so ein, dass die Daten am Ende jeder halben Stunde gemessen werden. Überwachen Sie die Gasproduktion, indem Sie Rate Chart oder Volume Chart auswählen.
HINWEIS: Dieser Schritt ist spezifisch für das Modell, das in dieser Studie verwendet wird. - Stoppen Sie nach dem Experiment (~7 Tage) den Lauf im Programm, schalten Sie den Kühler aus und schalten Sie das RSPF-Modul aus. Speichern Sie die Datendatei als CSV-Datei und konvertieren Sie sie dann in ein MS Excel-Dokument.
HINWEIS: Dieser Schritt ist spezifisch für das Modell, das in dieser Studie verwendet wird.
6. Messungen nach der Atmung
- Messen Sie pH, TSS, VSS und CSB an den Endproben wie in Abschnitt 4 beschrieben.
Ergebnisse
Zusammensetzung der Lebensmittelabfälle
Die in dieser Studie verwendeten Lebensmittelabfälle bestanden aus fünf verschiedenen Lebensmittelsorten, die typischerweise in einer College-Mensa serviert wurden. Jede Lebensmittelprobe enthielt unterschiedliche Mengen an Fetten, Kohlenhydraten und Proteinen, die in Tabelle 2 aufgeführt sind. 19 Die gemischten Lebensmittelabfälle bestanden zu 44 % aus Kohlenhydraten, 36 % Proteinen, 16 % Fetten und 4 % aus anderen Materialien. Eine ungefähr gleiche Masse jeder Lebensmittelart (56 g bis 86 g) wurde verwendet, um ein repräsentatives organisches Substrat für die anaerobe Co-Vergärung bereitzustellen. Die Masse der Lebensmittelabfälle wurde anschließend variiert, um für jedes untersuchte Szenario den gewünschten F:M (0,3, 0,7 und 1,1) zu erreichen.
Messungen von flüchtigen Schwebstoffen und organischen Stoffen
Die Ergebnisse für die anfängliche und endgültige VSS sowie den anfänglichen und endgültigen Sauerstoffbedarf sind in Tabelle 3 enthalten. Der Sauerstoffbedarf wird als BSB5 dargestellt, der aus CSB unter Verwendung des akzeptierten Umrechnungsverhältnisses (CSB = 1,6BSB5)8 umgerechnet wurde. Wie gezeigt, stiegen die anfänglichen VSS-Konzentrationen (in Tabelle 3 auch durch Masse dargestellt) von der Kontrolle auf das größte F:M-Verhältnis (1,1) an. Jedes untersuchte F:M wies eine VSS-Zerstörung auf, d. h. eine anaerobe Umwandlung von organischen Stoffen in gasförmige Endprodukte von Methan und Kohlendioxid. Aufgrund der Umwandlung sank die Konzentration von VSS von den ersten Messungen bis zu den endgültigen Messungen am Ende des Experiments. Die Menge des zerstörten VSS stieg von der Kontrolle auf größere F:M-Verhältnisse an. Unerwarteterweise überstieg die VSS-Zerstörung für das Szenario F:M = 0,7 das Szenario F:M = 1,1, möglicherweise aufgrund einer Hemmung im Szenario F:M von 1,1.
Die gemessenen anfänglichen Sauerstoffbedarfskonzentrationen folgten dem gleichen Trend wie die VSS, d.h. sie stiegen von der Kontrolle auf das größte F:M-Verhältnis an (Tabelle 3). Ähnlich wie bei der VSS-Zerstörung nahmen die BSB-5-Konzentrationen zwischen der Anfangs- und der Endkonzentration ab, mit Ausnahme der Kontrolle. Der Sauerstoffbedarf stieg in der Kontrolle an, wahrscheinlich aufgrund des endogenen Zerfalls. Im Gegensatz zur VSS-Zerstörung war die Verringerung des Sauerstoffbedarfs von der ersten bis zur endgültigen Messung für jede Probe relativ gering und lag zwischen 1 und 3 % und zeigte keinen Trend nach F:M-Verhältnis. Ein möglicher Grund für diesen Trend ist die Umwandlung von partikulärer organischer Substanz in lösliche organische Stoffe, die über lange Zeiträume erfolgt und oft ein geschwindigkeitsbegrenzender Schritt im Stoffwechsel der anaeroben mikrobiellen Konsortienist 20.
Methanproduktion
Die Mengen und Raten der Methanproduktion variierten während des 190-stündigen Untersuchungszeitraums über den Bereich der F:M-Verhältnisse. Experimentelle Ergebnisse zeigten, dass höhere F:M-Verhältnisse zu einem erhöhten Gesamtvolumen an Methan führten (Abbildung 7). Die Kontrolle, der kein Substrat zugesetzt wurde, produzierte eine geringe Menge Methan (~72 ml), wahrscheinlich aufgrund der relativ geringen Menge an löslichem BSB5 im Schlamm und/oder des endogenen Zerfalls. Wie erwartet, erhöhte die Zugabe von Substrat in anderen Szenarien die Methanproduktion im Vergleich zur Kontrolle. Das F:M-Szenario von 0,3 ergab fünfmal mehr Methan (~354 ml) als die Kontrolle. Eine Erhöhung des F:M-Verhältnisses auf 0,7 ergab 1,6-mal mehr Methan (~574 ml) als das F:M-Szenario von 0,3. In ähnlicher Weise ergab die Erhöhung des F:M-Verhältnisses auf 1,1 1,9-mal mehr Methan (~1098 ml) als das F:M-Szenario von 0,7. Die maximal beobachteten volumetrischen Methanproduktionswerte (Y max) für jedes untersuchte F:M-Verhältnis sind in Tabelle 4 aufgeführt. Auch die im Laufe der Zeit produzierte Methanmenge veränderte sich mit den untersuchten F:M-Verhältnissen. Wie in Abbildung 8 gezeigt, nahmen die Rate der Methanproduktion sowie die Zeitspanne, die während der Studie Methan produziert wurde, mit zunehmendem F:M zu. Zum Beispiel gab es im F:M-Szenario von 0,3 nach 129 Stunden der Studie keine beobachtete Methanproduktion (mit einem Maximum von 354 ml), während das F:M-Szenario von 1,1 am Ende der Studie immer noch eine kleine Menge Methan produzierte. In allen Szenarien nahm die Rate des produzierten Methans im Laufe der Zeit aufgrund der verringerten Substratverfügbarkeit ab. Obwohl am Ende der Studie immer noch ein reichlicher Sauerstoffbedarf vorhanden war (Tabelle 3), lag er möglicherweise nicht in bioverfügbarer Form vor, oder es gab möglicherweise nur einen begrenzten verbleibenden Elektronenakzeptor (z. B. Kohlendioxid) für die anaerobe Mikrobiota. Schließlich zeigt ein Vergleich des produzierten Methans (mL) pro beobachteter VSS-Zerstörung (mg), dass die Werte für F:M von 0,3 und 0,7 einen Bereich von 1,3 bis 1,6 ml/mg ergaben, während der F:M-Wert von 1,1 mehr Methan pro Einheit VSS-zerstörtes Medium produzierte (3,7 ml/mg) (Tabelle 4). Tchobanoglous et al. (2014) liefern typische Bereiche für die Gasausbeute pro vernichteter Feststoffeinheit für gängige Rohstoffe, einschließlich Fette (~1,4 mL/mg), Fette (~1,1 mL/mg) und Proteine (~0,7 mL/mg)8. Mata-Alvarez et al. (2014) überprüften Studien, in denen Klärschlamm mit einer Vielzahl von Substraten und unterschiedlichen Substratverhältnissen (z. B. unterschiedliche Verhältnisse von WAS und FOG) in Bioreaktoren im Labor- und Pilotmaßstab mitvergorenwurde 10. Sie fanden heraus, dass die gemeldete Methanproduktion pro zerstörter VSS-Einheit mit den mitvergorenen Substraten erheblich variierte, ebenso wie das Verhältnis der Substrate, das zwischen 0,2 mL und 1,1 mL Biogas pro zerstörtem mg VS lag. Repräsentative Ergebnisse aus dieser Studie, insbesondere für F:M von 0,3 und 0,7, sind im Vergleich zu den Ergebnissen von Vergleichsstudien positiv.
Biokinetische Parameter
Die Methanproduktion im Laufe der Zeit kann zur Bestimmung mehrerer wichtiger biokinetischer Parameter verwendet werden. Diese biokinetischen Parameter können weiter genutzt werden, um die Methanproduktion in ähnlichen Szenarien ohne den Einsatz des Respirometers vorherzusagen. Die Konstante der Methanproduktionsrate k kann unter Verwendung einer logarithmischen Anpassung des kleinsten Quadrats an die beobachteten Respirometerdaten für jedes untersuchte F:M-Verhältnis (d. h. die in Abbildung 8 gezeigten) abgeleitet werden. Eine repräsentative logarithmische Funktion für das Szenario F:M von 0,3 ist y = 93,465ln(X) - 175,91. Hier wird der Wert von 93,465 in Stundeneinheiten angegeben, die in Tage umgerechnet und dann invertiert werden müssen, was ein k = 0,257 ergibt. Die Geschwindigkeitskonstanten (k) und der Bestimmungskoeffizient (R2) für jedes untersuchte F:M-Verhältnis sind in Tabelle 4 enthalten.
Die Geschwindigkeitskonstante kann dann genutzt werden, um die Ausbeute an Methan zu einem bestimmten Zeitpunkt für jedes F:M-Verhältnis zu bestimmen. Die Methanrate, die im Laufe der Zeit aus dem organischen Substrat erzeugt wird, kann mit der folgenden Gleichung [1]21 modelliert werden:
(1)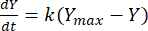
Wenn man die obige Gleichung zwischen den Grenzen t = 0 bis t = t integriert, erhält man folgendes [2]:
(2)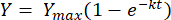
Dabei ist Y = Methanausbeute zu jedem Zeitpunkt [mL]; Ymax = maximale beobachtete Methanausbeute aus der Respirometer-Studie [mL]; k = Konstante der Methanproduktionsrate [d-1]; t = Zeit [d]
Während der oben vorgestellte Ansatz erster Ordnung zur Entwicklung biokinetischer Parameter eine sehr vernünftige Anpassung an die experimentellen Daten bietet (wie durchR2-Werte in Tabelle 4 angezeigt), haben andere Studien über die Verwendung anderer Modelle zur Anpassung von Methanproduktionsdaten berichtet, darunter das modifizierte Gompertz-Modell, das Zwei-Substrat-Modell und das Kegelmodell2.

Abbildung 1: Mixer für Lebensmittelabfälle. Standardmixer zum Mischen von Lebensmittelabfällen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Respirometer. Komplettes Respirometer-Setup zur Messung der Methanproduktion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Probenflasche im Respirometer-Kühler. Innenansicht des Respirometer-Kühlers mit acht Probenflaschen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Respirometer-Wäscher. Nahansicht des Respirometer-Wäschers. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
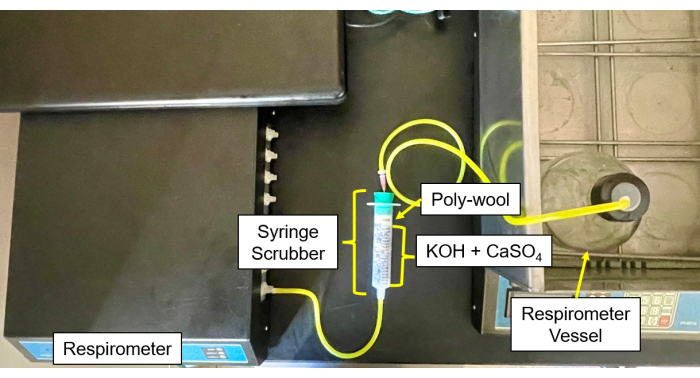
Abbildung 5: Respirometer-Wäscher zum Steuermodul. Respirometer-Bild des Steuermoduls und der Wäscher-Einrichtung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Einrichtung der Respirometer-Scrubber-Leitung. Nahaufnahme des Setups der Scrubber-Linie zwischen den Probenflaschen und dem Respirometer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
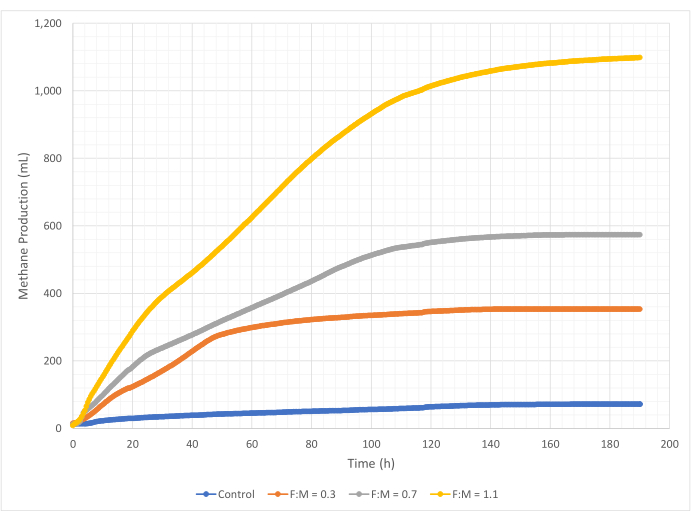
Abbildung 7: Gesamte Methanproduktion unter Verwendung verschiedener F:M-Verhältnisse. Die Methanproduktion für jedes F:M (0,3, 0,7, 1,1) wird über die Zeit (0 h bis 190 h) dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
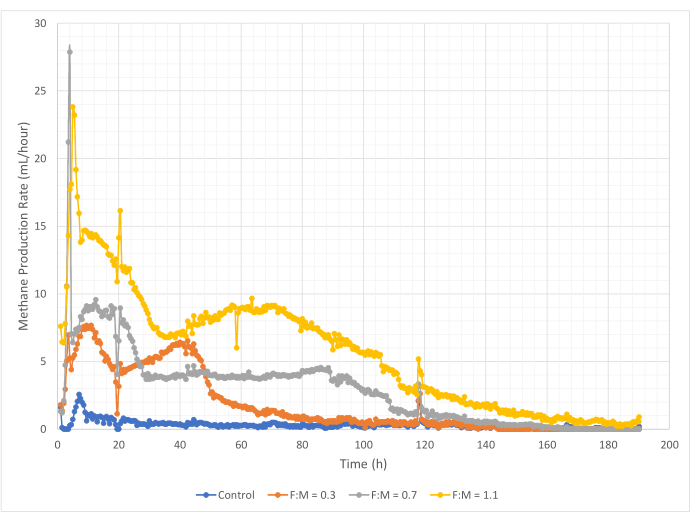
Abbildung 8: Methanproduktionsrate unter Verwendung verschiedener F:M-Verhältnisse. Die Methanproduktionsrate für jedes F:M (0,3, 0,7, 1,1) wird über die Zeit (0 h bis 190 h) dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Bestandteile der Probenflasche mit Lebensmittel-Mikroben-Verhältnis. Masse, Konzentration und Volumen der Bestandteile für jede F:M (0,3, 0,7, 1,1) und die leeren Flaschen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Zusammensetzung des organischen Substrats der Probe. Masse der Lebensmittelabfälle und prozentuale Zusammensetzung nach Lebensmitteln sowie Anteil an Kohlenhydraten, Proteinen und Fetten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Ergebnis des Bedarfs an flüchtigen Schwebstoffen und Sauerstoff in der Probe (± Standardabweichung). VSS und CSB für jedes F:M (0,3, 0,7, 1,1). Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 4: Kinetische Parameter der Stichprobe. Berechnete kinetische Parameter basierend auf der Methanausbeute. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Die in diesem Protokoll bereitgestellten Methoden können Forschern und Praktikern helfen, das Biomethanpotenzial von anaerob vergärten organischen Abfallströmen mithilfe der Respirometrie zu bestimmen. In diesem Protokoll demonstrieren wir die Methanerzeugung aus der Co-Vergärung eines typischen Lebensmittelabfallstroms in Verbindung mit WAS aus einer Kläranlage über einen Bereich von F:M-Verhältnissen. Dieses Protokoll ergänzt die Literatur, indem es einen schrittweisen Respirometrie-Ansatz zur kontinuierlichen Messung der Methanproduktion und zur Bestimmung biokinetischer Parameter unter Verwendung kinetischer Modellierung erster Ordnung bietet. Mehrere andere Studien haben Mikrokosmos-Experimente verwendet, die die Methanproduktion zu diskreten Zeitpunkten messen10,22, während andere Methan mit Durchflussmessern gemessen haben, die an langlebige Bioreaktoren im Dauerstrom-Labor- oder Pilotmaßstab angeschlossen sind14,23. Die Respirometrie bietet den Vorteil, dass die Methanproduktion kontinuierlich über eine Vielzahl von experimentellen Bedingungen gemessen werden kann. Da für Respirometrie-Experimente kein Bioreaktor gebaut werden muss, können die Versuchsbedingungen im Vergleich zu einigen Versuchen im Labor- oder Pilotmaßstab relativ häufig geändert werden. Aufgrund dieses Vorteils können Respirometrie-Experimente verwendet werden, um die Methanproduktion durch die Mitvergärung zahlreicher Kombinationen organischer Abfälle in relativ kurzer Zeit zu bestimmen. Als nächster Schritt zu dem in dieser Studie vorgestellten Protokoll könnten beispielsweise Fette, Öle und Fette, die im Vergleich zu WAS eine sehr hohe chemische Energiedichte aufweisen, mit Lebensmittelabfällen co-verdaut werden, um den wahrscheinlichen Anstieg der Methanerzeugung im Laufe der Zeit zu quantifizieren. Durch die Anwendung dieses Ansatzes kann die Literatur über die Methanerzeugungsraten und biokinetischen Parameter über mehrere Substratkombinationen in Co-Fermentationsschemata weiter ausgebaut werden. Darüber hinaus können neben der Bestimmung optimaler Substratkombinationen auch die Ergebnisse der Methanproduktion und biokinetische Parameter verwendet werden, um die Leistungsmodellierung in bestehenden Programmen zu unterstützen, z. B. in solchen, die für die Abwasserbehandlung konzipiert sind, oder um vorherzusagen, wie sich Co-Vergärungssysteme verhalten werden, wenn sie vom Labor- oder Pilotmaßstab auf den Großmaßstab hochskaliertwerden 24,25.
Darüber hinaus könnte dieses Protokoll geändert werden, um eine maßgeschneiderte Substratzufuhr für das anaerobe mikrobielle Konsortium anzuwenden. Wenn ein Forscher beispielsweise die Auswirkungen der ausschließlichen Bereitstellung von Kohlenhydraten oder nur Proteinen für die anaerobe Mikrobiota untersuchen möchte, könnte der Rohstoff in diesem Protokoll entsprechend geändert werden. Alternativ, wenn ein Forscher die Auswirkungen der Zugabe einer bestimmten CSB-Fraktion (z. B. nur löslicher CSB oder nur partikulärer CSB) oder hoher Konzentrationen eines bestimmten Substrats (z. B. Acetat, flüchtige Fettsäure und Zwischenprodukt des anaeroben Stoffwechsels) auf die Methanproduktion testen möchte, könnte eine Variation dieses Protokolls verwendet werden. Eine bewährte Vorgehensweise bei der Modifikation des Substrats oder der Abwechslung des F:M eines bestimmten Substrats besteht darin, für jede Probe die gleiche Masse der anaeroben Mikrobiota beizubehalten und nur die Masse des Substrats anzupassen (es sollten Masse-zu-Masse-Verhältnisse verwendet werden). Neben der Modifikation von Substraten können Forscher dieses Protokoll mit anderen Analysen verwenden, um ein besseres Verständnis der Substratnutzung und der Methanproduktion zu erhalten. Zum Beispiel könnte ein Forscher dieses Protokoll in Verbindung mit mikrobiellen Gemeinschaftsanalysen (z. B. 16S rRNA-Gensequenzierung oder Metagenomik) verwenden, um die Struktur der Gemeinschaft besser mit der Funktion in Beziehung zu setzen.
Trotz der Nützlichkeit dieser Methode gibt es mehrere Einschränkungen. Respirometer und Biomethanpotenzialtests werden am häufigsten als Batch-Reaktoren konfiguriert; Anaerobe Co-Fermenter im großen Maßstab werden jedoch in der Regel als kontinuierliche Strömungssysteme mit Schlammverweilzeiten von mehr als 10 Tagen betrieben1. Dementsprechend sind die aus Respirometrie-Experimenten gewonnenen Daten nützlich für die Abschätzung der Methanerzeugungsraten und die Entwicklung biokinetischer Parameter, aber diese Daten sollten im Feld mit größeren Fermentern validiert werden, die im Laufe der Zeit betrieben werden, wenn dies möglich ist.
Darüber hinaus muss bei der Auswahl und Vorbereitung der Proben vor der Respirometrie Vorsicht geboten werden. Große Partikel aus Lebensmittelabfällen verzerren VSS- und CSB-Messungen und können ungenaue Ergebnisse liefern. Wenn Lebensmittelabfälle als Substrat verwendet werden, sollte die Mischung gut mazeriert und frei von großen Lebensmittelpartikeln sein - ein Ansatz, der der Mazeration in Speiserestaufnahmegruben in großen Fermentern ähnelt. Die Verdünnung mit DI-Wasser kann den Mischprozess erleichtern und ähnelt der Zugabe von Wasser, die üblicherweise verwendet wird, wenn Lebensmittelreste in größerem Maßstab mazeriert werden. Es sollten jedoch alle Anstrengungen unternommen werden, um sicherzustellen, dass die Verdünnungen ordnungsgemäß gemessen werden und der angestrebte Feuchtigkeitsgehalt erreicht wird. Verdünnung kann leicht eine Fehlerquelle sein, insbesondere wenn unerfahrene Studenten dieses Protokoll ausführen.
Da die in der Co-Vergärung bestehenden mikrobiellen Konsortien obligate Anaerobier enthalten, muss besonders darauf geachtet werden, dass die Exposition gegenüber Sauerstoff während des Transfer- und Probenvorbereitungsprozesses vermieden (oder stark reduziert) wird. Durch Stickstoffspülung kann Sauerstoff aus Probenflaschen entfernt werden. Des Weiteren sollte, falls verfügbar, die Arbeit des Transfers der anaeroben Kultur zwischen Sammelflaschen und Respirometer-Probenflaschen in einer anaeroben Kammer durchgeführt werden. Da das Respirometer konsistente Ergebnisse liefert (Methanproduktionsmengen und -raten), kann jede Abweichung von den erwarteten Ergebnissen, z. B. ein nicht lebensfähiges mikrobielles Konsortium, zu Beginn des Tests leicht identifiziert werden. Die Verwendung einer doppelten oder dreifachen Probe kann außerdem dazu beitragen, fehlerhafte Tests zu identifizieren.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken Dr. Jim Young von Respirometer Systems and Applications für die Diskussion über die Entwicklung dieses Protokolls.
Materialien
| Name | Company | Catalog Number | Comments |
| 103 °C Oven Isotemp | Fisher Scientific | 13-247-737F | Model: 737F, Force Air Oven |
| 550 °C Vulcan Oven | Neytech (Manufacturer) / Cole Palmer (Vendor) | 9493308 | Model: 3-550 |
| Aerobic/Anaerobic Respirometer | Respirometer System and Applications (RSA) | PF-8000 | Model: PF-8000 |
| Analytical Balance | Mettler Toledo | 30029075 | Model: ME204E, Detection Limit: 0.1 mg |
| Smoothie Blender with 56 oz Plastic Jar | Hamilton Beach | 50190F | Model: 50190F |
| COD Vials TNT Plus Vial Test | HACH | TNT821 | TNT 821, 3–150 mg/L COD |
| COD Vials TNT Plus Vial Test | HACH | TNT822 | TNT 822, 20–1500 mg/L COD |
| Dessicator | SP Bel-Art | 942070050 | Model: SP Scienceware |
| Dionized Water System | Milli-Q | ZIQ7010T0C | IQ 7010 Pure & Ultrapure Water Purification System |
| Anhydrous CaSO4 | W.A. Hammond Drierite Company | 13001 | 8 Mesh, 1 lb |
| Glass Fiber Filters | Whatman (Manufacturer) / Cole-Parmer (Vendor) | 1827-150 | Model: 934-AH |
| Heat Digestor Block | HACH | DRB200-02 | DRB 200 |
| Hot Plate Stirrer | Corning | 6795-620D | Model: PC-620D |
| Industrial-Grade Nitrogen (Compressed Cylinder) | Air Gas | NI UHP300 | 300 cubic feet |
| Pellets (KOH) | Fisher Scientific | AC134062500 | 500 g |
| pH Meter | Fisher Scientific | 13-636-AP115 | AP115, Accumet pH meter |
| UV Spectrophotometer | HACH | LPV400.99.00012 | DR 3900 |
| Vaccum Pump | GAST | 1HAB-25-M100X |
Referenzen
- Mainardis, M., Buttazzoni, M., Cottes, M., Moretti, A., Goi, D. Respirometry tests in wastewater treatment: Why and how? A critical review. Sci Total Environ. 793, 148607 (2021).
- Pan, Y., et al. Synergistic effect and biodegradation kinetics of sewage sludge and food waste mesophilic anaerobic co-digestion and the underlying stimulation mechanisms. Fuel. 253, 40-49 (2019).
- Argiz, L., et al. Assessment of a fast method to predict the biochemical methane potential based on biodegradable COD obtained by fractionation respirometric tests. J Environ Manage. 269, 110695 (2020).
- Carucci, A., et al. Aerobic storage by activated sludge on real wastewater. Water Res. 35 (16), 3833-3844 (2001).
- McCarty, P. L., Bae, J., Kim, J. Domestic wastewater treatment as a net energy producer-Can this be achieved. Environ Sci Technol. 45 (17), 7100-7106 (2011).
- McCarty, P. The development of anaerobic treatment and its future. Water Sci Technol. 44 (8), 149-156 (2001).
- From farm to kitchen: The environmental impacts of U.S. food waste Part 1. United States Environmental Protection Agency Available from: https://www.epa.gov/system/files/documents/2021-11/from-farm-to-kitchen-the-environmental-impacts-of-u.s.-food-waste_508-tagged.pdf (2021)
- Tchobanoglous, G., Burton, F. L., Stensel, H. D. . WastewaterEngineering:TreatmentandReuse. 5th ed. , (2014).
- Pfluger, A., et al. Anaerobic digestion and biogas beneficial use at municipal wastewater treatment facilities in Colorado: A case study examining barriers to widespread implementation. J Clean Prod. 206, 97-107 (2019).
- Mata-Alvarez, J., Dosta, J., Romero-Güiza, M. S., Fonoll, X., Peces, M., Astals, S. A critical review on anaerobic co-digestion achievements between 2010 and 2013. Renew Sust Energ Rev. 36, 412-427 (2014).
- Pfluger, A. R., Hahn, M. J., Hering, A. S., Munakata-Marr, J., Figueroa, L. Statistical exposé of a multiple-compartment anaerobic reactor treating domestic wastewater. Water Environ Res. 90 (6), 530-542 (2018).
- Razaviarani, V., Buchanan, I. D. Calibration of the Anaerobic Digestion Model No. 1 (ADM1) for steady-state anaerobic co-digestion of municipal wastewater sludge with restaurant grease trap waste. Chem Eng J. 266, 91-99 (2015).
- Zhu, H., et al. Biohydrogen production by anaerobic co-digestion of municipal food waste and sewage sludges. Int J Hydrog Energy. 33 (14), 3651-3659 (2008).
- Serna-García, R., Ruiz-Barriga, P., Noriega-Hevia, G., Serralta, J., Pachés, M., Bouzas, A. Maximising resource recovery from wastewater grown microalgae and primary sludge in an anaerobic membrane co-digestion pilot plant coupled to a composting process. J Environ Manage. 281, 111890 (2021).
- Gossett, J. M., Belser, R. L. Anaerobic digestion of waste activated sludge. J Environ. 108 (6), 1101-1120 (1982).
- Yi, H., Han, Y., Zhuo, Y. Effect of combined pretreatment of waste activated sludge for anaerobic digestion process. Procedia Environ Sci. 18, 716-721 (2013).
- Nah, I. W., Kang, Y. W., Hwang, K. Y., Song, W. K. Mechanical pretreatment of waste activated sludge for anaerobic digestion process. Water Res. 34 (8), 2362-2368 (2000).
- American Public Health Association. . Standard Methods for the Examination of Water and Wastewater. Vol. 10. American Public Health Association. , (2012).
- Food Data Central. US Department of Agriculture Available from: https://fdc.nal.usda.gov/ (2024)
- Vanzin, G., Pfluger, A., Almstrand, R., Figueroa, L., Munakata-Marr, J. Succession of founding microbiota in an anaerobic baffled bioreactor treating low-temperature raw domestic wastewater. Environ Sci Water Res Technol. 8 (4), 792-806 (2022).
- Negi, S., Dhar, H., Hussain, A., Kumar, S. Biomethanation potential for co-digestion of municipal solid waste and rice straw: a batch study. Bioresour Technol. 254, 139-144 (2018).
- Rostkowski, K. H., Pfluger, A. R., Criddle, C. S. Stoichiometry and kinetics of the PHB-producing Type II methanotrophs Methylosinus trichosporium OB3b and Methylocystis parvus OBBP. Bioresour Technol. 132, 71-77 (2014).
- Pfluger, A., Vanzin, G., Munakata-Marr, J., Figueroa, L. An anaerobic hybrid bioreactor for biologically enhanced primary treatment of domestic wastewater under low temperatures. Environ Sci Water Res Technol. 4 (11), 1851-1866 (2018).
- Callahan, J. L., Pfluger, A. R., Figueroa, L. A., Munakata-Marr, J. BioWin® modeling of anaerobic sludge blanket treatment of domestic wastewater. Bioresour Technol Rep. 20, 101231 (2022).
- Linvill, C., Butkus, M., Bennett, E., Wait, M., Pytlar, A., Pfluger, A. Energy balances for proposed complete full-scale anaerobic wastewater treatment facilities. Environ Eng Sci. 40 (11), 482-493 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten