Method Article
呼吸測定法を用いた廃棄物活性汚泥と嫌気性共消化された生ごみ廃棄物のバイオメタン電位測定
要約
このプロトコルは、嫌気性微生物叢の呼吸測定を使用してメタン生成と微生物動態パラメータを決定するためのベストプラクティスを説明しています 食品廃棄物と廃棄物活性汚泥を共消化する。
要約
微生物叢のバイオキネティクスを研究するための呼吸測定法の使用、廃水の処理、または廃水汚泥の消化は、過去数十年にわたってより一般的になっています。嫌気性微生物叢のバイオキネティクスを調べるための呼吸測定の使用は、廃水、汚泥、食品廃棄物などの有機廃棄物の流れを共消化する分野であり、活発な研究の分野です。今日まで、このトピックに関する視覚化されたプロトコルは公開されていません。したがって、このプロトコルでは、3つの異なる食品対微生物(F:M)比と生ごみ廃棄物および廃棄物活性汚泥を基材として使用して、メタン生成と経時的な流量を測定する呼吸計を構成しました。得られたデータは、基質利用測定と相まって、嫌気性微生物叢がメタンを生成する速度にさまざまな基質濃度がどのように影響するかを理解するための基礎を提供します。さらに、このプロトコルは、バイオキネティックパラメータ(例えば、メタン生成速度定数および収率)を開発する方法を提示する。また、この呼吸器測定プロトコルを使用して、嫌気性条件下での有機分解を調べ、微生物パラメータを開発できる人もいます。
概要
研究者は、バッチ研究、マイクロコズム、呼吸測定など、さまざまなアプローチを使用して、ベンチスケールで微生物活動を研究しています。レスピロメーターは、制御された条件下で基質の消費と最終製品の生産を観察することにより、微生物群集の成長期および/または崩壊期を通じて細胞呼吸を測定するために使用できます1。ベンチスケールの呼吸計研究の結果は、プロセスモデル構築のための生体動態パラメータの推定にも使用できます2。呼吸計は、好気性微生物と嫌気性微生物の両方の活動を調べるために使用されてきました。しかし、特に混合有機基質のバイオメタン電位(BMP)を測定するために呼吸測定法を使用した研究は、進行中の研究分野です3,4。
生活排水中の有機物は、実行可能な再生可能な化学エネルギー源として認識されています5。廃水汚泥(すなわち、一次汚泥および廃棄物活性汚泥、WAS)の嫌気性消化は、1世紀以上にわたって廃水処理プラント(WWTP)でメタンに富むバイオガスを生成するために使用されてきました6。しかし、WASによる生ごみ廃棄物など、複数の有機廃棄物の流れの消化は近年になってようやく普及し、依然として活発な研究分野です。生ごみ廃棄物は、多くの先進国で高密度有機材料の一貫した廃棄物の流れであり、米国の埋立地質量の約25%を占めています7。生ごみの一部を埋め立て地への処分から転用するだけでなく、共消化シナリオでの生ごみとWASの組み合わせは、生成されるバイオガスの量が増加するため(単一の有機廃棄物の流れと比較して)有利です。バイオガスには、通常、60%〜70%のメタン、30〜40%の二酸化炭素、および微量の他のガス(硫化水素など)が含まれています8。バイオガスは、熱電併給技術を使用してWWTPの現場で洗浄および燃焼させ、電気および熱エネルギー要件の一部を相殺することができます9。
いくつかの研究では、有機廃棄物を共消化する嫌気性微生物叢のバイオメタネーションの可能性と生体動態パラメータが調査されています1。文献で利用可能な研究では、実験全体の離散的なポイントでメタン生成が測定される血清ボトルでのバッチアッセイが使用されていましたが、他の研究では、ベンチスケールまたはパイロットスケールのバイオリアクター2,10,11に直接接続された流量計を使用してメタン生成が測定されました。このプロトコルに記載されているような呼吸計を使用したメタン生成の連続測定は、さまざまな実験条件下で実行される多数のサンプルからの連続的かつ正確なメタン測定を提供できます1,12。いくつかの研究では、WASと他の有機基質(バイオ廃棄物、脂肪、油脂、グリース、農業廃棄物10,13,14)と結合した共消化によるメタン生成が測定されているが、多種多様な共消化シナリオからメタン生成速度を特定するための重要な研究が残っている。さらに、これまでのところ、食品スクラップとWASの共消化からのメタン生成を測定するための視覚的描写を使用した詳細で段階的なアプローチを提供する利用可能なプロトコルはありません。したがって、この研究では、希薄廃水、WAS、および食品廃棄物を基質として混合して、メタン生成を測定し、生体動態パラメータを導き出すための呼吸計プロトコルを提示します。メタン生産の変化を解明するために、さまざまな食品と微生物の比率(F:M)が使用されました。その他の測定値には、揮発性浮遊物質(VSS)、化学的酸素要求量(COD)、および各サンプルのpHが含まれます。このプロトコルでは、呼吸計のセットアップ、サンプルの作成、および重要な測定について説明します。
プロトコル
1. 基板の調製
- ~1.5 Lの一次排水、~1 Lの廃棄物活性汚泥(WAS)を回収します。
注:WASサンプルは実験の直前に採取する必要があります。しかし、WASは、実験前に4°Cで最大48時間保存することができ、基質15,16,17としての使用に識別可能な影響はない。 - 実験の直前に2 Lの嫌気性培養物を取得し、培養物を35°Cに維持します。 嫌気性消化槽から収集ボトルへの移送中は、空気との接触をできるだけ制限してください。
注:この研究で使用された嫌気性培養物は、廃水一次汚泥の嫌気性消化で8.5 MGD(38,640 m3 / d)を処理するWWTPから得られました。ベストプラクティスは、嫌気性培養物13 を取得する前に収集ボトルを窒素ガスで洗い流し、輸送および保管中に嫌気性条件を維持することにより、嫌気性条件を維持することである。 - 食品廃棄物を収集し、実験前に48°Cで最大48時間保管します。
注:実験デザインによっては、炭水化物、タンパク質などの目標比率で食品廃棄物を特定するように注意する必要があります。食品廃棄物中の有機物の目標割合は、実験によって異なる可能性があります。採取した食品中の炭水化物、タンパク質、脂肪の割合は、公開された文献から推定するか、確立されたプロトコル(ガスクロマトグラフィーなど)を使用して評価することができます。
2. 栄養補助食品の調製
- 800 mLの脱イオン(DI)水とCoCl2·6H2O(0.25 g)、FeCl3·6H2O (5 g)、MnCl2·4H2O (0.05 g)、NaMoO4·2H2O (0.005 g)、NiCl2·6H2O (0.025 g)、CuCl2·2H2O(0.007 g)、ZnCl2 (0.025 g)、H3BO3 (0.025 g)、Na2SeO4 (0.025 g)。脱イオン(DI)水で1Lまで希釈します。
- 800 mLの脱イオン水とCaCl2(27.7 g)およびMgCl2を混合して、ミネラルベース溶液#2を調製します。4H2O(101 g)。DI水で1Lまで希釈します。
- 800mLの脱イオン水とNH4Cl(38.2g)およびNa2SO4(15g)を混合して栄養塩基を調製します。脱イオン水に3.64 N NaOHを使用してpHを7.0に調整し、脱イオン水で最大1 Lに希釈します。
3. サンプル調製
- 食品廃棄物(表2)をブレンダー(図1)で混ぜ合わせて混合物を作ります。混合物に食品廃棄物の大きな粒子がないことを確認してください。食品廃棄物をDI水で希釈して、ブレンドを助けます。化学的酸素要求量(COD)の測定値を計算する際に使用する希釈水の量に注釈を付けます。この希釈された食品廃棄物は「作業廃棄物」として知られています。作業廃棄物を1Lのペットボトルに入れ、4°Cで保管します。
- 表1に従って4つの2Lビーカーにラベルを付けます。ビーカーを攪拌板に置き、大きな攪拌棒を追加します。食品廃棄物、WAS、希釈液(制御用のDI水と処理用の一次排水)を表1に従って2Lビーカーに組み合わせます。
- ミネラルベース液#1、ミネラルベース液#2、栄養ベースを各12mL加えます。
- 各ビーカーに2.4gのNaHCO3 (粉末)を加え、30秒間撹拌します。 表1 に従って8本の呼吸測定ボトルにラベルを付け、マグネチックスターバーを追加します。
注:これにより、コントロールと3つの処理の重複が作成され、異なるF:M比で作成されます。 - 表1に従って各2Lビーカーに嫌気性培養物を加え、攪拌します。ビーカーからメスシリンダーで混合物500mLをすぐに測定し、ラベル付きの呼吸計ボトルに移し、窒素ガスで洗い流してから、すぐにキャップをします。
注:嫌気性微生物叢と大気中の酸素との接触を制限するように注意する必要があります(利用可能な場合は、嫌気性チャンバーを使用して転送する必要があります)。
4. 初期条件の定量化
- セクション3の残りのサンプル(~200mL)を使用して、各サンプル18のpH、総COD(tCOD)、可溶性COD(sCOD)、総懸濁物質(TSS)、および揮発性懸濁物質(VSS)を測定する。
- 必要に応じて、測定装置の検出限界に基づいてサンプルをDI水で希釈します。
注:COD測定には、製造元の手順を使用しました。
- 必要に応じて、測定装置の検出限界に基づいてサンプルをDI水で希釈します。
5.呼吸計のセットアップ
- 呼吸計(図2)を低嫌気性設定に設定します。
- リセットボタンと電源オンボタンを同時に押します。
注: これは、このスタディで使用したモデルに固有のものです。 - チラー(図3)を35.5°Cに設定します。
- 各CO2 と水分スクラバー(図4 および 図5)に、CaSO4 とKOHペレットの50/50混合物を中央に充填し、両側をグラスウールで囲みます。
- サンプルボトルのチューブとニードルをスクラバーに接続し、次にスクラバーからガスインレットに接続します(図6)。
- 呼吸計ラップトップで、呼吸計プログラム RSA-8-v2.0を実行します。
注: この手順は、このスタディで使用するモデルに固有のものです。 - プログラム内のすべてのボトルを選択し、[ データラベルの編集] >選択します。すべてのボトルに名前を付けます。
注: この手順は、このスタディで使用するモデルに固有のものです。 - プログラムのスタートボタンをアクティブにして、ガス生産量の測定を開始します。30分ごとにデータを測定するようにプログラムを設定します。ガス生産を監視するには、[レートチャート]または[ボリュームチャート]を選択します。
注: この手順は、このスタディで使用するモデルに固有のものです。 - 実験後(~7日)は、プログラムの実行を停止し、チラーをオフにし、RSPFモジュールをオフにします。データファイルをCSVファイルとして保存し、MS Excelドキュメントに変換します。
注: この手順は、このスタディで使用するモデルに固有のものです。
6. 呼吸後の測定
- セクション4で行ったように、最終サンプルでpH、TSS、VSS、およびCODを測定します。
結果
食品廃棄物の組成
この研究で使用された食品廃棄物は、通常、大学の食堂で提供される5つの異なる食品タイプで構成されていました。各食品サンプルには、 表2にリストされているさまざまな量の脂肪、炭水化物、およびタンパク質が含まれていました。19 混合された生ごみ廃棄物は、炭水化物が44%、タンパク質が36%、脂肪が16%、その他の材料が4%でした。各食品タイプ(56g〜86g)のほぼ等しい質量を使用して、嫌気性共消化のための代表的なダイニング施設有機基質を提供しました。その後、生ごみ廃棄物の質量を変化させて、調査した各シナリオ(0.3、0.7、および1.1)で目的のF:Mを達成しました。
揮発性懸濁固体および有機測定
初期および最終VSSおよび初期および最終酸素要求量の結果を 表3に示します。酸素要求量はBOD5として表され、これは受け入れられた変換率(COD = 1.6BOD5)8を使用してCODから変換されました。図示されているように、初期 VSS 濃度( 表 3 でも質量で表されています)は、コントロールから最大 F:M 比(1.1)まで増加しました。調査した各F:Mは、VSS破壊、または有機物からメタンと二酸化炭素のガス状最終生成物への嫌気性変換を示しました。この変換により、VSSの濃度は初期測定から実験終了時の最終測定まで減少しました。破壊されるVSSの量は、コントロールからより大きなF:M比に増加しました。予想外に、F:M = 0.7 シナリオの VSS 破壊は、おそらく F:M 1.1 シナリオの抑制が原因で、F:M = 1.1 シナリオを上回りました。
測定された初期酸素要求濃度は、VSSと同じ傾向、すなわち、対照群から最大F:M比まで増加した(表3)。VSS破壊と同様に、BOD5 の濃度は、対照を除いて、初期濃度と最終濃度の間で減少しました。酸素要求量は、おそらく内因性の崩壊が原因で、コントロールで増加しました。VSS破壊とは異なり、最初の測定から最終的な測定までの酸素要求量の減少は、各サンプルで1〜3%の範囲と比較的低く、F:M比による傾向は見られませんでした。この傾向の考えられる理由は、粒子状有機物の可溶性有機物への変換であり、これは長い時間枠で行われ、嫌気性微生物コンソーシアム20の代謝における速度制限ステップであることが多い。
メタン生成
メタン生成の量と速度は、190時間の研究期間中、F:M比の範囲で変動しました。実験結果から、F:M比が高いほど、メタンの総量が増加することが明らかになりました(図7)。基質を添加しなかったコントロールでは、少量のメタン(~72 mL)が生成されましたが、これはおそらくスラッジ中の可溶性BOD5 および/または内因性崩壊によるものと考えられます。予想通り、他のシナリオで基質を追加すると、コントロールと比較してメタン生成が増加しました。F:M 0.3 のシナリオでは、対照群の 5 倍の体積 (~354 mL) のメタンが得られました。F:M 比を 0.7 に増やすと、F:M の 0.3 シナリオよりも 1.6 倍 (~574 mL) のメタンが得られました。同様に、F:M 比を 1.1 に増やすと、F:M の 0.7 シナリオよりも 1.9 倍多くのメタン (~1098 mL) が得られました。調査した各F:M比で観測された最大体積メタン生成値(Ymax)を 表4に示します。時間の経過とともに生成されるメタンの割合も、調査したF:M比によって変化しました。 図8に示すように、メタンの生成速度と、研究中のメタン生成時間の長さは、F:Mが増加するにつれて増加しました。たとえば、F:M 0.3 のシナリオでは、129 時間の試験後 (最大 354 mL) にメタン生成は観察されませんでしたが、F:M 1.1 のシナリオでは、試験終了時にも少量のメタンが生成されていました。すべてのシナリオにおいて、メタンの生成速度は、基質の利用可能性の低下により、時間の経過とともに減少しました。研究終了時にはまだ十分な酸素要求量がありましたが(表3)、生物学的に利用可能な形ではなかったか、嫌気性微生物叢に残された電子受容体(二酸化炭素など)が限られていた可能性があります。最後に、観測されたVSS破壊(mg)あたりのメタン生成量(mL)の比較は、0.3と0.7のF:Mの値が1.3〜1.6mL / mgの範囲を提供し、1.1のF:Mが破壊された単位VSS(3.7mL / mg)あたりのメタン生成量が多いことを示しています(表4)。Tchobanoglous et al. (2014) は、一般的な原料について、脂肪 (~1.4 mL/mg)、グリース (~1.1 mL/mg)、タンパク質 (~0.7 mL/mg) 8 を含む、破壊された単位固形分あたりのガス収率の典型的な範囲を提供しています。Mata-Alvarez et al.(2014)は、ベンチスケールとパイロットスケールのバイオリアクター10において、さまざまな基質と異なる基質比(例えば、WASとFOGの異なる比率)を用いて廃水汚泥を共消化する研究をレビューした。その結果、報告された単位VSSあたりのメタン生成量は、共消化された基質や、破壊された1mgあたり0.2mLから1.1mLのバイオガスの範囲で、共消化された基質によって大きく異なることがわかりました。この研究の代表的な結果、特にF:Mが0.3と0.7の場合、比較研究の結果と遜色ありません。
バイオキネティックパラメータ
経時的なメタン生成は、いくつかの重要な生体動態パラメータを決定するために使用できます。これらの生体動態パラメータは、呼吸計を使用せずに同様のシナリオでメタン生成を予測するためにさらに活用できます。メタン生成速度定数 kは、調査した各F:M比( 図8に示すもの)の観測された呼吸計データに対数最小二乗フィッティングを使用して導き出すことができます。F:M が 0.3 のシナリオの代表的な対数関数は、y = 93.465ln(X) - 175.91 です。ここで、93.465 の値は時間の単位であり、これを日に変換してから逆にすると、 k = 0.257 になります。調査した各F:M比のレート定数(k)と決定係数(R2)を 表4に示します。
次に、速度定数を活用して、各F:M比の任意の時点でのメタンの収量を決定できます。有機基質から経時的に生成されるメタンの割合は、次の式[1]21を使用してモデル化できます。
(1)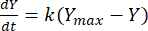
上記の方程式を制限t = 0からt = tの間で積分すると、次のようになります[2]。
(2)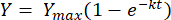
ここで、Y =任意の時点でのメタン収量[mL];Ymax = 呼吸計の研究から観察された最大メタン収量 [mL]; k =メタン生成速度定数[d-1];t = 時間 [d]
上記のバイオキネティックパラメータの開発に使用された一次アプローチは、実験データに非常に合理的に適合しますが(表4のR2値で示されているように)、他の研究では、メタン生成データを適合させるために、修正ゴンペルツモデル、2基質モデル、コーンモデル2などの他のモデルの使用が報告されています。

図1:食品廃棄物ブレンダー。食品廃棄物を組み合わせるために使用される標準的なブレンダー。この図の拡大版を表示するには、ここをクリックしてください。

図2:呼吸計。 メタン生成を測定するための呼吸計のセットアップが完了しました。 この図の拡大版を表示するには、ここをクリックしてください。

図3:呼吸計チラーのサンプルボトル。 8つのサンプルボトルを備えた呼吸計チラーの内部図。 この図の拡大版を表示するには、ここをクリックしてください。

図4:呼吸計スクラバー。 呼吸計スクラバーのクローズビュー。 この図の拡大版を表示するには、ここをクリックしてください。
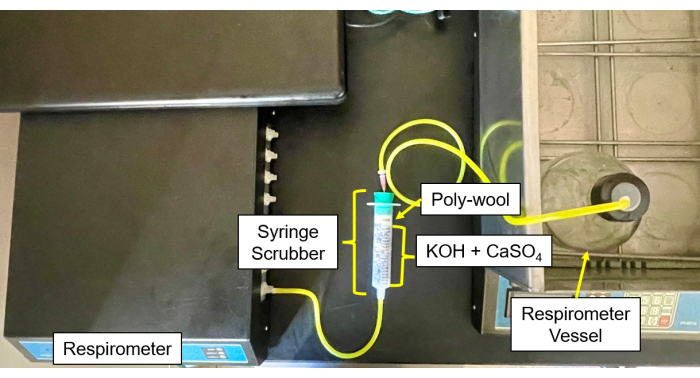
図5:制御モジュールへの呼吸計スクラバー。 制御モジュールとスクラバーセットアップの呼吸計画像。 この図の拡大版を表示するには、ここをクリックしてください。

図6:呼吸計スクラバーラインのセットアップ。 サンプルボトルと呼吸計の間のスクラバーラインのセットアップのクローズビュー。 この図の拡大版を表示するには、ここをクリックしてください。
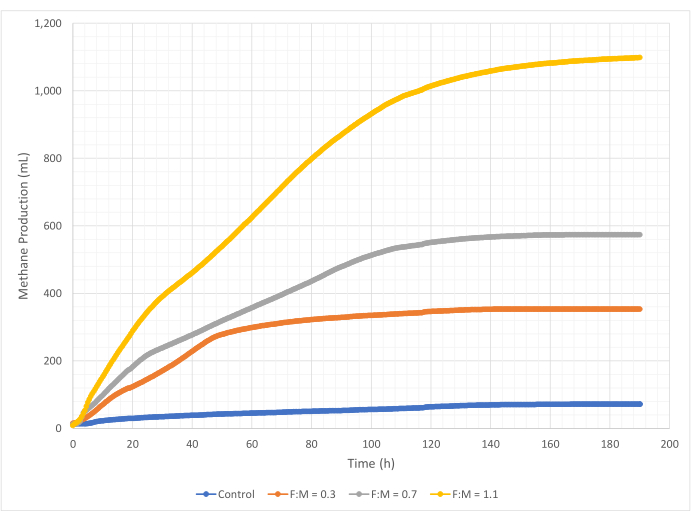
図7:異なるF:M比を使用した総メタン生産量。 各F:M(0.3、0.7、1.1)のメタン生成を経時的(0時間から190時間)で示します。 この図の拡大版を表示するには、ここをクリックしてください。
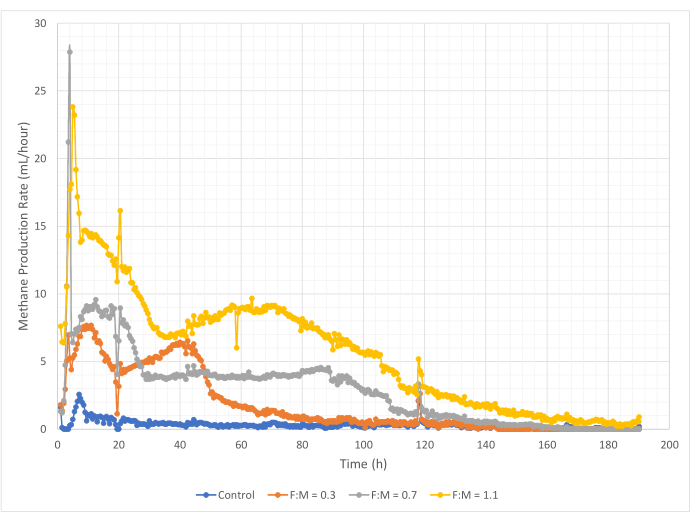
図8:異なるF:M比を使用したメタン生成率。 各F:M(0.3、0.7、1.1)のメタン生成率を経時的(0時間から190時間)で示しています。 この図の拡大版を表示するには、ここをクリックしてください。
表1:サンプルボトルの成分と食品と微生物の比率。 各F:M(0.3、0.7、1.1)およびブランクボトルの成分質量、濃度、および容量。 この表をダウンロードするには、ここをクリックしてください。
表2:サンプル有機基質組成。 食品廃棄物の質量と食品別の組成の割合、および炭水化物、タンパク質、脂肪の割合。 この表をダウンロードするには、ここをクリックしてください。
表3:サンプルの揮発性懸濁固体と酸素要求量の結果(±標準偏差)。 各 F:M の VSS と COD (0.3、0.7、1.1)。 この表をダウンロードするには、ここをクリックしてください。
表4:サンプルの動的パラメータ。 メタン収量に基づいて計算された速度論的パラメータ。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルで提供される方法は、研究者や開業医が呼吸測定を使用して有機廃棄物の流れを嫌気的に消化するバイオメタンの可能性を判断するのに役立ちます。このプロトコルでは、典型的な食品廃棄物の流れとWWTPからのWASを組み合わせた共消化によるメタン生成を、さまざまなF:M比で実証します。このプロトコルは、メタン生成の連続測定と一次動力学モデリングを使用した生体動態パラメータの決定のための段階的な呼吸測定アプローチを提供することにより、文献に追加されます。他のいくつかの研究では、離散的な時間10,22でのメタン生成を測定する小宇宙実験が採用されており、他の研究では、長時間連続フローベンチまたはパイロットスケールのバイオリアクター14,23に取り付けられた流量計を使用してメタンを測定しています。呼吸器測定には、さまざまな実験条件でメタン生成を連続的に測定できるという利点があります。呼吸器計測実験ではバイオリアクターの構築を必要としないため、実験条件は、一部のベンチスケールまたはパイロットスケールの実験と比較して、相対的な頻度で変更することができます。この利点により、呼吸測定実験を使用して、比較的短時間で多数の有機廃棄物の組み合わせを共消化することにより、メタン生成を決定できます。例えば、この研究で提示されたプロトコルの次のステップとして、WASに比べて化学エネルギーが非常に高い油脂、油脂、グリースを食品スクラップと一緒に消化して、時間の経過とともにメタン生成が増加する可能性を定量化することができます。このアプローチの適用は、共消化スキームにおける複数の基質の組み合わせにわたるメタン生成速度と生体動態パラメータに関する一連の文献を引き続き構築することができます。さらに、最適な基質の組み合わせを決定するだけでなく、メタン生成結果と生体動態パラメータを使用して、廃水処理用に設計されたプログラムなどの既存のプログラムのパフォーマンスモデリングに情報を提供したり、ベンチスケールまたはパイロットスケールからフルスケールにスケールアップしたときに共消化スキームがどのように機能するかを予測したりできます24,25。
さらに、このプロトコルは、嫌気性微生物コンソーシアムに合わせた基質フィードを適用するように修正される可能性があります。例えば、研究者が嫌気性微生物叢に炭水化物のみまたはタンパク質のみを提供することの影響を調べたい場合、このプロトコルの原料はそれに応じて変更することができます。あるいは、研究者が特定の画分COD(例えば、可溶性CODのみ、または微粒子CODのみ)または高濃度の特定の基質(例えば、酢酸塩、揮発性脂肪酸、嫌気性代謝の中間生成物)をメタン生成に添加することの影響をテストしたい場合は、このプロトコルのバリエーションを使用することができます。基質を改質したり、特定の基質のF:Mを交互にしたりする際に観察されるベストプラクティスは、各サンプルの嫌気性微生物叢の質量を同じに保ちながら、基質の質量のみを調整することです(質量対質量比を採用する必要があります)。研究者は、基質の改質に加えて、このプロトコルを他の分析と併用して、基質の使用とメタン生成について理解を深めることができます。例えば、研究者は、このプロトコルを微生物群集解析(16S rRNA遺伝子シーケンシングやメタゲノミクスなど)と組み合わせて使用することで、群集構造と機能をよりよく関連付けることができます。
この方法論の有用性にもかかわらず、いくつかの制限があります。呼吸計とバイオメタン電位試験は、バッチリアクターとして最も頻繁に構成されます。ただし、フルスケールの嫌気性共消化器は、通常、スラッジ保持時間が10日を超える連続フローシステムとして運用されます1。したがって、呼吸器計測実験から収集されたデータは、メタン生成速度の推定や生体動態パラメータの開発に役立ちますが、これらのデータは、可能であれば、長期にわたって動作する大規模な消化器を使用して現場で検証する必要があります。
さらに、呼吸測定の前にサンプルを選択して準備する際には注意を払う必要があります。大きな生ごみ粒子は、VSSおよびCOD測定を歪め、不正確な結果をもたらす可能性があります。食品廃棄物を基材として使用する場合、ブレンドは十分に浸軟し、大きな食品粒子を含まない必要があります-これは、フルスケールの消化槽で食品廃棄物を受け入れるピットでのマセラシオンに似たアプローチです。脱イオン水による希釈は、ブレンドプロセスに役立ち、生ごみを大規模に浸軟させるときに一般的に使用される水の追加と似ています。ただし、希釈が適切に測定され、目標水分含有量が達成されるように、あらゆる努力を払う必要があります。希釈化は、特に経験の浅い学生がこのプロトコルを実行している場合、エラーの原因になりやすいです。
共消化に存在する微生物コンソーシアムには偏性嫌気性菌が含まれているため、移送およびサンプル調製プロセス中の酸素への曝露を排除(または大幅に低減)するために特別な注意を払う必要があります。酸素は、窒素フラッシングによってサンプルボトルから除去できます。さらに、可能であれば、収集ボトルと呼吸計サンプルボトルの間で嫌気性培養を移す作業は、嫌気性チャンバーで行う必要があります。呼吸計は一貫した結果(メタン生成量と速度)を提供するため、期待される結果からの逸脱、例えば生存不可能な微生物コンソーシアムは、テストの開始に向けて簡単に特定できます。重複または三重のサンプルを使用すると、欠陥のあるテストの特定にさらに役立ちます。
開示事項
著者は何も開示していません。
謝辞
このプロトコルの開発に関する議論にご協力いただいたRespirometer Systems and ApplicationsのJim Young博士に感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| 103 °C Oven Isotemp | Fisher Scientific | 13-247-737F | Model: 737F, Force Air Oven |
| 550 °C Vulcan Oven | Neytech (Manufacturer) / Cole Palmer (Vendor) | 9493308 | Model: 3-550 |
| Aerobic/Anaerobic Respirometer | Respirometer System and Applications (RSA) | PF-8000 | Model: PF-8000 |
| Analytical Balance | Mettler Toledo | 30029075 | Model: ME204E, Detection Limit: 0.1 mg |
| Smoothie Blender with 56 oz Plastic Jar | Hamilton Beach | 50190F | Model: 50190F |
| COD Vials TNT Plus Vial Test | HACH | TNT821 | TNT 821, 3–150 mg/L COD |
| COD Vials TNT Plus Vial Test | HACH | TNT822 | TNT 822, 20–1500 mg/L COD |
| Dessicator | SP Bel-Art | 942070050 | Model: SP Scienceware |
| Dionized Water System | Milli-Q | ZIQ7010T0C | IQ 7010 Pure & Ultrapure Water Purification System |
| Anhydrous CaSO4 | W.A. Hammond Drierite Company | 13001 | 8 Mesh, 1 lb |
| Glass Fiber Filters | Whatman (Manufacturer) / Cole-Parmer (Vendor) | 1827-150 | Model: 934-AH |
| Heat Digestor Block | HACH | DRB200-02 | DRB 200 |
| Hot Plate Stirrer | Corning | 6795-620D | Model: PC-620D |
| Industrial-Grade Nitrogen (Compressed Cylinder) | Air Gas | NI UHP300 | 300 cubic feet |
| Pellets (KOH) | Fisher Scientific | AC134062500 | 500 g |
| pH Meter | Fisher Scientific | 13-636-AP115 | AP115, Accumet pH meter |
| UV Spectrophotometer | HACH | LPV400.99.00012 | DR 3900 |
| Vaccum Pump | GAST | 1HAB-25-M100X |
参考文献
- Mainardis, M., Buttazzoni, M., Cottes, M., Moretti, A., Goi, D. Respirometry tests in wastewater treatment: Why and how? A critical review. Sci Total Environ. 793, 148607 (2021).
- Pan, Y., et al. Synergistic effect and biodegradation kinetics of sewage sludge and food waste mesophilic anaerobic co-digestion and the underlying stimulation mechanisms. Fuel. 253, 40-49 (2019).
- Argiz, L., et al. Assessment of a fast method to predict the biochemical methane potential based on biodegradable COD obtained by fractionation respirometric tests. J Environ Manage. 269, 110695 (2020).
- Carucci, A., et al. Aerobic storage by activated sludge on real wastewater. Water Res. 35 (16), 3833-3844 (2001).
- McCarty, P. L., Bae, J., Kim, J. Domestic wastewater treatment as a net energy producer-Can this be achieved. Environ Sci Technol. 45 (17), 7100-7106 (2011).
- McCarty, P. The development of anaerobic treatment and its future. Water Sci Technol. 44 (8), 149-156 (2001).
- From farm to kitchen: The environmental impacts of U.S. food waste Part 1. United States Environmental Protection Agency Available from: https://www.epa.gov/system/files/documents/2021-11/from-farm-to-kitchen-the-environmental-impacts-of-u.s.-food-waste_508-tagged.pdf (2021)
- Tchobanoglous, G., Burton, F. L., Stensel, H. D. . WastewaterEngineering:TreatmentandReuse. 5th ed. , (2014).
- Pfluger, A., et al. Anaerobic digestion and biogas beneficial use at municipal wastewater treatment facilities in Colorado: A case study examining barriers to widespread implementation. J Clean Prod. 206, 97-107 (2019).
- Mata-Alvarez, J., Dosta, J., Romero-Güiza, M. S., Fonoll, X., Peces, M., Astals, S. A critical review on anaerobic co-digestion achievements between 2010 and 2013. Renew Sust Energ Rev. 36, 412-427 (2014).
- Pfluger, A. R., Hahn, M. J., Hering, A. S., Munakata-Marr, J., Figueroa, L. Statistical exposé of a multiple-compartment anaerobic reactor treating domestic wastewater. Water Environ Res. 90 (6), 530-542 (2018).
- Razaviarani, V., Buchanan, I. D. Calibration of the Anaerobic Digestion Model No. 1 (ADM1) for steady-state anaerobic co-digestion of municipal wastewater sludge with restaurant grease trap waste. Chem Eng J. 266, 91-99 (2015).
- Zhu, H., et al. Biohydrogen production by anaerobic co-digestion of municipal food waste and sewage sludges. Int J Hydrog Energy. 33 (14), 3651-3659 (2008).
- Serna-García, R., Ruiz-Barriga, P., Noriega-Hevia, G., Serralta, J., Pachés, M., Bouzas, A. Maximising resource recovery from wastewater grown microalgae and primary sludge in an anaerobic membrane co-digestion pilot plant coupled to a composting process. J Environ Manage. 281, 111890 (2021).
- Gossett, J. M., Belser, R. L. Anaerobic digestion of waste activated sludge. J Environ. 108 (6), 1101-1120 (1982).
- Yi, H., Han, Y., Zhuo, Y. Effect of combined pretreatment of waste activated sludge for anaerobic digestion process. Procedia Environ Sci. 18, 716-721 (2013).
- Nah, I. W., Kang, Y. W., Hwang, K. Y., Song, W. K. Mechanical pretreatment of waste activated sludge for anaerobic digestion process. Water Res. 34 (8), 2362-2368 (2000).
- American Public Health Association. . Standard Methods for the Examination of Water and Wastewater. Vol. 10. American Public Health Association. , (2012).
- Food Data Central. US Department of Agriculture Available from: https://fdc.nal.usda.gov/ (2024)
- Vanzin, G., Pfluger, A., Almstrand, R., Figueroa, L., Munakata-Marr, J. Succession of founding microbiota in an anaerobic baffled bioreactor treating low-temperature raw domestic wastewater. Environ Sci Water Res Technol. 8 (4), 792-806 (2022).
- Negi, S., Dhar, H., Hussain, A., Kumar, S. Biomethanation potential for co-digestion of municipal solid waste and rice straw: a batch study. Bioresour Technol. 254, 139-144 (2018).
- Rostkowski, K. H., Pfluger, A. R., Criddle, C. S. Stoichiometry and kinetics of the PHB-producing Type II methanotrophs Methylosinus trichosporium OB3b and Methylocystis parvus OBBP. Bioresour Technol. 132, 71-77 (2014).
- Pfluger, A., Vanzin, G., Munakata-Marr, J., Figueroa, L. An anaerobic hybrid bioreactor for biologically enhanced primary treatment of domestic wastewater under low temperatures. Environ Sci Water Res Technol. 4 (11), 1851-1866 (2018).
- Callahan, J. L., Pfluger, A. R., Figueroa, L. A., Munakata-Marr, J. BioWin® modeling of anaerobic sludge blanket treatment of domestic wastewater. Bioresour Technol Rep. 20, 101231 (2022).
- Linvill, C., Butkus, M., Bennett, E., Wait, M., Pytlar, A., Pfluger, A. Energy balances for proposed complete full-scale anaerobic wastewater treatment facilities. Environ Eng Sci. 40 (11), 482-493 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved