Method Article
호흡 측정법을 사용하여 폐기물 활성 슬러지와 혐기성 동시 소화된 음식물 쓰레기 폐기물의 바이오메탄 전위 측정
요약
이 프로토콜은 혐기성 미생물총, 음식물 쓰레기 폐기물 및 폐기물 활성 슬러지를 공동 소화하기 위한 호흡 측정법을 사용하여 메탄 생성 및 미생물 역학 매개변수를 결정하기 위한 모범 사례를 설명합니다.
초록
폐수를 처리하거나 폐수 슬러지를 소화하는 미생물군의 생체 역학을 연구하기 위해 호흡 측정법을 사용하는 것은 지난 수십 년 동안 더 널리 보급되었습니다. 폐수 슬러지 및 음식물 쓰레기와 같은 유기 폐기물 흐름을 공동 소화하는 혐기성 미생물군의 생체 역학을 검사하기 위해 호흡 측정법을 사용하는 것은 활발한 연구 분야입니다. 현재까지 이 주제에 대해 시각화된 프로토콜이 발표되지 않았습니다. 따라서 이 프로토콜에서는 세 가지 다른 식품 대 미생물(F:M) 비율과 음식물 쓰레기 폐기물 및 폐기물 활성 슬러지를 기판으로 사용하여 시간 경과에 따른 메탄 생성 및 유속을 측정하기 위해 호흡계를 구성했습니다. 기판 이용률 측정과 결합된 결과 데이터는 다양한 기판 농도가 혐기성 미생물군이 메탄을 생성하는 속도에 어떤 영향을 미치는지 이해하기 위한 기초를 제공합니다. 또한 이 프로토콜은 생체 역학 매개변수(예: 메탄 생성 속도, 일정한 및 수율)를 개발하는 방법을 제시합니다. 다른 사람들은 이 호흡 측정 프로토콜을 사용하여 혐기성 조건에서 유기 분해를 검사하고 미생물 매개변수를 개발할 수 있습니다.
서문
연구원들은 배치 연구, 소우주, 호흡 측정법 등을 포함한 다양한 접근 방식을 사용하여 벤치 스케일에서 미생물 활동을 연구합니다. 호흡계는 통제된 조건에서 기질 소비와 최종 제품 생산을 관찰하여 미생물 군집의 성장 및/또는 붕괴 단계를 통해 세포 호흡을 측정하는 데 사용할 수 있습니다1. 벤치 스케일 호흡계 연구의 결과는 프로세스 모델 구축을 위한 생체 역학 매개변수를 추정하는 데에도 사용할 수 있습니다2. 호흡계는 호기성 및 혐기성 미생물 활동을 모두 검사하는 데 사용되었습니다. 그러나 특히 혼합 유기 기질의 바이오메탄 전위(BMP)를 측정하기 위해 호흡 측정법을 사용하는 연구는 지속적인 연구 영역입니다 3,4.
가정 폐수의 유기물은 실행 가능한 재생 가능한 화학 에너지원으로 인식되고 있습니다5. 폐수 슬러지(즉, 1차 슬러지 및 폐기물 활성 슬러지, WAS)의 혐기성 소화는 100년 이상 폐수 처리장(WWTP)에서 메탄이 풍부한 바이오가스를 생산하는 데 사용되어 왔다6. 그러나 WAS를 통한 음식물 쓰레기 폐기물과 같은 여러 유기 폐기물 흐름의 소화는 최근 몇 년 동안에만 널리 보급되었으며 여전히 활발한 연구 분야입니다. 음식물 쓰레기 폐기물은 많은 선진국에서 지속적으로 발생하는 고밀도 유기 물질의 폐기물로, 미국 내 매립지 질량의 약 25%를 차지합니다7. 음식물 찌꺼기의 일부를 매립지에 버리는 것 외에도 음식물 찌꺼기와 WAS를 공동 소화 시나리오에서 결합하는 것은 생산되는 바이오 가스의 양이 증가하기 때문에 유리합니다(단일 유기 폐기물 흐름에 비해). 바이오 가스는 일반적으로 60%-70%의 메탄, 30%-40%의 이산화탄소 및 미량의 기타 가스(예: 황화수소)를 포함합니다8. 바이오가스는 전기 및 열 에너지 요구 사항의 일부를 상쇄하기 위해 결합된 열병합 발전 기술을 사용하여 WWTP에서 현장에서 세척 및 연소할 수 있습니다9.
여러 연구에서 혐기성 미생물군이 유기 폐기물을 공동 소화하는 생체 역학 잠재력과 생체 역학 매개변수를 조사했습니다1. 문헌에서 사용 가능한 연구는 메탄 생성이 실험 전반에 걸쳐 개별 지점에서 측정되는 혈청 병의 배치 분석을 사용한 반면, 다른 연구는 벤치 또는 파일럿 스케일 생물 반응기 2,10,11에 직접 연결된 유량계를 사용하여 메탄 생성을 측정했습니다. 이 프로토콜에 설명된 것과 같은 호흡계를 사용하여 메탄 생성을 지속적으로 측정하면 다양한 실험 조건(1,12)에서 실행되는 많은 수의 샘플로부터 연속적이고 정밀한 메탄 측정을 제공할 수 있습니다. 여러 연구에서 생물 폐기물, 지방, 오일, 그리스 및 농업 폐기물10,13,14과 같은 다른 유기 기질과 결합된 WAS의 공동 소화로 인한 메탄 생성을 측정했지만, 다양한 동시 소화 시나리오에서 메탄 생성 속도를 식별하기 위한 중요한 작업이 남아 있습니다. 또한, 현재까지 사용 가능한 프로토콜은 음식물 찌꺼기와 WAS의 동시 소화로 인한 메탄 생성을 측정하기 위해 시각적 묘사를 사용하여 심층적인 단계별 접근 방식을 제공하지 않습니다. 따라서 본 연구는 묽은 폐수, WAS 및 음식물 쓰레기 폐기물을 기질로 혼합하여 메탄 생성을 측정하고 생체 역학 매개변수를 도출하기 위한 호흡계 프로토콜을 제시합니다. 메탄 생성의 변화를 설명하기 위해 다양한 식품 대 미생물 비율(F:M)이 사용되었습니다. 다른 측정에는 휘발성 부유 물질(VSS), 화학적 산소 요구량(COD) 및 각 샘플의 pH가 포함됩니다. 이 프로토콜은 호흡계 설정, 검체 생성 및 중요 측정에 대해 설명합니다.
프로토콜
1. 기판의 제조
- ~1.5L의 1차 폐수, ~1L의 폐기물 활성 슬러지(WAS)를 수집합니다.
참고: WAS 샘플은 실험 직전에 채취해야 합니다. 그러나, WAS는 기판(15,16,17)으로서의 사용에 뚜렷한 영향 없이 실험 전에 4°C에서 최대 48시간 동안 보관될 수 있다. - 실험 직전에 2L의 혐기성 배양액을 획득하고 배양액을 35°C로 유지합니다. 혐기성 소화조에서 수집 병으로 이송하는 동안 공기와의 접촉을 가능한 한 제한하십시오.
참고: 이 연구에 사용된 혐기성 배양은 폐수 1차 슬러지의 혐기성 소화로 8.5MGD(38,640m3/d)를 처리하는 WWTP에서 얻었습니다. 최선의 방법은 혐기성 배양물(13 )을 획득하기 전에 수집 용기를 질소 가스로 세척하여 혐기성 상태를 유지하고 운송 및 보관 중에 혐기성 상태를 유지하는 것이다. - 음식물 쓰레기를 모아 48°C에서 실험하기 전에 최대 48시간 동안 보관합니다.
참고: 실험 설계에 따라 탄수화물, 단백질 등의 목표 비율로 음식물 쓰레기를 식별하는 데 주의를 기울여야 합니다. 음식물 쓰레기에서 유기물의 목표 비율은 실험에 따라 달라질 수 있습니다. 수집된 식품의 탄수화물, 단백질 및 지방의 비율은 발표된 문헌에서 추정하거나 확립된 프로토콜(예: 가스 크로마토그래피)을 사용하여 평가할 수 있습니다.
2. 영양 보충제의 준비
- 탈이온수(DI) 1mL와 800mL의 탈이온수(DI)를 CoCl2·6H2O(0.25g), FeCl3·6H2O (5 g), MnCl2 ·4H2O (0.05 g), NaMoO4 ·2H2O (0.005 g), NiCl2 ·6H2O (0.025 g), CuCl2 ·2H2O(0.007g),ZnCl2(0.025g),H3BO3(0.025g) 및Na2SeO4(0.025g). 탈이온수(DI)로 최대 1L를 희석합니다.
- 탈이온수 2mL를 CaCl2 (27.7g) 및 MgCl2·4H2O (101g). 탈이온수로 최대 1L까지 희석합니다.
- DI 물 800mL를 NH4Cl (38.2g) 및 Na2SO4 (15g)와 혼합하여 영양염기를 준비합니다. 탈이온수에 3.64N NaOH를 사용하여 pH를 7.0으로 조정하고 탈이온수로 최대 1L를 희석합니다.
3. 샘플 준비
- 음식물 쓰레기(표 2)를 블렌더(그림 1)에 넣고 혼합물을 만듭니다. 혼합물에 큰 음식물 쓰레기 입자가 없는지 확인하십시오. 음식물 쓰레기를 DI 물로 희석하여 블렌딩을 돕습니다. 화학적 산소 요구량(COD) 측정을 계산할 때 사용할 희석수의 양에 주석을 답니다. 이렇게 희석된 음식물 쓰레기를 '작업 쓰레기'라고 합니다. 작업 쓰레기를 1L 페트병에 넣고 4°C에서 보관합니다.
- 표 1에 따라 4개의 2L 비커에 라벨을 붙입니다. 젓는 접시에 비커를 놓고 큰 젓는 막대를 추가합니다. 표 1에 따라 음식물 쓰레기, WAS 및 희석(방제를 위한 DI 물 및 처리용 1차 폐수)을 2L 비커에 결합합니다.
- 미네랄 베이스 용액 #1, 미네랄 베이스 용액 #2 및 영양 베이스를 각각 12mL씩 추가합니다.
- 각 비커에 NaHCO3 (분말) 2.4g을 넣고 30초 동안 저어줍니다. 표 1 에 따라 8개의 호흡 측정 병에 라벨을 붙이고 자기 교반 막대를 추가합니다.
참고: 이렇게 하면 대조군과 서로 다른 F:M 비율로 세 가지 처리가 중복됩니다. - 표 1에 따라 각 2L 비커에 혐기성 배양액을 추가하고 저어줍니다. 눈금이 매겨진 실린더가 있는 비커에서 혼합물 500mL를 즉시 측정하고 라벨이 부착된 호흡계 병에 옮기고 질소 가스로 씻어낸 다음 즉시 뚜껑을 닫습니다.
알림: 혐기성 미생물군과 대기 산소의 접촉을 제한하도록 주의를 기울여야 합니다(가능한 경우 혐기성 챔버를 사용하여 전달해야 함).
4. 초기 조건의 정량화
- 섹션 3(~200mL)의 나머지 샘플을 사용하여 각 샘플18에 대해 pH, 총 COD(tCOD), 가용성 COD(sCOD), 총 부유 고형물(TSS) 및 휘발성 부유 고형물(VSS)을 측정합니다.
- 필요한 경우 측정 장비의 검출 한계에 따라 샘플을 DI 물로 희석합니다.
알림: COD 측정에는 제조업체의 절차가 사용되었습니다.
- 필요한 경우 측정 장비의 검출 한계에 따라 샘플을 DI 물로 희석합니다.
5. 호흡계계 설정
- 호흡계(그림 2)를 낮은 혐기성 설정으로 설정합니다.
- 리셋 버튼과 전원 버튼을 동시에 누릅니다.
참고: 이는 이 연구에 사용된 모델에만 해당됩니다. - 냉각기(그림 3)를 35.5°C로 설정합니다.
- 각 CO2 및 수분 스크러버(그림 4 및 그림 5)를 중앙에 CaSO4 및 KOH 펠릿의 50/50 혼합물로 채우고 양쪽은 유리솜으로 둘러싸여 있습니다.
- 샘플 병의 튜브와 바늘을 스크러버에 연결한 다음 스크러버에서 가스 주입구로 연결합니다(그림 6).
- 호흡계에서 노트북에서 호흡계계 프로그램 RSA-8-v2.0을 실행합니다.
참고: 이 단계는 이 연구에 사용된 모델에 따라 다릅니다. - 프로그램에서 모든 병을 선택하고 데이터 레이블 편집을 선택합니다>. 모든 병의 이름을 지정합니다.
참고: 이 단계는 이 연구에 사용된 모델에 따라 다릅니다. - 프로그램에서 시작 버튼을 활성화하여 가스 생산 측정을 시작합니다. 30분마다 데이터를 측정하도록 프로그램을 설정합니다. Rate Chart(속도 차트) 또는 Volume Chart(볼륨 차트)를 선택하여 가스 생산량을 모니터링합니다.
참고: 이 단계는 이 연구에 사용된 모델에 따라 다릅니다. - 실험 후(~7일) 프로그램에서 실행을 중지하고 냉각기를 끄고 RSPF 모듈을 끕니다. 데이터 파일을 CSV 파일로 저장한 다음 MS Excel 문서로 변환합니다.
참고: 이 단계는 이 연구에 사용된 모델에 따라 다릅니다.
6. 호흡 후 측정
- 섹션 4에서 수행한 대로 최종 샘플에서 pH, TSS, VSS 및 COD를 측정합니다.
결과
음식물 쓰레기 조성물
이 연구에 사용된 음식물 쓰레기는 일반적으로 대학 식당에서 제공되는 5가지 다른 식품 유형으로 구성되었습니다. 각 식품 샘플에는 다양한 양의 지방, 탄수화물 및 단백질이 있었으며 이는 표 2에 나열되어 있습니다. 19 혼합 된 음식물 쓰레기는 탄수화물 44 %, 단백질 36 %, 지방 16 % 및 기타 물질 4 %였습니다. 각 식품 유형(56 g 내지 86 g)의 거의 동일한 질량을 사용하여 혐기성 공동 소화를 위한 대표적인 식당 시설 유기 기질을 제공하였다. 음식물 쓰레기 폐기물의 질량은 조사된 각 시나리오(0.3, 0.7 및 1.1)에 대해 원하는 F:M을 달성하기 위해 이후에 변경되었습니다.
휘발성, 부유, 고체 및 유기 측정
초기 및 최종 VSS, 초기 및 최종 산소 요구량에 대한 결과는 표 3에서 확인할 수 있습니다. 산소 요구량은 BOD5로 표시되며, 이는 허용된 변환 비율(COD = 1.6BOD5)8을 사용하여 COD에서 변환되었습니다. 도시된 바와 같이, 초기 VSS 농도( 표 3에서 질량으로도 표시됨)는 대조군에서 가장 큰 F:M 비율(1.1)로 증가했습니다. 조사된 각 F:M은 VSS 파괴 또는 유기물을 메탄과 이산화탄소의 기체 최종 산물로 혐기성 전환하는 것으로 나타났습니다. 변환으로 인해 VSS의 농도는 초기 측정에서 실험 종료 시 수행된 최종 측정까지 감소했습니다. 파괴되는 VSS의 양은 대조군에서 더 큰 F:M 비율로 증가했습니다. 예기치 않게 F:M = 0.7 시나리오에 대한 VSS 파괴가 F:M = 1.1 시나리오를 초과했는데, 이는 아마도 1.1의 F:M 시나리오의 억제 때문일 수 있습니다.
측정된 초기 산소 요구량 농도는 VSS와 동일한 경향, 즉 대조군에서 가장 큰 F:M 비율로 증가하는 경향을 따랐습니다(표 3). VSS 파괴와 유사하게, BOD5 농도는 대조군을 제외하고 초기 농도와 최종 농도 사이에서 감소했습니다. 대조군에서 산소 요구량이 증가했는데, 이는 내인성 붕괴로 인한 것으로 보인다. VSS 파괴와 달리 초기 측정에서 최종 측정까지의 산소 요구량 감소는 각 샘플에 대해 1에서 3% 사이로 상대적으로 낮았으며 F:M 비율에 따른 추세를 보이지 않았습니다. 이러한 경향에 대한 가능한 이유는 미립자 유기물이 용해성 유기물로의 전환이기 때문이며, 이는 장기간에 걸쳐 일어나고 종종 혐기성 미생물 컨소시엄20의 대사에서 속도 제한 단계이다.
메탄 생산
메탄 생성의 양과 속도는 190시간의 연구 기간 동안 F:M 비율 범위에 따라 다양했습니다. 실험 결과, F:M 비율이 높을수록 메탄의 전체 부피가 증가하는 것으로 나타났습니다(그림 7). 기질이 첨가되지 않은 대조군은 소량의 메탄(~72mL)을 생성했는데, 이는 슬러지 및/또는 내인성 붕괴에서 상대적으로 적은 양의 용해성 BOD5 때문일 수 있습니다. 예상한 대로, 다른 시나리오에서 기질을 추가하면 대조군에 비해 메탄 생산량이 증가했습니다. 0.3의 F:M 시나리오는 대조군보다 부피(~354mL) 기준으로 5배 더 많은 메탄을 생성했습니다. F:M 비율을 0.7로 높이면 F:M 0.3 시나리오보다 1.6배 더 많은 메탄(~574mL)이 생성되었습니다. 마찬가지로, F:M 비율을 1.1로 높이면 F:M 0.7 시나리오보다 1.9배 더 많은 메탄(~1098mL)이 생성되었습니다. 조사된 각 F:M 비율에 대해 관찰된 최대 체적 메탄 생산 값(Y최대)은 표 4에 나열되어 있습니다. 시간이 지남에 따라 생성되는 메탄의 속도도 조사된 F:M 비율에 따라 변했습니다. 그림 8에서 볼 수 있듯이 메탄 생성 속도와 연구 중 메탄이 생성된 시간은 F:M이 증가함에 따라 증가했습니다. 예를 들어, 0.3의 F:M 시나리오에서는 연구 129시간(최대 354mL) 후에도 메탄 생성이 관찰되지 않은 반면, 1.1의 F:M 시나리오는 연구가 끝날 때까지 여전히 소량의 메탄을 생성했습니다. 모든 시나리오에서 생성된 메탄의 비율은 기판 가용성 감소로 인해 시간이 지남에 따라 감소했습니다. 연구가 끝날 때 여전히 풍부한 산소 요구량이 있었지만(표 3), 생체 이용 가능한 형태가 아니었거나 혐기성 미생물군에 대해 제한된 전자 수용체(예: 이산화탄소)가 남아 있었을 수 있습니다. 마지막으로, 관측된 VSS 파괴(mg)당 생성된 메탄(mL)을 비교한 결과, F:M 0.3 및 0.7 값은 1.3 - 1.6mL/mg의 범위를 제공하는 반면, 1.1의 F:M은 파괴된 단위 VSS(3.7mL/mg)당 더 많은 메탄을 생성했습니다(표 4). Tchobanoglous et al. (2014)는 지방(~1.4mL/mg), 그리스(~1.1mL/mg) 및 단백질(~0.7mL/mg)을 포함하는 일반적인 공급 원료에 대해 파괴된 단위 고형물당 가스 수율의 일반적인 범위를 제공합니다8. Mata-Alvarez et al. (2014)은 벤치 규모 및 파일럿 규모 바이오리액터에서 다양한 기질 및 다양한 기질 비율(예: WAS와 FOG의 다른 비율)과 폐수 슬러지를 함께 소화하는 연구를 검토했습니다10. 그들은 파괴된 단위 VSS 당 보고된 메탄 생산이 공동 소화된 기질과 기질의 비율에 따라 크게 다르다는 것을 발견했으며, 이는 파괴된 mg VS당 0.2mL에서 1.1mL의 바이오 가스에 이릅니다. 이 연구의 대표적인 결과, 특히 0.3 및 0.7의 F:M에 대한 결과는 비교 연구의 결과와 유리하게 비교됩니다.
생체 역학 파라미터
시간 경과에 따른 메탄 생성은 몇 가지 중요한 생체 역학 매개변수를 결정하는 데 사용할 수 있습니다. 이러한 생체 역학 매개변수는 호흡계를 사용하지 않고도 유사한 시나리오에서 메탄 생성을 예측하는 데 추가로 활용할 수 있습니다. 메탄 생산 속도 상수 k는 조사된 각 F:M 비율( 즉, 그림 8에 표시된 비율)에 대해 관찰된 호흡계 데이터에 대한 로그 최소 제곱 피팅을 사용하여 도출할 수 있습니다. 0.3 시나리오의 F:M에 대한 대표적인 로그 함수는 y = 93.465ln(X) - 175.91입니다. 여기서 93.465의 값은 시간 단위이며 일로 변환한 다음 역으로 변환하여 k = 0.257을 제공해야 합니다. 조사된 각 F:M 비율에 대한 속도 상수(k) 및 결정 계수(R2)는 표 4에 나와 있습니다.
그런 다음 속도 상수를 활용하여 각 F:M 비율에 대해 주어진 시간에 메탄의 수율을 결정할 수 있습니다. 유기 기판에서 시간이 지남에 따라 생성된 메탄의 속도는 다음 방정식 [1]21을 사용하여 모델링할 수 있습니다.
(1)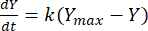
위의 방정식을 한계 t = 0에서 t = t 사이의 적분하면 다음과 같은 [2]가 됩니다.
(2)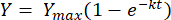
어디서, Y = 언제든지 메탄 수율 [mL]; Y max = 호흡계 연구에서 관찰된 최대 메탄 수율[mL]; k = 메탄 생산율 상수 [D-1]; t = 시간 [d]
위에 제시된 생체 역학 매개변수를 개발하는 데 사용된 1차 접근 방식은 실험 데이터에 매우 합리적인 적합도를 제공하지만(표 4의 R2 값으로 표시됨), 다른 연구에서는 메탄 생산 데이터를 맞추기 위해 Modified Gompertz 모델, 2 기판 모델 및 Cone 모델2를 포함하는 다른 모델을 사용했다고 보고했습니다.

그림 1: 음식물 쓰레기 믹서기. 음식물 쓰레기를 결합하는 데 사용되는 표준 믹서. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 호흡계. 메탄 생성을 측정하기 위한 호흡계 설정을 완료합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 호흡계 냉각기의 샘플 병. 8개의 샘플 병이 있는 호흡계 냉각기의 내부 모습. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 호흡계 스크러버. 호흡계 스크러버를 자세히 봅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
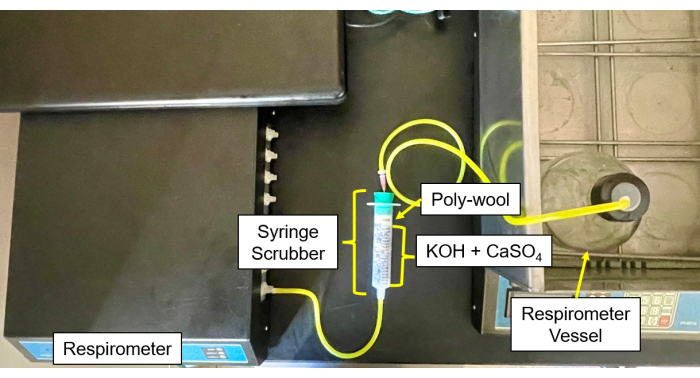
그림 5: 호흡계와 제어 모듈 스크러버. 제어 모듈 및 스크러버 설정의 호흡계 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 호흡계 스크러버 라인 설정. 자세히 보기 샘플 병과 호흡계 사이의 스크러버 라인 설정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
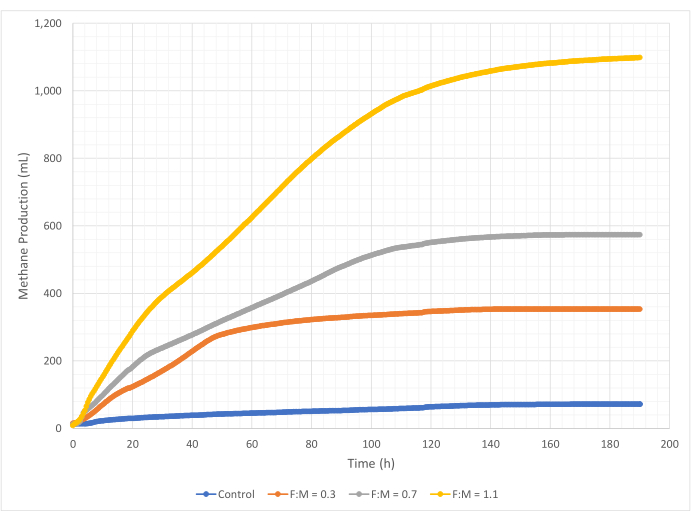
그림 7: 다양한 F:M 비율을 사용한 총 메탄 생산량. 각 F:M(0.3, 0.7, 1.1)에 대한 메탄 생성은 시간이 지남에 따라 표시됩니다(0시간에서 190시간까지). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
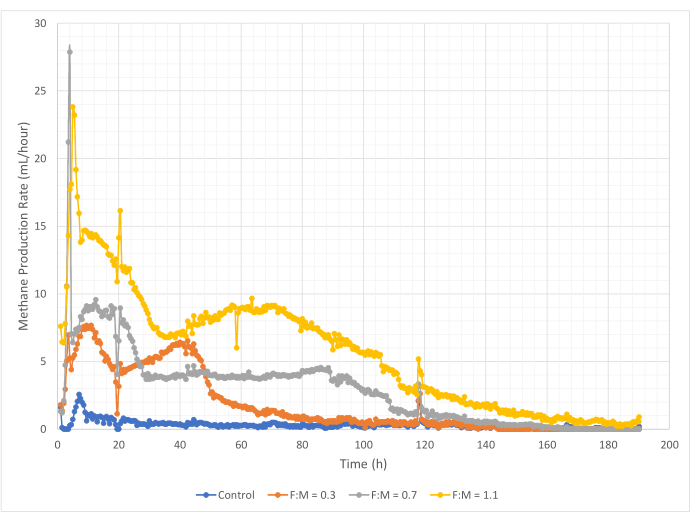
그림 8: 다양한 F:M 비율을 사용한 메탄 생산 속도. 각 F:M(0.3, 0.7, 1.1)에 대한 메탄 생성 속도는 시간이 지남에 따라(0시간에서 190시간까지) 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 식품 대 미생물 비율의 샘플 병 성분. 각 F:M(0.3, 0.7, 1.1) 및 빈 병에 대한 구성 질량, 농도 및 부피. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 샘플 유기 기판 조성. 음식물 쓰레기 질량 및 음식별 구성 비율 및 탄수화물, 단백질 및 지방의 비율. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: 시료 휘발성 부유 고체 및 산소 요구량 결과(± 표준 편차). 각 F:M(0.3, 0.7, 1.1)에 대한 VSS 및 COD. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 4: 샘플 Kinetic Parameters. 메탄 수율을 기반으로 계산된 운동 파라미터. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜에서 제공하는 방법은 연구자와 실무자가 호흡 측정법을 사용하여 유기 폐기물 흐름을 혐기성으로 소화할 때 바이오메탄 잠재력을 결정하는 데 도움이 될 수 있습니다. 이 프로토콜에서는 일반적인 음식물 쓰레기 흐름의 동시 소화를 통한 메탄 생성과 다양한 F:M 비율에 걸쳐 WWTP의 WAS를 보여줍니다. 이 프로토콜은 1차 운동 모델링을 사용하여 메탄 생성을 지속적으로 측정하고 생체 역학 매개변수를 결정하기 위한 단계별 호흡 측정 접근 방식을 제공함으로써 문헌에 추가됩니다. 몇몇 다른 연구들은 불연속적인 시점10,22에서 메탄 생산을 측정하는 소우주 실험을 사용하였으며, 다른 연구들은 장시간 연속-흐름 벤치-플로우 또는 파일럿 스케일 바이오리액터(14,23)에 부착된 유량계를 사용하여 메탄을 측정하였다. 호흡 측정법은 다양한 실험 조건에서 지속적으로 메탄 생성을 측정할 수 있는 이점을 제공합니다. 호흡 측정 실험은 생물 반응기의 구성을 필요로하지 않기 때문에 일부 벤치 또는 파일럿 규모 실험에 비해 상대적인 빈도로 실험 조건을 수정할 수 있습니다. 이러한 장점으로 인해 호흡 측정 실험은 상대적으로 짧은 시간 내에 수많은 유기 폐기물 조합을 공동 소화하여 메탄 생성을 결정하는 데 사용할 수 있습니다. 예를 들어, 이 연구에서 제시된 프로토콜의 다음 단계로, WAS에 비해 화학 에너지가 매우 밀도가 높은 지방, 오일 및 그리스를 음식물 찌꺼기와 함께 소화하여 시간이 지남에 따라 메탄 생성이 증가할 가능성을 정량화할 수 있습니다. 이 접근법의 적용은 co-digestion schemes의 여러 기질 조합에 걸쳐 메탄 생성 속도 및 생체 역학 매개변수에 관한 문헌을 계속 구축할 수 있습니다. 또한, 최적의 기질 조합을 결정하는 것 외에도 메탄 생산 결과 및 생체 역학 매개변수를 사용하여 폐수 처리를 위해 설계된 프로그램과 같은 기존 프로그램의 성능 모델링을 알리거나 벤치 또는 파일럿 규모에서 전체 규모로 확장할 때 공동 분해 계획이 어떻게 수행될지 예측할 수 있습니다24,25.
또한, 이 프로토콜은 혐기성 미생물 컨소시엄을 위한 맞춤형 기질 피드를 적용하기 위해 수정될 수 있습니다. 예를 들어, 연구자가 혐기성 미생물군에 탄수화물만 또는 단백질만 제공하는 것의 영향을 조사하려는 경우 이 프로토콜의 공급 원료를 그에 따라 변경할 수 있습니다. 대안적으로, 연구자가 COD의 특정 분획(예: 용해성 COD만 또는 미립자 COD만) 또는 특정 기질(예: 아세테이트, 휘발성 지방산 및 혐기성 대사의 중간 생성물)의 첨가가 메탄 생성에 미치는 영향을 테스트하려는 경우 이 프로토콜의 변형을 사용할 수 있습니다. 기질을 수정하거나 특정 기질의 F:M을 교대할 때 관찰되는 모범 사례는 각 샘플에 대해 동일한 질량의 혐기성 미생물군을 유지하면서 기판의 질량만 조정하는 것입니다(질량 대 질량 비율을 사용해야 함). 기판을 수정하는 것 외에도 연구원은 이 프로토콜을 다른 분석과 함께 사용하여 기판 사용 및 메탄 생성에 대한 더 나은 이해를 얻을 수 있습니다. 예를 들어, 연구자는 이 프로토콜을 미생물 군집 분석(예: 16S rRNA 유전자 염기서열 분석 또는 균유전체학)과 함께 사용하여 군집 구조를 기능과 더 잘 연관시킬 수 있습니다.
이 방법론의 유용성에도 불구하고 몇 가지 제한 사항이 있습니다. 호흡계 및 바이오 메탄 전위 검사는 가장 자주 배치 반응기로 구성됩니다. 그러나 본격적인 혐기성 공동 소화조는 일반적으로 슬러지 체류 시간이 10일 이상인 연속 흐름 시스템으로 작동됩니다1. 따라서 호흡 측정 실험에서 수집된 데이터는 메탄 생성 속도를 추정하고 생체 역학 매개변수를 개발하는 데 유용하지만, 이러한 데이터는 가능한 경우 시간이 지남에 따라 작동되는 더 큰 규모의 소화조를 사용하여 현장에서 검증해야 합니다.
또한 호흡 측정법 검사 전에 샘플을 선택하고 준비할 때 주의를 기울여야 합니다. 큰 음식물 쓰레기 입자는 VSS 및 COD 측정을 왜곡하고 부정확한 결과를 제공할 수 있습니다. 음식물 쓰레기 쓰레기를 기질로 사용하는 경우, 혼합물은 잘 침용되어야 하며 큰 음식물 입자가 없어야 합니다 - 이는 본격적인 소화조에서 음식물 쓰레기 수용 구덩이에서 침용하는 것과 유사한 접근 방식입니다. 탈이온수로 희석하면 혼합 과정에 도움이 될 수 있으며 음식물 찌꺼기를 더 큰 규모로 침용할 때 일반적으로 사용되는 물을 첨가하는 것과 유사합니다. 그러나 희석액이 적절하게 측정되고 목표 수분 함량이 달성되도록 모든 노력을 기울여야 합니다. 희석은 특히 경험이 부족한 학생이 이 프로토콜을 실행하는 경우 쉽게 오류의 원인이 될 수 있습니다.
co-digestion에 존재하는 미생물 컨소시엄에는 obligate 혐기성 미생물이 포함되어 있기 때문에 전달 및 시료 전처리 과정에서 산소에 대한 노출을 제거(또는 크게 줄이)하기 위해 특별한 주의를 기울여야 합니다. 질소 플러싱을 통해 시료 병에서 산소를 제거할 수 있습니다. 또한, 가능한 경우, 수집 병과 호흡계 샘플 병 간에 혐기성 배양액을 전달하는 작업은 혐기성 챔버에서 수행해야 합니다. 호흡계는 일관된 결과(메탄 생산량 및 속도)를 제공하기 때문에 예상 결과에서 벗어난 경우(예: 실행 불가능한 미생물 컨소시엄)는 테스트 시작 시 쉽게 식별할 수 있습니다. 중복 또는 삼중 샘플을 사용하면 잘못된 테스트를 식별하는 데 더 도움이 될 수 있습니다.
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 프로토콜 개발에 관한 논의에 대해 논의해 주신 Respirometer Systems and Applications의 Jim Young 박사님께 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 103 °C Oven Isotemp | Fisher Scientific | 13-247-737F | Model: 737F, Force Air Oven |
| 550 °C Vulcan Oven | Neytech (Manufacturer) / Cole Palmer (Vendor) | 9493308 | Model: 3-550 |
| Aerobic/Anaerobic Respirometer | Respirometer System and Applications (RSA) | PF-8000 | Model: PF-8000 |
| Analytical Balance | Mettler Toledo | 30029075 | Model: ME204E, Detection Limit: 0.1 mg |
| Smoothie Blender with 56 oz Plastic Jar | Hamilton Beach | 50190F | Model: 50190F |
| COD Vials TNT Plus Vial Test | HACH | TNT821 | TNT 821, 3–150 mg/L COD |
| COD Vials TNT Plus Vial Test | HACH | TNT822 | TNT 822, 20–1500 mg/L COD |
| Dessicator | SP Bel-Art | 942070050 | Model: SP Scienceware |
| Dionized Water System | Milli-Q | ZIQ7010T0C | IQ 7010 Pure & Ultrapure Water Purification System |
| Anhydrous CaSO4 | W.A. Hammond Drierite Company | 13001 | 8 Mesh, 1 lb |
| Glass Fiber Filters | Whatman (Manufacturer) / Cole-Parmer (Vendor) | 1827-150 | Model: 934-AH |
| Heat Digestor Block | HACH | DRB200-02 | DRB 200 |
| Hot Plate Stirrer | Corning | 6795-620D | Model: PC-620D |
| Industrial-Grade Nitrogen (Compressed Cylinder) | Air Gas | NI UHP300 | 300 cubic feet |
| Pellets (KOH) | Fisher Scientific | AC134062500 | 500 g |
| pH Meter | Fisher Scientific | 13-636-AP115 | AP115, Accumet pH meter |
| UV Spectrophotometer | HACH | LPV400.99.00012 | DR 3900 |
| Vaccum Pump | GAST | 1HAB-25-M100X |
참고문헌
- Mainardis, M., Buttazzoni, M., Cottes, M., Moretti, A., Goi, D. Respirometry tests in wastewater treatment: Why and how? A critical review. Sci Total Environ. 793, 148607 (2021).
- Pan, Y., et al. Synergistic effect and biodegradation kinetics of sewage sludge and food waste mesophilic anaerobic co-digestion and the underlying stimulation mechanisms. Fuel. 253, 40-49 (2019).
- Argiz, L., et al. Assessment of a fast method to predict the biochemical methane potential based on biodegradable COD obtained by fractionation respirometric tests. J Environ Manage. 269, 110695 (2020).
- Carucci, A., et al. Aerobic storage by activated sludge on real wastewater. Water Res. 35 (16), 3833-3844 (2001).
- McCarty, P. L., Bae, J., Kim, J. Domestic wastewater treatment as a net energy producer-Can this be achieved. Environ Sci Technol. 45 (17), 7100-7106 (2011).
- McCarty, P. The development of anaerobic treatment and its future. Water Sci Technol. 44 (8), 149-156 (2001).
- From farm to kitchen: The environmental impacts of U.S. food waste Part 1. United States Environmental Protection Agency Available from: https://www.epa.gov/system/files/documents/2021-11/from-farm-to-kitchen-the-environmental-impacts-of-u.s.-food-waste_508-tagged.pdf (2021)
- Tchobanoglous, G., Burton, F. L., Stensel, H. D. . WastewaterEngineering:TreatmentandReuse. 5th ed. , (2014).
- Pfluger, A., et al. Anaerobic digestion and biogas beneficial use at municipal wastewater treatment facilities in Colorado: A case study examining barriers to widespread implementation. J Clean Prod. 206, 97-107 (2019).
- Mata-Alvarez, J., Dosta, J., Romero-Güiza, M. S., Fonoll, X., Peces, M., Astals, S. A critical review on anaerobic co-digestion achievements between 2010 and 2013. Renew Sust Energ Rev. 36, 412-427 (2014).
- Pfluger, A. R., Hahn, M. J., Hering, A. S., Munakata-Marr, J., Figueroa, L. Statistical exposé of a multiple-compartment anaerobic reactor treating domestic wastewater. Water Environ Res. 90 (6), 530-542 (2018).
- Razaviarani, V., Buchanan, I. D. Calibration of the Anaerobic Digestion Model No. 1 (ADM1) for steady-state anaerobic co-digestion of municipal wastewater sludge with restaurant grease trap waste. Chem Eng J. 266, 91-99 (2015).
- Zhu, H., et al. Biohydrogen production by anaerobic co-digestion of municipal food waste and sewage sludges. Int J Hydrog Energy. 33 (14), 3651-3659 (2008).
- Serna-García, R., Ruiz-Barriga, P., Noriega-Hevia, G., Serralta, J., Pachés, M., Bouzas, A. Maximising resource recovery from wastewater grown microalgae and primary sludge in an anaerobic membrane co-digestion pilot plant coupled to a composting process. J Environ Manage. 281, 111890 (2021).
- Gossett, J. M., Belser, R. L. Anaerobic digestion of waste activated sludge. J Environ. 108 (6), 1101-1120 (1982).
- Yi, H., Han, Y., Zhuo, Y. Effect of combined pretreatment of waste activated sludge for anaerobic digestion process. Procedia Environ Sci. 18, 716-721 (2013).
- Nah, I. W., Kang, Y. W., Hwang, K. Y., Song, W. K. Mechanical pretreatment of waste activated sludge for anaerobic digestion process. Water Res. 34 (8), 2362-2368 (2000).
- American Public Health Association. . Standard Methods for the Examination of Water and Wastewater. Vol. 10. American Public Health Association. , (2012).
- Food Data Central. US Department of Agriculture Available from: https://fdc.nal.usda.gov/ (2024)
- Vanzin, G., Pfluger, A., Almstrand, R., Figueroa, L., Munakata-Marr, J. Succession of founding microbiota in an anaerobic baffled bioreactor treating low-temperature raw domestic wastewater. Environ Sci Water Res Technol. 8 (4), 792-806 (2022).
- Negi, S., Dhar, H., Hussain, A., Kumar, S. Biomethanation potential for co-digestion of municipal solid waste and rice straw: a batch study. Bioresour Technol. 254, 139-144 (2018).
- Rostkowski, K. H., Pfluger, A. R., Criddle, C. S. Stoichiometry and kinetics of the PHB-producing Type II methanotrophs Methylosinus trichosporium OB3b and Methylocystis parvus OBBP. Bioresour Technol. 132, 71-77 (2014).
- Pfluger, A., Vanzin, G., Munakata-Marr, J., Figueroa, L. An anaerobic hybrid bioreactor for biologically enhanced primary treatment of domestic wastewater under low temperatures. Environ Sci Water Res Technol. 4 (11), 1851-1866 (2018).
- Callahan, J. L., Pfluger, A. R., Figueroa, L. A., Munakata-Marr, J. BioWin® modeling of anaerobic sludge blanket treatment of domestic wastewater. Bioresour Technol Rep. 20, 101231 (2022).
- Linvill, C., Butkus, M., Bennett, E., Wait, M., Pytlar, A., Pfluger, A. Energy balances for proposed complete full-scale anaerobic wastewater treatment facilities. Environ Eng Sci. 40 (11), 482-493 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유