Method Article
Измерение биометанового потенциала отходов пищевых отходов, анаэробно сосбраженных с активированным илом отходов, с помощью респирометрии
В этой статье
Резюме
В этом протоколе описана передовая методика определения метанообразующих и микробных кинетических параметров с использованием респирометрии для анаэробной микробиоты, совместного переваривания пищевых отходов, отходов и отработанного активного ила.
Аннотация
Использование респирометрии для изучения биокинетики микробиоты, очистки сточных вод или переваривания осадка сточных вод стало более распространенным в последние несколько десятилетий. Использование респирометрии для изучения биокинетики анаэробной микробиоты, совместно переваривающей потоки органических отходов, таких как осадок сточных вод и пищевые отходы, является областью активных исследований. На сегодняшний день не было опубликовано ни одного визуализированного протокола по данной теме. Соответственно, в этом протоколе мы сконфигурировали респирометр для измерения производства метана и скорости потока с течением времени, используя три различных соотношения пищи и микроорганизмов (F:M), а также отходы пищевых отходов и активный ил отходов в качестве субстратов. Полученные данные в сочетании с измерениями использования субстрата обеспечивают основу для понимания того, как различные концентрации субстрата влияют на скорость, с которой анаэробная микробиота производит метан. Кроме того, в этом протоколе представлен метод разработки биокинетических параметров (например, постоянной скорости производства метана и выхода). Другие могут использовать этот протокол респирометрии для изучения органической деградации в анаэробных условиях и разработки микробных параметров.
Введение
Исследователи изучают микробную активность в масштабе стенда, используя различные подходы, включая периодические исследования, микрокосмы и респирометрию, среди прочих. Респирометры можно использовать для измерения клеточного дыхания в фазах роста и/или распада микробного сообщества путем наблюдения за потреблением субстрата и производством конечного продукта в контролируемых условиях1. Результаты лабораторных исследований респирометра также могут быть использованы для оценки биокинетических параметров при построении модели технологического процесса2. Респирометры использовались для изучения как аэробной, так и анаэробной микробной активности; тем не менее, исследования с использованием респирометрии для измерения потенциала биометана (BMP), особенно в смешанных органических субстратах, являются областью текущих исследований 3,4.
Органические вещества в бытовых сточных водах признаны жизнеспособным возобновляемым источником химической энергии5. Анаэробное сбраживание осадков сточных вод (т.е. первичного ила и отработанного активного ила, ВАС) используется для производства богатого метаном биогаза на очистных сооружениях (ОЧИСТНЫХ сооружений) уже более ста лет6. Тем не менее, переваривание многочисленных потоков органических отходов, таких как пищевые отходы с ВАС, стало распространенным только в последние годы и до сих пор является активной областью исследований. Пищевые отходы представляют собой постоянный поток отходов органического материала высокой плотности во многих развитых странах, составляющий примерно 25% массы свалок в США7. Помимо отвода части пищевых отходов от захоронения на свалках, комбинация пищевых отходов и WAS в сценарии совместного сбраживания является предпочтительной из-за увеличенного объема производимого биогаза (по сравнению с одним потоком органических отходов). Биогаз обычно содержит 60-70% метана, 30-40% углекислого газа и следовые количества других газов (например, сероводорода)8. Биогаз может быть очищен и сгорен на месте на очистных сооружениях с использованием технологии комбинированного производства тепла и электроэнергии, чтобы компенсировать некоторые потребности в электрической и тепловой энергии9.
В нескольких исследованиях изучался потенциал биометанирования и биокинетические параметры анаэробной микробиоты при совместном сбраживании органических отходов1. В доступных литературных исследованиях использовались периодические анализы в бутылках с сывороткой, где производство метана измерялось в дискретных точках на протяжении всего эксперимента, в то время как в других исследованиях измерялось производство метана с помощью расходомеров, подключенных непосредственно к лабораторным или опытным биореакторам 2,10,11. Непрерывное измерение образования метана с помощью респирометра, подобного описанному в данном протоколе, может обеспечить непрерывные и точные измерения метана из большого числа образцов, выполненных в различных экспериментальных условиях 1,12. В то время как в нескольких исследованиях измерялось образование метана в результате совместного сбраживания ВАС в сочетании с другими органическими субстратами, такими как биологические отходы, жиры, масла, жиры и сельскохозяйственные отходы 10,13,14, предстоит еще значительная работа по определению темпов производства метана из большого разнообразия сценариев совместного сбраживания. Кроме того, на сегодняшний день ни один из доступных протоколов не предусматривает углубленного, пошагового подхода с использованием визуальных изображений для измерения производства метана в результате совместного переваривания пищевых отходов и ВАС. Соответственно, в этом исследовании представлен протокол респирометра для измерения выработки метана и получения биокинетических параметров с использованием смеси разбавленных сточных вод, ВАС и отходов пищевых отходов в качестве субстрата. Различные соотношения пищи и микроорганизмов (F:M) были использованы для выяснения изменений в производстве метана. Другие измерения включают летучие взвешенные твердые частицы (VSS), химическую потребность в кислороде (ХПК) и pH каждого образца. Этот протокол описывает настройку респирометра, создание образца и критические измерения.
протокол
1. Подготовка субстрата
- Соберите ~1,5 л первичных стоков, ~1 л отработанного активного ила (ВАС).
ПРИМЕЧАНИЕ: Пробы WAS должны быть взяты непосредственно перед экспериментом; однако ВАС можно хранить до 48 часов при температуре 4 °C до начала эксперимента без заметного влияния на его использование в качестве субстрата 15,16,17. - Приобретите 2 л анаэробной культуры непосредственно перед экспериментом и поддерживайте культуру при температуре 35 °C. Максимально ограничьте контакт с воздухом во время переноса из анаэробного реактора в бутылку для сбора.
ПРИМЕЧАНИЕ: Анаэробная культура, использованная в этом исследовании, была получена из СОСВ, обрабатывающей 8,5 MGD (38 640м3/сут) с анаэробным сбраживанием первичного ила сточных вод. Наилучшей практикой является поддержание анаэробных условий путем промывки сборной бутылки газообразным азотом перед получением анаэробной культуры13 и поддержания анаэробных условий во время транспортировки и хранения. - Соберите пищевые отходы и храните их до 48 часов до начала эксперимента при температуре 4 °C.
Примечание: в зависимости от плана эксперимента следует проявлять осторожность при выявлении пищевых отходов с целевыми пропорциями углеводов, белков и т.д. Целевые пропорции органических веществ в пищевых отходах, вероятно, будут варьироваться в зависимости от эксперимента. Доля углеводов, белков и жиров в собранной пище может быть оценена по опубликованной литературе или оценена с использованием установленных протоколов (например, газовой хроматографии).
2. Приготовление питательных добавок
- Приготовьте раствор минерального основания #1, смешав 800 мл деионизированной (DI) воды с CoCl2·6H2O (0,25 г), FeCl3·6H2O (5 г), MnCl2·4H2O (0,05 г), NaMoO4·2H2O (0,005 г), NiCl2·6H2O (0,025 г), CuCl2·2H2O (0,007 г), ZnCl2 (0,025 г), H3BO3 (0,025 г) и Na2SeO4 (0,025 г). Разбавьте до 1 л деионизированной (DI) водой.
- Приготовьте раствор минерального основания #2, смешав 800 мл воды DI с CaCl2 (27,7 г) и MgCl2·4H2O (101 г). Разбавьте до 1 л деионизированной водой.
- Приготовьте питательную основу, смешав 800 мл воды DI с NH4Cl (38,2 г) и Na2SO4 (15 г). Отрегулируйте pH до 7,0 с помощью 3,64 Н NaOH в деионизированной воде и разбавьте до 1 л деионизированной водой.
3. Подготовка образцов
- Смешайте пищевые отходы (Таблица 2) в блендере (Рисунок 1) для создания смеси. Следите за тем, чтобы смесь не содержала крупных частиц пищевых отходов. Разбавьте пищевые отходы деионизированной водой, чтобы улучшить смешивание. Добавляйте примечания к количеству разбавляющей воды для использования при расчете химической потребности в кислороде (ХПК). Эти разбавленные пищевые отходы известны как «рабочие отходы». Поместите рабочие отходы в пластиковую бутылку объемом 1 л и храните при температуре 4 °C.
- Наклейте этикетку на четыре стакана объемом 2 л в соответствии с таблицей 1. Выложите стаканы на тарелку для перемешивания и добавьте большую полосу для перемешивания. Смешайте пищевые отходы, WAS и разбавление (деионизионная вода для контроля и первичные стоки для очистки) в соответствии с таблицей 1 в стаканах объемом 2 л.
- Добавьте по 12 мл раствора минеральной основы #1, раствора минеральной основы #2 и питательной основы.
- Добавьте по 2,4 г NaHCO3 (порошок) в каждый стакан и перемешивайте в течение 30 секунд. Наклейте этикетку на восемь флаконов для респирометрии в соответствии с таблицей 1 и добавьте магнитную мешалку.
ПРИМЕЧАНИЕ: При этом будут созданы дубликаты контроля и трех обработок с разными соотношениями F:M. - Добавьте анаэробную культуру в каждый стакан объемом 2 л в соответствии с таблицей 1 и перемешайте. Немедленно отмерьте 500 мл смеси из стакана с помощью градуированного цилиндра и переложите ее в промаркированный флакон с респирометром, промойте его газообразным азотом, затем немедленно закройте крышкой.
ПРИМЕЧАНИЕ: Следует соблюдать осторожность при ограничении контакта анаэробной микробиоты с кислородом воздуха (при наличии возможности следует использовать анаэробную камеру для переноса).
4. Количественная оценка начальных условий
- Используйте оставшийся образец из раздела 3 (~200 мл) для измерения pH, общего ХПК (tCOD), растворимого ХПК (sCOD), общего количества взвешенных веществ (TSS) и летучих взвешенных твердых веществ (VSS) для каждого образца18.
- При необходимости разбавляйте пробы деионизированной водой в соответствии с пределами обнаружения измерительного оборудования.
ПРИМЕЧАНИЕ: Для измерений ХПК использовались процедуры производителя.
- При необходимости разбавляйте пробы деионизированной водой в соответствии с пределами обнаружения измерительного оборудования.
5. Настройка респирометра
- Установите репирометр (рисунок 2) на низкую анаэробную настройку.
- Нажмите одновременно кнопку сброса и кнопку включения.
ПРИМЕЧАНИЕ: Это относится к модели, используемой в данном исследовании. - Установите чиллер (Рисунок 3) на 35,5 °C.
- Заполните каждый скруббер CO2 и влаги (Рисунок 4 и Рисунок 5) смесью гранул CaSO4 и KOH в соотношении 50/50 в центре, окруженных стеклянной ватой с каждой стороны.
- Подсоедините трубки и иглы от бутылок с образцами к скрубберу, а затем от скруббера к входу газа (Рисунок 6).
- На репирометре ноутбука запустите программу респирометра RSA-8-v2.0.
ПРИМЕЧАНИЕ: Этот шаг относится к модели, используемой в данном исследовании. - Выберите все бутылки в программе и выберите Редактировать > Этикетки с данными. Назовите все бутылки.
ПРИМЕЧАНИЕ: Этот шаг относится к модели, используемой в данном исследовании. - Начните измерение добычи газа, активировав кнопку «Пуск » в программе. Настройте программу на измерение данных в конце каждые полчаса. Контролируйте добычу газа, выбрав «Диаграмма расхода » или «Диаграмма объема».
ПРИМЕЧАНИЕ: Этот шаг относится к модели, используемой в данном исследовании. - После эксперимента (~7 дней) остановите прогон в программе, выключите чиллер и выключите модуль RSPF. Сохраните файл данных в формате CSV, а затем преобразуйте его в документ MS Excel.
ПРИМЕЧАНИЕ: Этот шаг относится к модели, используемой в данном исследовании.
6. Измерения после дыхания
- Измерьте pH, TSS, VSS и ХПК на окончательных образцах, как это сделано в разделе 4.
Результаты
Состав пищевых отходов
Пищевые отходы, использованные в этом исследовании, состояли из пяти различных видов пищи, которые обычно подаются в столовой колледжа. Каждый образец пищи содержал различное количество жиров, углеводов и белков, которые перечислены в таблице 2. 19 Смешанные пищевые отходы на 44% состояли из углеводов, на 36% из белков, на 16% из жиров и на 4% из других материалов. Примерно равная масса каждого типа пищи (от 56 г до 86 г) была использована для получения репрезентативного органического субстрата для анаэробного совместного сбраживания. Масса отходов пищевых отходов впоследствии варьировалась для достижения желаемого F:M для каждого рассматриваемого сценария (0,3, 0,7 и 1,1).
Измерения летучих взвешенных твердых частиц и органических веществ
Результаты для начальной и конечной потребности в кислороде, а также начальной и конечной потребности в кислороде приведены в таблице 3. Потребность в кислороде представлена в виде БПК5, который был преобразован из ХПК с использованием принятого коэффициента пересчета (ХПК = 1,6БПК5)8. Как показано, начальные концентрации VSS (также представленные по массе в таблице 3) увеличивались от контроля до наибольшего отношения F:M (1,1). В каждом исследованном F:M наблюдалось разрушение VSS или анаэробное превращение органических веществ в газообразные конечные продукты метана и углекислого газа. Благодаря преобразованию концентрация VSS снижалась от первоначальных измерений до окончательных измерений, сделанных в конце эксперимента. Количество уничтоженных VSS увеличивалось от контрольного до большего F:M соотношения. Неожиданно, разрушение VSS для сценария F:M = 0.7 превысило сценарий F:M = 1.1, возможно, из-за ингибирования в сценарии F:M 1.1.
Измеренные концентрации начальной потребности в кислороде следовали той же тенденции, что и VSS, т.е. увеличивались от контрольного до наибольшего отношения F:M (табл. 3). Как и при разрушении ВСС, концентрации БПК5 снижались между начальной и конечной концентрациями, за исключением контрольной концентрации. Потребность в кислороде в контрольной группе увеличивалась, вероятно, из-за эндогенного распада. В отличие от разрушения VSS, снижение потребности в кислороде от первоначального до конечного измерения было относительно низким для каждого образца, варьируясь от 1 до 3%, и не демонстрируя тенденции к соотношению F:M. Возможной причиной этой тенденции является превращение твердых органических веществ в растворимые органические, которое происходит в течение длительного периода времени и часто является ограничивающим скорость этапом метаболизма анаэробных микробных консорциумов20.
Производство метана
Количество и скорость производства метана варьировались в диапазоне соотношений F:M в течение 190-часового периода исследования. Экспериментальные результаты показали, что более высокие отношения F:M приводят к увеличению общих объемов метана (Рисунок 7). Контрольная группа, в которую не добавляли субстрат, продуцировала небольшое количество метана (~72 мл), вероятно, из-за относительно небольшого количества растворимого БПК5 в осадке и/или эндогенного распада. Как и ожидалось, добавление субстрата в других сценариях увеличило производство метана по сравнению с контролем. Сценарий F:M 0,3 дал в пять раз больше метана по объему (~354 мл), чем контроль. Увеличение отношения F:M до 0,7 дало в 1,6 раза больше метана (~574 мл), чем при сценарии F:M 0,3. Аналогичным образом, увеличение отношения F:M до 1,1 дало в 1,9 раза больше метана (~1098 мл), чем при сценарии F:M при 0,7. Максимальные наблюдаемые объемные значения производства метана (Ymax) для каждого рассмотренного соотношения F:M приведены в таблице 4. Скорость производства метана с течением времени также изменялась в зависимости от изученных соотношений F:M. Как показано на рисунке 8, скорость образования метана, а также продолжительность времени, в течение которого он производился, увеличивались по мере увеличения F:M. Например, в сценарии F:M 0,3 не наблюдалось образования метана после 129 ч исследования (с максимальным значением 354 мл), в то время как в сценарии F:M 1,1 все еще производилось небольшое количество метана в конце исследования. Во всех сценариях скорость производства метана со временем снижалась из-за снижения доступности субстрата. Несмотря на то, что в конце исследования потребность в кислороде все еще существовала в избытке (Таблица 3), он мог отсутствовать в биодоступной форме, или же остававшийся акцептор электронов (например, углекислый газ) для анаэробной микробиоты мог быть ограничен. Наконец, сравнение произведенного метана (мл) на единицу уничтоженного VSS (мг) показывает, что значения F:M 0,3 и 0,7 обеспечивают диапазон от 1,3 до 1,6 мл/мг, в то время как F:M 1,1 производит больше метана на единицу уничтоженного VSS (3,7 мл/мг) (Таблица 4). Tchobanoglous et al. (2014) приводит типичные диапазоны выхода газа на единицу разрушенных твердых веществ для обычного сырья, включая жиры (~1,4 мл/мг), жиры (~1,1 мл/мг) и белки (~0,7 мл/мг)8. Mata-Alvarez et al. (2014) рассмотрели исследования совместного сбраживания осадка сточных вод с различными субстратами и различными соотношениями субстрата (например, различными соотношениями WAS и FOG) в лабораторных и пилотных биореакторах10. Они обнаружили, что зарегистрированное производство метана на единицу уничтоженного VSS существенно варьировалось в зависимости от субстратов, которые совместно переваривались, а также от соотношения субстратов в диапазоне от 0,2 мл до 1,1 мл биогаза на мг уничтоженного VS. Репрезентативные результаты этого исследования, особенно для F:M 0,3 и 0,7, выгодно отличаются от результатов сравнительных исследований.
Биокинетические параметры
Производство метана с течением времени может быть использовано для определения нескольких важных биокинетических параметров. Эти биокинетические параметры могут быть в дальнейшем использованы для прогнозирования производства метана в аналогичных сценариях без использования респирометра. Константа скорости производства метана, k, может быть получена с помощью логарифмического метода наименьших квадратов, подогнанных к наблюдаемым данным респирометра для каждого исследуемого отношения F:M (т.е. показанного на рисунке 8). Репрезентативная логарифмическая функция для F:M сценария 0.3 равна y = 93.465ln(X) - 175.91. Здесь значение 93,465 выражено в единицах часов, которые должны быть переведены в дни, а затем инвертированы, что дает k = 0,257. Константы скорости (k) и коэффициент детерминации (R2) для каждого рассмотренного отношения F:M приведены в таблице 4.
Затем константа скорости может быть использована для определения выхода метана в любой момент времени для каждого соотношения F:M. Скорость метана, образующегося с течением времени из органического субстрата, может быть смоделирована с помощью следующего уравнения [1]21:
(1)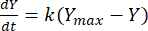
Интегрирование приведенного уравнения между пределами t = 0 до t = t, дает следующее [2]:
(2)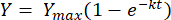
где, Y = выход метана в любой момент времени [мл]; Ymax = максимальный наблюдаемый выход метана по результатам исследования с помощью респирометра [мл]; k = константа скорости образования метана [D-1]; t = время [d]
В то время как подход первого порядка, используемый для разработки биокинетических параметров, представленный выше, обеспечивает весьма разумное соответствие экспериментальным данным (на что указывают значения R2 в таблице 4), в других исследованиях сообщалось об использовании других моделей для согласования данных о производстве метана, включая модифицированную модель Гомперца, модель с двумя субстратами и модель Конуса2.

Рисунок 1: Блендер для пищевых отходов. Стандартный блендер используется для объединения пищевых отходов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Респирометр. Полная настройка респирометра для измерения выработки метана. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Флакон с образцом в охладителе респирометра. Внутренний вид чиллера респирометра с восемью пробирками для образцов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Скруббер для респирометра. Близкий вид скруббера респирометра. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
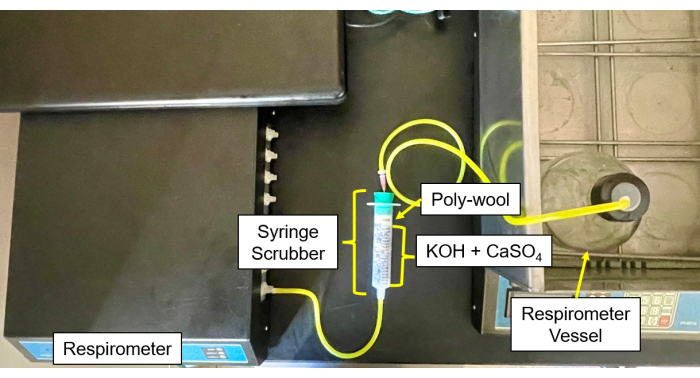
Рисунок 5: Скруббер респирометра к модулю управления. Респирометрическое изображение модуля управления и настройки скруббера. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Иллюстрация 6: Настройка линии скруббера респирометра. Близкий обзор расположенной линии скруббера между бутылками с образцами и респирометром. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
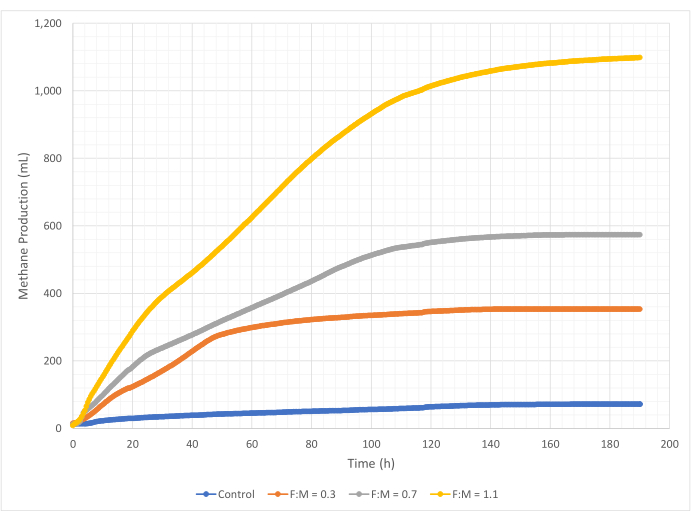
Рисунок 7: Общее производство метана при различных соотношениях F:M. Образование метана для каждого F:M (0,3, 0,7, 1,1) отображается во времени (от 0 ч до 190 ч). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
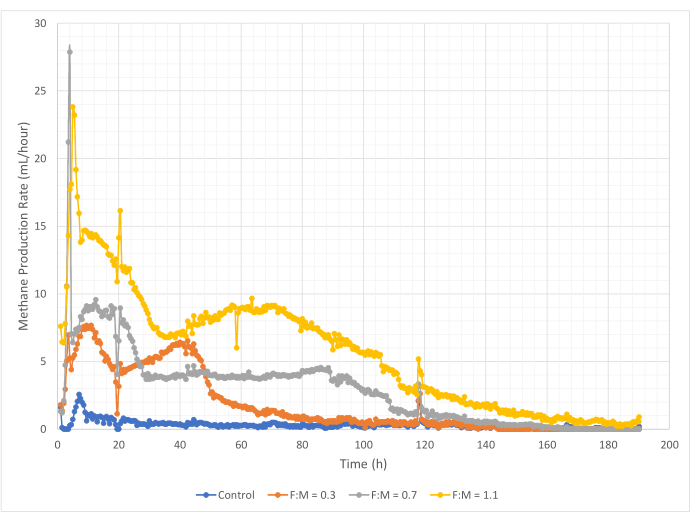
Рисунок 8: Скорость образования метана при различных соотношениях F:M. Скорость образования метана для каждого F:M (0,3, 0,7, 1,1) отображается во времени (от 0 ч до 190 ч). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Образцы компонентов бутылок с соотношением пищи к микробам. Составляющая масса, концентрация и объем для каждого F:M (0,3, 0,7, 1,1) и пустых бутылок. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Образец состава органического субстрата. Масса пищевых отходов и процентный состав по пище и соотношению углеводов, белков и жиров. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Результат потребности в летучих взвешенных твердых частицах и кислороде (± стандартное отклонение). VSS и COD для каждого F:M (0,3, 0,7, 1,1). Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 4: Образцы кинетических параметров. Рассчитаны кинетические параметры на основе выхода метана. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Методы, представленные в этом протоколе, могут помочь исследователям и практикам определить биометановый потенциал анаэробного сбраживания потоков органических отходов с помощью респирометрии. В этом протоколе мы демонстрируем образование метана в результате совместного сбраживания типичного потока отходов пищевых отходов в сочетании с WAS из очистных сооружений в диапазоне соотношений F:M. Этот протокол дополняет литературу, обеспечивая поэтапный подход к респирометрии для непрерывного измерения производства метана и определения биокинетических параметров с использованием кинетического моделирования первого порядка. В нескольких других исследованиях использовались эксперименты на микромире, которые измеряли производство метана в дискретных точках времени10,22, в то время как другие измеряли метан с помощью расходомеров, прикрепленных к долгосрочным непрерывным или опытным биореакторам14,23. Преимущество респирометрии заключается в непрерывном измерении выработки метана в различных экспериментальных условиях. Поскольку эксперименты по респирометрии не требуют строительства биореактора, условия эксперимента могут изменяться с относительной частотой по сравнению с некоторыми стендовыми или опытными экспериментами. Благодаря этому преимуществу эксперименты по респирометрии могут быть использованы для определения образования метана в результате совместного сбраживания многочисленных комбинаций органических отходов за относительно короткий период времени. Например, в качестве следующего шага к протоколу, представленному в этом исследовании, жиры, масла и смазки, которые имеют очень высокую химическую энергию по сравнению с WAS, могут быть переварены совместно с пищевыми отходами для количественной оценки вероятного увеличения образования метана с течением времени. Применение этого подхода может продолжить работу по сбору литературы о скоростях генерации метана и биокинетических параметрах в нескольких комбинациях субстратов в схемах совместного сбраживания. Кроме того, в дополнение к определению оптимальных комбинаций субстратов, результаты производства метана и биокинетические параметры могут быть использованы для моделирования производительности в существующих программах, таких как те, которые предназначены для очистки сточных вод, или для прогнозирования того, как схемы совместного сбраживания будут работать при масштабировании от настольного или пилотного масштаба до полномасштабного24,25.
Кроме того, в этот протокол могут быть внесены поправки, предусматривающие применение специализированного субстрата для анаэробного микробного консорциума. Например, если бы исследователь захотел изучить влияние обеспечения анаэробной микробиоты только углеводами или только белками, то исходное сырье в этом протоколе могло бы быть соответствующим образом изменено. В качестве альтернативы, если бы исследователь захотел проверить влияние добавления определенной фракции ХПК (например, только растворимого ХПК или только ХПК в виде частиц) или высоких концентраций определенного субстрата (например, ацетата, летучей жирной кислоты и промежуточного продукта анаэробного метаболизма) на производство метана, можно было бы использовать вариант этого протокола. При модификации субстрата или чередовании F:M конкретного субстрата рекомендуется поддерживать одинаковую массу анаэробной микробиоты для каждого образца при одновременной корректировке только массы субстрата (следует использовать отношение массы к массе). В дополнение к модификации субстратов, исследователи могут использовать этот протокол с другими анализами для лучшего понимания использования субстрата и производства метана. Например, исследователь может использовать этот протокол в сочетании с анализом микробных сообществ (например, секвенированием гена 16S рРНК или метагеномикой), чтобы лучше связать структуру сообщества с функцией.
Несмотря на полезность этой методологии, существует несколько ограничений. Респирометры и тесты на биометановый потенциал чаще всего конфигурируются как реакторы периодического действия; Тем не менее, полномасштабные анаэробные кометантенки обычно работают как системы непрерывного потока со временем удержания осадка более 10дней1. Соответственно, данные, полученные в ходе экспериментов по респирометрии, полезны для оценки скорости генерации метана и разработки биокинетических параметров, но эти данные должны быть проверены в полевых условиях с использованием более крупных реакторов, эксплуатируемых в течение определенного времени, когда это возможно.
Кроме того, необходимо проявлять осторожность при выборе и подготовке образцов перед респирометрией. Крупные частицы пищевого лома искажают измерения VSS и ХПК и могут привести к неточным результатам. Если в качестве субстрата используются отходы пищевого мусора, смесь должна быть хорошо мацерирована и не содержать крупных частиц пищи – подход, сходный с мацерацией в приямках для приема пищевых отходов в полномасштабных метантенках. Разбавление деионизионной водой может помочь в процессе смешивания и аналогично добавлению воды, обычно используемой при мацерации пищевых отходов в больших масштабах. Тем не менее, следует приложить все усилия для обеспечения правильного измерения разбавлений и достижения целевого содержания влаги. Разбавление может легко стать источником ошибки, особенно если этот протокол выполняют неопытные студенты.
Поскольку микробные консорциумы, существующие при совместном сбраживании, содержат облигатные анаэробы, необходимо проявлять особую осторожность для устранения (или значительного снижения) воздействия кислорода во время процессов переноса и пробоподготовки. Кислород может быть удален из бутылок с образцами с помощью промывки азотом. В дальнейшем, при наличии, работу по переносу анаэробной культуры между флаконами для сбора и флаконами с образцами респирометра следует проводить в анаэробной камере. Поскольку респирометр дает стабильные результаты (объемы и скорости производства метана), любое отклонение от ожидаемых результатов, например, нежизнеспособный микробный консорциум, может быть легко идентифицировано к началу испытания. Использование дубликата или тройной выборки может дополнительно помочь выявить дефектные тесты.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим доктора Джима Янга из компании Respirometer Systems and Applications за обсуждение разработки этого протокола.
Материалы
| Name | Company | Catalog Number | Comments |
| 103 °C Oven Isotemp | Fisher Scientific | 13-247-737F | Model: 737F, Force Air Oven |
| 550 °C Vulcan Oven | Neytech (Manufacturer) / Cole Palmer (Vendor) | 9493308 | Model: 3-550 |
| Aerobic/Anaerobic Respirometer | Respirometer System and Applications (RSA) | PF-8000 | Model: PF-8000 |
| Analytical Balance | Mettler Toledo | 30029075 | Model: ME204E, Detection Limit: 0.1 mg |
| Smoothie Blender with 56 oz Plastic Jar | Hamilton Beach | 50190F | Model: 50190F |
| COD Vials TNT Plus Vial Test | HACH | TNT821 | TNT 821, 3–150 mg/L COD |
| COD Vials TNT Plus Vial Test | HACH | TNT822 | TNT 822, 20–1500 mg/L COD |
| Dessicator | SP Bel-Art | 942070050 | Model: SP Scienceware |
| Dionized Water System | Milli-Q | ZIQ7010T0C | IQ 7010 Pure & Ultrapure Water Purification System |
| Anhydrous CaSO4 | W.A. Hammond Drierite Company | 13001 | 8 Mesh, 1 lb |
| Glass Fiber Filters | Whatman (Manufacturer) / Cole-Parmer (Vendor) | 1827-150 | Model: 934-AH |
| Heat Digestor Block | HACH | DRB200-02 | DRB 200 |
| Hot Plate Stirrer | Corning | 6795-620D | Model: PC-620D |
| Industrial-Grade Nitrogen (Compressed Cylinder) | Air Gas | NI UHP300 | 300 cubic feet |
| Pellets (KOH) | Fisher Scientific | AC134062500 | 500 g |
| pH Meter | Fisher Scientific | 13-636-AP115 | AP115, Accumet pH meter |
| UV Spectrophotometer | HACH | LPV400.99.00012 | DR 3900 |
| Vaccum Pump | GAST | 1HAB-25-M100X |
Ссылки
- Mainardis, M., Buttazzoni, M., Cottes, M., Moretti, A., Goi, D. Respirometry tests in wastewater treatment: Why and how? A critical review. Sci Total Environ. 793, 148607 (2021).
- Pan, Y., et al. Synergistic effect and biodegradation kinetics of sewage sludge and food waste mesophilic anaerobic co-digestion and the underlying stimulation mechanisms. Fuel. 253, 40-49 (2019).
- Argiz, L., et al. Assessment of a fast method to predict the biochemical methane potential based on biodegradable COD obtained by fractionation respirometric tests. J Environ Manage. 269, 110695 (2020).
- Carucci, A., et al. Aerobic storage by activated sludge on real wastewater. Water Res. 35 (16), 3833-3844 (2001).
- McCarty, P. L., Bae, J., Kim, J. Domestic wastewater treatment as a net energy producer-Can this be achieved. Environ Sci Technol. 45 (17), 7100-7106 (2011).
- McCarty, P. The development of anaerobic treatment and its future. Water Sci Technol. 44 (8), 149-156 (2001).
- From farm to kitchen: The environmental impacts of U.S. food waste Part 1. United States Environmental Protection Agency Available from: https://www.epa.gov/system/files/documents/2021-11/from-farm-to-kitchen-the-environmental-impacts-of-u.s.-food-waste_508-tagged.pdf (2021)
- Tchobanoglous, G., Burton, F. L., Stensel, H. D. . WastewaterEngineering:TreatmentandReuse. 5th ed. , (2014).
- Pfluger, A., et al. Anaerobic digestion and biogas beneficial use at municipal wastewater treatment facilities in Colorado: A case study examining barriers to widespread implementation. J Clean Prod. 206, 97-107 (2019).
- Mata-Alvarez, J., Dosta, J., Romero-Güiza, M. S., Fonoll, X., Peces, M., Astals, S. A critical review on anaerobic co-digestion achievements between 2010 and 2013. Renew Sust Energ Rev. 36, 412-427 (2014).
- Pfluger, A. R., Hahn, M. J., Hering, A. S., Munakata-Marr, J., Figueroa, L. Statistical exposé of a multiple-compartment anaerobic reactor treating domestic wastewater. Water Environ Res. 90 (6), 530-542 (2018).
- Razaviarani, V., Buchanan, I. D. Calibration of the Anaerobic Digestion Model No. 1 (ADM1) for steady-state anaerobic co-digestion of municipal wastewater sludge with restaurant grease trap waste. Chem Eng J. 266, 91-99 (2015).
- Zhu, H., et al. Biohydrogen production by anaerobic co-digestion of municipal food waste and sewage sludges. Int J Hydrog Energy. 33 (14), 3651-3659 (2008).
- Serna-García, R., Ruiz-Barriga, P., Noriega-Hevia, G., Serralta, J., Pachés, M., Bouzas, A. Maximising resource recovery from wastewater grown microalgae and primary sludge in an anaerobic membrane co-digestion pilot plant coupled to a composting process. J Environ Manage. 281, 111890 (2021).
- Gossett, J. M., Belser, R. L. Anaerobic digestion of waste activated sludge. J Environ. 108 (6), 1101-1120 (1982).
- Yi, H., Han, Y., Zhuo, Y. Effect of combined pretreatment of waste activated sludge for anaerobic digestion process. Procedia Environ Sci. 18, 716-721 (2013).
- Nah, I. W., Kang, Y. W., Hwang, K. Y., Song, W. K. Mechanical pretreatment of waste activated sludge for anaerobic digestion process. Water Res. 34 (8), 2362-2368 (2000).
- American Public Health Association. . Standard Methods for the Examination of Water and Wastewater. Vol. 10. American Public Health Association. , (2012).
- Food Data Central. US Department of Agriculture Available from: https://fdc.nal.usda.gov/ (2024)
- Vanzin, G., Pfluger, A., Almstrand, R., Figueroa, L., Munakata-Marr, J. Succession of founding microbiota in an anaerobic baffled bioreactor treating low-temperature raw domestic wastewater. Environ Sci Water Res Technol. 8 (4), 792-806 (2022).
- Negi, S., Dhar, H., Hussain, A., Kumar, S. Biomethanation potential for co-digestion of municipal solid waste and rice straw: a batch study. Bioresour Technol. 254, 139-144 (2018).
- Rostkowski, K. H., Pfluger, A. R., Criddle, C. S. Stoichiometry and kinetics of the PHB-producing Type II methanotrophs Methylosinus trichosporium OB3b and Methylocystis parvus OBBP. Bioresour Technol. 132, 71-77 (2014).
- Pfluger, A., Vanzin, G., Munakata-Marr, J., Figueroa, L. An anaerobic hybrid bioreactor for biologically enhanced primary treatment of domestic wastewater under low temperatures. Environ Sci Water Res Technol. 4 (11), 1851-1866 (2018).
- Callahan, J. L., Pfluger, A. R., Figueroa, L. A., Munakata-Marr, J. BioWin® modeling of anaerobic sludge blanket treatment of domestic wastewater. Bioresour Technol Rep. 20, 101231 (2022).
- Linvill, C., Butkus, M., Bennett, E., Wait, M., Pytlar, A., Pfluger, A. Energy balances for proposed complete full-scale anaerobic wastewater treatment facilities. Environ Eng Sci. 40 (11), 482-493 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены