Method Article
Respirometri Kullanılarak Atıkla Aktive Edilmiş Çamur ile Anaerobik Olarak Birlikte Sindirilen Gıda Hurda Atıklarının Biyometan Potansiyelinin Ölçülmesi
Bu Makalede
Özet
Bu protokol, anaerobik mikrobiyota için respirometri kullanarak metan üretimini ve mikrobiyal kinetik parametreleri belirlemek, gıda artıklarını, atıkları ve atıklarla aktive edilmiş çamuru birlikte sindirmek için en iyi uygulamayı açıklar.
Özet
Mikrobiyotanın biyokinetiğini incelemek, atık suyu arıtmak veya atık su çamurlarını sindirmek için respirometri kullanımı son birkaç on yılda daha yaygın hale gelmiştir. Anaerobik mikrobiyotanın biyokinetiğini incelemek için respirometrinin kullanılması, atık su, çamur ve gıda hurdası gibi organik atık akışlarının birlikte sindirilmesi aktif bir araştırma alanıdır. Bugüne kadar, konuyla ilgili görselleştirilmiş bir protokol yayınlanmamıştır. Bu doğrultuda, bu protokolde, substrat olarak üç farklı gıda-mikroorganizma (F:M) oranı ve gıda hurdası atığı ve atık aktif çamur kullanarak zaman içindeki metan üretimini ve akış hızını ölçmek için bir respirometre yapılandırdık. Elde edilen veriler, substrat kullanım ölçümleriyle birleştiğinde, farklı substrat konsantrasyonlarının anaerobik mikrobiyotanın metan üretme hızını nasıl etkilediğini anlamak için temel sağlar. Ek olarak, bu protokol biyokinetik parametreler geliştirmek için bir yöntem sunar (örneğin, metan üretim hızı sabiti ve verim). Diğerleri, anaerobik koşullar altında organik bozunmayı incelemek ve mikrobiyal parametreler geliştirmek için bu respirometri protokolünü kullanabilir.
Giriş
Araştırmacılar, diğerlerinin yanı sıra toplu çalışmalar, mikrokozmoslar ve respirometri dahil olmak üzere çeşitli yaklaşımlar kullanarak mikrobiyal aktiviteyi tezgah ölçeğinde inceler. Respirometreler, kontrollü koşullar altında substrat tüketimini ve son ürün üretimini gözlemleyerek bir mikrobiyal topluluğun büyüme ve/veya bozunma aşamaları boyunca hücresel solunumu ölçmek için kullanılabilir1. Tezgah ölçekli respirometre çalışmalarından elde edilen sonuçlar, proses modeli yapımı2 için biyokinetik parametreleri tahmin etmek için de kullanılabilir. Respirometreler hem aerobik hem de anaerobik mikrobiyal aktiviteyi incelemek için kullanılmıştır; bununla birlikte, özellikle karışık organik substratların biyometan potansiyelini (BMP) ölçmek için respirometri kullanan çalışmalar, devam eden bir araştırma alanıdır 3,4.
Evsel atık sulardaki organikler, uygulanabilir bir yenilenebilir kimyasal enerji kaynağı olarak kabul edilmektedir5. Atık su çamurlarının (yani birincil çamur ve atık aktif çamurlar, WAS) anaerobik çürütmesi, bir asırdan fazla bir süredir atık su arıtma tesislerinde (AAT'ler) metan açısından zengin biyogaz üretmek için kullanılmaktadır6. Bununla birlikte, WAS ile gıda hurdası atıkları gibi çoklu organik atık akışlarının sindirimi yalnızca son yıllarda yaygınlaşmıştır ve hala aktif bir araştırma alanıdır. Gıda hurda atıkları, birçok gelişmiş ülkede yüksek yoğunluklu organik materyalden oluşan tutarlı bir atık akışıdır ve ABD'deki çöp sahası kütlesinin yaklaşık %25'ini oluşturur7. Gıda artıklarının bir kısmının çöplüklerde bertaraf edilmesinin yanı sıra, gıda artıkları ve WAS'nin birlikte sindirim senaryosunda kombinasyonu, üretilen biyogaz hacminin artması (tek bir organik atık akışına göre) nedeniyle avantajlıdır. Biyogaz tipik olarak %60-70 metan, %30-%40 karbondioksit ve eser miktarda diğer gazlar (örneğin hidrojen sülfür) içerir8. Biyogaz, elektrik ve ısı enerjisi gereksinimlerinin bir kısmını dengelemek için birleşik bir ısı ve güç teknolojisi kullanılarak AAT'lerde yerinde temizlenebilir ve yakılabilir9.
Anaerobik mikrobiyotanın organik atıkları birlikte sindirmesinin biyometanasyon potansiyeli ve biyokinetik parametreleri çeşitli çalışmalarda incelenmiştir1. Literatürdeki mevcut çalışmalar, metan üretiminin deney boyunca ayrı noktalarda ölçüldüğü serum şişelerinde toplu tahliller kullanırken, diğerleri metan üretimini doğrudan tezgah veya pilot ölçekli biyoreaktörlerebağlı akış ölçerler kullanarak ölçmüştür 2,10,11. Bu protokolde tarif edilene benzer bir respirometre kullanılarak metan üretiminin sürekli ölçümü, çeşitli deneysel koşullar altında çalıştırılan çok sayıda numuneden sürekli ve hassas metan ölçümleri sağlayabilir 1,12. Birkaç çalışma, biyolojik atıklar, katı yağlar, sıvı yağlar, gres ve tarımsal atıklar gibi diğer organik substratlarla birlikte WAS'nin birlikte sindirilmesinden kaynaklanan metan üretimini ölçmüş olsa da 10,13,14, çok çeşitli birlikte sindirim senaryolarından metan üretim oranlarını belirlemek için önemli çalışmalar devam etmektedir. Ayrıca, bugüne kadar mevcut hiçbir protokol, gıda artıklarının ve WAS'nin birlikte sindirilmesinden metan üretiminin ölçümü için görsel tasvirler kullanan derinlemesine, adım adım bir yaklaşım sağlamamaktadır. Buna göre, bu çalışma, metan üretimini ölçmek ve substrat olarak seyreltik atık su, WAS ve gıda hurda atığının bir karışımını kullanarak biyokinetik parametreler türetmek için bir respirometre protokolü sunmaktadır. Metan üretimindeki değişiklikleri aydınlatmaya yardımcı olmak için farklı gıda-mikroorganizma oranları (F:M) kullanıldı. Diğer ölçümler arasında uçucu askıda katı maddeler (VSS), kimyasal oksijen ihtiyacı (KOİ) ve her bir numunenin pH'ı yer alır. Bu protokol, respirometre kurulumunu, numune oluşturmayı ve kritik ölçümleri açıklar.
Protokol
1. Substratın hazırlanması
- ~1,5 L birincil atık su, ~1 L atıkla aktif çamur (WAS) toplayın.
NOT: WAS numuneleri deneyden hemen önce alınmalıdır; bununla birlikte, WAS, deneyden önce 4 ° C'de 48 saate kadar saklanabilir ve bir substrat olarak kullanımı üzerinde fark edilebilir bir etkisi yoktur 15,16,17. - Deneyden hemen önce 2 L anaerobik kültür alın ve kültürü 35 °C'de tutun. Anaerobik çürütücüden toplama şişesine transfer sırasında hava ile teması mümkün olduğunca sınırlayın.
NOT: Bu çalışmada kullanılan anaerobik kültür, atık su birincil çamurunun anaerobik çürütmesi ile 8.5 MGD (38.640 m3/gün) arıtan bir AAT'den elde edilmiştir. En iyi uygulama, bir anaerobik kültür13 edinmeden önce toplama şişesini nitrojen gazı ile yıkayarak ve nakliye ve depolama sırasında anaerobik koşulları koruyarak anaerobik koşulları korumaktır. - Yiyecek atıklarını toplayın ve deneyden önce 48 °C'de 4 saate kadar saklayın.
NOT: Deney tasarımına bağlı olarak, gıda atıklarının hedef karbonhidrat, protein vb. oranlarıyla belirlenmesine özen gösterilmelidir. Gıda atıklarındaki organik maddelerin hedef oranları muhtemelen deneye göre değişecektir. Toplanan gıdalardaki karbonhidratların, proteinlerin ve yağların oranı, yayınlanmış literatürden tahmin edilebilir veya yerleşik protokoller (örneğin, gaz kromatografisi) kullanılarak değerlendirilebilir.
2. Besin takviyelerinin hazırlanması
- 800 mL deiyonize (DI) suyu CoCl2·6H2O(0.25 g), FeCl3· ile karıştırarak mineral baz çözeltisi #1'i hazırlayın6H2O (5 g), MnCl2·4H2O (0.05 g), NaMoO4·2H2O (0.005 g), NiCl2 ·6H2O (0.025 g), CuCl2 ·2H2O (0.007 g), ZnCl2 (0.025 g), H3BO3 (0.025 g) ve Na2SeO4 (0.025 g). Deiyonize (DI) su ile 1 L'ye kadar seyreltin.
- 800 mL DI suyu CaCl2 (27.7 g) ve MgCl2 ile karıştırarak mineral baz çözeltisi #2 hazırlayın·4H2O (101 g). DI su ile 1 L'ye kadar seyreltin.
- 800 mL DI suyu NH4Cl (38.2 g) ve Na2S04 (15 g) ile karıştırarak bir besin bazı hazırlayın. DI suda 3.64 N NaOH kullanarak pH'ı 7.0'a ayarlayın ve DI su ile 1 L'ye kadar seyreltin.
3. Numune hazırlama
- Bir karışım oluşturmak için yiyecek atıklarını (Tablo 2) bir karıştırıcıda (Şekil 1) birleştirin. Karışımın büyük yiyecek atığı parçacıklarından arınmış olduğundan emin olun. Karıştırmaya yardımcı olması için yiyecek atıklarını DI su ile seyreltin. Kimyasal Oksijen İhtiyacı (KOİ) ölçümlerini hesaplarken kullanmak için seyreltme suyu miktarını not edin. Bu seyreltilmiş gıda atığı 'çalışma atığı' olarak bilinir. Çalışma atıklarını 1 L'lik bir plastik şişeye koyun ve 4 °C'de saklayın.
- Dört adet 2 L'lik beheri Tablo 1'e göre etiketleyin. Beherleri bir karıştırma plakasına yerleştirin ve büyük bir karıştırma çubuğu ekleyin. 2 L'lik beherlerde Tablo 1'e göre gıda atığı, WAS ve seyreltmeyi (kontrol için DI suyu ve arıtmalar için birincil atık su) birleştirin.
- Mineral baz çözeltisi #1, mineral baz çözeltisi #2 ve besin bazının her birine 12 mL ekleyin.
- Her behere 2.4 g NaHCO3 (toz) ekleyin ve 30 saniye karıştırın. Sekiz respirometri şişesini Tablo 1'e göre etiketleyin ve manyetik bir karıştırma çubuğu ekleyin.
NOT: Bu, kontrolün kopyalarını ve farklı F:M oranlarında üç muamele oluşturacaktır. - Tablo 1'e göre her 2 L'lik behere anaerobik kültür ekleyin ve karıştırın. Dereceli bir silindire sahip beherden hemen 500 mL'lik bir karışım ölçün ve etiketli bir respirometre şişesine aktarın, nitrojen gazı ile yıkayın ve hemen kapatın.
NOT: Anaerobik mikrobiyotanın atmosferik oksijen ile temasını sınırlamak için özen gösterilmelidir (Varsa, transfer için anaerobik bir oda kullanılmalıdır).
4. Başlangıç koşullarının ölçülmesi
- Her numune 3 için pH, toplam KOİ (tCOD), çözünür KOİ (sCOD), toplam askıda katı madde (TSS) ve uçucu askıda katı maddeleri (VSS) ölçmek için bölüm 200'ten (~18 mL) kalan numuneyi kullanın.
- Gerekirse, ölçüm ekipmanının algılama sınırlarına göre numuneleri DI su ile seyreltin.
NOT: KOİ ölçümleri için üreticinin prosedürleri kullanılmıştır.
- Gerekirse, ölçüm ekipmanının algılama sınırlarına göre numuneleri DI su ile seyreltin.
5. Respirometre kurulumu
- Respirometreyi (Şekil 2) düşük anaerobik ayara getirin.
- Sıfırlama düğmesine ve güç açma düğmesine aynı anda basın.
NOT: Bu, bu çalışmada kullanılan modele özgüdür. - Soğutucuyu (Şekil 3) 35.5 °C'ye ayarlayın.
- Her bir CO2 ve nem yıkayıcıyı (Şekil 4 ve Şekil 5), her iki tarafı cam yünü ile çevrili, merkezde 50/50 CaSO4 ve KOH peletleri karışımı ile doldurun.
- Numune şişelerinden gelen tüpleri ve iğneleri yıkayıcıya ve ardından yıkayıcıdan gaz girişine bağlayın (Şekil 6).
- Respirometre dizüstü bilgisayarında, respirometre programı RSA-8-v2.0'ı çalıştırın.
NOT: Bu adım, bu çalışmada kullanılan modele özgüdür. - Programdaki tüm şişeleri seçin ve Veri Etiketlerini Düzenle > seçin. Tüm şişeleri adlandırın.
NOT: Bu adım, bu çalışmada kullanılan modele özgüdür. - Programdaki Başlat Düğmesini etkinleştirerek gaz üretimini ölçmeye başlayın. Programı, her yarım saatin sonunda verileri ölçecek şekilde ayarlayın. Oran Grafiği veya Hacim Grafiği'ni seçerek gaz üretimini izleyin.
NOT: Bu adım, bu çalışmada kullanılan modele özgüdür. - Deneyden sonra (~ 7 gün), programdaki çalışmayı durdurun, soğutucuyu kapatın ve RSPF modülünü kapatın. Veri dosyasını bir CSV dosyası olarak kaydedin, ardından bir MS Excel belgesine dönüştürün.
NOT: Bu adım, bu çalışmada kullanılan modele özgüdür.
6. Solunum sonrası ölçümler
- Bölüm 4'te yapıldığı gibi nihai numuneler üzerinde pH, TSS, VSS ve KOİ'yi ölçün.
Sonuçlar
Gıda atığı bileşimi
Bu çalışmada kullanılan gıda atıkları, tipik olarak bir üniversite yemek tesisinde servis edilen beş farklı gıda türünden oluşuyordu. Her gıda numunesi, Tablo 2'de listelenen değişen miktarlarda yağ, karbonhidrat ve protein içeriyordu. 19 Harmanlanmış gıda hurdası atığının %44'ü karbonhidrat, %36'sı protein, %16'sı yağ ve %4'ü diğer maddelerden oluşuyordu. Anaerobik birlikte sindirim için temsili bir yemek tesisi organik substratı sağlamak için her bir gıda türünün yaklaşık eşit kütlesi (56 g ila 86 g) kullanıldı. Gıda hurdası atığının kütlesi daha sonra incelenen her senaryo için istenen F:M'yi elde etmek için değiştirildi (0.3, 0.7 ve 1.1).
Uçucu askıda katı ve organik ölçümleri
İlk ve son VSS ve ilk ve son oksijen ihtiyacı için sonuçlar Tablo 3'te bulunur. Oksijen ihtiyacı, kabul edilen dönüşüm oranı (KOİ = 1.6BOD5)8 kullanılarak KOİ'den dönüştürülen BOİ5 olarak sunulur. Gösterildiği gibi, başlangıçtaki VSS konsantrasyonları (Tablo 3'te kütle ile de gösterilmiştir) kontrolden en büyük F: M oranına (1.1) yükselmiştir. İncelenen her F: M, VSS yıkımı veya organiklerin metan ve karbondioksitin gaz halindeki son ürünlerine anaerobik dönüşümünü sergiledi. Dönüşüm nedeniyle, VSS konsantrasyonu ilk ölçümlerden deneyin sonunda alınan son ölçümlere kadar azalmıştır. Yok edilen VSS miktarı, kontrolden daha büyük F:M oranlarına yükseldi. Beklenmedik bir şekilde, F:M = 0.7 senaryosu için VSS yıkımı, belki de F:M = 1.1 senaryosundaki engelleme nedeniyle, F:M = 1.1 senaryosunu aştı.
Ölçülen ilk oksijen ihtiyacı konsantrasyonları, VSS ile aynı eğilimi izledi, yani kontrolden en büyük F: M oranına yükseldi (Tablo 3). VSS yıkımına benzer şekilde, BOİ5 konsantrasyonları, kontrol hariç, başlangıç ve son konsantrasyonlar arasında azalmıştır. Kontrolde oksijen talebi, muhtemelen endojen bozunma nedeniyle artmıştır. VSS imhasından farklı olarak, ilk ölçümden son ölçüme kadar oksijen talebindeki azalma, her numune için nispeten düşüktü, %1 ile %3 arasında değişiyordu ve F:M oranına göre bir eğilim göstermedi. Bu eğilimin olası bir nedeni, partikül organik maddenin, uzun zaman dilimlerinde gerçekleşen ve genellikle anaerobik mikrobiyal konsorsiyumun20 metabolizmasında hız sınırlayıcı bir adım olan çözünür organiklere dönüştürülmesidir.
Metan üretimi
Metan üretim miktarları ve oranları, 190 saatlik çalışma süresi boyunca F: M oranları aralığında değişmiştir. Deneysel sonuçlar, daha yüksek F:M oranlarının toplam metan hacimlerinin arttığını ortaya koymuştur (Şekil 7). Hiçbir substrat eklenmeyen kontrol, muhtemelen çamurdaki nispeten az miktarda çözünür BOİ5 ve/veya endojen bozunma nedeniyle az miktarda metan (~ 72 mL) üretti. Beklendiği gibi, diğer senaryolarda substrat ilavesi, kontrole göre metan üretimini artırdı. 0.3'lük F: M senaryosu, kontrolden hacimce (~ 354 mL) beş kat daha fazla metan verdi. F: M oranını 0.7'ye çıkarmak, 0.3'lük F: M senaryosundan 1.6 kat daha fazla metan (~ 574 mL) verdi. Benzer şekilde, F: M oranını 1.1'e çıkarmak, 0.7'lik F: M senaryosundan 1.9 kat daha fazla metan (~ 1098 mL) verdi. İncelenen her bir F:M oranı için gözlemlenen maksimum hacimsel metan üretim değerleri (Ymax) Tablo 4'te listelenmiştir. Zaman içinde üretilen metan oranı da incelenen F:M oranları ile değişti. Şekil 8'de gösterildiği gibi, metan üretim hızı ve çalışma sırasında metanın üretildiği süre, F: M arttıkça artmıştır. Örneğin, 0.3'lük F: M senaryosunda, 129 saatlik çalışmadan sonra (maksimum 354 mL ile) gözlemlenen metan üretimi olmazken, 1.1'lik F: M senaryosu çalışmanın sonunda hala az miktarda metan üretiyordu. Tüm senaryolarda, substrat mevcudiyetinin azalması nedeniyle üretilen metan oranı zamanla azalmıştır. Çalışmanın sonunda hala bol miktarda oksijen talebi mevcut olsa da (Tablo 3), biyolojik olarak kullanılabilir bir formda olmayabilir veya anaerobik mikrobiyota için sınırlı kalan elektron alıcısı (örneğin, karbondioksit) olabilir. Son olarak, gözlemlenen tahrip edilmiş VSS (mg) başına üretilen metan (mL) karşılaştırması, 0.3 ve 0.7'lik F:M değerlerinin 1.3 ila 1.6 mL/mg arasında bir aralık sağladığını, 1.1'lik F:M'nin ise birim VSS tahrip başına daha fazla metan ürettiğini (3.7 mL/mg) göstermektedir (Tablo 4). Tchobanoglous ve ark. (2014), yağları (~1,4 mL/mg), gresi (~1,1 mL/mg) ve proteini (~0,7 mL/mg) içerecek şekilde, ortak hammaddeler için yok edilen birim katı madde başına gaz verimi için tipik aralıklar sağlar8. Mata-Alvarez ve ark. (2014), laboratuvar ölçekli ve pilot ölçekli biyoreaktörlerde atık su çamurunu çeşitli substratlarla ve farklı substrat oranlarıyla (örneğin, farklı WAS ve FOG oranları) birlikte sindiren çalışmaları gözden geçirmiştir10. Yok edilen birim VSS başına bildirilen metan üretiminin, birlikte sindirilen substratların yanı sıra, yok edilen mg VS başına 0.2 mL ila 1.1 mL biyogaz arasında değişen substrat oranıyla önemli ölçüde değiştiğini buldular. Bu çalışmadan elde edilen temsili sonuçlar, özellikle 0.3 ve 0.7'lik F:M için, karşılaştırma çalışmalarının sonuçlarıyla olumlu bir şekilde karşılaştırılmaktadır.
Biyokinetik parametreler
Zaman içinde metan üretimi, birkaç önemli biyokinetik parametreyi belirlemek için kullanılabilir. Bu biyokinetik parametreler, respirometre kullanılmadan benzer senaryolarda metan üretimini tahmin etmek için daha fazla kullanılabilir. Metan üretim hızı sabiti, k, incelenen her F:M oranı için gözlemlenen respirometre verilerine logaritmik en küçük kareler uydurması kullanılarak türetilebilir (yani, Şekil 8'de gösterilenler). 0.3 senaryosunun F:M için temsili bir logaritmik fonksiyonu y = 93.465ln(X) - 175.91'dir. Burada 93.465'in değeri saat cinsindendir, bu da günlere dönüştürülmesi ve ardından tersine çevrilmesi gerekir ve k = 0.257 verir. İncelenen her F:M oranı için hız sabitleri (k) ve belirleme katsayısı (R2) Tablo 4'te bulunmaktadır.
Oran sabiti daha sonra her bir F:M oranı için herhangi bir zamanda metan verimini belirlemek için kullanılabilir. Organik substrattan zaman içinde üretilen metan oranı, aşağıdaki denklem [1]21 kullanılarak modellenebilir:
(1)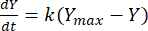
Yukarıdaki denklemi t = 0 ile t = t limitleri arasına entegre etmek, aşağıdakileri verir [2]:
(2)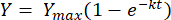
Nerede, Y = herhangi bir zamanda metan verimi [mL]; Ymax = respirometre çalışmasından gözlemlenen maksimum metan verimi [mL]; K = metan üretim hızı sabiti [D-1]; t = zaman [d]
Yukarıda sunulan biyokinetik parametreleri geliştirmek için kullanılan birinci dereceden yaklaşım, deneysel verilere çok makul bir uyum sağlarken (Tablo 4'teki R2 değerleri ile gösterildiği gibi), diğer çalışmalar, Modifiye Gompertz modeli, iki substrat modeli ve Koni modeli2'yi içerecek şekilde metan üretim verilerine uyacak şekilde diğer modellerin kullanıldığını bildirmiştir.

Şekil 1: Gıda atığı karıştırıcısı. Yemek atıklarını birleştirmek için kullanılan standart blender. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Resim 2: Respirometre. Metan üretimini ölçmek için eksiksiz respirometre kurulumu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Respirometre soğutucusundaki numune şişesi. Sekiz numune şişesi ile respirometre soğutucunun iç görünümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Respirometre yıkayıcı. Respirometre yıkayıcının yakından görünümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
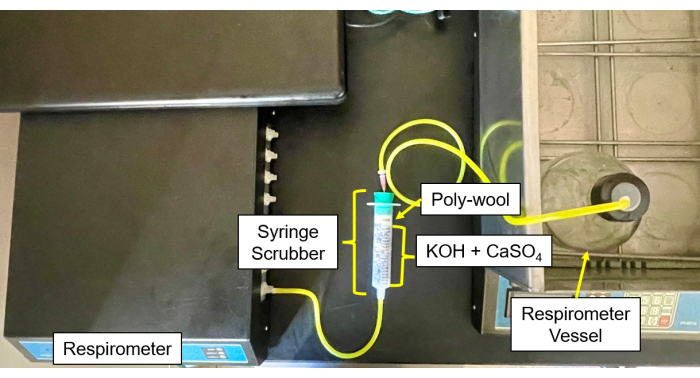
Şekil 5: Kontrol modülüne respirometre yıkayıcı. Kontrol modülünün ve yıkayıcı kurulumunun respirometre görüntüsü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Respirometre yıkayıcı hattı kurulumu. Numune şişeleri ve respirometre arasındaki yıkayıcı hattı kurulumunun yakından görünümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
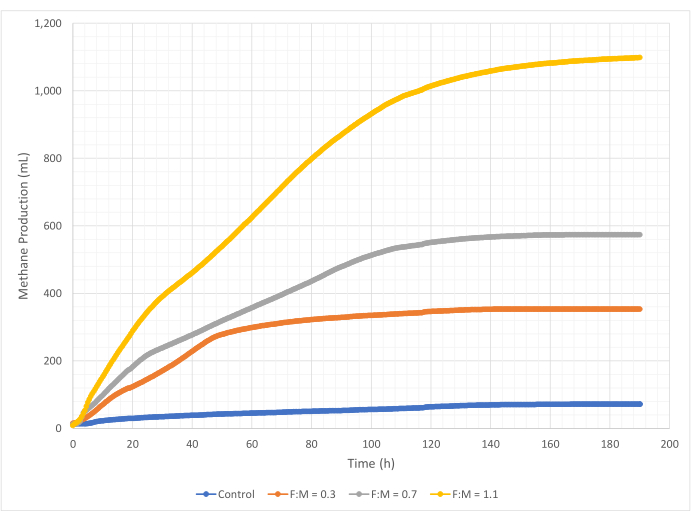
Şekil 7: Farklı F:M oranları kullanılarak toplam metan üretimi. Her F:M (0.3, 0.7, 1.1) için metan üretimi zaman içinde (0 saat ila 190 saat) gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
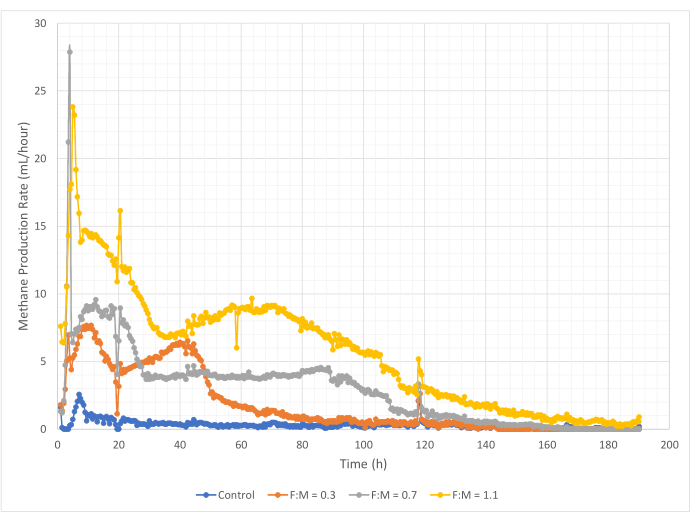
Şekil 8: Farklı F:M oranları kullanılarak metan üretim hızı. Her F:M (0.3, 0.7, 1.1) için metan üretim hızı zaman içinde (0 saat ila 190 saat) gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Gıda-Mikrop Oranlarına Sahip Numune Şişesi Bileşenleri. Her F: M (0.3, 0.7, 1.1) ve boş şişeler için bileşen kütlesi, konsantrasyon ve hacim. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Örnek Organik Substrat Bileşimi. Gıdaya göre gıda atığı kütlesi ve yüzde bileşimi ve karbonhidrat, protein ve yağ oranı. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: Numune Uçucu Askıda Katı ve Oksijen İhtiyacı Sonucu (± Standart Sapma). Her F:M için VSS ve COD (0.3, 0.7, 1.1). Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 4: Örnek Kinetik Parametreler. Metan verimine dayalı olarak hesaplanan kinetik parametreler. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde sağlanan yöntemler, araştırmacıların ve uygulayıcıların respirometri kullanarak organik atık akışlarını anaerobik olarak sindirmenin biyometan potansiyelini belirlemelerine yardımcı olabilir. Bu protokolde, tipik bir gıda hurdası atık akışının birlikte sindirilmesinden metan üretimini, bir dizi F:M oranında bir AAT'den WAS ile birleştiriyoruz. Bu protokol, metan üretiminin sürekli ölçümü ve birinci dereceden kinetik modelleme kullanılarak biyokinetik parametrelerin belirlenmesi için adım adım bir respirometri yaklaşımı sağlayarak literatüre katkıda bulunmaktadır. Diğer bazı çalışmalar, zaman içinde ayrı noktalarda metan üretimini ölçen mikro kozmos deneyleri kullanmıştır10,22, diğerleri ise uzun süreli sürekli akışlı tezgah veya pilot ölçekli biyoreaktörlere14,23 bağlı akış ölçerler kullanarak metanı ölçmüştür. Respirometri, çeşitli deneysel koşullara göre metan üretimini sürekli olarak ölçme avantajı sunar. Respirometri deneyleri bir biyoreaktörün inşasını gerektirmediğinden, deney koşulları, bazı tezgah veya pilot ölçekli deneylere kıyasla nispi frekansta değiştirilebilir. Bu avantaj nedeniyle, respirometri deneyleri, nispeten kısa bir süre içinde çok sayıda organik atık kombinasyonunun birlikte sindirilmesinden metan üretimini belirlemek için kullanılabilir. Örneğin, bu çalışmada sunulan protokolün bir sonraki adımı olarak, WAS'ye göre kimyasal enerjide çok yoğun olan katı yağlar, sıvı yağlar ve gresler, zaman içinde metan üretimindeki olası artışları ölçmek için gıda artıkları ile birlikte sindirilebilir. Bu yaklaşımın uygulanması, birlikte sindirim şemalarında çoklu substrat kombinasyonları boyunca metan üretim oranları ve biyokinetik parametrelerle ilgili literatürü oluşturmaya devam edebilir. Ayrıca, optimal substrat kombinasyonlarının belirlenmesine ek olarak, metan üretim sonuçları ve biyokinetik parametreler, atık su arıtımı için tasarlananlar gibi mevcut programlarda performans modellemesini bilgilendirmek veya birlikte çürütme şemalarının tezgah veya pilot ölçekten tam ölçeğe ölçeklendirildiğinde nasıl performans göstereceğini tahmin etmek için kullanılabilir24,25.
Ek olarak, bu protokol, anaerobik mikrobiyal konsorsiyum için özel bir substrat beslemesi uygulamak üzere değiştirilebilir. Örneğin, bir araştırmacı anaerobik mikrobiyotaya sadece karbonhidrat veya sadece protein sağlamanın etkilerini incelemek isterse, bu protokoldeki hammadde buna göre değiştirilebilir. Alternatif olarak, bir araştırmacı belirli bir KOİ fraksiyonunun eklenmesinin etkisini test etmek isterse (örneğin, sadece çözünür KOİ veya sadece partikül KOİ) veya belirli bir substratın yüksek konsantrasyonları (örneğin, asetat, uçucu yağ asidi ve anaerobik metabolizmanın ara ürünü) metan üretimi üzerinde, bu protokolün bir varyasyonu kullanılabilir. Substratı değiştirirken veya belirli bir substratın F:M'sini değiştirirken gözlemlenen en iyi uygulama, yalnızca substratın kütlesini ayarlarken her numune için aynı anaerobik mikrobiyota kütlesini korumaktır (kütle-kütle oranları kullanılmalıdır). Substratları modifiye etmenin yanı sıra, araştırmacılar substrat kullanımı ve metan üretimini daha iyi anlamak için bu protokolü diğer analizlerle birlikte kullanabilirler. Örneğin, bir araştırmacı, topluluk yapısını işlevle daha iyi ilişkilendirmek için bu protokolü mikrobiyal topluluk analizleriyle (örneğin, 16S rRNA gen dizilimi veya metagenomik) birlikte kullanabilir.
Bu metodolojinin kullanışlılığına rağmen, birkaç sınırlama vardır. Respirometreler ve biyometan potansiyeli testleri çoğunlukla kesikli reaktörler olarak yapılandırılır; Bununla birlikte, tam ölçekli anaerobik yardımcı çürütücüler normalde 10 güne kadar çamur tutma sürelerine sahip sürekli akış sistemleri olarak çalıştırılır1. Buna göre, respirometri deneylerinden toplanan veriler, metan üretim oranlarını tahmin etmek ve biyokinetik parametreler geliştirmek için yararlıdır, ancak bu veriler, mümkün olduğunda zaman içinde çalıştırılan daha büyük ölçekli çürütücüler kullanılarak sahada doğrulanmalıdır.
Ek olarak, respirometriden önce numunelerin seçilmesine ve hazırlanmasına özen gösterilmelidir. Büyük gıda hurdası parçacıkları VSS ve KOİ ölçümlerini çarpıtır ve yanlış sonuçlar verebilir. Substrat olarak gıda hurdası atığı kullanılıyorsa, karışım iyi bir şekilde yumuşatılmalı ve büyük gıda parçacıklarından arındırılmalıdır - tam ölçekli çürütücülerde gıda hurdası alma çukurlarında maserasyona benzer bir yaklaşım. DI su ile seyreltme, karıştırma işlemine yardımcı olabilir ve gıda artıkları daha büyük ölçekte yumuşatıldığında yaygın olarak kullanılan su ilavesine benzer. Bununla birlikte, seyreltmelerin uygun şekilde ölçülmesini ve hedef nem içeriğine ulaşılmasını sağlamak için her türlü çaba gösterilmelidir. Seyreltme, özellikle deneyimsiz öğrenciler bu protokolü uyguluyorsa, kolayca bir hata kaynağı olabilir.
Birlikte sindirimde bulunan mikrobiyal konsorsiyumlar zorunlu anaeroblar içerdiğinden, transfer ve numune hazırlama işlemleri sırasında oksijene maruz kalmayı ortadan kaldırmak (veya büyük ölçüde azaltmak) için özel dikkat gösterilmelidir. Oksijen, nitrojen yıkama yoluyla numune şişelerinden çıkarılabilir. Ayrıca, varsa, anaerobik kültürün toplama şişeleri ve respirometre numune şişeleri arasında aktarılması işi anaerobik bir odada yapılmalıdır. Respirometre tutarlı sonuçlar (metan üretim hacimleri ve oranları) sağladığından, beklenen sonuçlardan herhangi bir sapma, örneğin uygun olmayan bir mikrobiyal konsorsiyum, testin başlangıcına doğru kolayca tanımlanabilir. Yinelenen veya üç kopyalı bir numunenin kullanılması, hatalı testlerin belirlenmesine daha fazla yardımcı olabilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu protokolün geliştirilmesine ilişkin tartışma için Respirometre Sistemleri ve Uygulamaları'ndan Dr. Jim Young'a teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 103 °C Oven Isotemp | Fisher Scientific | 13-247-737F | Model: 737F, Force Air Oven |
| 550 °C Vulcan Oven | Neytech (Manufacturer) / Cole Palmer (Vendor) | 9493308 | Model: 3-550 |
| Aerobic/Anaerobic Respirometer | Respirometer System and Applications (RSA) | PF-8000 | Model: PF-8000 |
| Analytical Balance | Mettler Toledo | 30029075 | Model: ME204E, Detection Limit: 0.1 mg |
| Smoothie Blender with 56 oz Plastic Jar | Hamilton Beach | 50190F | Model: 50190F |
| COD Vials TNT Plus Vial Test | HACH | TNT821 | TNT 821, 3–150 mg/L COD |
| COD Vials TNT Plus Vial Test | HACH | TNT822 | TNT 822, 20–1500 mg/L COD |
| Dessicator | SP Bel-Art | 942070050 | Model: SP Scienceware |
| Dionized Water System | Milli-Q | ZIQ7010T0C | IQ 7010 Pure & Ultrapure Water Purification System |
| Anhydrous CaSO4 | W.A. Hammond Drierite Company | 13001 | 8 Mesh, 1 lb |
| Glass Fiber Filters | Whatman (Manufacturer) / Cole-Parmer (Vendor) | 1827-150 | Model: 934-AH |
| Heat Digestor Block | HACH | DRB200-02 | DRB 200 |
| Hot Plate Stirrer | Corning | 6795-620D | Model: PC-620D |
| Industrial-Grade Nitrogen (Compressed Cylinder) | Air Gas | NI UHP300 | 300 cubic feet |
| Pellets (KOH) | Fisher Scientific | AC134062500 | 500 g |
| pH Meter | Fisher Scientific | 13-636-AP115 | AP115, Accumet pH meter |
| UV Spectrophotometer | HACH | LPV400.99.00012 | DR 3900 |
| Vaccum Pump | GAST | 1HAB-25-M100X |
Referanslar
- Mainardis, M., Buttazzoni, M., Cottes, M., Moretti, A., Goi, D. Respirometry tests in wastewater treatment: Why and how? A critical review. Sci Total Environ. 793, 148607 (2021).
- Pan, Y., et al. Synergistic effect and biodegradation kinetics of sewage sludge and food waste mesophilic anaerobic co-digestion and the underlying stimulation mechanisms. Fuel. 253, 40-49 (2019).
- Argiz, L., et al. Assessment of a fast method to predict the biochemical methane potential based on biodegradable COD obtained by fractionation respirometric tests. J Environ Manage. 269, 110695 (2020).
- Carucci, A., et al. Aerobic storage by activated sludge on real wastewater. Water Res. 35 (16), 3833-3844 (2001).
- McCarty, P. L., Bae, J., Kim, J. Domestic wastewater treatment as a net energy producer-Can this be achieved. Environ Sci Technol. 45 (17), 7100-7106 (2011).
- McCarty, P. The development of anaerobic treatment and its future. Water Sci Technol. 44 (8), 149-156 (2001).
- From farm to kitchen: The environmental impacts of U.S. food waste Part 1. United States Environmental Protection Agency Available from: https://www.epa.gov/system/files/documents/2021-11/from-farm-to-kitchen-the-environmental-impacts-of-u.s.-food-waste_508-tagged.pdf (2021)
- Tchobanoglous, G., Burton, F. L., Stensel, H. D. . WastewaterEngineering:TreatmentandReuse. 5th ed. , (2014).
- Pfluger, A., et al. Anaerobic digestion and biogas beneficial use at municipal wastewater treatment facilities in Colorado: A case study examining barriers to widespread implementation. J Clean Prod. 206, 97-107 (2019).
- Mata-Alvarez, J., Dosta, J., Romero-Güiza, M. S., Fonoll, X., Peces, M., Astals, S. A critical review on anaerobic co-digestion achievements between 2010 and 2013. Renew Sust Energ Rev. 36, 412-427 (2014).
- Pfluger, A. R., Hahn, M. J., Hering, A. S., Munakata-Marr, J., Figueroa, L. Statistical exposé of a multiple-compartment anaerobic reactor treating domestic wastewater. Water Environ Res. 90 (6), 530-542 (2018).
- Razaviarani, V., Buchanan, I. D. Calibration of the Anaerobic Digestion Model No. 1 (ADM1) for steady-state anaerobic co-digestion of municipal wastewater sludge with restaurant grease trap waste. Chem Eng J. 266, 91-99 (2015).
- Zhu, H., et al. Biohydrogen production by anaerobic co-digestion of municipal food waste and sewage sludges. Int J Hydrog Energy. 33 (14), 3651-3659 (2008).
- Serna-García, R., Ruiz-Barriga, P., Noriega-Hevia, G., Serralta, J., Pachés, M., Bouzas, A. Maximising resource recovery from wastewater grown microalgae and primary sludge in an anaerobic membrane co-digestion pilot plant coupled to a composting process. J Environ Manage. 281, 111890 (2021).
- Gossett, J. M., Belser, R. L. Anaerobic digestion of waste activated sludge. J Environ. 108 (6), 1101-1120 (1982).
- Yi, H., Han, Y., Zhuo, Y. Effect of combined pretreatment of waste activated sludge for anaerobic digestion process. Procedia Environ Sci. 18, 716-721 (2013).
- Nah, I. W., Kang, Y. W., Hwang, K. Y., Song, W. K. Mechanical pretreatment of waste activated sludge for anaerobic digestion process. Water Res. 34 (8), 2362-2368 (2000).
- American Public Health Association. . Standard Methods for the Examination of Water and Wastewater. Vol. 10. American Public Health Association. , (2012).
- Food Data Central. US Department of Agriculture Available from: https://fdc.nal.usda.gov/ (2024)
- Vanzin, G., Pfluger, A., Almstrand, R., Figueroa, L., Munakata-Marr, J. Succession of founding microbiota in an anaerobic baffled bioreactor treating low-temperature raw domestic wastewater. Environ Sci Water Res Technol. 8 (4), 792-806 (2022).
- Negi, S., Dhar, H., Hussain, A., Kumar, S. Biomethanation potential for co-digestion of municipal solid waste and rice straw: a batch study. Bioresour Technol. 254, 139-144 (2018).
- Rostkowski, K. H., Pfluger, A. R., Criddle, C. S. Stoichiometry and kinetics of the PHB-producing Type II methanotrophs Methylosinus trichosporium OB3b and Methylocystis parvus OBBP. Bioresour Technol. 132, 71-77 (2014).
- Pfluger, A., Vanzin, G., Munakata-Marr, J., Figueroa, L. An anaerobic hybrid bioreactor for biologically enhanced primary treatment of domestic wastewater under low temperatures. Environ Sci Water Res Technol. 4 (11), 1851-1866 (2018).
- Callahan, J. L., Pfluger, A. R., Figueroa, L. A., Munakata-Marr, J. BioWin® modeling of anaerobic sludge blanket treatment of domestic wastewater. Bioresour Technol Rep. 20, 101231 (2022).
- Linvill, C., Butkus, M., Bennett, E., Wait, M., Pytlar, A., Pfluger, A. Energy balances for proposed complete full-scale anaerobic wastewater treatment facilities. Environ Eng Sci. 40 (11), 482-493 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır