Method Article
Mejora de la eficiencia y el rendimiento de radiomarcaje de radioligandos de carbono-11 para la investigación clínica mediante el método de bucle
En este artículo
Resumen
Este protocolo presenta un procedimiento detallado para preparar cuatro radiotrazadores de carbono-11 mediante el "método de bucle" [11C]metilación. Describimos el procedimiento para sintetizar [11C]ER-176, con datos de tres radiotrazadores adicionales: [11C]MRB, [11C]mHED y [11C]PiB. El método de bucle proporciona una síntesis eficiente con mayores rendimientos radioquímicos en comparación con la metilación tradicional de recipientes de reacción [11C].
Resumen
Un programa exitoso de imágenes de tomografía por emisión de positrones que involucra radiotrazadores de carbono-11 exige métodos de síntesis rápidos, eficientes y confiables, que requieren un ciclotrón en el lugar y un grupo de radioquímica, así como personal clínico capacitado para operar bajo las limitaciones únicas del radionúclido de carbono-11. Este estudio examina los méritos y ventajas de un "método de bucle" de solvente cautivo para radiomarcar cuatro trazadores con el radionúclido de carbono-11, produciendo los radioligandos [11C]ER-176, [11C]MRB, [11C]mHED y [11C]PiB.
El "método de bucle" se compara con el método tradicional de metilación de carbono-11 basado en reactores en el curso de la síntesis de los mismos radiotrazadores en la misma plataforma automatizada. Además, se presenta una descripción completa de la preparación de la investigación clínica del radiotrazador [11C]ER-176. Como lo demuestra la producción de [11C]ER-176, el "método de bucle" de solvente cautivo de alquilación heterogénea demostró ser más eficiente, con una excelente pureza radioquímica (99,6 ± 0,6%, n = 25), un rendimiento radioquímico más alto y consistente (fin de síntesis (EOS) = 5,4 ± 2,2 GBq, n = 25) en comparación con el método del reactor (EOS = 1,6 ± 0,5 GBq, n = 6), aumento de la actividad molar (método de bucle = 194 ± 66 GBq/μmol, n = 25; método del reactor = 132 ± 78 GBq/μmol, n = 6), junto con una secuencia de reacción media 5 min más corta.
Introducción
Entre las modalidades de la imagen molecular, la tomografía por emisión de positrones (PET) se distingue por su forma de resolución de los procesos bioquímicos asociados a objetivos fisiológicos específicos o regiones de interés 1,2. La sensibilidad característica y la naturaleza no invasiva de la PET se aprovechan para la visualización y cuantificación in vivo de la fisiopatología de la enfermedad, que a menudo revela objetivos invisibles mediante técnicas de imagen más anatómicas como la tomografía computarizada (TC)3 o la resonancia magnética (RM)4. La imagen molecular contemporánea ve la combinación de PET con TC o MR (PET/CT o PET/MR, respectivamente), aprovechando la resolución de alto contraste y los parámetros de imagen cuantificables de la PET para proporcionar mapas de corrección de atenuación altamente precisos (PET/CT) y una resolución espacial mejorada (PET/MR)5, superando algunos obstáculos presentados por la variabilidad en las energías cinéticas más altas de los positrones de radionúclidos como el galio-68 y el rubidio-826. Estas técnicas de imagen de doble modalidad canalizan los atributos distintivos de cada modalidad individual, proporcionando a los clínicos o investigadores una gran cantidad de conocimientos anatómicos y bioquímicos corregistrados sobre el sujeto de estudio5.
La aplicabilidad clínica de esta técnica de imagen es vasta, ofreciendo visualización y medición de procesos fisiológicos a nivel molecular tan diversos como el metabolismo de la glucosa 7,8, la unión al receptor de neurotransmisores9, la perfusión miocárdica10 y diversas afecciones neurológicas11. Fuera del uso clínico, los atributos inherentes de la PET se alinean para desempeñar un papel integral en el desarrollo de fármacos diagnósticos y terapéuticos, lo que permite la cuantificación de parámetros como el potencial de unión (BP), la biodistribución, el volumen de distribución (VT) y la ocupación del receptor del fármaco (RO%) mediante la observación directa de la interacción de la farmacología, la farmacocinética y la farmacodinamia. Esto, a su vez, contribuye a las determinaciones, incluyendo si un compuesto alcanza un objetivo a una concentración de dosis efectiva (ED50), el grado de penetración efectiva de la barrera hematoencefálica, la integridad metabólica del compuesto y la dosis y el intervalo de dosificación apropiados11.
Al desarrollar una sonda útil para la obtención de imágenes por PET, tras la identificación de un biomarcador apropiado y la selección de un ligando asociado, el radiomarcaje de la biomolécula con un radionúclido PET adecuado produce la sonda radiotrazadora para el estudio PET. Entre los radionúclidos PET para investigar cuestiones biológicas, farmacológicas o médicas, el carbono-11 ofrece una combinación de versatilidad sintética y características físicas favorables que permite su uso generalizado en diversas biomoléculas y ligandos elegibles6. Con una emisión de positrones del 99,8% y una vida media de 20,4 minutos12, el carbono-11 permite la administración repetida a los sujetos en intervalos cortos, al tiempo que permite síntesis de varios pasos. Sin embargo, estas ventajas requieren una instalación con capacidades de ciclotrón y radioquímica in situ5.
Dichas instalaciones requieren métodos de metilación fiables, potentes y reproducibles que permitan el radiomarcaje de moléculas precursoras, a menudo con el sustrato electrofílico [11C]iodometano ([11C]CH3I) o [11C]metiltriflato ([11C]CH3OTf)13. Un módulo de radiosíntesis, tal como lo suministra el fabricante, está típicamente configurado para un enfoque de recipiente de reacción a reacciones de metilación [11C]14. Esto implica enfriar el recipiente para una retención efectiva de [11C]yodometano o [11C]triflato de metilo en el momento de la entrega, sellar y calentar el recipiente para efectuar la reacción, enfriar y luego transferir el contenido reaccionado a un sistema de cromatografía líquida de alta resolución (HPLC) para la purificación semipreparativa13. Si bien es efectiva15, esta técnica presenta numerosos puntos estructurales potenciales de falla, que involucran tabiques viales, agujas y líneas de transferencia asociadas.
La necesidad de un método de metilación más fiable y reproducible guió la investigación y la búsqueda de una modificación de disolvente cautivo para muchos de nuestros protocolos de síntesis de radioligandos de carbono-11. Este enfoque tiene como objetivo abordar las limitaciones del método convencional de recipientes de reacción y, al mismo tiempo, mantener o mejorar la eficiencia del radiomarcaje.
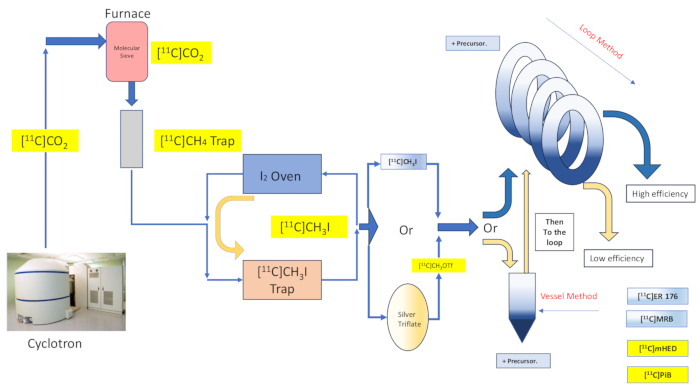
Figura 2: Diseño y flujo de la síntesis de recipientes de reacción y método de bucle. Haga clic aquí para ver una versión más grande de esta figura.
La química de solventes cautivos ofrece la promesa de una captura eficiente y una reacción con el reactivo de radiomarcaje mediante la propagación de la solución precursora sobre un área grande de un material o estructura de soporte, y luego dirigir el reactivo de marcado gaseoso en contacto con el material recubierto 16,17. Esto mejora el grado y la calidad del contacto entre las dos fases reactivas16,18. Se han documentado numerosas implementaciones y variaciones de esta técnica desde 1985 16,17,18,19,20, y ha encontrado aplicación con [11C]yoduro de metilo, [11C]triflato de metilo, así como reacciones de radiomarcaje de dióxido de carbono [11 C] reactivo de Grignard 20. El refinamiento adicional fue presentado por la discusión de la química del "método de bucle" de solvente cautivo, originalmente descrita por Wilson et al., que no requiere ningún soporte adicional al ya ofrecido por el circuito de purificación de HPLC, ni calentamiento o enfriamiento del ambiente de reacción13. Se encontró que el radiomarcaje con solvente cautivo "método de bucle" imparte reacciones de metilación de yodometano y triflato de metilo [11C] con las virtudes de pérdida de transferencia mínima, alto rendimiento radioquímico, alta actividad molar, disminución del tiempo de reacción y simplicidad 7,21,22,23.
En este trabajo describimos la implementación por parte de nuestro grupo de la técnica de metilación del "método de bucle" [11C] descrita originalmente por Wilson13, y otras posteriores 14,15,18,21,22,23, (ver Figura 2) por medio de modificación mecánica (ver Figura 3) a nuestro módulo de síntesis (en adelante, el Módulo). Estas modificaciones mecánicas, que se ajustaban lo más posible al espíritu aspiracional de la simplicidad, fueron mínimas y accesibles, lo que resultó en una reducción general de la complejidad de la ingeniería y solo en la adición de componentes esenciales a los ya instalados por el fabricante del módulo como asociados con una disposición de radioetiquetado de recipiente de reacción predeterminada. Esto se refleja en la decisión de utilizar el bucle de purificación de HPLC de acero inoxidable ya suministrado y preinstalado por el fabricante del módulo, como se describe a continuación, que resultó compatible y eficaz con las síntesis examinadas. Discutimos, con todo detalle, el protocolo de radiomarcaje del método de bucle completo y validado utilizado en la producción de investigación clínica para la síntesis del radiotrazador [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida,[11C]ER-176 (1), utilizando yodometano carbono-11. Además, comparamos numerosos atributos relacionados con la eficiencia del radiomarcaje realizado tanto por el método del reactor como por el método del bucle a través de tres radioligandos adicionales, que incluyen (S,S)-[11C]metilreboxetina ([11C]MRB (2)),[11C]-meta-hidroxiefedrina ([11C]mHED (3)) y 2-[4-[(11C)metilamino]fenil]-1,3-benzotiazol-6-ol ([11C]PiB (4)) desarrollados en nuestras instalaciones, según lo determinado por el análisis de los lotes sintetizados (ver Tabla 1 yFigura 1 ). Esta comparación ilustra la clara ventaja de parámetros como el rendimiento radioquímico y la actividad molar asociados con la implementación del radiomarcaje por "método de bucle", que se obtiene mediante modificaciones de módulos accesibles y sencillas de costo mínimo para el laboratorio de radioquímica.
Protocolo
NOTA: Todos los equipos y síntesis se realizan en una celda caliente o minicelda con protección de plomo. PRECAUCIÓN: A partir del ciclotrón se generan y utilizan partículas emisoras de positrones de alta energía. El área se monitorea con contadores Geiger calibrados, y las personas usan anillos y insignias de dosimetría de seguridad radiológica. Todo el personal está capacitado para trabajar con materiales radiactivos de alta energía.
Todas las síntesis se realizan en un módulo limpio y esterilizado de acuerdo con nuestros procedimientos operativos estándar (SOP) internos. El proceso de limpieza incluye el uso de HCl 1 N, agua, acetona y acetonitrilo para la parte de reacción del módulo. Mientras tanto, la parte de formulación del módulo se limpia y esteriliza con agua y etanol.
1. El radiomarcaje de [ 11C]ER-176 (1) mediante el método de bucle
NOTA: Para obtener una lista de los materiales utilizados en la preparación de [11C]ER-176 (1), consulte la Tabla de Materiales.
- Replumente el módulo para la producción del método de bucle (consulte la Figura 4A-D). Conecte una válvula V8 a una unión que se conecte directamente al circuito de HPLC. Esto evitará el recipiente de reacción.
- Acondicione el horno de metano (CH4) a 350 oC durante 20 min con un flujo de gas hidrógeno de 100 mL/min antes de todas las producciones realizadas en el módulo. Deje enfriar a 45 oC antes de continuar.
- Acondicione la trampa CH4 a 120 oC durante 20 min con un flujo de gas helio de 50 mL/min antes de todas las producciones realizadas en el módulo. Deje enfriar a 70 oC antes de continuar.
- Acondicione la trampa de yoduro de metilo a 190 oC durante 20 min con un flujo de gas helio de 50 mL/min antes de todas las producciones realizadas en el módulo. Deje enfriar a 50 oC antes de continuar.
- Carga de reactivos para el módulo:
- Usando una jeringa de 100 μL, inyecte la siguiente mezcla a través del adaptador en la posición #1 del circuito de HPLC interno de la válvula de seis puertos: (R)-N-sec-butil-4-(2-clorofenil)-quinazolina-2-carboxamida (1.0 ± 0.05 mg) en dimetilsulfóxido-d6 (100 ± 10 μL) e hidróxido de sodio 6 N (4 μL).
NOTA: Los solventes deuterados se seleccionaron por su disponibilidad en forma de ampolla y porque generalmente se destilan durante la fabricación, lo que garantiza que estén libres de agua. - Cargue el depósito V4 con 3,0 mL de cloruro de sodio al 0,9% para inyección.
- Cargue el depósito V5 con 1.0 mL de etanol de 200 grados.
- Cargue el depósito V6 con 10 mL de agua desionizada estéril.
- Llene el matraz receptor grande con 25 ml de agua desionizada estéril.
- Llene el matraz de formulación con 6,0 mL de cloruro de sodio al 0,9% para inyección.
- Asegúrese de que la línea de entrega esté conectada a un vial estéril de producto final preensamblado.
- Prepare la fase móvil con una mezcla 37:63 (v/v) de acetonitrilo y 20 mM de hidróxido de amonio.
- Acondicione la columna de semi-preparación con cuatro volúmenes de columna de fase móvil.
NOTA: La columna utilizada es una columna C18 de 100 mm x 10 mm de fase inversa.
- Usando una jeringa de 100 μL, inyecte la siguiente mezcla a través del adaptador en la posición #1 del circuito de HPLC interno de la válvula de seis puertos: (R)-N-sec-butil-4-(2-clorofenil)-quinazolina-2-carboxamida (1.0 ± 0.05 mg) en dimetilsulfóxido-d6 (100 ± 10 μL) e hidróxido de sodio 6 N (4 μL).
- Durante la preparación del módulo automatizado, bombardee el objetivo del ciclotrón de carbono-11 (1% de oxígeno, 99% de nitrógeno) en un ciclotrón de 11 MeV a 55 μA durante 60-80 min en objetivos de doble haz para producir [11C] dióxido de carbono mediante la reacción nuclear de 14N(p,α) 11C.
- Aproximadamente 20 minutos antes de descargar el dióxido de carbono [11C]del ciclotrón al módulo, inicie la lista de tiempo validada para la síntesis [11C]ER-176 haciendo clic en el botón de inicio . Deje que la columna CH4 se enfríe a 45 oC antes de recibir dióxido de carbono radiactivo [11C] (consulte la Figura 3). Deje que la trampa de columna de carbosfera (trampa CH4 ) se enfríe a -75 oC.
- Que el método incorporado en el módulo para la conversión de dióxido de carbono [11C] en yoduro de metilo [11C], mediante un proceso de química seca, proceda de la siguiente manera:
- Convierte la actividad de dióxido de carbono de [11C] en metano [11C] haciendo reaccionar con gas hidrógeno a 350 oC sobre un catalizador de níquel (Shimalita-Níquel). Use una trampa de ascarita (hidróxido de sodio) para retener el dióxido de carbono [11C] no convertido y el agua formada.
- Atrape el metano formado [11C] en una trampa de columna de carbosfera (trampa CH4 ) a -75 oC para una mayor purificación y concentración. Para liberar el metano atrapado [11C], caliente la columna de carbosfera a 80 oC.
- Hacer reaccionar el metano purificado [11C] con yodo elemental a 720 oC para formar yoduro de metilo [11C] ([11C]CH3I) a través de una bomba de gas de recirculación de helio donde el yoduro de hidrógeno generado por incidente es retenido por otra trampa de ascarita mientras que el metano [11C] no convertido regresa al proceso de circulación.
- Atrape el [11C]CH3I formado a temperatura ambiente en la columna de yoduro de metilo (MeI) que se ha acumulado durante el proceso de recirculación.
- Al final del proceso de circulación, libere el [11C]CH3I recogido de la trampa de MeI calentándolo a 190 oC bajo un flujo de helio (15 mL/min), desviado de la columna de MeTf y guiado a través de una válvula de retención hacia el circuito de acero inoxidable de 1,5 mL que contiene la solución precursora precargada (paso 1.5.1).
- Una vez que el [11C]CH3I haya pasado por el circuito durante 180 s, inyecte la mezcla de reacción en la columna de HPLC de semipreparación para su purificación. Utilice las siguientes condiciones de HPLC: fase móvil de acetonitrilo 37:63 (v/v): hidróxido de amonio de 20 mM a un caudal de 5,0 mL/min y una longitud de onda UV de 235 nm; tiempo de retención (tR) de [11C]ER-176: aproximadamente 12–14 min. Véase la figura 5.
- Recoja la muestra de fracción en un matraz receptor grande que contenga 25 mL de agua desionizada estéril. Cargue la mezcla diluida en un cartucho de extracción ligera en fase sólida (SPE) C18 .
- Lave el producto (1) con 10 mL adicionales de agua desionizada estéril.
- Eluir el producto deseado de la SPE ligera C18 con el uso de etanol de 200 grados (1 mL). Dirija esta elución a un matraz de formulación precargado con cloruro de sodio al 0,9% para inyección (6 mL).
- Enjuague aún más el C18 light SPE con 3 mL adicionales de cloruro de sodio al 0,9% para inyección a través del depósito V4.
- Recoja la solución final en el matraz de formulación (~10 mL) y pásela a través de un filtro esterilizante de 0,22 μm a un vial de vidrio estéril, apirogénico, USP Tipo I de 50 mL preensamblado, sellado con un tabique de goma y engarzado con una tapa de aluminio.
- Con el uso de telemanipuladores, retire una alícuota del vial del producto final como una muestra de control de calidad (QC). Sométase esta muestra a numerosas pruebas de control de calidad para garantizar la conformidad con las especificaciones establecidas antes de su liberación y administración a un paciente (ver Tabla 2).
NOTA: Aplique este procedimiento del método de bucle utilizando [11C]CH3I para el radiomarcaje de (2); generar y utilizar [11C]CH3OTf para producir (3) y (4) (ver Archivo Suplementario 1).- Para seguir el análisis de control de calidad típico realizado en la instalación, utilice telemanipuladores para transferir una muestra del vial del producto final a una jeringa de TB y, a continuación, a la sala de control de calidad utilizando un portador con protección contra el plomo.
- En un área protegida por plomo (bloque L), expulse la muestra a un tubo libre de pirógenos y luego dispense en viales de vidrio más pequeños (50-100 μL) para análisis de HPLC y cromatografía de gases (GC).
- Diluir una segunda muestra con agua libre de pirógenos hasta la concentración adecuada para el análisis de endotoxinas bacterianas.
- Inocular una muestra de la solución del producto final (tanto en caldo de soja tríptico (TSB) como en medio de medio tioglicolato fluido (FTM) como muestra de esterilidad). Incube y observe el crecimiento de estas muestras durante 14 días.
- Aplique una pequeña alícuota a una tira de pH para determinar visualmente la acidez/basicidad de la solución del producto final.
2. Método de recipiente de reacción para el radiomarcaje de [11C]ER-176 (1)
- Asegúrese de que el módulo se limpie a fondo de acuerdo con el protocolo de limpieza interno.
- Utilice 1 N HCl, agua, acetona y acetonitrilo para limpiar la parte de reacción del módulo, y agua seguida de etanol para limpiar y esterilizar la parte de formulación del módulo.
- Acondicione el horno de metano (CH4) a 350 oC durante 20 min con un flujo de gas hidrógeno de 100 mL/min antes de todas las producciones realizadas en el módulo. Deje enfriar a 45 oC antes de continuar.
- Acondicione la trampa CH4 a 120 oC durante 20 min con un flujo de gas helio de 50 mL/min antes de todas las producciones realizadas en el módulo. Deje enfriar a 70 oC antes de continuar.
- Acondicione la trampa MeI a 190 oC durante 20 min con un flujo de gas helio de 50 mL/min antes de todas las producciones. Deje enfriar a 50 oC antes de continuar. Asegúrese de que el tubo V8 esté conectado a la aguja en el recipiente.
- Realice una prueba de fugas utilizando gas helio, desde la válvula receptora (V24 a V16) hasta el bucle MeI interno, y desde V8 hasta el recipiente utilizando V23 como fuente de sellado/escape.
- Carga de reactivos para el módulo:
- Agregue lo siguiente: (R)-N-sec-butil-4-(2-clorofenil)-quinazolina-2-carboxamida (1,0 ± 0,05 mg) en dimetilsulfóxido-d6 (100 ± 10 μL) e hidróxido de sodio 6 N (4 μL) a la vasija del reactor.
- Cargue el depósito V2 con 1,0 mL de acetonitrilo:20 mM de hidróxido de amonio 37:63.
- Cargue el depósito V4 con 3,0 mL de cloruro de sodio al 0,9% para inyección.
- Cargue el depósito V5 con 1.0 mL de etanol de 200 grados.
- Cargue el depósito V6 con 10 mL de agua desionizada estéril.
- Llene el matraz receptor grande con 25 ml de agua desionizada estéril.
- Llene el matraz de formulación con 6,0 mL de cloruro de sodio al 0,9% para inyección.
- Asegúrese de que la línea de suministro esté conectada al vial estéril de producto final preensamblado.
- Llene un depósito con fase móvil de HPLC (acetonitrilo 37:63 (v/v):20 mM) e hidróxido de amonio de HPLC) y conéctelo a la bomba de HPLC.
NOTA: La columna de semi-preparación utilizada es la misma que la anterior y precondicionada con la fase móvil (4 volúmenes de columna).
- Durante la preparación del módulo automatizado, bombardee el objetivo del ciclotrón de carbono-11 (1% de oxígeno, 99% de nitrógeno) en un ciclotrón de 11 MeV a 55 μA durante 60-80 min en objetivos de doble haz para producir [11C] dióxido de carbono mediante la reacción nuclear de 14N(p,α) 11C.
- Aproximadamente 20 minutos antes de descargar el dióxido de carbono [11C]del ciclotrón al módulo, inicie la lista de tiempo validada para la síntesis [11C]ER-176 haciendo clic en el botón de inicio . Deje que la columna CH4 se enfríe a 45 oC antes de recibir dióxido de carbono radiactivo [11C] (consulte la Figura 3). Deje que la trampa de columna de carbosfera (trampa CH4 ) se enfríe a -75 oC
- Que el método incorporado en el módulo para la conversión de dióxido de carbono [11C] en yoduro de metilo [11C], mediante un proceso de química seca, proceda de la siguiente manera:
- Convierte la actividad de dióxido de carbono de [11C] en metano [11C] haciendo reaccionar con gas hidrógeno a 350 oC sobre un catalizador de níquel (Shimalita-Níquel). Retenga tanto el dióxido de carbono [11C] no convertido como el agua formada con una trampa de ascarita (hidróxido de sodio).
- Atrape [11C]metano en una columna de carbósfera a -75 oC para una mayor purificación y concentración. Para liberar el metano [11C], caliente la columna de carbosfera a 80 oC.
- Hacer reaccionar el metano purificado [11C] con yodo elemental a 720 °C para formar yoduro de metilo [11C] a través de una bomba de gas de recirculación donde el hidrógeno generado por incidente es retenido por otra trampa de ascarita mientras que el metano no convertido [11C] regresa al proceso de circulación, llamado recirculación de bucle interno.
- Atrape el yoduro de metilo [11C] formado a temperatura ambiente en la columna de MeI que se ha acumulado durante el proceso de recirculación.
- Al final del proceso de circulación, calentar la trampa de adsorbente polimérico poroso a 190 oC bajo un flujo de helio (30 mL/min) para liberar el yoduro de metilo [11C] recogido y guiarlo a través de una válvula de retención hasta el recipiente de reacción de 3 mL para el radiomarcaje de carbono-11 de (1).
- Una vez que la generación y acumulación de yoduro de metilo [11C] se haya estabilizado, se evita la columna de triflato de plata y se dirige el gas radiactivo a través de V8 hacia el recipiente de reacción que contiene la mezcla precursora. Deje que el yoduro de metilo [11C] burbujee durante 3 minutos, luego selle el recipiente de reacción y caliéntelo a 80 oC durante 5 minutos.
- Una vez finalizado el etiquetado, después de 5 min, enfriar el recipiente de reacción a 30 oC y diluir con 1 mL de fase móvil del depósito V2.
- Inyectar la mezcla en la columna de HPLC semi-prep para su purificación utilizando las siguientes condiciones de HPLC: fase móvil de acetonitrilo 37:63 (v/v): 20 mM de hidróxido de amonio a un caudal de 5,0 mL/min y una longitud de onda UV de 235 nm; tR de [11C]ER-176 (1): aproximadamente 9–11 min, véase la Figura 6.
- Recoja la muestra de fracción en el matraz receptor grande que contiene 25 mL de agua desionizada estéril. Cargue esta mezcla diluida en un cartucho SPE ligero C18 .
- Lave el producto atrapado (1) con 10 mL adicionales de agua desionizada estéril.
- Eluir el producto deseado de la SPE ligera C18 con el uso de etanol de 200 grados (1,0 mL), dirigido a un matraz de formulación precargado con cloruro de sodio al 0,9% para inyección (6,0 mL).
- Enjuague el C18 light SPE con 3,0 mL adicionales de cloruro de sodio al 0,9% para inyección.
- Recoja la solución final en el matraz de formulación (~10 mL). Pase este medio a través de un filtro esterilizante de 0,22 μm a un vial de vidrio estéril, apirogénico, USP Tipo I de 50 ml preensamblado, sellado con un tabique de goma y engarzado con una tapa de aluminio.
- Utilice telemanipuladores para eliminar una alícuota del vial del producto final como muestra de control de calidad (QC) (consulte el paso 1.15). Someter la muestra a varias pruebas en las que el radiotrazador debe superar todos los criterios de aceptación antes de ser liberado y administrado a un paciente (ver Tabla 2).
NOTA: Aplique este método de recipiente de reactor utilizando [11C]CH3I para el radiomarcaje de (2); generar y utilizar [11C]CH3OTf para producir (3) y (4) (ver Archivo Suplementario 1).
Resultados
El grupo de radioquímica de Langone Health (NYULH) de la Universidad de Nueva York proporciona varios radiotrazadores de carbono-11, flúor-18 y galio-68 que se utilizan tanto para la investigación humana como para aplicaciones preclínicas. Se utilizan varios métodos para la producción de los radiotrazadores PET. Nuestro equipo emplea el método de bucle para la síntesis de (1), (2), (3) y (4) (ver Figura 1 y Figura 8). Una vez finalizada la producción, se retira una alícuota del vial estéril del producto final. Esta muestra se utiliza tanto para la inoculación de la solución del producto final (tanto en caldo de soja tríptico (TSB) como en medio de medio tioglicolato fluido (FTM) como muestra de esterilidad), así como una muestra representativa de la solución a granel para las pruebas de control de calidad. Cada radiotrazador se somete a pruebas de control de calidad antes de que el producto se libere para su administración (ver Tabla 2).
Las pruebas de control de calidad incluyen la visualización de la apariencia del producto, la verificación de la integridad del filtro, la determinación de la identidad radionucídica, el pH, la identidad radioquímica (radio-HPLC), la pureza radioquímica (radio-HPLC), la pureza química (HPLC), la actividad molar, la resistencia, el solvente residual, las endotoxinas y la esterilidad (consulte la Tabla 2). Los siguientes resultados se obtuvieron de la producción clínica de cada uno de los radiotrazadores mencionados anteriormente (ver Tabla 1).
Para obtener un cromatograma analítico representativo de HPLC, consulte la Figura 7 y el Archivo complementario 1. Se requiere que cada radiotrazador pase todas las especificaciones de control de calidad (ver Tabla 2) antes de que puedan ser liberados y administrados a un sujeto.
Consulte el Archivo complementario 1 para conocer las cantidades de precursores y reactivos, así como los cromatogramas analíticos de HPLC de [11C]MRB (2) (Figura complementaria 1), [11C]mHED (3) (Figura complementaria 2) y [11C]PiB (4) (Figura complementaria 3).
| Compuesto | Parámetros | Método de bucle (avg ± std) | Método del reactor (promedio ± estándar) |
| [11C]ER-176 | Número de producciones | 25 | 6 |
| Inicio de la síntesis | 86 ± 5.0 GBq | 52 ± 25,7 GBq | |
| Fin de la síntesis | 5,4 ± 2,2 GBq | 1,6 ± 0,5 GBq | |
| Pureza radioquímica | 99,6 ± 0,6% | 99,9 ± 0,1% | |
| Concentración ER-176 | 1,1 ± 0,5 μg/mL | 0,63 ± 0,37 μg/mL | |
| Actividad molar | 194 ± 66 GBq/μmol | 132 ± 78 GBq/μmol | |
| Tiempo total de síntesis | 36 ± 3 minutos | 44 ± 6 min | |
| [11C]MRB | Número de producciones | 70 | 6 |
| Inicio de la síntesis | 84 ± 5,4 GBq | 39 ± 11.9 GBq | |
| Fin de la síntesis | 3.0 ± 1.2 GBq | 1,9 ± 0,7 GBq | |
| Pureza radioquímica | 99,5 ± 0,5% | 99,7 ± 0,8% | |
| Concentración de MRB | 0,52 ± 0,24 μg/mL | 0,68 ± 0,41 μg/mL | |
| Actividad molar | 190 ± 50 GBq/μmol | 99 ± 55 GBq/μmol | |
| Tiempo total de síntesis | 35 ± 3 minutos | 42 ± 3 min | |
| [11C]mHED | Número de producciones | 5 | 11 |
| Inicio de la síntesis | 69 ± 10,5 GBq | 82 ± 4.3 GBq | |
| Fin de la síntesis | 5,5 ± 1,3 GBq | 3.3 ± 1.0 GBq | |
| Pureza radioquímica | 98,2 ± 1,3% | 99,1 ± 0,7% | |
| Concentración de mHED | 0,40 ± 0,10 μg/mL | 0,52 ± 0,37 μg/mL | |
| Actividad molar | 301 ± 48 GBq/μmol | 155 ± 77 GBq/μmol | |
| Tiempo total de síntesis | 27 ± 4 minutos | 32 ± 2 minutos | |
| [11C]PiB | Número de producciones | 51 | 10 |
| Inicio de la síntesis | 86 ± 5,4 GBq | 57 ± 17,2 GBq | |
| Fin de la síntesis | 3,2 ± 0,8 GBq | 1,4 ± 0,2 GBq | |
| Pureza radioquímica | 97.0 ± 1.5% | 99,1 ± 1,4% | |
| Concentración de PiB | 0,22 ± 0,51 μg/mL | 0,30 ± 0,24 μg/mL | |
| Actividad molar | 201 ± 68 GBq/μmol | 207 ± 124 GBq/μmol | |
| Tiempo total de síntesis | 35 ± 2 minutos | 36 ± 5 minutos |
Tabla 1: Resultados de la producción de [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) y [11C]PiB (4) mediante el método de bucle o el método de recipiente de reacción. Todos los valores se informan al final de la síntesis. Abreviaturas: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; [11C]MRB = (S,S)-[11C]metilreboxetina; [11C]mHED = [11C]-metahidroxiefedrina; [11C]PiB = 2-[4-[(11C)metilamino]fenil]-1,3-benzotiazol-6-ol.
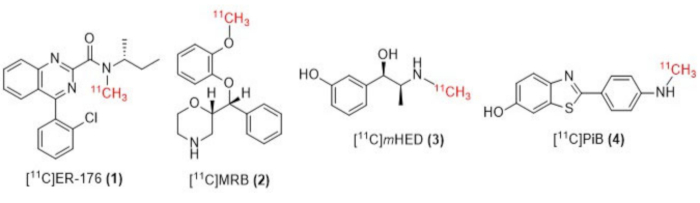
Figura 1: Estructuras de [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) y [11C]PiB (4). Abreviaturas: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; [11C]MRB = (S,S)-[11C]metilreboxetina; [11C]mHED = [11C]-metahidroxiefedrina; [11C]PiB = 2-[4-[(11C)metilamino]fenil]-1,3-benzotiazol-6-ol. Haga clic aquí para ver una versión más grande de esta figura.
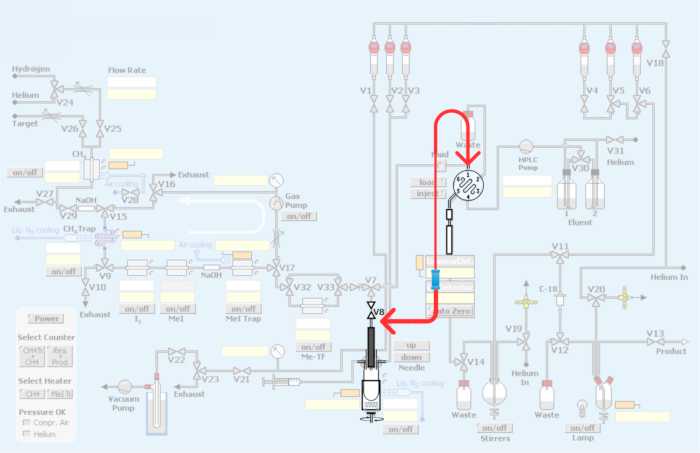
Figura 3: Modificaciones realizadas en el módulo automatizado. En rojo representa la reinstalación del módulo de síntesis para incorporar el bucle para la producción de radiotrazadores PET mediante metilación de carbono-11. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Módulo de fontanería y reinstalación para incorporar el método de bucle para la metilación de carbono-11 de radiotrazadores PET. (A) Bucle de inyección de HPLC con conectores de unión. (B) Método del recipiente de reacción. La flecha roja que muestra la conexión V8. (C) Método de re-plomería por circuito, sin pasar por la vasija del reactor. Tenga en cuenta que la conexión V8 a la entrada de HPLC evita el recipiente de reacción, lo que permite el acceso directo de [11C]yodometano o [11C]triflato de metilo al bucle de HPLC. (D) Ubicación de la unión con respecto a la vasija del reactor. Observe la conexión al bucle de HPLC de acero inoxidable. Haga clic aquí para ver una versión más grande de esta figura.
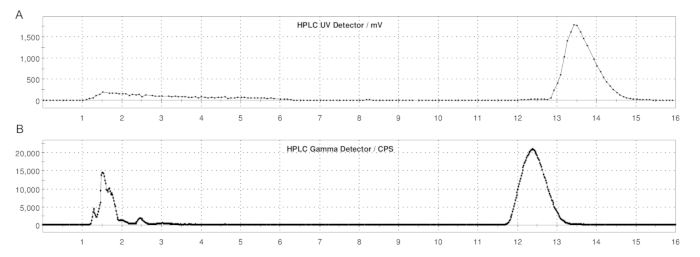
Figura 5: Perfiles de HPLC de semi-preparación de ER-176 y [11C]ER-176 con producción de método de bucle. (A) Perfil de HPLC de semi-preparación para ER-176 (1) mediante producción de método de bucle a UV = 235 nm; tR = 13,2 min. (B) Perfil de radio-HPLC de semipreparación para [11C]ER-176 (1); tR = 12,4 min. Condiciones: fase móvil de acetonitrilo 37:63 (v/v): hidróxido de amonio de 20 mM a un caudal de 5,0 mL/min. Abreviatura: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida. Haga clic aquí para ver una versión más grande de esta figura.
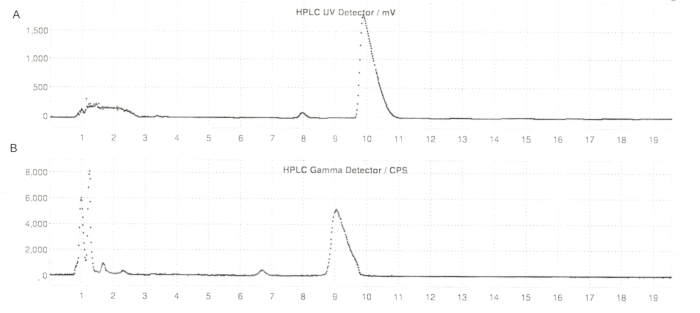
Figura 6: Perfiles de HPLC de semi-preparación de ER-176 y [11C]ER-176 con producción de método de reactor. (A) Perfil de HPLC de semi-preparación para ER-176 (1) mediante la producción del método de reactor a UV = 235 nm; tR = 9.8 min. (B) Perfil de radio-HPLC de semi-preparación para [11C]ER-176 (1); tR = 9,2 min. Condiciones: fase móvil de acetonitrilo 37:63 (v/v): hidróxido de amonio de 20 mM a un caudal de 5,5 mL/min. Abreviaturas: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; tR = tiempo de retención. Haga clic aquí para ver una versión más grande de esta figura.
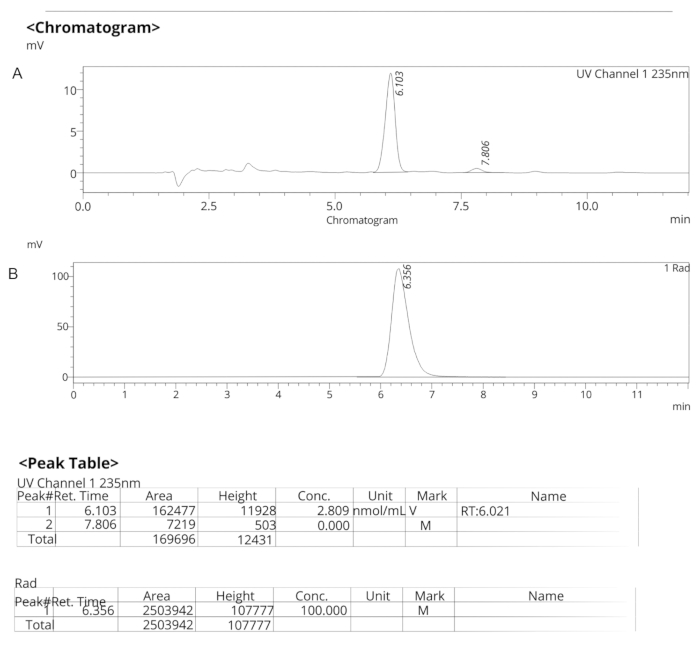
Figura 7: Perfiles analíticos de HPLC para ER-176. (A) Perfil analítico de HPLC de espectros UV para ER-176 (1) a 235 nm; tR = 6.10 min. (B) Perfil analítico de HPLC del radiotrazador para [11C]ER-176 (1); tR = 6.36 min. Condiciones: 10 μm C18 (2) 100  LC Columna 250 x 4,6 mm; metanol/agua 74/26 con un caudal de 1,5 mL/min. Abreviatura: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; tR = tiempo de retención Haga clic aquí para ver una versión más grande de esta figura.
LC Columna 250 x 4,6 mm; metanol/agua 74/26 con un caudal de 1,5 mL/min. Abreviatura: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; tR = tiempo de retención Haga clic aquí para ver una versión más grande de esta figura.
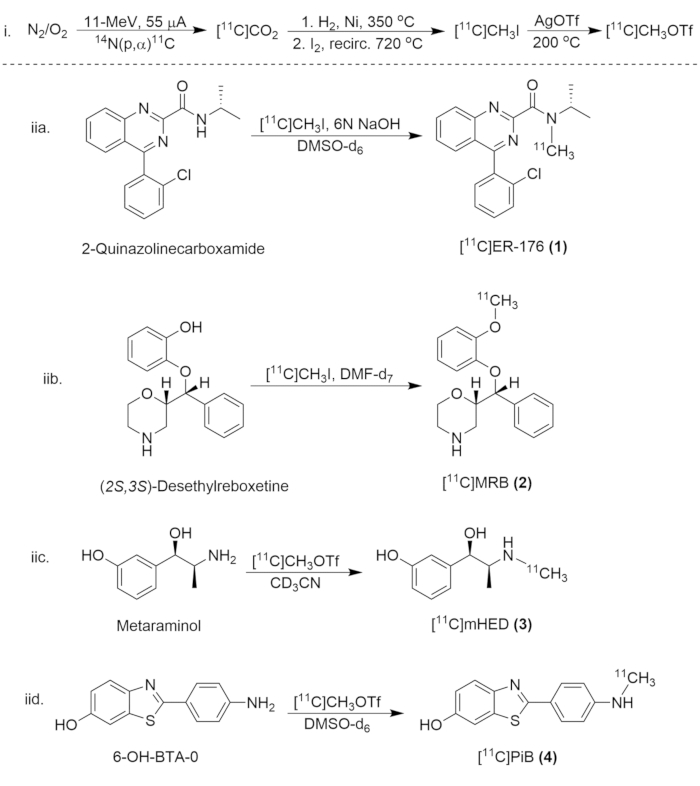
Figura 8: Esquema sintético para la síntesis de compuestos de carbono-11. (i) la formación de [11C]CH3I y [11C]CH3OTf, y (iia.) el radiomarcaje de [11C]ER-176 (1), (iib.) [11C]MRB (2), (iic.)[11C]mHED (3), y (iid.) [11C]PiB (4). Haga clic aquí para ver una versión más grande de esta figura.
| Prueba/Parámetros | Características técnicas |
| Apariencia (inspección visual) | Solución transparente, incolora y libre de partículas |
| Integridad del filtro de membrana | ≥ 50 psi |
| pH | 4.5 - 8.0 |
| Identidad radionúclida (vida media) | 19,3 - 21,3 minutos |
| Identidad radioquímica (radio-HPLC) | 0.90 ≤ tR Prod / t R Std ≤ 1.10 |
| Pureza radioquímica (radio-HPLC) | ≥ 95.0%† |
| Concentración del fármaco (HPLC) | Ver Notas* |
| Impurezas químicas totales (HPLC) | Ver notas** |
| Actividad molar (@ EOS) | > 9,25 GBq/μmol |
| Acetonitrilo residual (GC) | ≤ 410 ppm |
| Acetona residual (GC) | ≤ 5.000 ppm |
| Difetisulfóxido (GC) residual | ≤ 5.000 ppm |
| Etanol residual (GC) | ≤ 10% (v/v) |
| Metanol residual (GC) | ≤ 3.000 ppm |
| N,N-dimetilformamida residual (GC) | ≤ 880 ppm |
| Lisado de amebocitos de Limulus (LAL) | ≤ 17,5 UE/ml |
| Esterilidad (iniciar dentro de las 30 h) | Estéril (14 días) |
| Registros de preparación | Completo y preciso |
| Etiquetas | Completo, preciso, conciliado |
Tabla 2: Criterios de control de calidad para la aprobación o rechazo de radiotrazadores de carbono-11. † Pureza radioquímica ≥ 90,0% para [11C]mHED; * Concentración del fármaco: [11C]ER-176 ≤ 10 μg/dosis; [11C]MRB ≤ 10 μg/dosis; [11C]mHED ≤ 50 μg/dosis; [11C]PiB ≤ 13,4 μg/dosis; ** Impurezas químicas totales: [11C]ER-176 ≤ 1,0 μg/dosis; [11C]MRB ≤ 1,0 μg/dosis; [11C]mHED ≤ 5,0 μg/dosis; [11C]PiB ≤ 1,34 μg/dosis. Abreviaturas: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilquinazolina-2-carboxamida; [11C]MRB = (S,S)-[11C]metilreboxetina; [11C]mHED = [11C]-metahidroxiefedrina; [11C]PiB = 2-[4-[(11C)metilamino]fenil]-1,3-benzotiazol-6-ol; EOS = fin de la síntesis; GC = cromatografía de gases; LAL = Lisado de amebocitos de Limulus.
Legajo Complementario 1: Productos químicos y materiales, reactivos utilizados para el método de bucle o recipiente de reactor, pruebas de control de calidad, cromatogramas analíticos de HPLC. Haga clic aquí para descargar este archivo.
Discusión
El radiomarcaje tradicional de heteroátomos terminales con yodometano de carbono-11 o triflato de metilo implica burbujear el gas electrofílico radiactivo en un recipiente de reacción, atrapándolo y permitiendo que la solución reaccione durante largos períodos de tiempo18. El burbujeo convencional de la reacción heterogénea puede ser lento y puede requerir calentamiento para acelerar la velocidad de reacción. Antes de la purificación, puede ser necesario enfriar el medio de reacción a temperatura ambiente, seguido de la transferencia a un circuito de HPLC con el uso de solvente (por ejemplo, fase móvil) para la purificación del radiotrazador deseado. Estos pasos requieren mucho tiempo y es posible que los productos radioetiquetados fugaces se pierdan durante la transferencia de dichos materiales.
En nuestras instalaciones, hemos demostrado la justificación para utilizar el método de bucle, en el que la solución precursora se recubre con un bucle de acero inoxidable de HPLC y el radiomarcaje del compuesto se lleva a cabo dentro del bucle a temperatura ambiente. El bucle está conectado en línea con la entrega de la vacuna radiactiva [11C]CH3I o [11C]CH3OTf y se conecta al puerto de inyección de un sistema de HPLC. No se requiere calentamiento para que se produzca el radiomarcaje, y para todos los casos mostrados en este manuscrito, la reacción tiene lugar en menos de 3 minutos.
El caudal y el tamaño del bucle de HPLC de acero inoxidable parecen ser críticos para que este proceso funcione de manera eficiente. Las pruebas comenzaron variando el caudal del gas portador, el helio, de 8,0 mL/min a 15,0 mL/min para que el gas radiactivo se entregara al circuito. Buckley estudió la importancia de aplicar el caudal correcto, así como de utilizar el disolvente y el material de bucle adecuados15. Para nuestro sistema, el caudal de 15 mL/min para cualquiera de las especies electrofílicas radiactivas de [11C]CH3I o [11C]CH3OTf funciona bien para el radiomarcaje de los cuatro radiotrazadores discutidos en este manuscrito. El bucle utilizado para todas las síntesis es un bucle de inyección de HPLC de acero inoxidable a 1,5 mL que posee un diámetro exterior de 1/16 de pulgada y un diámetro interior de 1 mm.
Al comparar los dos métodos (recipiente de reacción versus método de bucle), en nuestras manos, el método de bucle demostró una mayor eficiencia de radiomarcaje junto con un aumento sustancial en la actividad molar al final de la síntesis (EOS) para la producción de cuatro radiotrazadores aprobados por la investigación humana. A modo de ejemplo, el radiotrazador [11C]mHED (3) tuvo un aumento de 1,6 veces en la actividad del producto final aislado junto con el doble de la actividad molar en EOS. Esta tendencia de aumento de la actividad general se observa en los cuatro radiotrazadores (véase el Cuadro 1). Los resultados favorables adicionales cuando se utiliza el método de bucle incluyen un tiempo de configuración reducido en 5 minutos y la no necesidad de limpiar el recipiente de reacción, lo que ahorra tiempo al operador y el uso de solventes para un protocolo de limpieza.
Algunos inconvenientes de esta metodología incluyen los límites en los que los radiotrazadores pueden marcarse eficazmente utilizando el método de bucle. Si el calor es necesario para el radiomarcado, es difícil modificar este sistema para permitir el calentamiento dentro del circuito de HPLC. Este sistema requiere modificaciones en la plomería; Esta característica de no tenerlo listo "listo para usar" puede disuadir a otros usuarios de realizar tales alteraciones en su plataforma automatizada14. Dado que se requieren tuberías y uniones suplementarias para este método (consulte la Figura 4A-D), la posibilidad de sitios adicionales para emisiones radiactivas aumenta cuando se etiqueta en estas condiciones. Es prudente realizar una verificación de fugas antes de cada ejecución en el módulo.
Nuestro equipo ha implementado el método de bucle utilizado en la producción de cuatro radiotrazadores de carbono-11 aprobados por la Solicitud de Nuevo Fármaco en Investigación de Medicamentos en Investigación (IND) y el Comité de Investigación de Medicamentos Radiactivos (RDRC). En nuestras manos, este método demostró ser un proceso más eficiente y de mayor rendimiento que el método tradicional de recipientes de reacción. Es necesario tener en cuenta la plomería adicional y los ajustes del caudal del gas helio portador al aplicar este método a la mayoría de los módulos automatizados. Por último, este método tiene limitaciones y no es adecuado para ciertos radiotrazadores de carbono-11, como [11C]UCB-J, que requiere la activación del intermedio de paladio (II) y el calentamiento24 de la mezcla de reacción.
Divulgaciones
Los autores declaran que no tienen intereses relevantes o financieros relacionados con esta investigación para divulgar.
Agradecimientos
Nos gustaría agradecer a los ex miembros del laboratorio de radioquímica de NYULH, Raul Jackson y Grace Yoon, por su trabajo en los esfuerzos iniciales para la metilación del carbono-11 utilizando un método de bucle.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
Referencias
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados