Method Article
Повышение эффективности и выхода радиолигандов углерода-11 для радиолицензирования для клинических исследований с использованием метода петли
В этой статье
Резюме
В настоящем протоколе подробно описана процедура получения четырех радиоиндикаторов углерода-11 с помощью «петлевого метода» [11C]метилирования. Мы описываем процедуру синтеза [11C]ER-176 с данными для трех дополнительных радиоактивных индикаторов: [11C]MRB, [11C]mHED и [11C]PiB. Петлевой метод обеспечивает эффективный синтез с повышенным радиохимическим выходом по сравнению с традиционным реакционным сосудом [11C]метилированием.
Аннотация
Успешная программа позитронно-эмиссионной томографии с использованием радиоиндикаторов углерода-11 требует быстрых, эффективных и надежных методов синтеза, требующих наличия на месте циклотронной и радиохимической группы, а также клинического персонала, обученного работе в условиях уникальных ограничений радионуклида углерода-11. В данном исследовании изучаются достоинства и преимущества «петлевого метода» с использованием растворителя в неразберихе для радиоактивного мечения четырех индикаторов радионуклидом углерода-11, в результате чего образуются радиолиганды [11C]ER-176, [11C]MRB, [11C]mHED и [11C]PiB.
«Петлевый метод» сравнивается с традиционным реакторным методом метилирования углерода-11 в ходе синтеза тех же радиоактивных индикаторов на идентичной автоматизированной платформе. Далее представлен полный обзор подготовки к клиническим исследованиям радиоактивного индикатора [11C]ER-176. Как показал опыт производства [11C]ER-176, «петлевый метод» гетерогенного алкилирования на основе невыпадающего растворителя оказался более эффективным, с отличной радиохимической чистотой (99,6 ± 0,6%, n = 25), более высоким и стабильным радиохимическим выходом (окончание синтеза (EOS) = 5,4 ± 2,2 GBq, n = 25) по сравнению с реакторным методом (EOS = 1,6 ± 0,5 GBq, n = 6), повышенная молярная активность (петлевой метод = 194 ± 66 Гбк/моль, n = 25; реакторный метод = 132 ± 78 Гбк/моль, n = 6), а также в среднем на 5 мин более короткая последовательность реакций.
Введение
Среди методов молекулярной визуализации позитронно-эмиссионная томография (ПЭТ) отличается способом разрешения биохимических процессов, связанных с конкретными физиологическими мишенями или областями интереса 1,2. Характерная чувствительность и неинвазивный характер ПЭТ используются для визуализации in vivo и количественной оценки патофизиологии заболевания, часто выявляя мишени, невидимые с помощью более анатомических методов визуализации, таких как компьютерная томография (КТ)3 или магнитно-резонансная томография (МРТ)4. Современная молекулярная визуализация представляет собой комбинацию ПЭТ с КТ или МРТ (ПЭТ/КТ или ПЭТ/МРТ соответственно), используя высококонтрастное разрешение ПЭТ и количественные параметры визуализации для создания высокоточных карт коррекции затухания (ПЭТ/КТ) и улучшенного пространственного разрешения (ПЭТ/МРТ)5, преодолевая некоторые препятствия, связанные с изменчивостью более высоких кинетических энергий позитронов от радионуклидов, таких как галлий-68 и рубидий-826. Эти методы двухмодальной визуализации передают отличительные черты каждой отдельной модальности, предоставляя клиницистам или исследователям богатство совместно зарегистрированных анатомических и биохимических знанийо предмете исследования.
Клиническая применимость этого метода визуализации обширна, он позволяет визуализировать и измерять физиологические процессы на молекулярном уровне, такие как метаболизм глюкозы 7,8, связывание рецепторов нейротрансмиттеров9, перфузия миокарда10 и различные неврологические состояния11. За пределами клинического использования неотъемлемые свойства ПЭТ играют неотъемлемую роль в диагностике и разработке терапевтических препаратов, позволяя количественно оценить такие параметры, как потенциал связывания (BP), биораспределение, объем распределения (VT) и заполненность рецепторов препарата (RO%) путем непосредственного наблюдения за взаимодействием фармакологии, фармакокинетики и фармакодинамики. Это, в свою очередь, способствует определению, в том числе, достигает ли соединение цели при концентрации эффективной дозы (ЭД50), степени эффективного проникновения через гематоэнцефалический барьер, метаболической целостности соединения, а также соответствующей дозы и интервала дозирования11.
При разработке полезного зонда для ПЭТ-визуализации, после идентификации подходящего биомаркера и выбора связанного с ним лиганда, радиоактивное мечение биомолекулы подходящим радионуклидом ПЭТ позволяет получить радиоиндикаторный зонд для исследования ПЭТ. Среди радионуклидов ПЭТ для исследования биологических, фармакологических или медицинских вопросов углерод-11 сочетает в себе синтетическую универсальность и благоприятные физические характеристики, что позволяет широко использовать его в различных биомолекулах иподходящих лигандах. С 99,8% эмиссии позитронов и периодом полураспада 20,4 минуты12, углерод-11 позволяет многократно вводить препаратам в течение коротких интервалов, обеспечивая при этом многоступенчатый синтез. Однако эти преимущества обуславливают необходимость установки с циклотронными и радиохимическими возможностями на месте5.
Для таких установок требуются надежные, мощные и воспроизводимые методы метилирования, которые позволяют наносить радиоактивное мечение молекулам-предшественникам, часто с помощью электрофильного субстрата [11C]йодметана ([11C]CH3I) или [11C]метилтрифлата ([11C]CH3OTf)13. Модуль радиосинтеза, поставляемый производителем, обычно сконфигурирован для подхода с помощью реакционного сосуда к реакциям [11С]метилирования14. Это включает в себя охлаждение сосуда для эффективного удержания [11С]йодметана или [11С]метилтрифлата при доставке, герметизацию и нагрев сосуда для осуществления реакции, гашение и последующий перенос прореагировавшего содержимого в высокоэффективную систему жидкостной хроматографии (ВЭЖХ) для полупрепаративной очистки13. Несмотря на свою эффективность15, этот метод представляет собой многочисленные потенциальные структурные точки отказа, включающие перегородки флаконов, иглы и связанные с ними передаточные линии.
Потребность в более надежном и воспроизводимом методе метилирования привела к поиску и поиску модификации растворителя для многих наших протоколов синтеза радиолигандов углерода-11. Этот подход направлен на устранение ограничений традиционного метода с использованием реакционных сосудов при сохранении или повышении эффективности радиоактивного мечения.
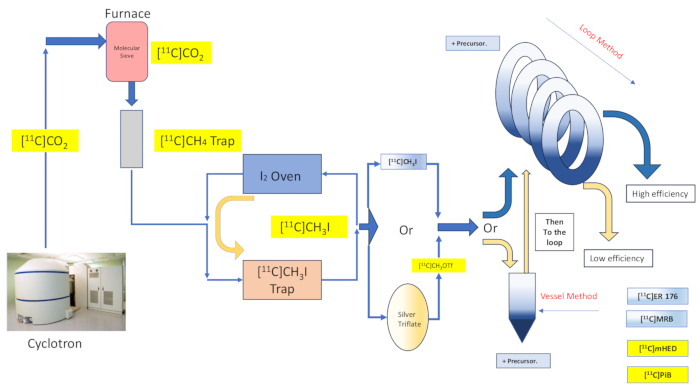
Рисунок 2: Конструкция и протекание метода синтеза и петли в реакционном сосуде. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Химия растворителей в неразберихе обеспечивает эффективное улавливание и реакцию с реагентом, производящим радиоактивное мечение, путем распределения раствора прекурсора по большой площади поддерживающего материала или структуры, а затем направления газообразного реагента для мечения в контакт с материалом с покрытием16,17. Это повышает степень и качество контакта между двумя реагентными фазами16,18. Многочисленные реализации и вариации этого метода были задокументированы еще в 1985 году 16,17,18,19,20, и он нашел применение с [11С]метилйодидом, [11С]метилтрифлатом, а также реактивом Гриньяра [11С]реакциями радиоактивного мечения углекислого газа20. Дальнейшее уточнение было представлено в ходе обсуждения химического состава «петлевого метода» с использованием растворителей в неволе, первоначально описанного Wilson et al., который не требует никаких дополнительных опор к тому, что уже предлагается контуром очистки ВЭЖХ, а также нагрева или охлаждения реакционной среды13. Было обнаружено, что радиоактивное мечение методом «петли» с помощью неволгих растворителей придает реакциям метилирования йодметана и метилтрифлата [11C] с такими преимуществами, как минимальные потери переноса, высокий радиохимический выход, высокая молярная активность, уменьшенное время реакции и простота 7,21,22,23.
В данной работе мы описываем реализацию нашей группой «метода петли» [11С]метилирования, первоначально описанного Уилсоном13, а затем 14,15,18,21,22,23 (см. Рисунок 2) путем механической модификации (см. Рисунок 3) нашего модуля синтеза (далее именуемого Модулем)). Максимально приближенные к стремящемуся духу простоты, эти механические модификации были минимальными и доступными, что привело к общему снижению инженерной сложности, и только добавление основных компонентов к уже установленным производителем модуля в связи с установленной по умолчанию схемой радиоактивного маркировки реакционного сосуда. Это нашло отражение в решении использовать контур очистки ВЭЖХ из нержавеющей стали, уже поставленный и предварительно установленный производителем модуля, как описано ниже, который оказался совместимым и эффективным с рассмотренными синтезами. Мы подробно обсуждаем полный и валидированный протокол петлевого метода радиомечения, используемый в клинических исследованиях для синтеза радиоактивного индикатора [11C]-(R)-N-сек-бутил-4-(2-хлорфенил)-N-метилхиназолина-2-карбоксамида,[11C]ER-176 (1) с использованием йодметана углерода-11. Кроме того, мы сравниваем многочисленные характеристики, связанные с эффективностью радиоактивного мечения, проводимые как реакторным, так и петлевым методом, по трем дополнительным радиолигандам, которые включают (S,S)-[11C]метилребоксетин ([11C]MRB (2)),[11C]-мета-гидроксиефедрин ([11C]mHED (3)) и 2-[4-[[(11C)метиламино]фенил]-1,3-бензотиазол-6-ол ([11C]PiB (4)), что определено по анализу синтезированных партий (см. Таблицу 1 иРисунок 1 ). Это сравнение иллюстрирует явную пользу для таких параметров, как радиохимический выход и молярная активность, связанную с реализацией радиометок «петлевым методом», обеспечиваемым доступными и простыми модификациями модулей с минимальными затратами для радиохимической лаборатории.
протокол
ПРИМЕЧАНИЕ: Все оборудование и синтез выполняются либо в горячих элементах со свинцовым экраном, либо в мини-элементах. ВНИМАНИЕ: Высокоэнергетические частицы, излучающие позитроны, генерируются и используются циклотроном. Территория контролируется с помощью калиброванных счетчиков Гейгера, а люди носят дозиметрические кольца и бейджи, выданные в соответствии с требованиями радиационной безопасности. Весь персонал обучен работе с высокоэнергетическими радиоактивными материалами.
Все синтезы выполняются на чистом и стерилизованном модуле в соответствии с нашими внутренними стандартными операционными процедурами (СОП). Процесс очистки включает использование 1 Н HCl, воды, ацетона и ацетонитрила для реакционной части модуля. Между тем, составная часть модуля очищается и стерилизуется водой и этанолом.
1. Радиоактивное мечение [ 11C]ER-176 (1) методом петли
ПРИМЕЧАНИЕ: Список материалов, использованных при подготовке [11C]ER-176 (1), см. в Таблице материалов.
- Отремонтируйте модуль для создания циклического метода (см. Рисунок 4A-D). Прикрепите клапан V8 к штуцеру, который напрямую подключается к контуру ВЭЖХ. Это позволит обойти реакционный сосуд.
- Подготовьте метановую печь (CH4) при температуре 350 °C в течение 20 мин с потоком газообразного водорода 100 мл/мин перед всеми производственными работами, выполненными на модуле. Остудите до 45 °C перед тем, как продолжить.
- Кондиционируйте ловушку CH4 при температуре 120 °C в течение 20 мин с потоком гелия 50 мл/мин перед всеми работами, выполненными на модуле. Остудите до 70 °C, прежде чем продолжить.
- Кондитивируйте ловушку с йодидом метила при температуре 190 °C в течение 20 мин с потоком гелия 50 мл/мин перед всеми работами, выполненными на модуле. Остудите до 50 °Cперед тем, как продолжить.
- Загрузка реагентов для Модуля:
- С помощью шприца объемом 100 мкл введите следующую смесь через адаптер в положение #1 внутренней петли ВЭЖХ шестилинейного клапана: (R)-N-сек-бутил-4-(2-хлорфенил)-хиназолин-2-карбоксамид (1,0 ± 0,05 мг) в диметилсульфоксиде-d6 (100 ± 10 мкл) и 6 Н гидроксиде натрия (4 мкл).
ПРИМЕЧАНИЕ: Дейтерированные растворители были выбраны из-за их доступности в форме ампул и потому, что они обычно дистиллируются во время производства, что гарантирует отсутствие воды. - Загрузите в резервуар V4 3,0 мл 0,9% хлорида натрия для инъекции.
- Загрузите в резервуар V5 1,0 мл 200-градусного этанола.
- Загрузите в резервуар V6 10 мл стерильной деионизированной воды.
- Наполните большую приемную колбу 25 мл стерильной деионизированной воды.
- Наполните колбу с рецептурой 6,0 мл 0,9% натрия хлорида для инъекций.
- Убедитесь, что линия подачи прикреплена к стерильному предварительно собранному флакону с конечным продуктом.
- Приготовьте подвижную фазу из смеси ацетонитрила и гидроксида аммония 37:63 (v/v).
- Кондиционируйте колонну полуподготовки с четырьмя объемами колонн подвижной фазы.
ПРИМЕЧАНИЕ: Используемая колонна представляет собой колонну с обратной фазой C18 100 мм x 10 мм.
- С помощью шприца объемом 100 мкл введите следующую смесь через адаптер в положение #1 внутренней петли ВЭЖХ шестилинейного клапана: (R)-N-сек-бутил-4-(2-хлорфенил)-хиназолин-2-карбоксамид (1,0 ± 0,05 мг) в диметилсульфоксиде-d6 (100 ± 10 мкл) и 6 Н гидроксиде натрия (4 мкл).
- Во время подготовки автоматизированного модуля бомбардировка циклотронной мишени углерод-11 (1% кислорода, 99% азота) на циклотроне с энергией 11 МэВ при 55 мкА в течение 60–80 мин на двухлучевых мишенях с получением углекислого газа [11C] в результате ядерной реакции 14N(p,α) 11C.
- Примерно за 20 минут до выгрузки [11C]углекислого газа из циклотрона в модуль запустите проверенный список времени для синтеза [11C]ER-176, нажав кнопку «Пуск ». Дайте столбцу CH4 остыть до 45 °C перед приемом радиоактивного [11C]углекислого газа (см. рисунок 3). Дайте конденсатоотводчику карбосферы (ловушка CH4 ) остыть до -75 °C.
- Пусть метод, заложенный в модуле для преобразования [11С]диоксида углерода в [11С]метилйодид, с помощью процесса сухой химии, будет осуществляться следующим образом:
- Преобразуйте активность углекислого газа [11°C] в [11°C]метан путем реакции с газообразным водородом при 350 °С на никелевом катализаторе (шималит-никель). Используйте ловушку для аскаритов (гидроксид натрия) для удержания непреобразованного углекислого газа [11C] и образовавшейся воды.
- Образовавшийся [11С]метан улавливают в ловушке карбосферного столба (ловушка СН4 ) при -75 °С для дальнейшей очистки и концентрирования. Чтобы высвободить захваченный метан [11°C], нагрейте столб карбосферы до 80 °C.
- Реакцию очищенного [11C]метана с элементарным йодом при 720 °C с образованием [11C]метилйодида ([11C]CH3I) с помощью газового насоса рециркуляции гелия, где образующийся случайно образующийся йодид водорода задерживается другой ловушкой для аскаритов, в то время как непреобразованный [11C]метан возвращается в процесс циркуляции.
- Образовавшийся [11C]CH3I при комнатной температуре улавливают в столбце метилйодида (MeI), который накопился в процессе рециркуляции.
- В конце процесса циркуляции собранный [11C]CH3I из ловушки MeI путем нагревания до 190 °C под действием потока гелия (15 мл/мин), минующий колонну MeTf и направленный через обратный клапан в контур из нержавеющей стали объемом 1,5 мл, содержащий предварительно загруженный раствор прекурсора (шаг 1.5.1).
- После того, как [11C]CH3I пройдет через петлю в течение 180 с, введите реакционную смесь в полуподготовительную колонку ВЭЖХ для очистки. Используйте следующие условия ВЭЖХ: подвижная фаза 37:63 (v/v) ацетонитрил: 20 мМ гидроксид аммония при расходе 5,0 мл/мин и длине волны ультрафиолетового излучения 235 нм; время удержания (tR) [11C]ER-176: примерно 12–14 мин. Смотрите Рисунок 5.
- Соберите образец фракции в большую приемную колбу, содержащую 25 мл стерильной деионизированной воды. Загрузите разбавленную смесь в картридж C18 для легкой твердофазной экстракции (SPE).
- Промойте изделие (1) еще 10 мл стерильной деионизированной воды.
- Выведите желаемый продукт из C18 light SPE с помощью 200-градусного этанола (1 мл). Направьте это выведение в колбу с предварительным добавлением 0,9% хлорида натрия для инъекций (6 мл).
- Далее промойте C18 light SPE еще 3 мл 0,9% хлорида натрия для инъекции через резервуар V4.
- Соберите окончательный раствор в колбе с рецептурой (~10 мл) и пропустите через стерилизующий фильтр 0,22 мкм в предварительно собранный стерильный, апирогенный, 50 мл стеклянный флакон USP типа I объемом 50 мл, запечатанный резиновой перегородкой и обжатый алюминиевым колпачком.
- С помощью телеманипуляторов удалите аликвоту из флакона с готовым продуктом в качестве образца для контроля качества (КК). Подвергните этот образец многочисленным тестам контроля качества, чтобы убедиться в соответствии с установленными спецификациями перед выпуском и введением пациенту (см. Таблицу 2).
ПРИМЕЧАНИЕ: Применяют эту процедуру петлевого метода с использованием [11C]CH3I для радиоактивного мечения (2); генерировать и использовать [11C]CH3OTf для создания (3) и (4) (см . Дополнительный файл 1).- Чтобы следовать типичному анализу контроля качества, проводимому на предприятии, используйте телеманипуляторы для переноса образца из флакона с конечным продуктом в шприц для туберкулеза, а затем в комнату контроля качества с помощью носителя, защищенного свинцом.
- В области со свинцовым экраном (L-блок) вытолкните образец в пробирку, не содержащую пирогенов, а затем распределите его по стеклянным флаконам меньшего размера (50–100 мкл) для анализа ВЭЖХ и газовой хроматографии (ГХ).
- Разбавьте второй образец водой, не содержащей пирогенов, до концентрации, подходящей для анализа бактериального эндотоксина.
- Инокулируйте образец раствора конечного продукта (как в триптический соевый бульон (TSB), так и в жидкую тиогликолатную среду (FTM) в качестве образца стерильности). Инкубируйте и наблюдайте за ростом этих образцов в течение 14 дней.
- Нанесите небольшую аликвоту на полоску pH, чтобы визуально определить кислотность/основность конечного раствора продукта.
2. Метод реакционного сосуда для радиоактивного мечения [11C]ER-176 (1)
- Убедитесь, что модуль тщательно очищен в соответствии с внутренним протоколом очистки.
- Используйте 1 Н HCl, воду, ацетон и ацетонитрил для очистки реакционной части модуля и воду, а затем этанол для очистки и стерилизации составной части модуля.
- Подготовьте метановую печь (CH4) при температуре 350 °C в течение 20 мин с потоком газообразного водорода 100 мл/мин перед всеми производственными работами, выполненными на модуле. Остудите до 45 °C перед тем, как продолжить.
- Кондиционируйте ловушку CH4 при температуре 120 °C в течение 20 мин с потоком гелия 50 мл/мин перед всеми работами, выполненными на модуле. Остудите до 70 °C, прежде чем продолжить.
- Перед началом производства конденсатоуловитель MeI кондиционируйте при температуре 190 °C в течение 20 мин с расходом гелия 50 мл/мин. Остудите до 50 °Cперед тем, как продолжить. Убедитесь, что трубка V8 подсоединена к игле в сосуде.
- Проведите испытание на утечку с использованием газообразного гелия из приемного клапана (V24 - V16) во внутренний контур MeI и из V8 в сосуд с использованием V23 в качестве источника уплотнения/выхлопа.
- Загрузка реагентов для Модуля:
- Добавить в корпус реактора (R)-N-сек-бутил-4-(2-хлорфенил)-хиназолин-2-карбоксамид (1,0 ± 0,05 мг) в диметилсульфоксиде-d6 (100 ± 10 мкл) и 6 N гидроксиде натрия (4 мкл).
- Загрузите в резервуар V2 1,0 мл 37:63 ацетонитрила:20 мМ гидроксида аммония.
- Загрузите в резервуар V4 3,0 мл 0,9% хлорида натрия для инъекции.
- Загрузите в резервуар V5 1,0 мл 200-градусного этанола.
- Загрузите в резервуар V6 10 мл стерильной деионизированной воды.
- Наполните большую приемную колбу 25 мл стерильной деионизированной воды.
- Наполните колбу с рецептурой 6,0 мл 0,9% натрия хлорида для инъекций.
- Убедитесь, что линия подачи подключена к предварительно собранной стерильной пробирке с конечным продуктом.
- Заполните резервуар подвижной фазой ВЭЖХ (37:63 (v/v) ацетонитрил:20 мМ гидроксид аммония) и подключите к насосу ВЭЖХ.
ПРИМЕЧАНИЕ: Используемая полуподготовительная колонка такая же, как и выше, и предварительно подготовлена с помощью подвижной фазы (4 объема колонны).
- Во время подготовки автоматизированного модуля бомбардировка циклотронной мишени углерод-11 (1% кислорода, 99% азота) на циклотроне с энергией 11 МэВ при 55 мкА в течение 60–80 мин на двухлучевых мишенях с получением углекислого газа [11C] в результате ядерной реакции 14N(p,α) 11C.
- Примерно за 20 минут до выгрузки [11C]углекислого газа из циклотрона в модуль запустите проверенный список времени для синтеза [11C]ER-176, нажав кнопку «Пуск ». Дайте столбцу CH4 остыть до 45 °C перед приемом радиоактивного [11C]углекислого газа (см. рисунок 3). Дайте конденсатоотводчику с карбосферой (ловушка CH4 ) остыть до -75 °C
- Пусть метод, заложенный в модуле для преобразования [11С]диоксида углерода в [11С]метилйодид, с помощью процесса сухой химии, будет осуществляться следующим образом:
- Преобразуйте активность углекислого газа [11°C] в [11°C]метан путем реакции с газообразным водородом при 350 °С на никелевом катализаторе (шималит-никель). Удерживайте как непреобразованный [11С]углекислый газ, так и образовавшуюся воду с помощью ловушки для аскаритов (гидроксид натрия).
- Захватите метан [11°C] в столбе карбосферы при температуре -75 °C для дальнейшей очистки и концентрации. Чтобы высвободить метан [11°C], нагрейте столб карбосферы до 80 °C.
- Реакцию очищенного [11C]метана с элементарным йодом при 720 °C с образованием [11C]метилйодида с помощью рециркуляционного газового насоса, где образующийся при инциденте водород задерживается другой аскаритовой ловушкой, в то время как непреобразованный [11C]метан возвращается в процесс циркуляции, называемый внутренней петлевой рециркуляцией.
- Захватите образовавшийся [11C]метилйодид при комнатной температуре на колонне MeI, который накопился в процессе рециркуляции.
- В конце процесса циркуляции нагрейте пористую ловушку полимерного адсорбента до 190 °C под действием потока гелия (30 мл/мин) для высвобождения собранного [11C]метилйодида и направьте его через обратный клапан в реакционный сосуд объемом 3 мл для радиоактивного мечения углерода-11 (1).
- После того как образование и накопление [11C]метилйодида стабилизировалось, обойдите колонну трифлатов серебра и направьте радиоактивный газ через V8 в реакционный сосуд, содержащий смесь прекурсоров. Дайте [11C]метилйодиду пузыриться в течение 3 минут, затем закройте реакционный сосуд и нагрейте его при 80 °C в течение 5 минут.
- После завершения мечения, через 5 мин охладите реакционный сосуд до 30 °C и разбавьте 1 мл подвижной фазы из резервуара V2.
- Ввести смесь в полуподготовительную колонну ВЭЖХ для очистки с использованием следующих условий ВЭЖХ: подвижная фаза 37:63 (v/v) ацетонитрил: 20 мМ гидроксид аммония при расходе 5,0 мл/мин и длине волны ультрафиолетового излучения 235 нм; tR от [11C]ER-176 (1): примерно 9–11 мин, см. рисунок 6.
- Соберите образец фракции в большую приемную колбу, содержащую 25 мл стерильной деионизированной воды. Загрузите эту разбавленную смесь на картридж C18 light SPE.
- Промойте попавшее изделие (1) еще 10 мл стерильной деионизированной воды.
- Разбавьте желаемый продукт из C18 light SPE с использованием этанола 200 proof (1,0 мл), направленного в колбу с рецептурой, предварительно загруженную 0,9% хлорида натрия для инъекций (6,0 мл).
- Промойте C18 light SPE еще 3,0 мл 0,9% хлорида натрия для инъекций.
- Наберите окончательный раствор в колбу с рецептурой (~10 мл). Пропустите этот фильтр через стерилизующий фильтр толщиной 0,22 мкм в предварительно собранный стерильный, апирогенный, стеклянный флакон USP типа I объемом 50 мл, запечатанный резиновой перегородкой и обжатый алюминиевым колпачком.
- С помощью телеманипуляторов удалите аликвоту из флакона с конечным продуктом в качестве образца для контроля качества (QC) (см. шаг 1.15). Подвергните образец нескольким испытаниям, в ходе которых радиоактивный индикатор должен соответствовать всем критериям приемлемости, прежде чем он будет введен пациенту (см. Таблицу 2).
ПРИМЕЧАНИЕ: Применяйте данный метод для корпуса реактора с использованием [11C]CH3I для радиоактивного мечения (2); генерировать и использовать [11C]CH3OTf для создания (3) и (4) (см . Дополнительный файл 1).
Результаты
Радиохимическая группа Нью-Йоркского университета Langone Health (NYULH) предлагает различные радиоиндикаторы углерода-11, фтора-18 и галлия-68, используемые как для исследований на людях, так и для доклинических применений. Для производства радиоактивных индикаторов ПЭТ используется несколько методов. Наша команда использует метод цикла для синтеза (1), (2), (3) и (4) (см. Рисунок 1 и Рисунок 8). После завершения производства аликвота удаляется из флакона со стерильным конечным продуктом. Этот образец используется как для модифицирования раствора конечного продукта (как в триптическом соевом бульоне (TSB), так и в жидкой среде тиогликолят (FTM) в качестве образца стерильности), а также в качестве репрезентативного образца сыпучего раствора для испытаний контроля качества. Каждый радиоактивный индикатор подвергается тестам контроля качества перед выпуском продукта для введения (см. Таблицу 2).
Контроль качества включает в себя визуализацию внешнего вида продукта, проверку целостности фильтра, определение радионуклидной идентичности, pH, радиохимической идентичности (радио-ВЭЖХ), радиохимической чистоты (радио-ВЭЖХ), химической чистоты (ВЭЖХ), молярной активности, прочности, остаточного растворителя, эндотоксинов и стерильности (см. таблицу 2). При клиническом производстве каждого из вышеупомянутых радиоактивных индикаторов были получены следующие результаты (см. табл. 1).
Репрезентативную аналитическую хроматограмму ВЭЖХ см. на рисунке 7 и в дополнительном файле 1. Каждый радиоиндикатор должен пройти все спецификации контроля качества (см. Таблицу 2), прежде чем его можно будет выпустить и ввести субъекту.
Количество прекурсора и реагентов, а также аналитические хроматограммы ВЭЖХ [11C]MRB (2) (Дополнительный рисунок 1), [11C]mHED (3) (Дополнительный рисунок 2) и [11C]PiB (4) (Дополнительный рисунок 3) см. в Дополнительном файле 1.
| Соединение | Параметры | Метод цикла (avg ± std) | Реакторный метод (средний ± стандартный) |
| [11С]ЭР-176 | Количество постановок | 25 | 6 |
| Начало синтеза | 86 ± 5,0 ГБк | 52 ± 25,7 ГБк | |
| Окончание синтеза | 5,4 ± 2,2 ГБк | 1,6 ± 0,5 ГБк | |
| Радиохимическая чистота | 99,6 ± 0,6% | 99,9 ± 0,1% | |
| Концентрация ЭР-176 | 1,1 ± 0,5 г/мл | 0,63 ± 0,37 мкг/мл | |
| Молярная активность | 194 ± 66 ГБк/моль | 132 ± 78 ГБк/моль | |
| Общее время синтеза | 36 ± 3 мин | 44 ± 6 мин | |
| [11С]МРБ | Количество постановок | 70 | 6 |
| Начало синтеза | 84 ± 5,4 ГБк | 39 ± 11,9 ГБк | |
| Окончание синтеза | 3,0 ± 1,2 ГБк | 1,9 ± 0,7 ГБк | |
| Радиохимическая чистота | 99,5 ± 0,5% | 99,7 ± 0,8% | |
| Концентрация MRB | 0,52 ± 0,24 мкг/мл | 0,68 ± 0,41 мкг/мл | |
| Молярная активность | 190 ± 50 ГБк/моль | 99 ± 55 ГБк/μмоль | |
| Общее время синтеза | 35 ± 3 мин | 42 ± 3 мин | |
| [11C]mHED | Количество постановок | 5 | 11 |
| Начало синтеза | 69 ± 10,5 ГБк | 82 ± 4,3 ГБк | |
| Окончание синтеза | 5,5 ± 1,3 ГБк | 3,3 ± 1,0 ГБк | |
| Радиохимическая чистота | 98,2 ± 1,3% | 99,1 ± 0,7% | |
| Концентрация mHED | 0,40 ± 0,10 мкг/мл | 0,52 ± 0,37 мкг/мл | |
| Молярная активность | 301 ± 48 ГБк/моль | 155 ± 77 ГБк/μмоль | |
| Общее время синтеза | 27 ± 4 мин | 32 ± 2 мин | |
| [11С]ПиБ | Количество постановок | 51 | 10 |
| Начало синтеза | 86 ± 5,4 ГБк | 57 ± 17,2 ГБк | |
| Окончание синтеза | 3,2 ± 0,8 ГБк | 1,4 ± 0,2 ГБк | |
| Радиохимическая чистота | 97,0 ± 1,5% | 99,1 ± 1,4% | |
| Концентрация ПиБ | 0,22 ± 0,51 мкг/мл | 0,30 ± 0,24 мкг/мл | |
| Молярная активность | 201 ± 68 ГБк/моль | 207 ± 124 ГБк/моль | |
| Общее время синтеза | 35 ± 2 мин | 36 ± 5 мин |
Таблица 1: Результаты производства [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) и [11C]PiB (4) методом петли или методом реакционного сосуда. Все значения сообщаются в конце синтеза. Сокращения: [11C]ER-176 = [11C]-(R)-N-сек-бутил-4-(2-хлорфенил)-N-метилхиназолин-2-карбоксамид; [11С]MRB = (S,S)-[11C]метилребоксетин; [11С]мHED = [11C]-мета-гидроксиефедрин; [11С]PiB = 2-[4-[(11С)метиламино]фенил]-1,3-бензотиазол-6-ол.
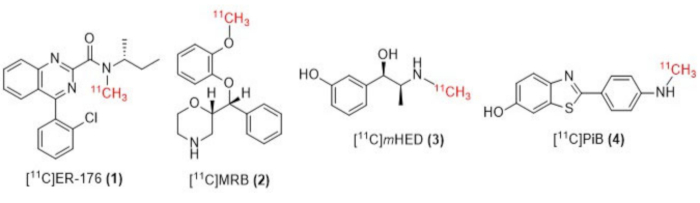
Рисунок 1: Конструкции [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) и [11C]PiB (4). Сокращения: [11C]ER-176 = [11C]-(R)-N-сек-бутил-4-(2-хлорфенил)-N-метилхиназолин-2-карбоксамид; [11С]MRB = (S,S)-[11C]метилребоксетин; [11С]мHED = [11C]-мета-гидроксиефедрин; [11С]PiB = 2-[4-[(11С)метиламино]фенил]-1,3-бензотиазол-6-ол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
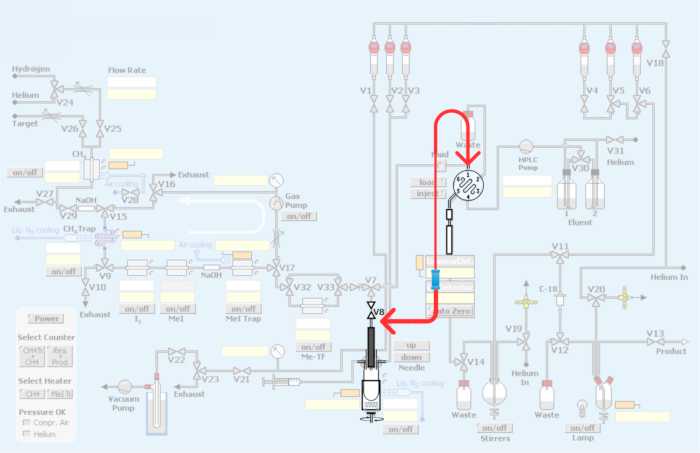
Рисунок 3: Изменения, внесенные в автоматизированный модуль. Красным цветом обозначена замена модуля синтеза для включения контура для производства радиоиндикаторов ПЭТ путем метилирования углерода-11. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Модульная облицовка и замена водопровода с использованием метода петли для метилирования углерода-11 радиоиндикаторов ПЭТ. (A) Петля впрыска ВЭЖХ с соединительными разъемами. (В) Метод реакционного сосуда. Красная стрелка, показывающая подключение V8. (В) Петлевый метод переоборудования в обход корпуса реактора. Обратите внимание, что соединение V8 с входом ВЭЖХ обходит реакционный сосуд, обеспечивая прямой доступ [11C]йодметана или [11C]метилтрифлата к контуру ВЭЖХ. (D) Размещение соединения по отношению к корпусу реактора. Обратите внимание на подключение к контуру ВЭЖХ из нержавеющей стали. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
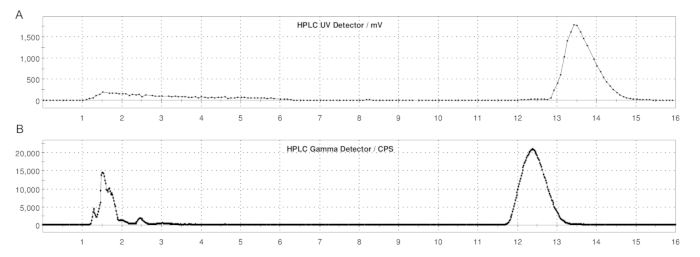
Рисунок 5: Полуподготовительные профили ВЭЖХ ER-176 и [11C]ER-176 с использованием петлевого метода. (A) Полуподготовительный профиль ВЭЖХ для ER-176 (1) методом петлевого производства при UV = 235 нм; tR = 13,2 мин. (B) Полуподготовительный профиль радио-ВЭЖХ для [11C]ER-176 (1); tR = 12,4 мин. Условия: подвижная фаза 37:63 (v/v) ацетонитрил: 20 мМ гидроксид аммония при расходе 5,0 мл/мин. Сокращение: [11C]ER-176 = [11C]-(R)-N-сек-бутил-4-(2-хлорфенил)-N-метилхиназолин-2-карбоксамид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
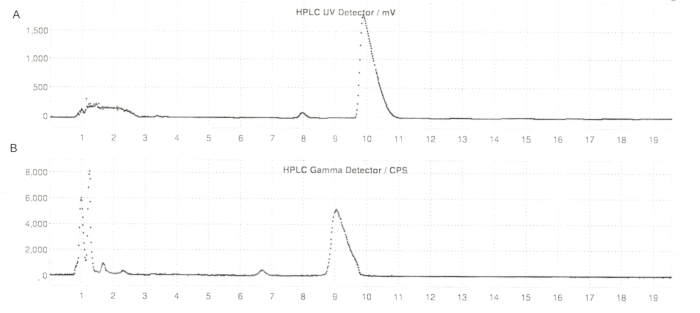
Иллюстрация 6: Полуподготовительные профили ВЭЖХ ER-176 и [11C]ER-176 с реакторным способом. (A) Полуподготовительный профиль ВЭЖХ для ER-176 (1) методом реакторного производства при UV = 235 нм; tR = 9,8 мин. (B) Полуподготовительный профиль радио-ВЭЖХ для [11C]ER-176 (1); tR = 9,2 мин. Условия: подвижная фаза 37:63 (v/v) ацетонитрил: 20 мМ гидроксид аммония при расходе 5,5 мл/мин. Сокращения: [11C]ER-176 = [11C]-(R)-N-сек-бутил-4-(2-хлорфенил)-N-метилхиназолин-2-карбоксамид; tR = время хранения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
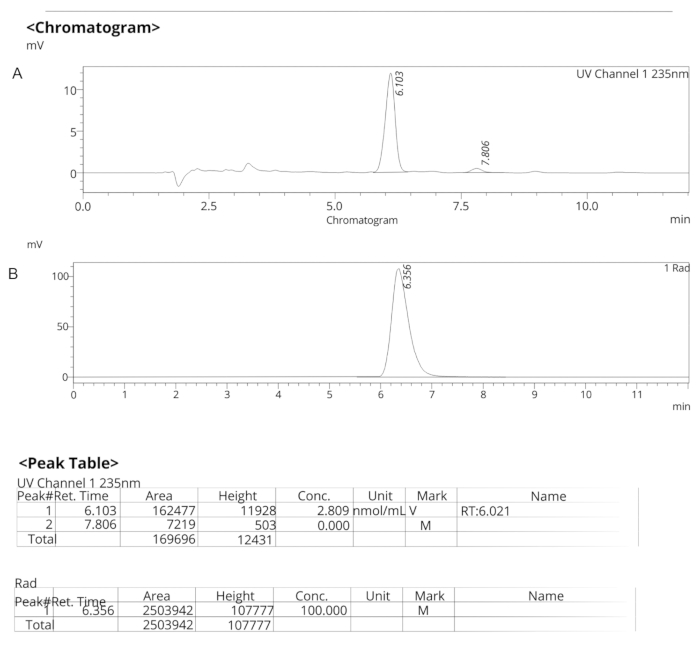
Рисунок 7: Аналитические профили ВЭЖХ для ER-176. (A) Аналитический профиль ВЭЖХ УФ-спектров для ER-176 (1) на длине волны 235 нм; tR = 6,10 мин. (B) Аналитический профиль ВЭЖХ радиоактивного индикатора для [11C]ER-176 (1); tR = 6,36 мин. Условия: 10 мкм C18 (2) 100  LC Колонка 250 x 4,6 мм; метанол/вода 74/26 с расходом 1,5 мл/мин. Сокращение: [11C]ER-176 = [11C]-(R)-N-сек-бутил-4-(2-хлорфенил)-N-метилхиназолин-2-карбоксамид; tR = время удержания Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
LC Колонка 250 x 4,6 мм; метанол/вода 74/26 с расходом 1,5 мл/мин. Сокращение: [11C]ER-176 = [11C]-(R)-N-сек-бутил-4-(2-хлорфенил)-N-метилхиназолин-2-карбоксамид; tR = время удержания Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
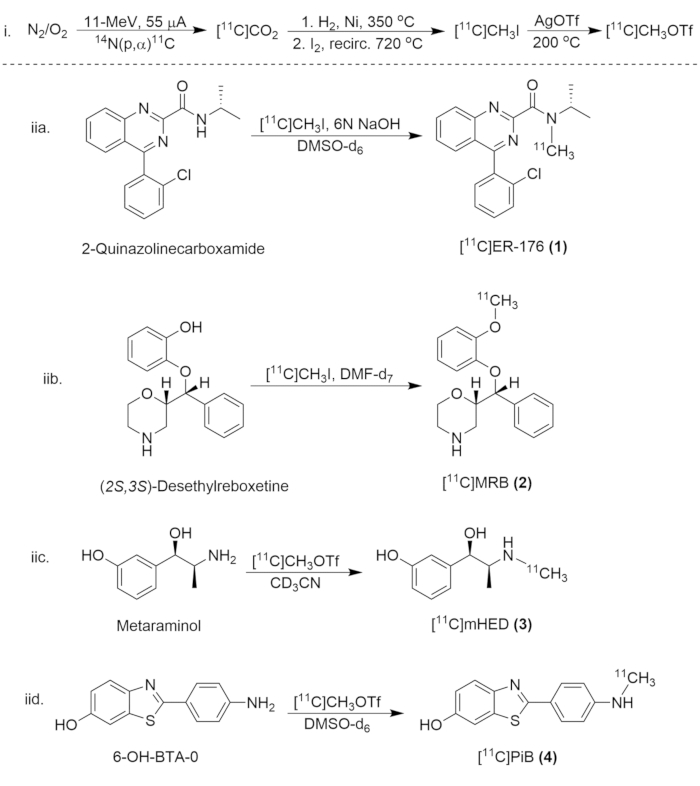
Рисунок 8: Синтетическая схема синтеза соединений углерода-11. (i) образование [11C]CH3I и [11C]CH3OTf, и (iia.) радиоактивное мечение [11C]ER-176 (1), (iib.) [11С]MRB (2), (iic.)[11С]мHED (3) и (там же) [11С]ПиБ (4). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Тест/Параметры | Спецификации |
| Внешний вид (визуальный осмотр) | Прозрачный, бесцветный раствор без твердых частиц |
| Целостность мембранного фильтра | ≥ 50 фунтов/кв. дюйм |
| pH | 4.5 - 8.0 |
| Радионуклидная идентичность (период полураспада) | 19,3 - 21,3 мин |
| Радиохимическая идентификация (радио-ВЭЖХ) | 0,90 ≤ тР Прод / т Р Стд ≤ 1,10 |
| Радиохимическая чистота (радио-ВЭЖХ) | ≥ 95,0%† |
| Концентрация лекарственных средств (ВЭЖХ) | Смотрите примечания* |
| Общее количество химических примесей (ВЭЖХ) | Смотрите примечания** |
| Молярная активность (@ EOS) | > 9,25 ГБк/моль |
| Остаточный ацетонитрил (ГК) | ≤ 410 ppm |
| Остаточный ацетон (ГХ) | ≤ 5 000 ppm |
| Остаточный диметилсульфоксид (ГХ) | ≤ 5 000 ppm |
| Остаточный этанол (ГХ) | ≤ 10% (v/v) |
| Остаточный метанол (GC) | ≤ 3 000 ppm |
| Остаточный N,N-диметилформамид (ГХ) | ≤ 880 ppm |
| Лизат амебоцитов лимулюса (LAL) | ≤ 17,5 EU/мл |
| Стерильность (начало в течение 30 ч) | Стерильный (14 дней) |
| Записи о подготовке | Полный и точный |
| Метки | Полный, точный, согласованный |
Таблица 2: Критерии контроля качества для утверждения или отклонения радиоактивных индикаторов углерода-11. † Радиохимическая чистота ≥ 90,0% для [11C]mHED; * Концентрация препарата: [11C]ER-176 ≤ 10 мкг/доза; [11С]MRB ≤ 10 мкг/доза; [11С]мHED ≤ 50 мкг/доза; [11С]PiB ≤ 13,4 мкг/доза; ** Общее количество химических примесей: [11C]ER-176 ≤ 1,0 мкг/доза; [11С]MRB ≤ 1,0 мкг/доза; [11С]мHED ≤ 5,0 мкг/доза; [11С]ПиВ ≤ 1,34 мкг/доза. Сокращения: [11C]ER-176 = [11C]-(R)-N-сек-бутил-4-(2-хлорфенил)-N-метилхиназолин-2-карбоксамид; [11С]MRB = (S,S)-[11C]метилребоксетин; [11С]мHED = [11C]-мета-гидроксиефедрин; [11С]PiB = 2-[4-[(11С)метиламино]фенил]-1,3-бензотиазол-6-ол; EOS = окончание синтеза; GC = газовая хроматография; LAL = лизат амебоцитов Limulus.
Дополнительный файл 1: Химикаты и материалы, реагенты, используемые для контурного или корпусного метода, испытания контроля качества, аналитические хроматограммы ВЭЖХ. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Традиционное радиоактивное мечение концевых гетероатомов йодметаном углерода-11 или метилтрифлатом включает в себя барботирование радиоактивного электрофильного газа в реакционном сосуде, его захват и предоставление раствору возможности вступать в реакцию в течение длительных периодоввремени. Обычное барботирование гетерогенной реакции может быть вялым и может потребовать нагрева для ускорения скорости реакции. Перед очисткой может потребоваться охлаждение реакционной среды до комнатной температуры с последующим переводом в контур ВЭЖХ с использованием растворителя (например, подвижной фазы) для очистки желаемого радиоактивного индикатора. Эти шаги отнимают много времени, и во время транспортировки таких материалов могут быть утеряны мимолетные продукты с радиоактивной маркировкой.
На нашем предприятии мы продемонстрировали обоснованность использования петлевого метода, при котором раствор прекурсора покрывается на петлю из нержавеющей стали ВЭЖХ, а радиоактивное мечение соединения происходит внутри петли при комнатной температуре. Петля связана с подачей радиоактивного [11C]CH3I или [11C]CH3OTf и подключается к порту впрыска системы ВЭЖХ. Для нанесения радиоактивного мечения не требуется нагревания, и во всех случаях, описанных в данной рукописи, реакция протекает менее чем за 3 минуты.
Расход и размер контура ВЭЖХ из нержавеющей стали, по-видимому, имеют решающее значение для эффективной работы этого процесса. Тестирование началось с изменения расхода газа-носителя, гелия, от 8,0 мл/мин до 15,0 мл/мин для радиоактивного газа, доставляемого в контур. Бакли изучил важность применения правильной скорости потока, а также использования соответствующего растворителя и материала петли15. Для нашей системы скорость потока 15 мл/мин для радиоактивных электрофильных форм [11C]CH3I или [11C]CH3OTf хорошо подходит для радиоактивного мечения всех четырех радиоактивных индикаторов, обсуждаемых в данной рукописи. Петля, используемая для всех синтезов, представляет собой петлю впрыска ВЭЖХ из нержавеющей стали объемом 1,5 мл, с наружным диаметром 1/16 дюйма и внутренним диаметром 1 мм.
Сравнивая эти два метода (метод реакционного сосуда и метод петли), мы обнаружили, что метод петли продемонстрировал повышенную эффективность радиоактивного мечения наряду со значительным увеличением молярной активности в конце синтеза (EOS) для производства четырех радиоиндикаторов, одобренных исследованиями на людях. Например, радиоиндикатор [11C]mHED (3) имел 1,6-кратное увеличение активности изолированного конечного продукта при одновременном достижении двукратной молярной активности в EOS. Эта тенденция к увеличению общей активности наблюдается по всем четырем радиоиндикаторам (см. таблицу 1). К дополнительным благоприятным результатам при использовании контурного метода можно отнести сокращение времени наладки на 5 минут и отсутствие необходимости в очистке реакционного сосуда, экономию времени оператора и использование растворителей для протокола очистки.
К некоторым недостаткам этой методологии относятся пределы, на которых радиоиндикаторы могут быть эффективно мечены с помощью метода петли. Если для радиоактивного мечения требуется нагрев, то трудно модифицировать эту систему для обеспечения нагрева внутри контура ВЭЖХ. Эта система требует модификации сантехники; Эта функция, заключающаяся в том, что она не готова «из коробки», может отпугнуть других пользователей от внесения таких изменений в их автоматизированную платформу14. Поскольку для этого метода требуется дополнительная сантехника и соединения (см. рисунок 4A-D), вероятность появления дополнительных участков для радиоактивных выбросов увеличивается при маркировке в этих условиях. Целесообразно выполнять проверку на герметичность перед каждым запуском модуля.
Наша команда внедрила метод петли, используемый при производстве четырех радиоиндикаторов углерода-11, одобренном Комитетом по исследованию новых лекарственных препаратов (IND) и Комитетом по исследованию радиоактивных лекарств (RDRC). В наших руках этот метод оказался более эффективным и высокопроизводительным процессом, чем традиционный метод реакционных сосудов. При применении этого метода к большинству автоматизированных модулей необходимо учитывать дополнительные настройки и корректировки расхода газообразного гелия-носителя. Наконец, этот метод имеет ограничения и не подходит для некоторых радиоактивных индикаторов углерода-11, таких как [11C]UCB-J, для которого требуется активация промежуточного продукта палладия (II) и нагревание24 реакционной смеси.
Раскрытие информации
Авторы заявляют, что у них нет соответствующих или финансовых интересов, связанных с этим исследованием, которые они могли бы раскрывать.
Благодарности
Мы хотели бы выразить признательность бывшим сотрудникам лаборатории радиохимии NYULH Раулю Джексону и Грейс Юн за их работу по первоначальным усилиям по метилированию углерода-11 с использованием петлевого метода.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
Ссылки
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены