Method Article
Enhancing Efficiency and Radiolabeling Yields of Carbon-11 Radioligands for clinical research with the loop method(루프 방법을 사용한 임상 연구를 위한 탄소-11 방사성 리간드의 효율성 및 방사성 표지 수율 향상)
요약
이 프로토콜은 "루프 방법"[11C]메틸화를 통해 4개의 탄소-11 방사성 추적자를 준비하는 자세한 절차를 제시합니다. [11C]ER-176을 3개의 추가 방사성 추적자([11C]MRB, [11C]mHED 및 [11C]PiB)에 대한 데이터와 함께 합성하는 절차를 설명합니다. 루프 방법은 전통적인 반응 용기 [11C] 메틸화에 대한 증가된 방사성 화학적 수율로 효율적인 합성을 제공합니다.
초록
탄소-11 방사성 추적자를 이용한 성공적인 양전자 방출 단층 촬영 이미징 프로그램은 빠르고 효율적이며 신뢰할 수 있는 합성 방법을 필요로 하며, 현장 사이클로트론 및 방사성 화학 그룹뿐만 아니라 탄소-11 방사성 핵종의 고유한 제약 조건 하에서 작동하도록 훈련된 임상 직원이 필요합니다. 이 연구는 탄소-11 방사성 핵종으로 4개의 추적자를 방사성 표지하는 캡티브 용매 '루프 방법'의 장점과 장점을 조사하여 방사성 리간드 [11C]ER-176, [11C]MRB, [11C]m HED 및 [11C]PiB를 생성합니다.
'루프 방법'은 동일한 자동화 플랫폼에서 동일한 방사성 추적자를 합성하는 과정에서 기존의 원자로 기반 탄소-11 메틸화 방법과 비교됩니다. 또한, [11C]ER-176 방사성 추적자의 임상 연구 준비에 대한 완전한 개요가 제시됩니다. [11C]ER-176의 생산에서 입증된 바와 같이, 이종 알킬화의 캡티브 용매 '루프 방법'은 반응기 방법(EOS = 1.6 ± 0.5 GBq, n = 6)에 비해 우수한 방사성 화학적 순도(99.6 ± 0.6%, n = 25), 더 높고 일관된 방사성 화학적 수율(합성 종료 (EOS) = 5.4 ± 2.2 GBq, n = 25)으로 더 효율적인 것으로 입증되었습니다. 평균 5분 더 짧은 반응 시퀀스와 함께 몰 활성이 증가하고(루프 방법 = 194 ± 66 GBq/μmol, n = 25; 반응기 방법 = 132 ± 78 GBq/μmol, n = 6).
서문
분자 이미징의 양식 중 양전자 방출 단층 촬영(PET)은 특정 생리학적 표적 또는 관심 영역과 관련된 생화학적 과정의 해상도 방식이 구별됩니다 1,2. PET의 특징적인 민감도와 비침습적 특성은 질병 병태생리학의 생체 내 시각화 및 정량화에 활용되며, 컴퓨터 단층 촬영(CT)3 또는 자기 공명 영상(MRI)4과 같은 해부학적 영상 기술로는 보이지 않는 표적을 드러내는 경우가 많습니다. 현대 분자 이미징은 PET와 CT 또는 MRI(PET/CT 또는 PET/MR)의 결합을 보고 PET의 고대비 해상도 및 정량화 가능한 이미징 매개변수를 활용하여 매우 정확한 감쇠 보정 맵(PET/CT) 및 향상된 공간 해상도(PET/MR)5를 제공하여 갈륨-68 및 루비듐-82와 같은 방사성 핵종에서 양전자의 더 높은 운동 에너지의 변동성으로 인해 제시되는 몇 가지 장애물을 극복합니다6. 이러한 이중 양식 이미징 기술은 각 개별 양식의 특징적인 특성을 전달하여 임상의나 연구자에게 연구 대상에 대한 풍부한 해부학적 및 생화학적 통찰력을 제공한다5.
이 영상 기법의 임상적 적용 가능성은 방대하며, 포도당 대사7,8, 신경전달물질 수용체 결합9, 심근 관류10 및 다양한 신경학적 상태11와 같은 다양한 분자 수준의 생리학적 과정을 시각화하고 측정할 수 있습니다. 임상적 사용 외에도 PET의 고유한 특성은 진단 및 치료 약물 개발에 필수적인 역할을 하도록 조정되어 약리학, 약동학 및 약력학의 상호 작용을 직접 관찰하여 결합 전위(BP), 생체 분포, 분포 부피(VT) 및 약물 수용체 점유율(RO%)과 같은 매개변수를 정량화할 수 있습니다. 이는 차례로 화합물이 유효 용량(ED50) 농도에서 목표에 도달하는지 여부, 혈액-뇌 장벽의 효과적인 침투 정도, 화합물의 대사 무결성, 적절한 용량 및 투여 간격(11)을 포함한 결정에 기여한다.
PET 이미징에 유용한 프로브를 개발할 때 적절한 바이오마커를 식별하고 관련 리간드를 선택한 후 적절한 PET 방사성 핵종으로 생체 분자를 방사성 라벨링하면 PET 연구를 위한 방사성 추적자 프로브가 생성됩니다. 생물학적, 약리학적 또는 의학적 문제를 조사하기 위한 PET 방사성 핵종 중 탄소-11은 다양한 생체 분자 및 적격 리간드에 걸쳐 널리 사용될 수 있는 합성적 다양성과 유리한 물리적 특성의 조합을 제공합니다6. 99.8%의 양전자 방출과 20.4분의 반감기12를 가진 탄소-11은 짧은 간격 내에 피험자에게 반복적인 투여를 허용하면서도 다단계 합성을 허용한다. 그러나 이러한 장점으로 인해 현장 사이클로트론 및 방사화학 기능을 갖춘 시설이 필요합니다5.
이러한 설비는 종종 친전자성 [11C] 요오도메탄 ([11C] CH3I) 또는 [11C] 메틸 트리플레이트 ([11C] CH3OTf) 기질13을 사용하여 전구체 분자의 방사선 표지를 가능하게하는 신뢰할 수 있고 강력하며 재현 가능한 메틸화 방법을 필요로합니다. 제조업체로부터 공급되는 방사성 합성 모듈은 전형적으로 [11C]메틸화 반응14에 대한 반응 용기 접근법을 위해 구성된다. 여기에는 배송 시 효과적인 [11C]요오도메탄 또는 [11C]메틸 트리플레이트 보유를 위해 용기를 냉각하고, 반응을 일으키기 위해 용기를 밀봉 및 가열하고, 담금질한 다음 반응된 내용물을 반분취 정제를 위한 고성능 액체 크로마토그래피(HPLC) 시스템으로 옮기는 것이 포함됩니다13. 이 기술은 효과적이지만(15), 바이알 격막, 바늘 및 관련 전달 라인과 관련된 수많은 잠재적인 구조적 실패 지점을 제시합니다.
보다 신뢰할 수 있고 재현 가능한 메틸화 방법에 대한 필요성으로 인해 많은 탄소-11 방사성 리간드 합성 프로토콜에 대한 캡티브 용매 변형에 대한 조사와 추구가 이루어졌습니다. 이 접근법은 기존 반응 용기 방법의 한계를 해결하는 동시에 방사성 표지 효율성을 유지하거나 개선하는 것을 목표로 합니다.
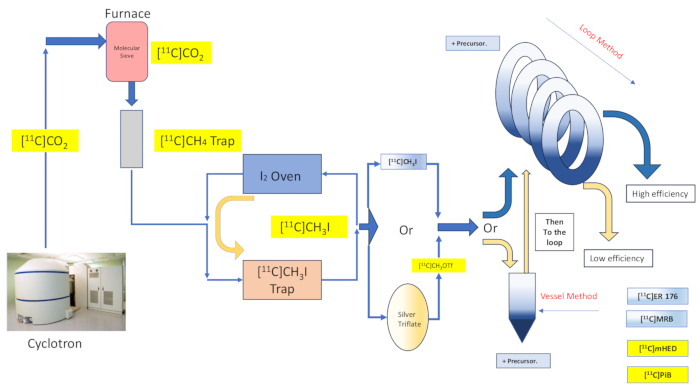
그림 2: 반응 용기 synthesis 및 loop method의 설계 및 흐름. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
캡티브 용매 화학은 전구체 용액을 지지 물질 또는 구조의 넓은 영역에 걸쳐 살포한 다음 기체 라벨링 시약을 코팅된 물질(16,17)과 접촉하도록 유도함으로써 방사성 표지 시약의 효율적인 포획 및 반응에 대한 약속을 제공합니다. 이는 두 반응물 상(16,18) 사이의 접촉 범위 및 품질을 향상시킵니다. 이 기법의 수많은 구현 및 변형은 1985 16,17,18,19,20 일찍이 문서화되었으며, [11 C] 메틸 요오드화물, [11C] 메틸 트리플레이트, 그리나드 시약 [11C] 이산화탄소 방사성 표지 반응 20. Wilson et al.이 원래 설명한 캡티브 용매 "루프 방법" 화학에 대한 논의에 의해 추가적인 개선이 이루어졌으며, 이는 HPLC 정제 루프에서 이미 제공하는 것에 대한 추가 지원이나 반응 환경의 가열 또는 냉각을 필요로 하지 않습니다13. Captive Solvent "loop method" 방사성 표지는 요오드메탄 및 메틸 트리플레이트[11C]메틸화 반응을 부여하는 것으로 밝혀졌으며 최소 전달 손실, 높은 방사성 화학적 수율, 높은 몰 활성, 반응 시간 감소 및 단순성의 장점이 있습니다 7,21,22,23.
여기에서 우리는 원래 Wilson13에 의해 설명 된 "루프 방법"[11C] 메틸화 기술 및 그 이후의 다른 사람들 14,15,18,21,22,23 (그림 2 참조)에 대한 기계적 수정 (그림 3 참조)에 대한 합성 모듈 (이하 모듈이라고 함)의 구현을 설명합니다.). 단순함이라는 열망적인 정신에 최대한 가깝게 바짝 붙인 이러한 기계적 수정은 최소화되고 접근하기 쉬웠으며, 그 결과 엔지니어링 복잡성이 전반적으로 감소하고 기본 반응 용기 방사선 표지 장치와 관련하여 모듈 제조업체가 이미 설치한 구성 요소에 필수 구성 요소만 추가되었습니다. 이는 모듈 제조업체가 이미 공급하고 사전 설치한 스테인리스강 HPLC 정제 루프를 사용하기로 한 결정에 반영되어 있으며, 이는 아래 설명된 바와 같이 검사된 합성체와 호환성이 있고 효과적인 것으로 입증되었습니다. 탄소-11 요오도메탄을 사용하여 방사성 추적자 [11C]-(R)-N-sec-부틸-4-(2-클로로페닐)-N-메틸퀴나졸린-2-카르복스아미드,[11C]ER-176 (1)의 합성을 위한 임상 연구 생산에 사용되는 완전하고 검증된 루프 방법 방사성 라벨링 프로토콜에 대해 자세히 설명합니다. 또한, (S,S)-[11C]메틸레복세틴([11C]MRB (2)), [11C]-메타-하이드록시에페드린([11C]mHED(3)) 및 2-[4-[(11C)메틸아미노]페닐]-1,3-벤조티아졸-6-올([11C]PiB(4))을 포함하는 세 가지 추가 방사성 리간드에 걸쳐 반응기 방법과 루프 방법에 의해 수행되는 방사성 표지 효율성과 관련된 수많은 속성을 비교합니다.)는 합성된 배치의 분석에 의해 결정된 바와 같이 당사 시설에서 개발되었습니다(표 1 및그림 1 참조). 이 비교는 방사화학 실험실에 최소한의 비용으로 접근 가능하고 간단한 모듈 수정을 통해 제공되는 "루프 방법" 방사성 표지 구현과 관련된 방사성 화학 수율 및 몰 활성과 같은 매개변수에 대한 분명한 이점을 보여줍니다.
프로토콜
알림: 모든 장비 및 합성은 납 차폐 핫셀 또는 미니셀에서 수행됩니다. 주의: 고에너지 양전자 방출 입자는 사이클로트론에서 생성되고 사용됩니다. 이 지역은 보정된 가이거 계수기로 모니터링되며, 개인은 방사선 안전에서 발행한 선량 링과 배지를 착용합니다. 모든 인원은 고에너지 방사성 물질을 다룰 수 있도록 훈련을 받는다.
모든 합성은 내부 표준 운영 절차(SOP)에 따라 깨끗하고 멸균된 모듈에서 수행됩니다. 세척 공정에는 모듈의 반응 부분에 대해 1N HCl, 물, 아세톤 및 아세토니트릴의 사용이 포함됩니다. 한편, 모듈의 제형 부분은 물과 에탄올로 세척하고 멸균합니다.
1. 루프 방법을 통한 [ 11C] ER-176 (1)의 radiolabeling
알림: [11C]ER-176 (1)을 준비하는 데 사용된 재료 목록은 재료 표를 참조하십시오.
- 루프 방법 생산을 위해 모듈을 다시 연결합니다( 그림 4A-D 참조). V8 밸브를 HPLC 루프에 직접 연결되는 유니온에 부착합니다. 이것은 반응 용기를 우회합니다.
- 모듈에서 모든 생산을 수행하기 전에 메탄(CH 4) 용광로를 350oC 에서20분 동안 100mL/min의 수소 가스 흐름으로 컨디셔닝합니다. 계속하기 전에 45 °C로 식히십시오.
- 모듈에서 모든 생산을 수행하기 전에 CH4 트랩을 120oC 에서20분 동안 50mL/min의 헬륨 가스 흐름으로 컨디셔닝합니다. 계속하기 전에 70 °C로 식히십시오.
- 모듈에서 모든 생산을 수행하기 전에 190mL/분의 헬륨 가스 흐름으로 20분 동안 요오드화 메틸 트랩을 컨디셔닝합니다. 계속하기 전에 50°C로 식히십시오.
- 모듈에 대한 시약 로딩:
- 100 μL 주사기를 사용하여 6포트 밸브의 내부 HPLC 루프 #1 위치에 있는 어댑터를 통해 (R)-N-sec-butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide(1.0 ± 0.05 mg) 혼합물을 dimethyl sulfoxide-d6(100 ± 10 μL) 및 6 N 수산화나트륨(4 μL)에 주입합니다.
참고: 중수소화 용매는 앰플 형태의 가용성과 일반적으로 제조 과정에서 증류되어 물이 없음을 보장하기 때문에 선택되었습니다. - 주입을 위해 V4 저장소에 0.9% 염화나트륨 3.0mL를 로드합니다.
- V5 저장용기에 200-proof 에탄올 1.0mL를 로드합니다.
- V6 저장소에 10mL의 멸균 탈이온수를 로드합니다.
- 대형 수용 플라스크에 25mL의 멸균 탈이온수를 채웁니다.
- 주입을 위해 배합 플라스크에 0.9% 염화나트륨 6.0mL를 채웁니다.
- 공급 라인이 멸균 사전 조립된 최종 제품 바이알에 부착되어 있는지 확인합니다.
- 아세토니트릴과 20mM 수산화암모늄의 37:63 (v/v) 혼합물로 이동상을 준비합니다.
- semi-prep 컬럼을 4개의 컬럼 부피의 이동상으로 컨디셔닝합니다.
참고: 사용된 컬럼은 C18 100mm x 10mm 역상 컬럼입니다.
- 100 μL 주사기를 사용하여 6포트 밸브의 내부 HPLC 루프 #1 위치에 있는 어댑터를 통해 (R)-N-sec-butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide(1.0 ± 0.05 mg) 혼합물을 dimethyl sulfoxide-d6(100 ± 10 μL) 및 6 N 수산화나트륨(4 μL)에 주입합니다.
- 자동화 모듈을 준비하는 동안 이중 빔 타겟에서 60-80분 동안 55μA의 11MeV 사이클로트론에 탄소-11 사이클로트론 타겟(1% 산소, 99% 질소)을 폭격하여 14N(p,α) 11C핵 반응에 의해 [11C] 이산화탄소를 생성합니다.
- 사이클로트론에서 [11C]이산화탄소를 모듈로 내리기 약 20분 전에 시작 버튼을 클릭하여 [11C]ER-176 합성을 위한 검증된 시간 목록을 시작합니다. 방사성 [4C] 이산화탄소를 받기 전에 CH4 컬럼을 45 oC로 냉각시키십시오 (그림 3 참조). carbosphere column trap(CH4 trap)을 -75°C로 냉각시킵니다.
- 건조 화학 공정을 통해 [11C] 이산화탄소를 [11C] 메틸 요오드화물로 변환하기 위해 모듈에 내장 된 방법을 다음과 같이 진행하십시오.
- 니켈 촉매(Shimalite-Nickel)를 통해 350oC에서수소 가스와 반응하여 [11C] 이산화탄소 활성을 [11C]메탄으로 변환합니다. 아스카라이트 트랩(수산화나트륨)을 사용하여 전환되지 않은 [11C] 이산화탄소와 형성된 물을 유지합니다.
- 추가 정제 및 농축을 위해 -75 oC에서 형성된 [11C] 메탄을 carbosphere column trap (CH4 trap)에 포획합니다. 갇힌 [11C] 메탄을 방출하려면 카보스피어 컬럼을 80 °C로 가열합니다.
- 헬륨 재순환 가스 펌프를 통해 정제 된 [11C] 메탄을 원소 요오드와 반응시켜 [11C] 메틸 요오드화물 ([11C] CH3I)을 형성합니다. 여기서 입사 생성 된 요오드화 수소는 다른 아스타라이트 트랩에 의해 유지되고 전환되지 않은 [11C] 메탄은 순환 과정으로 돌아갑니다.
- 형성된 [11C]CH3I를 실온에서 재순환 과정에서 축적된 요오드화메틸(MeI) 컬럼에 포획합니다.
- 순환 공정이 끝나면 헬륨 흐름(15mL/분)에서 190°C로 가열하여 MeI 트랩에서 수집된 [11C]CH3I를 방출하고 MeTf 컬럼에서 우회하고 체크 밸브를 통해 사전 로드된 전구체 용액이 포함된 1.5mL 스테인리스강 루프로 안내합니다(단계 1.5.1).
- [11C]CH3I가 180초 동안 루프를 통과하면 정제를 위해 반응 혼합물을 반-분취 HPLC 컬럼에 주입합니다. 다음 HPLC 조건을 사용하십시오: 37:63 (v/v) 아세토니트릴의 이동상: 5.0mL/min의 유속 및 235nm의 UV 파장에서 20mM 수산화암모늄; [11C]ER-176의 머무름 시간(tR): 약 12–14분 그림 5를 참조하십시오.
- 분획 샘플을 25mL의 멸균 탈이온수가 들어 있는 대형 수용 플라스크에 수집합니다. 희석된 혼합물을 C18 경질 고체상 추출(SPE) 카트리지에 로드합니다.
- 제품 (1) 을 추가로 멸균 탈이온수 10mL로 세척합니다.
- 200프루프 에탄올(18mL )을 사용하여 C 1 light SPE에서 원하는 제품을 용리합니다. 이 용출액을 주입하기 위해 0.9% 염화나트륨(6mL)이 사전 로드된 제형 플라스크에 넣습니다.
- V4 reservoir를 통해 주입하기 위해 C18 light SPE를 0.9% 염화나트륨 3mL를 추가로 헹굽니다.
- 제형 플라스크(~10mL)에 최종 용액을 수집하고 0.22μm 멸균 필터를 통과시켜 고무 격막으로 밀봉하고 알루미늄 캡으로 압착한 사전 조립된 멸균, 아피로겐, USP Type I 50mL 유리 바이알에 넣습니다.
- 텔레매니퓰레이터를 사용하여 최종 제품 바이알에서 부분 표본을 품질 관리(QC) 샘플로 제거합니다. 이 샘플을 수많은 QC 테스트를 실시하여 환자에게 투여하기 전에 확립된 사양을 준수하는지 확인합니다( 표 2 참조).
참고: (11)의 라디오 라벨링을 위해 [3C]CH2I를 사용하여 이 루프 방법 절차를 적용하십시오. [11C]CH3OTf를 생성하고 사용하여 (3) 및 (4)를 생성합니다(보충 파일 1 참조).- 시설에서 수행되는 일반적인 품질 관리 분석을 따르려면 텔레매니퓰레이터를 사용하여 최종 제품 바이알의 샘플을 TB 주사기로 옮긴 다음 납 차폐 캐리어를 사용하여 품질 관리실로 옮깁니다.
- 납 차폐 영역(L-블록)에서 시료를 발열원이 없는 튜브로 배출한 다음 HPLC 및 가스 크로마토그래피(GC) 분석을 위해 더 작은 유리 바이알(50–100μL)에 분주합니다.
- 두 번째 샘플을 발열원이 없는 물로 박테리아 내독소 분석을 위한 적절한 농도로 희석합니다.
- 최종 제품 용액의 샘플을 접종합니다(트립틱 대두 육수(TSB) 및 유체 티오글리콜레이트 배지(FTM) 매체 모두에 멸균 샘플로 주입). 이 샘플을 배양하고 14일 동안 성장을 관찰합니다.
- pH 스트립에 작은 부분 표본을 적용하여 최종 제품 용액의 산도/염기도를 육안으로 측정합니다.
2. [11C]ER-176의 방사성 표지를 위한 반응 용기 방법 (1)
- 내부 청소 프로토콜에 따라 모듈이 철저히 청소되었는지 확인하십시오.
- 모듈의 반응 부분을 세척하기 위해 1 N HCl, 물, 아세톤 및 아세토니트릴을 사용하고 물과 에탄올을 사용하여 모듈의 제형 부분을 세척 및 멸균합니다.
- 모듈에서 모든 생산을 수행하기 전에 메탄(CH 4) 용광로를 350oC 에서20분 동안 100mL/min의 수소 가스 흐름으로 컨디셔닝합니다. 계속하기 전에 45 °C로 식히십시오.
- 모듈에서 모든 생산을 수행하기 전에 CH4 트랩을 120oC 에서20분 동안 50mL/min의 헬륨 가스 흐름으로 컨디셔닝합니다. 계속하기 전에 70 °C로 식히십시오.
- 모든 생산 전에 MeI 트랩을 190oC 에서20분 동안 50mL/분의 헬륨 가스 흐름으로 컨디셔닝합니다. 계속하기 전에 50 °C로 식히십시오. V8 튜브가 용기의 바늘에 연결되어 있는지 확인하십시오.
- 헬륨 가스를 사용하여 수용 밸브(V24에서 V16까지)에서 내부 MeI 루프까지, V8에서 V23을 밀봉/배기 소스로 사용하여 용기까지 누출 테스트를 수행합니다.
- 모듈에 대한 시약 로딩:
- (R)-N-sec-butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide(1.0 ± 0.05 mg)를 dimethyl sulfoxide-d6(100 ± 10 μL) 및 6 N 수산화나트륨(4 μL)을 반응기 용기에 추가합니다.
- V2 저장소에 1.0mL의 37:63 아세토니트릴:20mM 수산화암모늄을 로드합니다.
- 주입을 위해 V4 저장소에 0.9% 염화나트륨 3.0mL를 로드합니다.
- V5 저장용기에 200-proof 에탄올 1.0mL를 로드합니다.
- V6 저장소에 10mL의 멸균 탈이온수를 로드합니다.
- 대형 수용 플라스크에 25mL의 멸균 탈이온수를 채웁니다.
- 주입을 위해 배합 플라스크에 0.9% 염화나트륨 6.0mL를 채웁니다.
- 공급 라인이 사전 조립된 멸균 최종 제품 바이알에 연결되어 있는지 확인합니다.
- HPLC 이동상(37:63 (v/v) 아세토니트릴:20 mM 수산화암모늄)으로 저장소를 채우고 HPLC 펌프에 연결합니다.
참고: 사용된 semi-prep 컬럼은 위와 동일하며 이동상(4 컬럼 부피)으로 사전 조절됩니다.
- 자동화 모듈을 준비하는 동안 이중 빔 타겟에서 60-80분 동안 55μA의 11MeV 사이클로트론에 탄소-11 사이클로트론 타겟(1% 산소, 99% 질소)을 폭격하여 14N(p,α) 11C핵 반응에 의해 [11C] 이산화탄소를 생성합니다.
- 사이클로트론에서 [11C]이산화탄소를 모듈로 내리기 약 20분 전에 시작 버튼을 클릭하여 [11C]ER-176 합성을 위한 검증된 시간 목록을 시작합니다. 방사성 [4C] 이산화탄소를 받기 전에 CH4 컬럼을 45 oC로 냉각시키십시오 (그림 3 참조). carbosphere column trap(CH4 trap)을 -75 oC로 냉각시킵니다.
- 건조 화학 공정을 통해 [11C] 이산화탄소를 [11C] 메틸 요오드화물로 변환하기 위해 모듈에 내장 된 방법을 다음과 같이 진행하십시오.
- 니켈 촉매(Shimalite-Nickel)를 통해 350oC에서수소 가스와 반응하여 [11C] 이산화탄소 활성을 [11C]메탄으로 변환합니다. 전환되지 않은 [11C] 이산화탄소와 아스카라이트 트랩(수산화나트륨)으로 형성된 물을 모두 보존합니다.
- 추가 정제 및 농축을 위해 -75 oC의 기화산 기둥에 [11C] 메탄을 가두십시오. [11C] 메탄을 방출하려면 기목권 기둥을 80 °C로 가열하십시오.
- 정제 된 [11C] 메탄을 720 oC에서 원소 요오드와 반응시켜 재순환 가스 펌프를 통해 [11C] 메틸 요오드화물을 형성합니다. 여기서 입사 생성 수소는 다른 아스카라이트 트랩에 의해 유지되고 전환되지 않은 [11C] 메탄은 내부 루프 재순환이라고하는 순환 과정으로 돌아갑니다.
- 형성된 [11C]메틸 요오드화물을 실온에서 재순환 과정에서 축적된 MeI 컬럼에 가둡니다.
- 순환 과정이 끝나면 다공성 고분자 흡착제 트랩을 헬륨 흐름(30mL/분)에서 190 °C로 가열하여 수집된 [11C]메틸 요오드화물을 방출하고 체크 밸브를 통해 ( 1)의 탄소-11 방사선 표지를 위한 3mL 반응 용기로 안내합니다.
- [11C]요오드화메틸의 생성 및 축적이 안정되면 은 트리플레이트 컬럼을 우회하고 방사성 가스를 V8을 통해 전구체 혼합물을 포함하는 반응 용기로 보냅니다. [11C] 요오드화 메틸을 3 분 동안 거품을 일으키십시오., 그런 다음 반응 용기를 밀봉하고 80 oC에서 5 분 동안 가열하십시오.
- 라벨링이 완료되면 5분 후 반응 용기를 30oC로 냉각하고 V2 저장소에서 1mL의 이동상으로 희석합니다.
- 다음 HPLC 조건을 사용하여 정제를 위해 혼합물을 반분취 HPLC 컬럼에 주입합니다: 37:63 (v/v) 아세토니트릴의 이동상: 5.0mL/min의 유속 및 235nm의 UV 파장에서 20mM 수산화암모늄; [11C]ER-176 (1)의t R: 약 9–11분, 그림 6 참조.
- 분획 샘플을 25mL의 멸균 탈이온수가 들어 있는 대형 수용 플라스크에 수집합니다. 이 희석된 혼합물을 C18 라이트 SPE 카트리지에 로드합니다.
- 트랩된 제품 (1) 을 추가로 10mL의 멸균 탈이온수로 세척합니다.
- 200 프루프 에탄올(1.0 mL)을 사용하여 C18 light SPE에서 원하는 제품을 용출하고 주입을 위해 0.9% 염화나트륨(6.0 mL)이 사전 로드된 배합 플라스크에 넣습니다.
- 주입을 위해 C18 light SPE에 0.9% 염화나트륨 3.0mL를 추가로 헹굽니다.
- 배합 플라스크(~10mL)에 최종 용액을 수집합니다. 이 매체를 0.22μm 제균 필터를 통해 고무 격막으로 밀봉하고 알루미늄 캡으로 압착한 사전 조립된 멸균, 아피로겐, USP Type I 50mL 유리 바이알에 통과시킵니다.
- 텔레매니퓰레이터를 사용하여 최종 제품 바이알에서 부분 표본을 품질 관리(QC) 샘플로 제거합니다(1.15단계 참조). 방사성 추적자가 방출 및 환자에게 투여하기 전에 모든 허용 기준을 통과해야 하는 여러 테스트를 검체에 실시합니다( 표 2 참조).
참고: (11)의 방사성 표지를 위해 [3C]CH2I를 사용하여 이 원자로 용기 방법을 적용하십시오. [11C]CH3OTf를 생성하고 사용하여 (3) 및 (4)를 생성합니다(보충 파일 1 참조).
결과
NYULH(New York University Langone Health) 방사화학 그룹은 인체 연구 및 전임상 응용 분야에 사용되는 다양한 탄소-11, 불소-18 및 갈륨-68 방사성 추적자를 제공합니다. PET 방사성 추적자 생산에는 여러 가지 방법이 사용됩니다. 우리 팀은 (1), (2), (3) 및 (4)의 합성을 위해 루프 방법을 사용합니다(그림 1 및 그림 8 참조). 생산이 완료되면 멸균 최종 제품 바이알에서 부분 표본을 제거합니다. 이 샘플은 최종 제품 용액(무균 시료로 트립틱 대두 육수(TSB) 및 유체 티오글리콜레이트 배지(FTM) 매체 모두)의 접종과 QC 테스트를 위한 벌크 용액의 대표 시료 모두에 사용됩니다. 각 방사성 추적자는 투여를 위해 제품이 출시되기 전에 QC 테스트를 거칩니다(표 2 참조).
품질 관리 테스트에는 제품 외관의 시각화, 필터 무결성 검증, 방사성 핵종 식별 여부, pH, 방사성 화학적 식별성(radio-HPLC), 방사성 화학적 순도(radio-HPLC), 화학적 순도(HPLC), 몰 활성도, 강도, 잔류 용매, 내독소 및 멸균성 측정이 포함됩니다( 표 2 참조). 이하의 결과는 상술한 각 방사성추적자의 임상생산으로부터 얻어진 것이다( 표 1 참조).
대표적인 분석 HPLC 크로마토그램은 그림 7 및 보충 파일 1을 참조하십시오. 모든 방사성 추적자는 피험자에게 방출되어 투여되기 전에 모든 품질 관리 사양( 표 2 참조)을 통과해야 합니다.
[11C]MRB (2) (보충 그림 1), [11C]mHED (3) (보충 그림 2) 및 [11C]PiB (4) (보충 그림 3)의 분석 HPLC 크로마토그램뿐만 아니라 전구체 및 시약의 양에 대해서는 보충 파일 1을 참조하십시오.
| 화합물 | 매개 변수 | 루프 메서드(avg ± std) | 반응기 방법(평균 ± 표준) |
| [11다씨]ER-176 시리즈 | 생산 횟수 | 25 | 6 |
| 합성 시작 | 86 ± 5.0 GBq | 52 ± 25.7 GBq | |
| 합성의 끝 | 5.4 ± 2.2 GBq | 1.6 ± 0.5 GBq | |
| 방사화학 순도 | 99.6 ± 0.6% | 99.9 ± 0.1% | |
| ER-176 농도 | 1.1 ± 0.5 μg/mL | 0.63 ± 0.37 μg/mL | |
| 어금니 활동 | 194 ± 66 GBq/μmol | 132 ± 78 GBq/μmol | |
| 총 합성 시간 | 36 ± 3 분 | 44 ± 6 분 | |
| [11다씨]증권 시세 표시기 | 생산 횟수 | 70 | 6 |
| 합성 시작 | 84 ± 5.4 GBq | 39 ± 11.9 GBq | |
| 합성의 끝 | 3.0 ± 1.2 GBq | 1.9 ± 0.7 기가바이트 | |
| 방사화학 순도 | 99.5 ± 0.5% | 99.7 ± 0.8% | |
| MRB 농도 | 0.52 ± 0.24 μg/mL | 0.68 ± 0.41 μg/mL | |
| 어금니 활동 | 190 ± 50 GBq/μmol | 99 ± 55 GBq/μmol | |
| 총 합성 시간 | 35 ± 3 분 | 42 ± 3 분 | |
| [11C]mHED | 생산 횟수 | 5 | 11 |
| 합성 시작 | 69 ± 10.5 GBq | 82 ± 4.3 기가바이트 | |
| 합성의 끝 | 5.5 ± 1.3 GBq | 3.3 ± 1.0 GBq | |
| 방사화학 순도 | 98.2 ± 1.3% | 99.1 ± 0.7% | |
| mHED 농도 | 0.40 ± 0.10 μg/mL | 0.52 ± 0.37 μg / mL | |
| 어금니 활동 | 301 ± 48 GBq/μmol | 155 ± 77 GBq/μmol | |
| 총 합성 시간 | 27 ± 4 분 | 32 ± 2 분 | |
| [11다씨]파이브(PiB) | 생산 횟수 | 51 | 10 |
| 합성 시작 | 86 ± 5.4 GBq | 57 ± 17.2 GBq | |
| 합성의 끝 | 3.2 ± 0.8 GBq | 1.4 ± 0.2 GBq | |
| 방사화학 순도 | 97.0 ± 1.5% | 99.1 ± 1.4% | |
| PiB 농도 | 0.22 ± 0.51 μg/mL | 0.30 ± 0.24 μg/mL | |
| 어금니 활동 | 201 ± 68 GBq/μmol | 207 ± 124 GBq / μmol | |
| 총 합성 시간 | 35 ± 2 분 | 36 ± 5 분 |
표 1: 루프 방법 또는 반응 용기 방법을 통해 [11C]ER-176(1), [11C]MRB(2), [11C]m HED(3) 및 [11C]PiB(4)를 생산한 결과. 모든 값은 합성이 끝날 때 보고됩니다. 약어: [11C]ER-176 = [11C]-(R)-N-sec-부틸-4-(2-클로로페닐)-N-메틸퀴나졸린-2-카르복스아미드; [11다씨]MRB = (S,S)-[11C]메틸레복세틴; [11다씨]미디엄HED = [11C]-메타-하이드록시에페드린; [11다씨]PiB = 2- [4- [(11C) 메틸 아미노] 페닐] -1,3- 벤조 티아 졸 -6- 올.
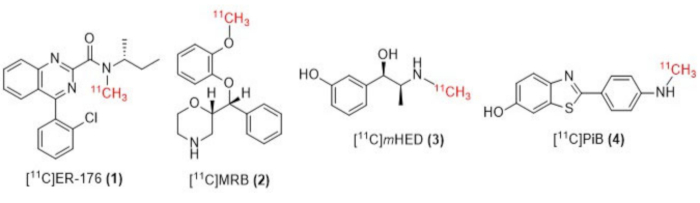
그림 1: [11C]ER-176(1), [11C]MRB(2), [11C] m GED(3) 및 [11C]PiB(4)의 구조. 약어: [11C]ER-176 = [11C]-(R)-N-sec-부틸-4-(2-클로로페닐)-N-메틸퀴나졸린-2-카르복스아미드; [11다씨]MRB = (S,S)-[11C]메틸레복세틴; [11다씨]미디엄HED = [11C]-메타-하이드록시에페드린; [11다씨]PiB = 2- [4- [(11C) 메틸 아미노] 페닐] -1,3- 벤조 티아 졸 -6- 올. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
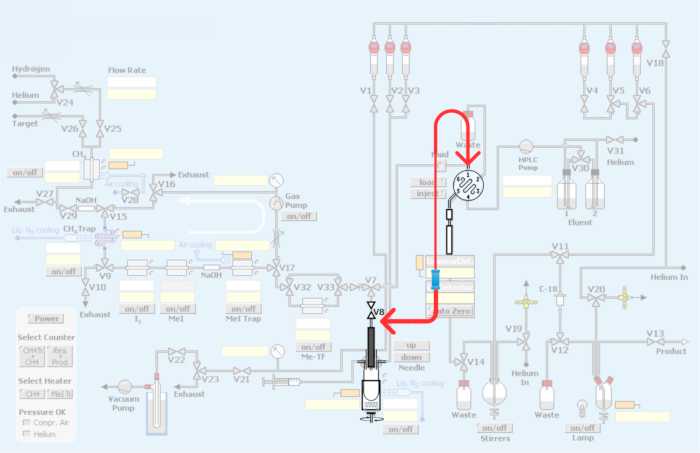
그림 3: 자동화된 모듈에 대한 수정 사항. 빨간색은 탄소-11 메틸화를 통해 PET 방사성 추적자 생산을 위한 루프를 통합하기 위한 합성 모듈의 재배관을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: PET 방사성 추적자의 탄소-11 메틸화를 위한 루프 방법을 통합하기 위한 모듈 배관 및 재배관. (A) 유니온 커넥터가 있는 HPLC 주입 루프. (B) 반응 용기 방법. V8 연결을 나타내는 빨간색 화살표입니다. (C) 반응기 용기를 우회하여 재배관하는 루프 방법. HPLC 주입구에 대한 V8 연결은 반응 용기를 우회하여 [11C]요오도메탄 또는 [11C]메틸 트리플레이트가 HPLC 루프에 직접 접근할 수 있도록 합니다. (D) 원자로 용기에 관한 연합의 배치. 스테인리스강 HPLC 루프에 대한 연결에 유의하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
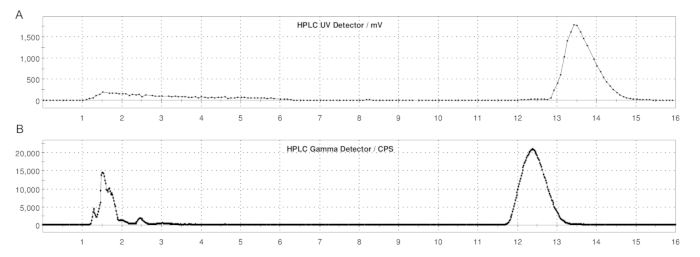
그림 5: 루프 분석법 생산을 사용한 ER-176 및 [11C]ER-176의 반분취 HPLC 프로파일. (A) ER-176용 반분취 HPLC 프로파일 (1) UV = 235nm에서 루프 방법 생산을 통해; tR = 13.2 min. (B) [11C]ER-176 (1)에 대한 Semi-prep radio-HPLC 프로파일; tR = 12.4분 조건: 37:63 (v/v) 아세토니트릴의 이동상: 5.0mL/분의 유속에서 20mM 수산화암모늄. 약어: [11C]ER-176 = [11C]-(R)-N-sec-부틸-4-(2-클로로페닐)-N-메틸퀴나졸린-2-카르복스아미드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
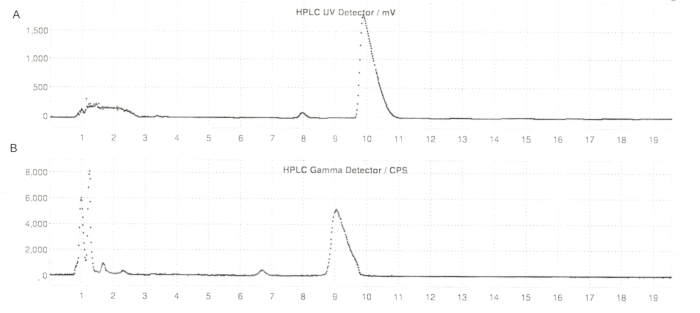
그림 6: 반응기 분석법 생산을 통한 ER-176 및 [11C]ER-176의 반분취 HPLC 프로필. (A) ER-176용 반분취 HPLC 프로파일 (1) UV = 235nm에서 반응기 방법 생산을 통해; tR = 9.8 min. (B) [11C]ER-176 (1)에 대한 Semi-prep radio-HPLC 프로파일; tR = 9.2분 조건: 37:63 (v/v) 아세토니트릴의 이동상: 5.5mL/분의 유속에서 20mM 수산화암모늄. 약어: [11C]ER-176 = [11C]-(R)-N-sec-부틸-4-(2-클로로페닐)-N-메틸퀴나졸린-2-카르복스아미드; tR = 보존 시간. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
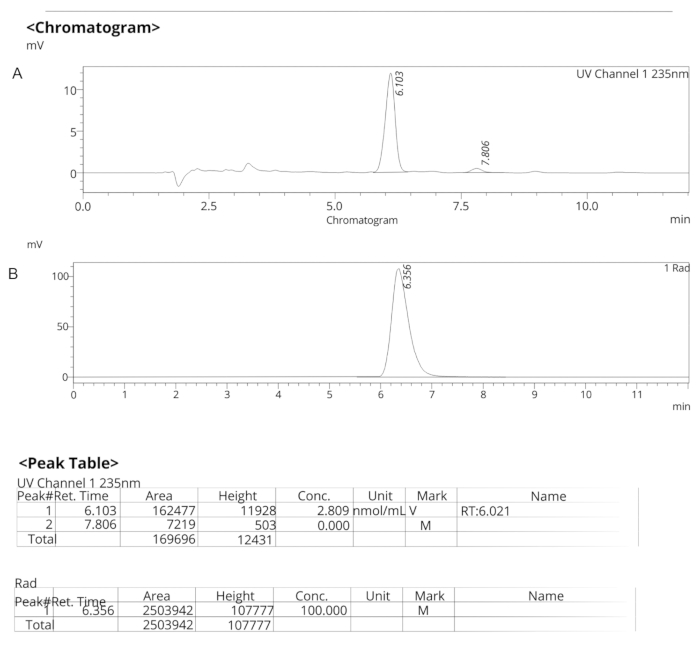
그림 7: ER-176에 대한 분석용 HPLC 프로필. (A) 235nm에서 ER-176 (1)에 대한 UV 스펙트럼의 분석용 HPLC 프로필; tR = 6.10 min. (B) [11C]ER-176 (1)에 대한 방사성 추적자의 분석적 HPLC 프로파일; tR = 6.36 분. 조건: 10 μm C18 (2) 100  LC 컬럼 250 x 4.6 mm; 유속 1.5mL/분의 메탄올/물 74/26. 약어: [11C]ER-176 = [11C]-(R)-N-sec-부틸-4-(2-클로로페닐)-N-메틸퀴나졸린-2-카르복스아미드; tR = 머무름 시간 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
LC 컬럼 250 x 4.6 mm; 유속 1.5mL/분의 메탄올/물 74/26. 약어: [11C]ER-176 = [11C]-(R)-N-sec-부틸-4-(2-클로로페닐)-N-메틸퀴나졸린-2-카르복스아미드; tR = 머무름 시간 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
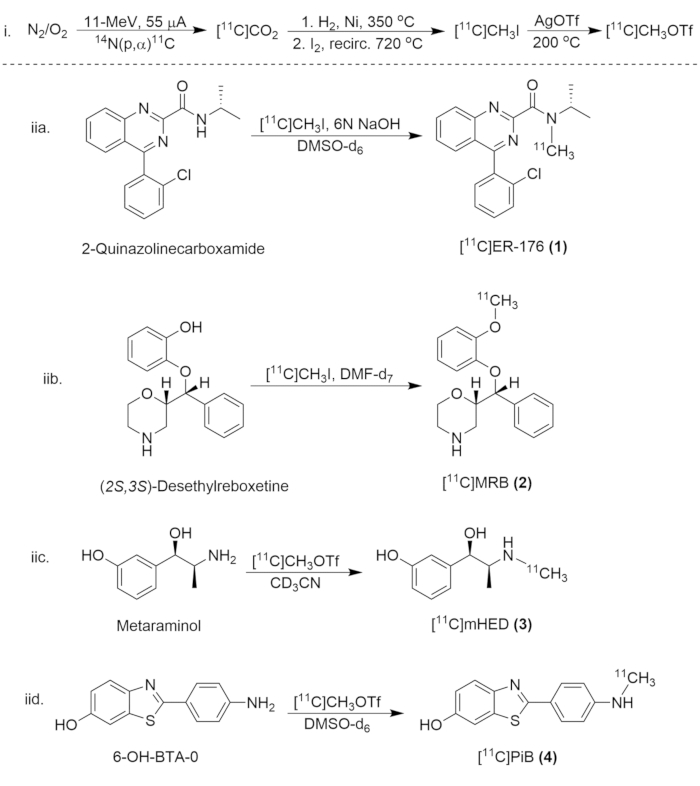
그림 8: 탄소-11 화합물의 합성을 위한 합성 계획. (i) [11C]CH3I 및 [11C]CH3OTf의 형성, 및 [11C]ER-176의 방사성 표지 (1), (iib.) [11다씨]MRB (2), (iic.)[11다씨]미디엄HED (3) 및 (iid.) [11다씨]PiB (4)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 테스트/파라미터 | 사양 |
| 외관 (육안 검사) | 미립자 물질이 없는 투명하고 무색의 용액 |
| 멤브레인 필터 무결성 | ≥ 50의 PSI |
| 산도 | 4.5 - 8.0 |
| 방사성 핵종 식별(반감기) | 19.3 - 21.3 분 |
| 방사성 화학적 식별(방사성 HPLC) | 0.90 ≤ tR Prod / t R Std ≤ 1.10 |
| 방사성 화학 순도 (radio-HPLC) | ≥ 95.0%† |
| 약물 농도(HPLC) | 주석 참조* |
| 총 화학 불순물(HPLC) | 주석 참조** |
| 어금니 활성(@ EOS) | > 9.25 GBq / μmol |
| 잔류 아세토니트릴(GC) | ≤ 410 페이지/분 |
| 잔류 아세톤(GC) | ≤ 5,000 페이지/분 |
| 잔류 디메틸 설폭사이드(GC) | ≤ 5,000 페이지/분 |
| 잔류 에탄올(GC) | ≤ 10% (V/V) |
| 잔류 메탄올(GC) | ≤ 3,000 페이지/분 |
| 잔류 N,N-디메틸포름아미드(GC) | ≤ 880 페이지/분 |
| Limulus Amoebocyte 용해물(LAL) | ≤ 17.5 EU/mL |
| 멸균(30시간 이내에 시작) | 멸균(14일) |
| 준비 기록 | 완전하고 정확함 |
| 레이블 | 완전하고, 정확하며, 조화를 이룹니다. |
표 2: 탄소-11 방사성 추적자의 승인 또는 거부에 대한 품질 관리 기준. † 방사성 화학 순도 ≥ [11C] mHED의 경우 90.0 %; * 약물 농도 : [11C] ER-176 ≤ 10 μg / 용량; [11다씨]MRB ≤ 10 μg/용량; [11다씨]미디엄HED ≤ 50 μg/용량; [11다씨]PiB ≤ 13.4 μg / 용량; ** 총 화학 불순물 : [11C] ER-176 ≤ 1.0 μg / 용량; [11다씨]MRB ≤ 1.0 μg/용량; [11다씨]미디엄HED ≤ 5.0 μg/용량; [11다씨]PiB ≤ 1.34μg/용량. 약어: [11C]ER-176 = [11C]-(R)-N-sec-부틸-4-(2-클로로페닐)-N-메틸퀴나졸린-2-카르복스아미드; [11다씨]MRB = (S,S)-[11C]메틸레복세틴; [11다씨]미디엄HED = [11C]-메타-하이드록시에페드린; [11다씨]PiB = 2- [4- [(11C) 메틸 아미노] 페닐] -1,3- 벤조 티아 졸 -6- 올; EOS = 합성 종료; GC = 가스 크로마토그래피; LAL = Limulus Amebocyte 용해물.
보충 파일 1: 화학 물질 및 재료, 루프 또는 반응기 용기 방법에 사용되는 시약, 품질 관리 테스트, 분석 HPLC 크로마토 그램. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
탄소-11 요오도메탄 또는 메틸 트리플레이트를 사용한 말단 헤테로원자의 전통적인 방사성 표지는 방사성 친전자성 가스를 반응 용기에 버블링하여 가두고, 용액이 장시간 동안 반응하도록 하는 것을 포함한다18. 이종 반응의 종래의 버블링은 느릴 수 있으며 반응 속도를 가속화하기 위해 가열이 필요할 수 있습니다. 정제하기 전에 반응 매체를 실온으로 냉각한 다음 원하는 방사성 추적자의 정제를 위해 용매(예: 이동상)를 사용하여 HPLC 루프로 옮겨야 할 수 있습니다. 이러한 단계는 시간이 많이 소요되며, 이러한 물질을 이송하는 동안 일시적인 방사성 표지 제품이 손실될 수 있습니다.
우리 시설에서는 전구체 용액을 HPLC 스테인리스강 루프에 코팅하고 화합물의 방사선 표지가 실온의 루프 내부에서 이루어지는 루프 방법 사용에 대한 정당성을 입증했습니다. 루프는 방사성 [11C] CH3I 또는 [11C] CH3OTf의 전달과 인라인으로 연결되고 HPLC 시스템의 주입 포트에 연결됩니다. 방사성 표지가 발생하기 위해 가열이 필요하지 않으며, 이 원고에 표시된 모든 경우에 대해 반응은 3분 이내에 이루어집니다.
스테인리스강 HPLC 루프의 유속과 크기는 이 공정이 효율적으로 작동하는 데 중요한 것으로 보입니다. 테스트는 방사성 가스가 루프로 전달될 수 있도록 운반 가스인 헬륨의 유속을 8.0mL/min에서 15.0mL/min으로 변경하는 것으로 시작되었습니다. Buckley는 올바른 유속을 적용하고 적절한 용매 및 루프 재료를 사용하는 것의 중요성을 연구했습니다15. 우리 시스템의 경우, [11C]CH3I 또는 [11C]CH3OTf의 방사성 친전자성 종에 대한 15mL/min의 유속은 이 원고에서 논의된 4가지 방사성 추적자 모두의 방사성 표지에 적합합니다. 모든 합성에 사용되는 루프는 1/16인치의 OD와 1mm의 ID를 가진 1.5mL의 스테인리스강 HPLC 주입 루프입니다.
두 가지 방법(반응 용기 대 루프 방법)을 비교한 결과, 루프 방법은 인간 연구에서 승인한 4개의 방사성 추적자 생산을 위해 합성 말기(EOS)에서 몰 활성이 크게 증가함과 함께 방사성 표지 효율이 증가했음을 입증했습니다. 예를 들어, 방사성 추적자[11C]mHED(3)는 EOS에서 두 배의 몰 활성을 달성함과 함께 분리된 최종 제품 활성이 1.6배 증가했습니다. 이러한 전반적인 활동 증가 추세는 4개의 방사성 추적자 모두에서 관찰됩니다(표 1 참조). 루프 분석법을 사용할 때 추가로 얻을 수 있는 유리한 결과로는 설정 시간이 5분 단축되고 반응 용기를 세척할 필요가 없어 작업자의 시간을 절약하고 세척 프로토콜을 위한 용매를 사용할 수 있다는 것입니다.
이 방법의 몇 가지 단점은 루프 방법을 사용하여 방사성 추적자를 효과적으로 라벨링할 수 있는 한계를 포함합니다. 방사선 표지에 열이 필요한 경우 HPLC 루프 내부에서 가열할 수 있도록 이 시스템을 수정하기가 어렵습니다. 이 시스템은 배관을 수정해야 합니다. '즉시' 준비되지 않은 이러한 특징은 다른 사용자들이 그들의 자동화된 플랫폼(14)에 대해 이러한 변경을 수행하는 것을 단념시킬 수 있다. 이 방법에는 추가 배관 및 유니온이 필요하기 때문에(그림 4A-D 참조) 이러한 조건에서 라벨링할 때 방사성 방출에 대한 추가 사이트의 가능성이 증가합니다. 모듈을 실행할 때마다 누출 검사를 수행하는 것이 좋습니다.
우리 팀은 임상시험용 신약 신청(IND) 및 방사성 약물 연구 위원회(RDRC)가 승인한 4개의 탄소-11 방사성 추적자 생산에 사용된 루프 방법을 구현했습니다. 우리의 손에서 이 방법은 전통적인 반응 용기 방법보다 더 효율적이고 수율이 높은 공정임이 입증되었습니다. 캐리어 헬륨 가스의 유량에 대한 추가 배관 및 조정은 이 방법을 대부분의 자동화된 모듈에 적용할 때 고려해야 합니다. 마지막으로, 이 방법은 한계가 있으며, 팔라듐(II) 중간체의 활성화와 반응 혼합물의가열(24)을 필요로 하는 [11C]UCB-J와 같은 특정 탄소-11 방사성 추적자에는 적합하지 않다.
공개
저자들은 이 연구와 관련하여 공개할 관련 또는 재정적 이해관계가 없음을 선언합니다.
감사의 말
루프 방법을 사용하여 탄소-11 메틸화를 위한 초기 노력에 대한 전 NYULH 방사화학 연구소 구성원인 Raul Jackson과 Grace Yoon에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
참고문헌
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유