Method Article
Miglioramento dell'efficienza e della resa di radiomarcatura dei radioligandi al carbonio-11 per la ricerca clinica utilizzando il metodo Loop
In questo articolo
Riepilogo
Questo protocollo presenta una procedura dettagliata per preparare quattro radiotraccianti al carbonio-11 mediante il "metodo loop" [11C]metilazione. Descriviamo la procedura per sintetizzare [11C]ER-176, con dati per tre radiotraccianti aggiuntivi: [11C]MRB, [11C]mHED e [11C]PiB. Il metodo ad anello fornisce una sintesi efficiente con maggiori rese radiochimiche contro la tradizionale metilazione dei recipienti di reazione [11C].
Abstract
Un programma di imaging di tomografia a emissione di positroni che coinvolge radiotraccianti al carbonio-11 richiede metodi di sintesi rapidi, efficienti e affidabili, che richiedono un ciclotrone e un gruppo di radiochimica in loco, nonché personale clinico addestrato a operare sotto i vincoli unici del radionuclide di carbonio-11. Questo studio esamina i meriti e i vantaggi di un "metodo ad anello" con solvente vincolato in cattività per la radiomarcatura di quattro traccianti con il radionuclide di carbonio-11, producendo i radioligandi [11C]ER-176, [11C]MRB, [11C]mHED e [11C]PiB.
Il "metodo ad anello" viene confrontato con il metodo tradizionale di metilazione del carbonio-11 basato su reattori nel corso della sintesi degli stessi radiotraccianti sulla stessa piattaforma automatizzata. Inoltre, viene presentata una panoramica completa della preparazione alla ricerca clinica del radiotracciante [11C]ER-176. Come dimostrato dalla produzione di [11C]ER-176, il metodo del "loop" del solvente vincolato di alchilazione eterogenea si è dimostrato più efficiente, con un'eccellente purezza radiochimica (99,6 ± 0,6%, n = 25), una resa radiochimica più elevata e più costante (fine della sintesi (EOS) = 5,4 ± 2,2 GBq, n = 25) rispetto al metodo del reattore (EOS = 1,6 ± 0,5 GBq, n = 6), aumento dell'attività molare (metodo del loop = 194 ± 66 GBq/μmol, n = 25; metodo del reattore = 132 ± 78 GBq/μmol, n = 6), insieme a una sequenza di reazione media più breve di 5 minuti.
Introduzione
Tra le modalità di imaging molecolare, la tomografia a emissione di positroni (PET) si distingue per il suo modo di risolvere i processi biochimici associati a specifici bersagli fisiologici o regioni di interesse 1,2. La sensibilità caratteristica e la natura non invasiva della PET sono sfruttate per la visualizzazione e la quantificazione in vivo della fisiopatologia della malattia, rivelando spesso bersagli invisibili da tecniche di imaging più anatomiche come la tomografia computerizzata (TC)3 o la risonanza magnetica per immagini (MRI)4. L'imaging molecolare contemporaneo vede la combinazione di PET con TC o MRI (PET/CT o PET/RM, rispettivamente), sfruttando la risoluzione ad alto contrasto e i parametri di imaging quantificabili della PET per fornire mappe di correzione dell'attenuazione (PET/CT) altamente accurate e una migliore risoluzione spaziale (PET/MR)5, superando alcuni ostacoli presentati dalla variabilità delle energie cinetiche più elevate dei positroni da radionuclidi come il gallio-68 e il rubidio-826. Queste tecniche di imaging a doppia modalità incanalano gli attributi distintivi di ogni singola modalità, fornendo ai medici o ai ricercatori una ricchezza di approfondimenti anatomici e biochimici co-registrati sul soggetto dello studio5.
L'applicabilità clinica di questa tecnica di imaging è vasta, offrendo la visualizzazione e la misurazione di processi fisiologici a livello molecolare diversi come il metabolismo del glucosio 7,8, il legame del recettore dei neurotrasmettitori9, la perfusione miocardica10 e varie condizioni neurologiche11. Al di fuori dell'uso clinico, gli attributi intrinseci della PET sono allineati per svolgere un ruolo fondamentale nello sviluppo di farmaci diagnostici e terapeutici, consentendo la quantificazione di parametri come il potenziale di legame (BP), la biodistribuzione, il volume di distribuzione (VT) e l'occupazione del recettore del farmaco (RO%) attraverso l'osservazione diretta dell'interazione tra farmacologia, farmacocinetica e farmacodinamica. Questo, a sua volta, contribuisce a determinare, tra cui se un composto raggiunge un bersaglio a una concentrazione di dose efficace (ED50), l'entità della penetrazione effettiva della barriera emato-encefalica, l'integrità metabolica del composto e la dose appropriata e l'intervallo di dosaggio11.
Nello sviluppo di una sonda utile per l'imaging PET, dopo l'identificazione di un biomarcatore appropriato e la selezione di un ligando associato, la marcatura radiografica della biomolecola con un radionuclide PET adatto produce la sonda radiotracciante per lo studio PET. Tra i radionuclidi PET per lo studio di questioni biologiche, farmacologiche o mediche, il carbonio-11 offre una combinazione di versatilità sintetica e caratteristiche fisiche favorevoli che ne consentono l'uso diffuso in diverse biomolecole e ligandi idonei6. Con un'emissione di positroni del 99,8% e un'emivita di 20,4 minuti12, il carbonio-11 consente la somministrazione ripetuta ai soggetti entro brevi intervalli, pur consentendo sintesi in più fasi. Tuttavia, questi vantaggi richiedono una struttura con capacità di ciclotrone e radiochimica in loco5.
Tali strutture richiedono metodi di metilazione affidabili, potenti e riproducibili che consentano la radiomarcatura di molecole precursori, spesso con il substrato elettrofilo [11C]iodometano ([11C]CH3I) o [11C]metiltriflato ([11C]CH3OTf)13. Un modulo di radiosintesi, fornito dal produttore, è tipicamente configurato per un approccio a recipiente di reazione alle reazioni di metilazione [11C]14. Ciò comporta il raffreddamento del recipiente per un'efficace ritenzione di [11C]iodometano o [11C]metiltriflato al momento della consegna, la sigillatura e il riscaldamento del recipiente per effettuare la reazione, l'estinzione e quindi il trasferimento del contenuto reagito a un sistema di cromatografia liquida ad alte prestazioni (HPLC) per la purificazione semipreparativa13. Sebbene efficace15, questa tecnica presenta numerosi potenziali punti di guasto strutturali, che coinvolgono i setti delle fiale, gli aghi e le linee di trasferimento associate.
La necessità di un metodo di metilazione più affidabile e riproducibile ha guidato la ricerca e la ricerca di una modifica del solvente vincolato a molti dei nostri protocolli di sintesi di radioligandi al carbonio-11. Questo approccio mira ad affrontare i limiti del metodo convenzionale dei recipienti di reazione, mantenendo o migliorando l'efficienza della radiomarcatura.
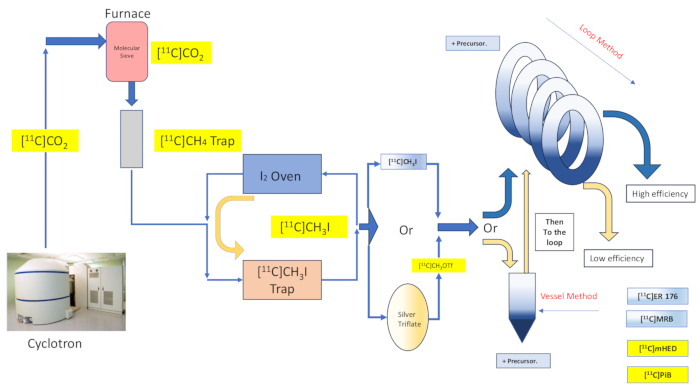
Figura 2: Progettazione e flusso del metodo di sintesi e loop del recipiente di reazione. Clicca qui per visualizzare una versione più grande di questa figura.
La chimica dei solventi in cattività offre la promessa di intrappolare e reagire in modo efficiente con il reagente di marcatura radiomarcante mediante la diffusione della soluzione precursore su un'ampia area di un materiale o di una struttura di supporto e quindi dirigendo il reagente di marcatura gassoso a contatto con il materiale rivestito16,17. Ciò aumenta l'estensione e la qualità del contatto tra le due fasi reagenti16,18. Numerose implementazioni e variazioni di questa tecnica sono state documentate già nel 1985 16,17,18,19,20, e ha trovato applicazione con [11C]ioduro di metile, [11C]metiltriflato, così come il reagente Grignard [11C]reazioni di radiomarcatura dell'anidride carbonica 20. Un ulteriore perfezionamento è stato presentato dalla discussione della chimica del "metodo del loop" del solvente vincolato, originariamente descritta da Wilson et al., che non richiede alcun supporto aggiuntivo a quello già offerto dal ciclo di purificazione HPLC, né riscaldamento o raffreddamento dell'ambiente di reazione13. È stato riscontrato che la radiomarcatura con il "metodo del loop" del solvente in cattività conferisce reazioni di metilazione di iodometano e metiltriflato [11C] con le virtù di una minima perdita di trasferimento, un'elevata resa radiochimica, un'elevata attività molare, una diminuzione del tempo di reazione e semplicità 7,21,22,23.
Qui descriviamo l'implementazione da parte del nostro gruppo del "metodo del loop" [11C]metilazione originariamente descritta da Wilson13, e da altri successivamente 14,15,18,21,22,23, (vedi Figura 2) per mezzo di modifiche meccaniche (vedi Figura 3) al nostro modulo di sintesi (di seguito indicato come il Modulo). Attenendosi il più possibile all'aspirazione alla semplicità, queste modifiche meccaniche sono state minime e accessibili, con conseguente riduzione complessiva della complessità ingegneristica e solo l'aggiunta di componenti essenziali a quelli già installati dal produttore del modulo come associato a una disposizione di radiomarcatura predefinita del recipiente di reazione. Ciò si riflette nella scelta di utilizzare il circuito di purificazione HPLC in acciaio inox già fornito e preinstallato dal produttore del modulo, come descritto di seguito, che si è dimostrato compatibile ed efficace con le sintesi esaminate. Discutiamo, in dettaglio, il protocollo di radiomarcatura completo e convalidato con il metodo del loop utilizzato nella produzione di ricerca clinica per la sintesi del radiotracciante [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilchinazolina-2-carbossammide,[11C]ER-176 (1), utilizzando carbonio-11 iodometano. Inoltre, confrontiamo numerosi attributi relativi all'efficienza della radiomarcatura condotta sia con il metodo del reattore che con il metodo del loop su tre radioligandi aggiuntivi, che includono (S,S)-[11C]metilreboxetina ([11C]MRB (2),[11C]-meta-idrossiefedrina ([11C]mHED (3)) e 2-[4-[(11C)metilammino]fenil]-1,3-benzotiazol-6-olo ([11C]PiB (4)) sviluppato nella nostra struttura, come determinato dall'analisi dei lotti sintetizzati (vedi Tabella 1 eFigura 1 ). Questo confronto illustra il chiaro vantaggio per parametri come la resa radiochimica e l'attività molare associati all'implementazione della radiomarcatura con il "metodo loop", offerto da modifiche dei moduli accessibili e semplici con un costo minimo per il laboratorio di radiochimica.
Protocollo
NOTA: Tutte le apparecchiature e le sintesi vengono eseguite in una cella calda schermata in piombo o in una minicella. ATTENZIONE: Dal ciclotrone vengono generate e utilizzate particelle che emettono positroni ad alta energia. L'area è monitorata con contatori Geiger calibrati e le persone indossano anelli e distintivi di dosimetria emessi per la sicurezza dalle radiazioni. Tutto il personale è addestrato a lavorare con materiali radioattivi ad alta energia.
Tutte le sintesi vengono eseguite su un modulo pulito e sterilizzato secondo le nostre procedure operative standard (SOP) interne. Il processo di pulizia include l'uso di HCl 1 N, acqua, acetone e acetonitrile per la parte di reazione del modulo. Nel frattempo, la parte di formulazione del modulo viene pulita e sterilizzata con acqua ed etanolo.
1. La marcatura radiofonica di [ 11C]ER-176 (1) mediante il metodo dell'ansa
NOTA: Per un elenco dei materiali utilizzati nella preparazione di [11C]ER-176 (1), consultare la Tabella dei materiali.
- Ricollegare il modulo per la produzione del metodo del loop (vedere la Figura 4A-D). Collegare una valvola V8 a un raccordo che si collega direttamente al circuito HPLC. Questo bypasserà il recipiente di reazione.
- Condizionare il forno a metano (CH4) a 350 oC per 20 minuti con un flusso di idrogeno gassoso di 100 mL/min prima di tutte le produzioni eseguite sul modulo. Raffreddare a 45 oC prima di procedere.
- Condizionare la trappola CH4 a 120 oC per 20 minuti con un flusso di gas elio di 50 mL/min prima di tutte le produzioni eseguite sul modulo. Raffreddare a 70 oC prima di procedere.
- Condizionare la trappola di ioduro di metile a 190 oC per 20 minuti con un flusso di gas di elio di 50 mL/min prima di tutte le produzioni eseguite sul modulo. Raffreddare a 50 oC prima di procedere.
- Caricamento dei reagenti per il modulo:
- Utilizzando una siringa da 100 μl, iniettare la seguente miscela attraverso l'adattatore in posizione #1 dell'ansa HPLC interna della valvola a sei vie: (R)-N-sec-butil-4-(2-clorofenil)-chinazolina-2-carbossammide (1,0 ± 0,05 mg) in dimetilsolfossido-d6 (100 ± 10 μl) e 6 N idrossido di sodio (4 μl).
NOTA: I solventi deuterati sono stati selezionati per la loro disponibilità in forma di fiala e perché vengono tipicamente distillati durante la produzione, garantendo che siano privi di acqua. - Caricare il serbatoio V4 con 3,0 mL di cloruro di sodio allo 0,9% per preparazioni iniettabili.
- Caricare il serbatoio V5 con 1,0 mL di etanolo a prova 200.
- Caricare il serbatoio V6 con 10 mL di acqua deionizzata sterile.
- Riempire il pallone di raccolta grande con 25 ml di acqua deionizzata sterile.
- Riempire il pallone di formulazione con 6,0 mL di cloruro di sodio allo 0,9% per preparazioni iniettabili.
- Assicurarsi che la linea di erogazione sia collegata a una fiala sterile preassemblata del prodotto finale.
- Preparare la fase mobile con una miscela 37:63 (v/v) di acetonitrile e idrossido di ammonio 20 mM.
- Condizionare la colonna di semi-preparazione con quattro volumi di colonna di fase mobile.
NOTA: La colonna utilizzata è una colonna C18 100 mm x 10 mm a fase inversa.
- Utilizzando una siringa da 100 μl, iniettare la seguente miscela attraverso l'adattatore in posizione #1 dell'ansa HPLC interna della valvola a sei vie: (R)-N-sec-butil-4-(2-clorofenil)-chinazolina-2-carbossammide (1,0 ± 0,05 mg) in dimetilsolfossido-d6 (100 ± 10 μl) e 6 N idrossido di sodio (4 μl).
- Durante la preparazione del modulo automatizzato, bombardare il bersaglio del ciclotrone carbonio-11 (1% di ossigeno, 99% di azoto) su un ciclotrone da 11 MeV a 55 μA per 60-80 minuti su bersagli a doppio raggio per produrre [11C]anidride carbonica mediante la reazione nucleare 14N(p,α) 11C.
- Circa 20 minuti prima di scaricare l'anidride carbonica [11C] dal ciclotrone al modulo, avviare l'elenco dei tempi convalidati per la sintesi di [11C]ER-176 facendo clic sul pulsante di avvio . Lasciare raffreddare la colonna CH4 a 45 oC prima di ricevere l'anidride carbonica radioattiva [11C] (vedere la Figura 3). Lasciare raffreddare la trappola della colonna carbosferica (trappola CH4 ) a -75 oC.
- Si proceda come segue il metodo incorporato nel modulo per la conversione dell'anidride carbonica [11C] in [11C]ioduro di metile, mediante un processo di chimica a secco:
- Convertire l'attività dell'anidride carbonica in [11C]metano reagendo con l'idrogeno gassoso a 350 oC su un catalizzatore di nichel (Shimalite-Nickel). Utilizzare una trappola per ascarite (idrossido di sodio) per trattenere l'anidride carbonica non convertita [11C] e l'acqua formata.
- Intrappolare il [11C]metano formato su una trappola a colonna di carbosfera (trappola CH4 ) a -75 oC per un'ulteriore purificazione e concentrazione. Per rilasciare il [11C]metano intrappolato, riscaldare la colonna della carbosfera a 80 oC.
- Far reagire il [11C] metano purificato con lo iodio elementare a 720 oC per formare [11C]ioduro di metile ([11C]CH3I) per mezzo di una pompa a gas di ricircolo di elio in cui lo ioduro di idrogeno generato in modo incidente viene trattenuto da un'altra trappola di ascarite mentre il [11C] metano non convertito ritorna nel processo di circolazione.
- Intrappolare il [11C]CH3I formato a temperatura ambiente sulla colonna di ioduro di metile (MeI) che si è accumulato durante il processo di ricircolo.
- Al termine del processo di circolazione, rilasciare il [11C]CH3I raccolto dalla trappola MeI riscaldandolo a 190 oC sotto flusso di elio (15 mL/min), bypassato dalla colonna MeTf e guidato attraverso una valvola di ritegno nel circuito di acciaio inossidabile da 1,5 mL contenente la soluzione precursore precaricata (passaggio 1.5.1).
- Una volta che il [11C]CH3I ha attraversato l'ansa per 180 s, iniettare la miscela di reazione sulla colonna HPLC semi-prep per la purificazione. Utilizzare le seguenti condizioni HPLC: fase mobile di acetonitrile 37:63 (v/v): idrossido di ammonio 20 mM a una velocità di flusso di 5,0 mL/min e una lunghezza d'onda UV di 235 nm; tempo di ritenzione (tR) di [11C]ER-176: circa 12-14 min. Vedere la Figura 5.
- Raccogliere il campione di frazione in un grande pallone di raccolta contenente 25 ml di acqua deionizzata sterile. Caricare la miscela diluita su una cartuccia di estrazione in fase solida leggera (SPE) C18 .
- Lavare il prodotto (1) con altri 10 ml di acqua deionizzata sterile.
- Eluire il prodotto desiderato dal C18 light SPE con l'uso di etanolo a prova di 200 (1 mL). Dirigere questa eluizione in un pallone di formulazione precaricato con cloruro di sodio allo 0,9% per preparazioni iniettabili (6 mL).
- Sciacquare ulteriormente il C18 light SPE con altri 3 mL di cloruro di sodio allo 0,9% per preparazioni iniettabili attraverso il serbatoio V4.
- Raccogliere la soluzione finale nel pallone di formulazione (~10 mL) e passare attraverso un filtro sterilizzante da 0,22 μm in un flaconcino di vetro USP Tipo I da 50 mL sterile, apirogeno, preassemblato, sigillato con un setto di gomma e crimpato con un tappo di alluminio.
- Utilizzando i telemanipolatori, rimuovere un'aliquota dalla fiala del prodotto finale come campione di controllo qualità (QC). Sottoporre questo campione a numerosi test di controllo qualità per garantire la conformità con le specifiche stabilite prima del rilascio e della somministrazione a un paziente (vedere Tabella 2).
NOTA: Applicare questa procedura con il metodo del loop utilizzando [11C]CH3I per la radiomarcatura di (2); generare e utilizzare [11C]CH3OTf per produrre (3) e (4) (vedi File supplementare 1).- Per seguire la tipica analisi di controllo qualità condotta nello stabilimento, utilizzare i telemanipolatori per trasferire un campione dalla fiala del prodotto finale in una siringa per la tubercolosi e quindi alla sala di controllo qualità utilizzando un supporto schermato in piombo.
- In un'area schermata dal piombo (blocco L), espellere il campione in una provetta apirogena e quindi erogarlo in fiale di vetro più piccole (50-100 μl) per analisi HPLC e gascromatografia (GC).
- Diluire un secondo campione con acqua apirogena alla concentrazione appropriata per l'analisi delle endotossine batteriche.
- Inoculare un campione della soluzione del prodotto finale (sia in brodo di soia triptico (TSB) che in terreno fluido tioglicolato (FTM) come campione di sterilità). Incubare e osservare questi campioni per la crescita nell'arco di 14 giorni.
- Applicare una piccola aliquota su una striscia di pH per determinare visivamente l'acidità/basicità della soluzione del prodotto finale.
2. Metodo del recipiente di reazione per la marcatura radiofonica di [11C]ER-176 (1)
- Assicurarsi che il modulo sia pulito a fondo secondo il protocollo di pulizia interno.
- Utilizzare 1 N HCl, acqua, acetone e acetonitrile per pulire la parte di reazione del modulo e acqua seguita da etanolo per pulire e sterilizzare la parte di formulazione del modulo.
- Condizionare il forno a metano (CH4) a 350 oC per 20 minuti con un flusso di idrogeno gassoso di 100 mL/min prima di tutte le produzioni eseguite sul modulo. Raffreddare a 45 oC prima di procedere.
- Condizionare la trappola CH4 a 120 oC per 20 minuti con un flusso di gas elio di 50 mL/min prima di tutte le produzioni eseguite sul modulo. Raffreddare a 70 oC prima di procedere.
- Condizionare la trappola MeI a 190 oC per 20 minuti con un flusso di gas elio di 50 mL/min prima di tutte le produzioni. Raffreddare a 50 oC prima di procedere. Assicurarsi che il tubo V8 sia collegato all'ago nel recipiente.
- Eseguire un test di tenuta utilizzando gas elio, dalla valvola di ricezione (da V24 a V16) al circuito interno di MeI, e da V8 al recipiente utilizzando V23 come fonte di tenuta/scarico.
- Caricamento dei reagenti per il modulo:
- Aggiungere quanto segue: (R)-N-sec-butil-4-(2-clorofenil)-chinazolina-2-carbossammide (1,0 ± 0,05 mg) in dimetilsolfossido-d6 (100 ± 10 μL) e 6 N idrossido di sodio (4 μL) al recipiente del reattore.
- Caricare il serbatoio V2 con 1,0 mL di acetonitrile 37:63:20 mM idrossido di ammonio.
- Caricare il serbatoio V4 con 3,0 mL di cloruro di sodio allo 0,9% per preparazioni iniettabili.
- Caricare il serbatoio V5 con 1,0 mL di etanolo a prova 200.
- Caricare il serbatoio V6 con 10 mL di acqua deionizzata sterile.
- Riempire il pallone di raccolta grande con 25 ml di acqua deionizzata sterile.
- Riempire il pallone di formulazione con 6,0 mL di cloruro di sodio allo 0,9% per preparazioni iniettabili.
- Assicurarsi che la linea di erogazione sia collegata alla fiala di prodotto finale sterile preassemblata.
- Riempire un serbatoio con la fase mobile HPLC (acetonitrile:20 mM idrossido di ammonio 37:63 (v/v)) e collegarlo alla pompa HPLC.
NOTA: La colonna di semi-preparazione utilizzata è la stessa di cui sopra e precondizionata con la fase mobile (4 volumi di colonna).
- Durante la preparazione del modulo automatizzato, bombardare il bersaglio del ciclotrone carbonio-11 (1% di ossigeno, 99% di azoto) su un ciclotrone da 11 MeV a 55 μA per 60-80 minuti su bersagli a doppio raggio per produrre [11C]anidride carbonica mediante la reazione nucleare 14N(p,α) 11C.
- Circa 20 minuti prima di scaricare l'anidride carbonica [11C] dal ciclotrone al modulo, avviare l'elenco dei tempi convalidati per la sintesi di [11C]ER-176 facendo clic sul pulsante di avvio . Lasciare raffreddare la colonna CH4 a 45 oC prima di ricevere l'anidride carbonica radioattiva [11C] (vedere la Figura 3). Lasciare raffreddare la trappola della colonna della carbosfera (trappola CH4 ) a -75 oC
- Si proceda come segue il metodo incorporato nel modulo per la conversione dell'anidride carbonica [11C] in [11C]ioduro di metile, mediante un processo di chimica a secco:
- Convertire l'attività dell'anidride carbonica in [11C]metano reagendo con l'idrogeno gassoso a 350 oC su un catalizzatore di nichel (Shimalite-Nickel). Trattenere sia l'anidride carbonica [11C] non convertita che l'acqua formata con una trappola per ascarite (idrossido di sodio).
- Intrappolare il [11C]metano su una colonna di carbosfera a -75 oC per un'ulteriore purificazione e concentrazione. Per rilasciare il [11C]metano, riscaldare la colonna della carbosfera a 80 oC.
- Far reagire il [11C] metano purificato con lo iodio elementare a 720 oC per formare [11C]ioduro di metile per mezzo di una pompa di gas di ricircolo in cui l'idrogeno generato in modo incidente viene trattenuto da un'altra trappola di ascarite mentre il [11C] metano non convertito ritorna nel processo di circolazione, chiamato ricircolo del circuito interno.
- Intrappolare lo ioduro di metile [11C] formato a temperatura ambiente sulla colonna MeI che si è accumulato durante il processo di ricircolo.
- Al termine del processo di circolazione, riscaldare la trappola adsorbente polimerica porosa a 190 oC sotto flusso di elio (30 mL/min) per rilasciare lo ioduro di metile [11C]raccolto e guidarlo attraverso una valvola di ritegno fino al recipiente di reazione da 3 mL per la radiomarcatura al carbonio-11 di (1).
- Una volta che la generazione e l'accumulo di [11C]ioduro di metile si sono stabilizzati, bypassare la colonna di triflato d'argento e dirigere il gas radioattivo attraverso V8 nel recipiente di reazione contenente la miscela precursore. Lasciare bollire lo iodurodi metile per 3 minuti, quindi sigillare il recipiente di reazione e riscaldarlo a 80 °C per 5 minuti.
- Una volta completata la marcatura, dopo 5 minuti, raffreddare il recipiente di reazione a 30 oC e diluire con 1 mL di fase mobile dal serbatoio V2.
- Iniettare la miscela sulla colonna HPLC semi-prep per la purificazione utilizzando le seguenti condizioni HPLC: fase mobile di acetonitrile 37:63 (v/v): 20 mM di idrossido di ammonio a una velocità di flusso di 5,0 mL/min e una lunghezza d'onda UV di 235 nm; tR di [11C]ER-176 (1): circa 9-11 min, vedi Figura 6.
- Raccogliere il campione di frazione nel grande pallone di raccolta contenente 25 ml di acqua deionizzata sterile. Caricare questa miscela diluita su una cartuccia SPE leggera C18 .
- Lavare il prodotto intrappolato (1) con altri 10 ml di acqua deionizzata sterile.
- Eluire il prodotto desiderato dal C18 light SPE con l'uso di etanolo proof 200 (1,0 mL), diretto in un pallone di formulazione precaricato con cloruro di sodio allo 0,9% per preparazioni iniettabili (6,0 mL).
- Sciacquare il C18 light SPE con altri 3,0 mL di cloruro di sodio allo 0,9% per preparazioni iniettabili.
- Raccogliere la soluzione finale nel pallone di formulazione (~10 mL). Passare questo terreno attraverso un filtro sterilizzante da 0,22 μm in una fiala di vetro USP Tipo I da 50 mL sterile e apirogena preassemblata, sigillata con un setto di gomma e crimpata con un tappo di alluminio.
- Utilizzare i telemanipolatori per rimuovere un'aliquota dalla fiala del prodotto finale come campione di controllo qualità (QC) (vedere il passaggio 1.15). Sottoporre il campione a diversi test in cui il radiotracciante deve superare tutti i criteri di accettazione prima del rilascio e della somministrazione in un paziente (vedere Tabella 2).
NOTA: Applicare questo metodo del recipiente del reattore utilizzando [11C]CH3I per la radiomarcatura di (2); generare e utilizzare [11C]CH3OTf per produrre (3) e (4) (vedi File supplementare 1).
Risultati
Il gruppo di radiochimica della New York University Langone Health (NYULH) fornisce vari radiotraccianti al carbonio-11, fluoro-18 e gallio-68 utilizzati sia per la ricerca umana che per le applicazioni precliniche. Diversi metodi sono utilizzati per la produzione dei radiotraccianti PET. Il nostro team utilizza il metodo del loop per la sintesi di (1), (2), (3) e (4) (vedi Figura 1 e Figura 8). Al termine della produzione, un'aliquota viene rimossa dal flacone sterile del prodotto finale. Questo campione viene utilizzato sia per l'inoculazione della soluzione del prodotto finale (sia in brodo di soia triptico (TSB) che in terreno di terreno fluido tioglicolato (FTM) come campione di sterilità) sia come campione rappresentativo della soluzione sfusa per i test QC. Ogni radiotracciante viene sottoposto a test QC prima che il prodotto venga rilasciato per la somministrazione (vedere Tabella 2).
I test di controllo qualità includono la visualizzazione dell'aspetto del prodotto, la verifica dell'integrità del filtro, la determinazione dell'identità radionuclidica, del pH, dell'identità radiochimica (radio-HPLC), della purezza radiochimica (radio-HPLC), della purezza chimica (HPLC), dell'attività molare, della resistenza, del solvente residuo, delle endotossine e della sterilità (vedere la Tabella 2). I seguenti risultati sono stati ottenuti dalla produzione clinica di ciascun radiotracciante sopra menzionato (vedi Tabella 1).
Per un cromatogramma HPLC analitico rappresentativo, vedere la Figura 7 e il File supplementare 1. Ogni radiotracciante è tenuto a superare tutte le specifiche del controllo di qualità (vedere la Tabella 2) prima di poter essere rilasciato e somministrato a un soggetto.
Fare riferimento al file supplementare 1 per le quantità di precursori e reagenti, nonché per i cromatogrammi analitici HPLC di [11C]MRB (2) (Figura supplementare 1), [11C]mHED (3) (Figura supplementare 2) e [11C]PiB (4) (Figura supplementare 3).
| Composto | Parametri | Metodo del ciclo (media ± std) | Metodo del reattore (media ± std) |
| [11C]ER-176 | numero di produzioni | 25 | 6 |
| Inizio della sintesi | 86 ± 5,0 GBq | 52 ± 25,7 GBq | |
| Fine della sintesi | 5,4 ± 2,2 GBq | 1,6 ± 0,5 GBq | |
| Purezza radiochimica | 99,6 ± 0,6% | 99,9 ± 0,1% | |
| Concentrazione ER-176 | 1,1 ± 0,5 μg/mL | 0,63 ± 0,37 μg/mL | |
| Attività molare | 194 ± 66 GBq/μmol | 132 ± 78 GBq/μmol | |
| Tempo di sintesi totale | 36 ± 3 minuti | 44 ± 6 minuti | |
| [11C]MRB | numero di produzioni | 70 | 6 |
| Inizio della sintesi | 84 ± 5,4 GBq | 39 ± 11,9 GBq | |
| Fine della sintesi | 3,0 ± 1,2 GBq | 1,9 ± 0,7 GBq | |
| Purezza radiochimica | 99,5 ± 0,5% | 99,7 ± 0,8% | |
| Concentrazione di MRB | 0,52 ± 0,24 μg/mL | 0,68 ± 0,41 μg/mL | |
| Attività molare | 190 ± 50 GBq/μmol | 99 ± 55 GBq/μmol | |
| Tempo di sintesi totale | 35 ± 3 minuti | 42 ± 3 minuti | |
| [11C]mHED | numero di produzioni | 5 | 11 |
| Inizio della sintesi | 69 ± 10,5 GBq | 82 ± 4,3 GBq | |
| Fine della sintesi | 5,5 ± 1,3 GBq | 3,3 ± 1,0 GBq | |
| Purezza radiochimica | 98,2 ± 1,3% | 99,1 ± 0,7% | |
| Concentrazione di mHED | 0,40 ± 0,10 μg/mL | 0,52 ± 0,37 μg/mL | |
| Attività molare | 301 ± 48 GBq/μmol | 155 ± 77 GBq/μmol | |
| Tempo di sintesi totale | 27 ± 4 minuti | 32 ± 2 minuti | |
| [11C]PiB | numero di produzioni | 51 | 10 |
| Inizio della sintesi | 86 ± 5,4 GBq | 57 ± 17,2 GBq | |
| Fine della sintesi | 3,2 ± 0,8 GBq | 1,4 ± 0,2 GBq | |
| Purezza radiochimica | 97,0 ± 1,5% | 99,1 ± 1,4% | |
| Concentrazione di PiB | 0,22 ± 0,51 μg/mL | 0,30 ± 0,24 μg/mL | |
| Attività molare | 201 ± 68 GBq/μmol | 207 ± 124 GBq/μmol | |
| Tempo di sintesi totale | 35 ± 2 minuti | 36 ± 5 minuti |
Tabella 1: Risultati della produzione di [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) e [11C]PiB (4) mediante il metodo dell'ansa o del recipiente di reazione. Tutti i valori sono riportati alla fine della sintesi. Abbreviazioni: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilchinazolina-2-carbossammide; [11C]MRB = (S,S)-[11C]metilreboxetina; [11C]mHED = [11C]-meta-idrossiefedrina; [11C]PiB = 2-[4-[(11C)metilammino]fenil]-1,3-benzotiazol-6-olo.
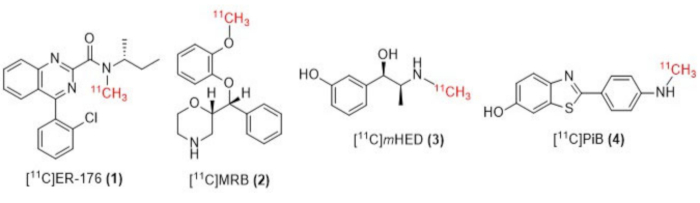
Figura 1: Strutture di [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) e [11C]PiB (4). Abbreviazioni: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilchinazolina-2-carbossammide; [11C]MRB = (S,S)-[11C]metilreboxetina; [11C]mHED = [11C]-meta-idrossiefedrina; [11C]PiB = 2-[4-[(11C)metilammino]fenil]-1,3-benzotiazol-6-olo. Clicca qui per visualizzare una versione più grande di questa figura.
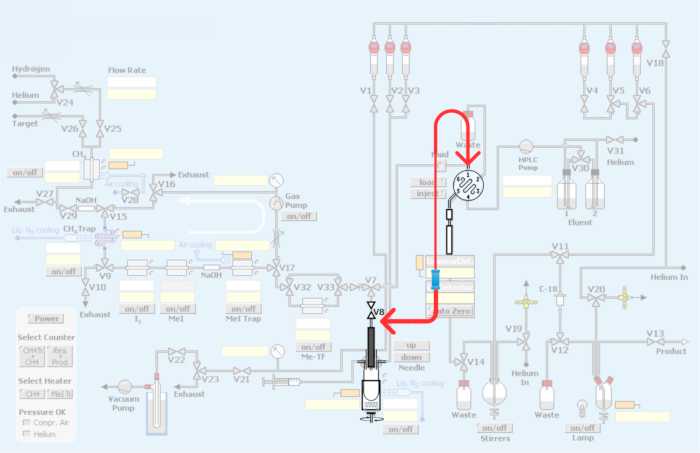
Figura 3: Modifiche apportate al modulo automatizzato. In rosso rappresenta il replumbing del modulo di sintesi per incorporare il loop per la produzione di radiotraccianti PET mediante metilazione del carbonio-11. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Impianto idraulico e riimpianto idraulico del modulo per incorporare il metodo del circuito per la metilazione del carbonio-11 dei radiotraccianti PET. (A) Circuito di iniezione HPLC con connettori di raccordo. (B) Metodo del recipiente di reazione. La freccia rossa che mostra la connessione V8. (C) Ri-impianto idraulico con metodo ad anello, by-passando il contenitore del reattore. Si noti che la connessione V8 all'ingresso dell'HPLC bypassa il recipiente di reazione, consentendo l'accesso diretto al [11C]iodometano o al [11C]metiltriflato all'ansa dell'HPLC. (D) Collocazione dell'unione per quanto riguarda il contenitore del reattore. Notare il collegamento all'anello HPLC in acciaio inossidabile. Clicca qui per visualizzare una versione più grande di questa figura.
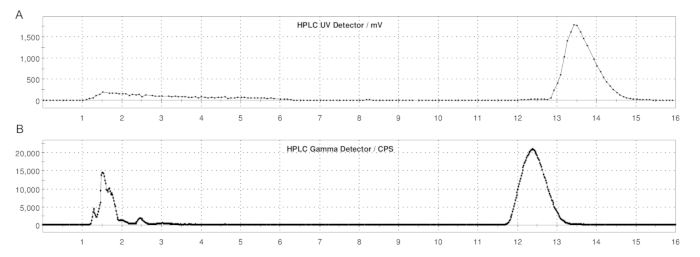
Figura 5: Profili HPLC semi-prep di ER-176 e [11C]ER-176 con produzione con metodo loop. (A) Profilo HPLC semi-prep per ER-176 (1) mediante produzione con metodo loop a UV = 235 nm; tR = 13,2 min. (B) Profilo radio-HPLC semi-prep per [11C]ER-176 (1); tR = 12,4 min. Condizioni: fase mobile di acetonitrile 37:63 (v/v): 20 mM di idrossido di ammonio a una velocità di flusso di 5,0 mL/min. Abbreviazione: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilchinazolina-2-carbossammide. Clicca qui per visualizzare una versione più grande di questa figura.
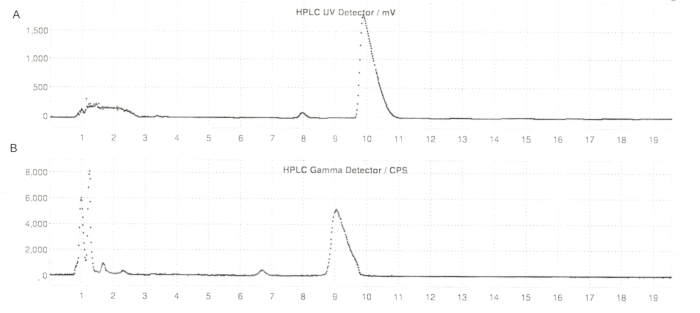
Figura 6: Profili HPLC semi-prep di ER-176 e [11C]ER-176 con produzione del metodo del reattore. (A) Profilo HPLC semi-prep per ER-176 (1) mediante produzione con metodo del reattore a UV = 235 nm; tR = 9,8 min. (B) Profilo radio-HPLC semi-prep per [11C]ER-176 (1); tR = 9,2 min. Condizioni: fase mobile di acetonitrile 37:63 (v/v): 20 mM di idrossido di ammonio a una velocità di flusso di 5,5 mL/min. Abbreviazioni: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilchinazolina-2-carbossammide; tR = tempo di ritenzione. Clicca qui per visualizzare una versione più grande di questa figura.
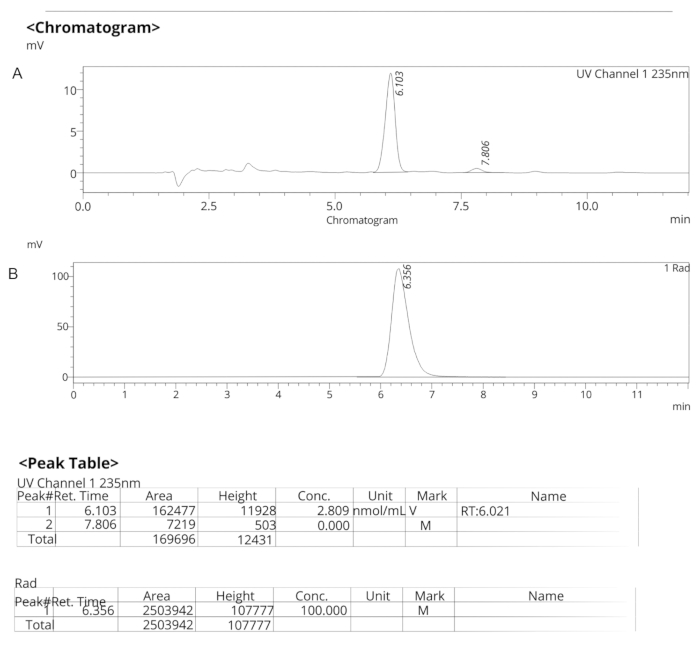
Figura 7: Profili analitici HPLC per ER-176. (A) Profilo analitico HPLC degli spettri UV per ER-176 (1) a 235 nm; tR = 6,10 min. (B) Profilo analitico HPLC del radiotracciante per [11C]ER-176 (1); tR = 6,36 min. Condizioni: 10 μm C18 (2) 100  LC Colonna 250 x 4,6 mm; metanolo/acqua 74/26 con una portata di 1,5 mL/min. Abbreviazione: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilchinazolina-2-carbossammide; tR = tempo di ritenzione Fare clic qui per visualizzare una versione più grande di questa figura.
LC Colonna 250 x 4,6 mm; metanolo/acqua 74/26 con una portata di 1,5 mL/min. Abbreviazione: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilchinazolina-2-carbossammide; tR = tempo di ritenzione Fare clic qui per visualizzare una versione più grande di questa figura.
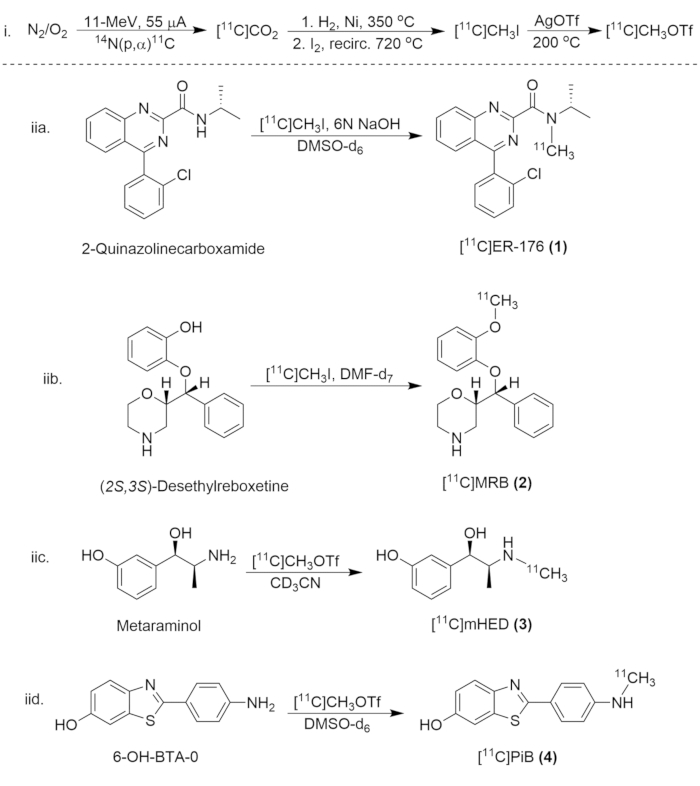
Figura 8: Schema sintetico per la sintesi di composti di carbonio-11. (i) La formazione di [11C]CH3I e [11C]CH3OTf, e (iia.) la marcatura radiofonica di [11C]ER-176 (1), (iib.) [11C]MRB (2), (iic.)[11C]mHED (3), e (iid.) [11C]PiB (4). Clicca qui per visualizzare una versione più grande di questa figura.
| Test/Parametri | Indicazioni |
| Aspetto (ispezione visiva) | Soluzione limpida, incolore e priva di particelle |
| Integrità del filtro a membrana | ≥ 50 psi |
| ph | 4.5 - 8.0 |
| Identità radionuclidica (emivita) | 19,3 - 21,3 minuti |
| Identità radiochimica (radio-HPLC) | 0,90 ≤t R Prod / t R Std ≤ 1,10 |
| Purezza radiochimica (radio-HPLC) | ≥ 95,0%† |
| Concentrazione del farmaco (HPLC) | Vedi note* |
| Impurità chimiche totali (HPLC) | vedi note** |
| Attività molare (@ EOS) | > 9,25 GBq/μmol |
| Acetonitrile residuo (GC) | ≤ 410 ppm |
| Acetone residuo (GC) | ≤ 5.000 ppm |
| Residuo di dimetilsolfossido (GC) | ≤ 5.000 ppm |
| Etanolo residuo (GC) | ≤ 10% (v/v) |
| Metanolo residuo (GC) | ≤ 3.000 ppm |
| Residuo di N,N-dimetilformammide (GC) | ≤ 880 ppm |
| Limulus Amoebocyte Lysate (LAL) | ≤ 17,5 EU/mL |
| Sterilità (iniziare entro 30 ore) | Sterile (14 giorni) |
| Registri di preparazione | Completo e accurato |
| Etichette | Completo, accurato, riconciliato |
Tabella 2: Criteri di controllo della qualità per l'approvazione o il rifiuto dei radiotraccianti al carbonio-11. † Purezza radiochimica ≥ 90,0% per [11C]mHED; * Concentrazione del farmaco: [11C]ER-176 ≤ 10 μg/dose; [11C]MRB ≤ 10 μg/dose; [11C]mHED ≤ 50 μg/dose; [11C]PiB ≤ 13,4 μg/dose; ** Impurità chimiche totali: [11C]ER-176 ≤ 1,0 μg/dose; [11C]MRB ≤ 1,0 μg/dose; [11C]mHED ≤ 5,0 μg/dose; [11C]PiB ≤ 1,34 μg/dose. Abbreviazioni: [11C]ER-176 = [11C]-(R)-N-sec-butil-4-(2-clorofenil)-N-metilchinazolina-2-carbossammide; [11C]MRB = (S,S)-[11C]metilreboxetina; [11C]mHED = [11C]-meta-idrossiefedrina; [11C]PiB = 2-[4-[(11C)metilammino]fenil]-1,3-benzotiazol-6-olo; EOS = fine della sintesi; GC = gascromatografia; LAL = Limulus Lisato di Amebociti.
File supplementare 1: Sostanze chimiche e materiali, reagenti utilizzati per il metodo del loop o del recipiente del reattore, test di controllo qualità, cromatogrammi analitici HPLC. Clicca qui per scaricare questo file.
Discussione
La radiomarcatura tradizionale di eteroatomi terminali con iodometano di carbonio-11 o triflato di metile comporta il gorgogliamento del gas elettrofilo radioattivo in un recipiente di reazione, intrappolandolo e lasciando che la soluzione reagisca per lunghi periodi di tempo18. Il gorgogliamento convenzionale della reazione eterogenea può essere lento e può richiedere il riscaldamento per accelerare la velocità di reazione. Prima della purificazione, può essere necessario raffreddare il mezzo di reazione a temperatura ambiente, seguito dal trasferimento in un circuito HPLC con l'uso di solvente (ad esempio, fase mobile) per la purificazione del radiotracciante desiderato. Questi passaggi richiedono molto tempo e i prodotti radiomarcati fugaci possono andare persi durante il trasferimento di tali materiali.
Presso la nostra struttura, abbiamo dimostrato la giustificazione per l'utilizzo del metodo del loop, in cui la soluzione precursore è rivestita su un loop di acciaio inossidabile HPLC e la marcatura radiografica del composto avviene all'interno del loop a temperatura ambiente. L'ansa è legata in linea con l'erogazione del radioattivo [11C]CH3I o [11C]CH3OTf e collegata alla porta di iniezione di un sistema HPLC. Non è necessario alcun riscaldamento per la radiomarcatura e, per tutti i casi mostrati in questo manoscritto, la reazione avviene in meno di 3 minuti.
La portata e le dimensioni del circuito HPLC in acciaio inossidabile sembrano essere fondamentali per il funzionamento efficiente di questo processo. I test sono iniziati variando la portata del gas di trasporto, l'elio, da 8,0 mL/min a 15,0 mL/min per il gas radioattivo da erogare al circuito. Buckley ha studiato l'importanza di applicare la corretta portata e di utilizzare il solvente e il materiale dell'ansa appropriati15. Per il nostro sistema, la velocità di flusso di 15 mL/min per le specie elettrofile radioattive di [11C]CH3I o [11C]CH3OTf si comporta bene per la radiomarcatura di tutti e quattro i radiotraccianti discussi in questo manoscritto. L'ansa utilizzata per tutte le sintesi è un'ansa di iniezione HPLC in acciaio inossidabile da 1,5 mL con un diametro esterno di 1/16 di pollice e un diametro interno di 1 mm.
Confrontando i due metodi (metodo del recipiente di reazione rispetto al metodo del loop), nelle nostre mani, il metodo del loop ha dimostrato una maggiore efficienza di radiomarcatura insieme a un aumento sostanziale dell'attività molare alla fine della sintesi (EOS) per la produzione di quattro radiotraccianti approvati dalla ricerca umana. Ad esempio, il radiotracciante [11C]mHED (3) ha avuto un aumento di 1,6 volte dell'attività del prodotto finale isolato insieme al raggiungimento del doppio dell'attività molare a EOS. Questa tendenza all'aumento dell'attività complessiva si osserva in tutti e quattro i radiotraccianti (vedi Tabella 1). Ulteriori risultati favorevoli quando si utilizza il metodo ad anello includono un tempo di configurazione ridotto di 5 minuti e l'assenza di pulizia del recipiente di reazione, risparmiando tempo all'operatore e l'uso di solventi per un protocollo di pulizia.
Alcuni svantaggi di questa metodologia includono i limiti in base ai quali i radiotraccianti possono essere efficacemente marcati utilizzando il metodo del loop. Se il calore è necessario per la radiomarcatura, è difficile modificare questo sistema per consentire il riscaldamento all'interno del circuito HPLC. Questo sistema richiede modifiche all'impianto idraulico; Questa caratteristica di non averlo pronto "fuori dalla scatola" può dissuadere altri utenti dall'eseguire tali modifiche alla loro piattaforma automatizzata14. Poiché per questo metodo sono necessari impianti idraulici e raccordi supplementari (vedi Figura 4A-D), il potenziale per ulteriori siti per i rilasci radioattivi aumenta quando si esegue la marcatura in queste condizioni. È prudente eseguire un controllo delle perdite prima di ogni esecuzione del modulo.
Il nostro team ha implementato il metodo del loop utilizzato nella produzione approvata dall'Investigational New Drug Application (IND) e dal Radioactive Drug Research Committee (RDRC) di quattro radiotraccianti al carbonio-11. Nelle nostre mani, questo metodo si è rivelato un processo più efficiente e più produttivo rispetto al tradizionale metodo del recipiente di reazione. Quando si applica questo metodo alla maggior parte dei moduli automatizzati, è necessario prendere in considerazione ulteriori impianti idraulici e regolazioni della portata del gas elio di trasporto. Infine, questo metodo presenta limitazioni e non è adatto per alcuni radiotraccianti al carbonio-11, come il [11C]UCB-J, che richiede l'attivazione dell'intermedio del palladio (II) e il riscaldamento24 della miscela di reazione.
Divulgazioni
Gli autori dichiarano di non avere interessi rilevanti o finanziari relativi a questa ricerca da divulgare.
Riconoscimenti
Vorremmo ringraziare gli ex membri del laboratorio di radiochimica del NYULH, Raul Jackson e Grace Yoon, per il loro lavoro sugli sforzi iniziali per la metilazione del carbonio-11 utilizzando un metodo ad anello.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
Riferimenti
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon