Method Article
שיפור היעילות ותפוקות התיוג הרדיואקטיבי של רדיוליגנדים פחמן-11 למחקר קליני בשיטת לולאה
In This Article
Summary
פרוטוקול זה מציג הליך מפורט להכנת ארבעה רדיוטרייסרים פחמן-11 באמצעות "שיטת הלולאה" [11C]מתילציה. אנו מתארים את הליך הסינתזה [11C]ER-176, עם נתונים עבור שלושה רדיוטרייסרים נוספים: [11C]MRB, [11C]mHED ו-[11C]PiB. שיטת הלולאה מספקת סינתזה יעילה עם תפוקות רדיוכימיות מוגברות כנגד כלי התגובה המסורתיים [11C]methylation.
Abstract
תוכנית מוצלחת להדמיית טומוגרפיה של פליטת פוזיטרונים הכוללת רדיוטרייסרים של פחמן-11 דורשת שיטות סינתזה מהירות, יעילות ואמינות, הדורשות קבוצת ציקלוטרון ורדיוכימיה באתר, כמו גם צוות קליני שהוכשר לפעול תחת האילוצים הייחודיים של רדיונוקליד פחמן-11. מחקר זה בוחן את היתרונות והיתרונות של 'שיטת לולאה' של ממס בשבי של תיוג רדיואקטיבי של ארבעה עוקבים עם רדיונוקליד פחמן-11, המייצר את הרדיוליגנדים [11C]ER-176, [11C]MRB, [11C]mHED, ו-[11C]PiB.
"שיטת הלולאה" מושווית לשיטה המסורתית מבוססת הכור של מתילציה של פחמן-11 במהלך סינתזה של אותם רדיוטרייסרים על פלטפורמה אוטומטית זהה. יתר על כן, מוצגת סקירה מלאה של הכנת המחקר הקליני של [11C]ER-176 radiotracer. כפי שהודגם על ידי הייצור של [11C]ER-176, 'שיטת הלולאה' של הממס השבוי של אלקילציה הטרוגנית הוכחה כיעילה יותר, עם טוהר רדיוכימי מעולה (99.6 ± 0.6%, n = 25), תפוקה רדיוכימית גבוהה ועקבית יותר (סוף הסינתזה (EOS) = 5.4 ± 2.2 GBq, n = 25) בהשוואה לשיטת הכור (EOS = 1.6 ± 0.5 GBq, n = 6), פעילות מולרית מוגברת (שיטת לולאה = 194 ± 66 GBq/μmol, n = 25; שיטת כור = 132 ± 78 GBq/μmol, n = 6), יחד עם רצף תגובה קצר יותר בממוצע של 5 דקות.
Introduction
בין השיטות בדימות מולקולרי, טומוגרפיית פליטת פוזיטרונים (PET) נבדלת באופן הרזולוציה של התהליכים הביוכימיים הקשורים למטרות פיזיולוגיות ספציפיות או לאזורי עניין 1,2. הרגישות האופיינית והאופי הלא פולשני של PET נרתמים להדמיית in vivo וכימות של פתופיזיולוגיה של מחלות, ולעתים קרובות חושפים מטרות בלתי נראות על ידי טכניקות הדמיה אנטומיות יותר כגון טומוגרפיה ממוחשבת (CT)3 או דימות תהודה מגנטית (MRI)4. הדמיה מולקולרית עכשווית רואה את השילוב של PET עם CT או MRI (PET/CT או PET/MR, בהתאמה), תוך מינוף רזולוציית הניגודיות הגבוהה ופרמטרי הדימות הניתנים לכימות של PET כדי לספק מפות תיקון הנחתה מדויקות ביותר (PET/CT) ורזולוציה מרחבית משופרת (PET/MR)5, תוך התגברות על כמה מכשולים המוצגים על ידי שונות באנרגיות קינטיות גבוהות יותר של פוזיטרונים מרדיונוקלידים כגון גליום-68 ורובידיום-826. טכניקות הדמיה דו-מודאליות אלה מתעלות את תכונות ההיכר של כל מודל בנפרד, ומספקות לקלינאים או לחוקרים שפע של תובנות אנטומיות וביוכימיות רשומות במשותף על נושא המחקר5.
הישימות הקלינית של טכניקת הדמיה זו היא עצומה, ומציעה הדמיה ומדידה של תהליכים פיזיולוגיים ברמה מולקולרית מגוונים כמו מטבוליזם של גלוקוז 7,8, קשירת קולטן נוירוטרנסמיטר9, זילוח שריר הלב10 ומצבים נוירולוגיים שונים11. מחוץ לשימוש קליני, התכונות הטבועות ב-PET מותאמות למלא תפקיד אינטגרלי בפיתוח תרופות אבחוניות וטיפוליות, ומאפשרות לכמת פרמטרים כגון פוטנציאל קשירה (BP), הפצה ביולוגית, נפח הפצה (VT) ותפוסת קולטני תרופות (RO%) על ידי תצפית ישירה על יחסי הגומלין בין פרמקולוגיה, פרמקוקינטיקה ופרמקודינמיקה. זה בתורו תורם לקביעות, כולל האם תרכובת מגיעה למטרה במינון יעיל (ED50) ריכוז, מידת החדירה היעילה של מחסום הדם-מוח, שלמות חילוף החומרים של התרכובת, ומינון מתאים מרווחמינון 11.
בפיתוח בדיקה שימושית להדמיית PET, עם זיהוי סמן ביולוגי מתאים ובחירת ליגנד קשור, תיוג רדיואקטיבי של הביומולקולה עם רדיונוקליד PET מתאים מניב את הגשושית הרדיוטרייסר למחקר PET. בין רדיונוקלידים מסוג PET לחקר שאלות ביולוגיות, פרמקולוגיות או רפואיות, פחמן-11 מציע שילוב של רב-תכליתיות סינתטית ומאפיינים פיזיקליים חיוביים המאפשרים שימוש נרחב בו על פני ביומולקולות מגוונות וליגנדים מתאימים6. עם פליטת פוזיטרונים של 99.8% וזמן מחצית חיים של 20.4 דקות12, פחמן-11 מאפשר מתן חוזר לנבדקים בפרקי זמן קצרים תוך שהוא עדיין מאפשר סינתזות מרובות שלבים. עם זאת, יתרונות אלה מחייבים מתקן עם יכולות ציקלוטרון ורדיוכימיה באתר5.
מתקנים כאלה דורשים שיטות מתילציה אמינות, חזקות וניתנות לשחזור המאפשרות תיוג רדיואקטיבי של מולקולות מקדימות, לעתים קרובות עם המצע האלקטרופילי [11C]iodomethane ([11C]CH3I) או [11C]methyl triflate ([11C]CH3OTf)13. מודול רדיוסינתזה, כפי שסופק מהיצרן, מוגדר בדרך כלל לגישת כלי תגובה לתגובות מתילציה [11C]14. זה כרוך בקירור הכלי לשימור יעיל [11C] יודומתאן או [11C] מתיל טריפלטה עם המסירה, איטום וחימום הכלי כדי להשפיע על התגובה, מרווה, ולאחר מכן העברת התוכן המגיב למערכת כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC) לטיהור חצי מכין13. בעוד טכניקה זו יעילה15, היא מציגה נקודות כשל מבניות פוטנציאליות רבות, המערבות מחיצות, מחטים וקווי העברה נלווים.
הצורך בשיטת מתילציה אמינה יותר וניתנת לשחזור הנחה את החקירה והמרדף אחר שינוי ממס בשבי לרבים מפרוטוקולי סינתזת הרדיוליגנד פחמן-11 שלנו. גישה זו נועדה להתמודד עם המגבלות של שיטת כלי התגובה הקונבנציונלית תוך שמירה או שיפור יעילות תיוג רדיו.
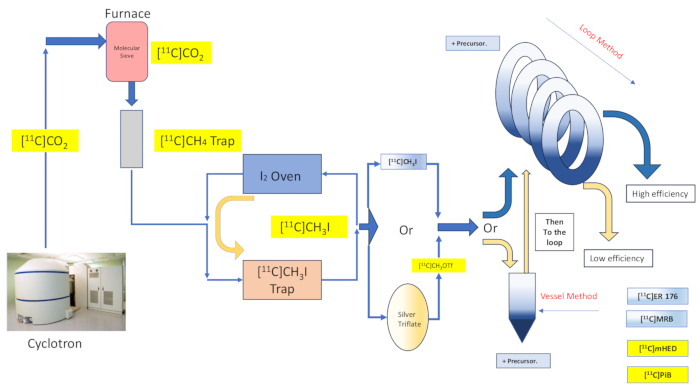
איור 2: תכנון וזרימה של סינתזת כלי התגובה ושיטת הלולאה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כימיה של ממס בשבי מציעה הבטחה ללכידה יעילה של מגיב התיוג הרדיואקטיבי ותגובה איתו באמצעות פיזור התמיסה המקדימה על פני שטח גדול של חומר או מבנה תומך, ולאחר מכן הכוונת מגיב התיוג הגזי למגע עם החומר המצופה16,17. זה משפר את היקף ואיכות הקשר בין שני השלבים המגיבים16,18. יישומים ווריאציות רבות של טכניקה זו תועדו כבר בשנת 1985 16,17,18,19,20, והיא נמצאה מיושמת עם [11C]methyl iodide, [11C]methyl triflate, כמו גם מגיב Grignard [11 C] פחמן דו חמצני תגובות radiolabeling20. חידוד נוסף הוצג על ידי הדיון בכימיה של "שיטת הלולאה" של ממס שבוי, שתוארה במקור על ידי וילסון ואחרים, שאינה דורשת תמיכה נוספת לזו שכבר מוצעת על ידי לולאת הטיהור של HPLC, וגם לא חימום או קירור של סביבת התגובה13. נמצא כי תיוג רדיואקטיבי של "שיטת לולאה" של ממס בשבי מקנה יודומתאן ומתיל טריפלטה [11C] תגובות מתילציה עם סגולות של אובדן העברה מינימלי, תפוקה רדיוכימית גבוהה, פעילות מולרית גבוהה, זמן תגובה מופחת ופשטות 7,21,22,23.
כאן נתאר את יישום "שיטת הלולאה" [11C] של טכניקת מתילציה שתוארה במקור על ידי וילסון13, ואחרות לאחר מכן 14,15,18,21,22,23 (ראו איור 2) באמצעות שינוי מכני (ראו איור 3) למודול הסינתזה שלנו (להלן המודול). בהתאם לאתוס השאפתני של פשטות ככל האפשר, שינויים מכניים אלה היו מינימליים ונגישים, וכתוצאה מכך הפחתה כוללת של המורכבות ההנדסית, ורק הוספת רכיבים חיוניים לאלה שכבר הותקנו על ידי יצרן המודול כמשויכים לסידור ברירת מחדל של תיוג רדיו כלי תגובה. הדבר בא לידי ביטוי בהחלטה להשתמש בלולאת הטיהור HPLC מנירוסטה שכבר סופקה והותקנה מראש על ידי יצרן המודולים, כמתואר להלן, אשר הוכיחה את עצמה כתואמת ויעילה לסינתזות שנבדקו. אנו דנים, בפירוט מלא, בפרוטוקול תיוג הרדיו המלא והמאומת של שיטת הלולאה המשמש בייצור המחקר הקליני לסינתזה של הרדיוטרייסר [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-methylquinazoline-2-carboxamide,[11C]ER-176 (1), באמצעות פחמן-11 יודומתאן. יתר על כן, אנו משווים תכונות רבות הקשורות ליעילות תיוג רדיו כפי שהן מבוצעות הן על ידי שיטת הכור והן על ידי שיטת הלולאה על פני שלושה רדיוליגנדים נוספים, הכוללים (S,S)-[11C]methylreboxetine ([11C]MRB (2)),[11C]-meta-hydroxyephedrine ([11C]mHED (3)), ו-2-[4-[(11C)methylamino]phenyl]-1,3-benzothiazol-6-ol ([11C]PiB (4)) שפותחו במתקן שלנו, כפי שנקבע על ידי ניתוח של אצוות מסונתזות (ראה טבלה 1 ואיור 1 ). השוואה זו ממחישה את הברכה הברורה לפרמטרים כגון תפוקה רדיוכימית ופעילות מולרית הקשורים ביישום תיוג רדיו "שיטת לולאה", המתאפשרת על ידי שינויים נגישים ופשוטים במודול בעלות מינימלית למעבדה לרדיוכימיה.
Protocol
הערה: כל הציוד והסינתזות מבוצעים בתא חם או במיני-תא עם סיכוך עופרת. זהירות: חלקיקים פולטי פוזיטרונים באנרגיה גבוהה נוצרים ומשמשים מהציקלוטרון. האזור מנוטר באמצעות מוני גייגר מכוילים, ואנשים עונדים טבעות ותגי דוזימטריה שהונפקו על ידי בטיחות קרינה. כל אנשי הצוות מאומנים לעבוד עם חומרים רדיואקטיביים באנרגיה גבוהה.
כל הסינתזות מבוצעות על מודול נקי ומעוקר בהתאם לנוהלי ההפעלה הסטנדרטיים הפנימיים שלנו (SOP). תהליך הניקוי כולל שימוש ב-1 N HCl, מים, אצטון ואצטוניטריל עבור חלק התגובה של המודול. בינתיים, חלק הפורמולציה של המודול מנוקה ומעוקר עם מים ואתנול.
1. תיוג רדיו של [ 11C]ER-176 (1) בדרך של שיטת לולאה
הערה: לקבלת רשימה של החומרים המשמשים להכנת [11C]ER-176 (1), ראה טבלת חומרים.
- Replumb את המודול עבור ייצור שיטת לולאה (ראה איור 4A-D). חבר שסתום V8 לאיחוד המתחבר ישירות ללולאת HPLC. זה יעקוף את כלי התגובה.
- מצב את תנור המתאן (CH4) ב 350 oC למשך 20 דקות עם זרימת גז מימן של 100 מ"ל / דקה לפני כל ההפקות שבוצעו על המודול. מצננים ל 45 מעלותצלזיוס לפני שתמשיכו.
- התנה את מלכודת CH4 ב 120 oC במשך 20 דקות עם זרימת גז הליום של 50 מ"ל / דקה לפני כל ההפקות שבוצעו על המודול. מצננים ל 70 מעלותצלזיוס לפני שתמשיכו.
- התנה את מלכודת המתיל יודיד ב 190 oC למשך 20 דקות עם זרימת גז הליום של 50 מ"ל / דקה לפני כל ההפקות שבוצעו על המודול. מצננים ל-50 מעלותלפני שממשיכים.
- טעינת מגיב למודול:
- באמצעות מזרק 100 μL, הזריקו את התערובת הבאה דרך המתאם במיקום #1 של לולאת HPLC הפנימית של שסתום שש היציאות: (R)-N-sec-butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide (1.0 ± 0.05 מ"ג) בדימתיל סולפוקסיד-d6 (100 ± 10 μL) ו-6 N נתרן הידרוקסידי (4 μL).
הערה: ממיסים מפוזרים נבחרו בשל זמינותם בצורת אמפולה ומכיוון שהם מזוקקים בדרך כלל במהלך הייצור, מה שמבטיח שהם נקיים ממים. - טען את מאגר V4 עם 3.0 מ"ל של 0.9% נתרן כלורי להזרקה.
- טען את מאגר V5 עם 1.0 מ"ל של אתנול 200-proof .
- טען את מאגר V6 עם 10 מ"ל של מים סטריליים deionized.
- ממלאים את בקבוק הקבלה הגדול עם 25 מ"ל של מים סטריליים deionized.
- ממלאים את בקבוק הפורמולה ב-6.0 מ"ל של 0.9% נתרן כלורי להזרקה.
- ודא שקו המשלוח מחובר לבקבוקון מוצר סופי סטרילי שהורכב מראש.
- הכן את השלב הנייד עם תערובת 37:63 (v/v) של אצטוניטריל ואמוניום הידרוקסיד 20 mM.
- התנה את עמודת ההכנה למחצה בארבעה כרכי עמודות של שלב נייד.
הערה: העמודה המשמשת היא C18 100 מ"מ x 10 מ"מ עמודה הפוכה.
- באמצעות מזרק 100 μL, הזריקו את התערובת הבאה דרך המתאם במיקום #1 של לולאת HPLC הפנימית של שסתום שש היציאות: (R)-N-sec-butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide (1.0 ± 0.05 מ"ג) בדימתיל סולפוקסיד-d6 (100 ± 10 μL) ו-6 N נתרן הידרוקסידי (4 μL).
- במהלך הכנת המודול האוטומטי, הפציץ מטרת ציקלוטרון פחמן-11 (1% חמצן, 99% חנקן) על ציקלוטרון 11 MeV ב 55 μA למשך 60-80 דקות על מטרות קרן כפולה כדי לייצר [11C] פחמן דו חמצני על ידי התגובה הגרעינית 14N(p,α) 11C.
- כ-20 דקות לפני פריקת [11C] פחמן דו-חמצני מהציקלוטרון למודול, התחל את רשימת הזמן המאומתת לסינתזה [11C]ER-176 על-ידי לחיצה על לחצן התחל . אפשרו לעמודת CH4 להתקרר ל-45 מעלותצלזיוס לפני קבלת פחמן דו-חמצני רדיואקטיבי [11C] (ראו איור 3). אפשר להשמנת עמודי קרבוספירה (מלכודת CH4 ) להתקרר לטמפרטורה של -75 מעלותצלזיוס.
- תן לשיטה המוטמעת במודול להמרה של [11C] פחמן דו חמצני לתוך [11C]מתיל יודי, באמצעות תהליך כימי יבש, להמשיך כדלקמן:
- המרת פעילות [11C] פחמן דו-חמצני למתאן [11C] על-ידי תגובה עם גז מימן ב-350 oC על פני זרז ניקל (Shimalite-Nickel). השתמש במלכודת אסקריט (נתרן הידרוקסידי) כדי לשמור על הפחמן הדו-חמצני [11C] שלא הומר ונוצר מים.
- ללכוד את המתאן שנוצר [11C] על מלכודת עמוד קרבוספירה (מלכודת CH4 ) ב -75 oC לטיהור וריכוז נוספים. כדי לשחרר את המתאן הלכוד [11C], חממו את עמוד הקרבוספירה ל-80 מעלותצלזיוס.
- הגיבו למתאן המטוהר [11C] עם יוד יסודי ב-720 oC ליצירת [11C] מתיל יודיד ([11C]CH3I) באמצעות משאבת גז למחזור הליום, שבה יודיד מימן שנוצר במקרה נשמר על ידי מלכודת אסקריט אחרת, בעוד שמתאן לא מומר [11C] חוזר לתהליך הסירקולציה.
- ללכוד את הנוצר [11C]CH3I בטמפרטורת החדר על עמודת המתיל יודיד (MeI) שהצטברה במהלך תהליך המחזור.
- בסוף תהליך הסירקולציה, שחררו את [11C]CH3I שנאסף ממלכודת MeI על ידי חימום ל 190 oC תחת זרימת הליום (15 מ"ל לדקה), עקפו מעמודת MeTf, ודרכו דרך שסתום בדיקה לתוך לולאת הנירוסטה 1.5 מ"ל המכילה את הפתרון המקדים הטעון מראש (שלב 1.5.1).
- לאחר ש[11C]CH3עברתי דרך הלולאה במשך 180 שניות, הזריקו את תערובת התגובה על עמודת HPLC חצי מוכנה לטיהור. השתמש בתנאי HPLC הבאים: פאזה ניידת של אצטוניטריל 37:63 (v/v): 20 mM אמוניום הידרוקסיד בקצב זרימה של 5.0 מ"ל/דקה ואורך גל UV של 235 ננומטר; זמן שמירה (tR) של [11C]ER-176: בערך 12–14 דקות. ראו איור 5.
- אספו את דגימת השבר לבקבוק קבלה גדול המכיל 25 מ"ל מים סטריליים שעברו דה-יוניזציה. טען את התערובת המדוללת למחסנית C18 Light solid phaseion extraction (SPE).
- יש לשטוף את המוצר (1) בתוספת של 10 מ"ל מים סטריליים שעברו דה-יוניזציה.
- הסר את המוצר הרצוי מה- C18 Light SPE באמצעות אתנול 200 הוכחות (1 מ"ל). כוונו את האלוציה הזו לבקבוק פורמולציה טעון מראש עם 0.9% נתרן כלורי להזרקה (6 מ"ל).
- יש לשטוף את C18 light SPE עם 3 מ"ל נוספים של 0.9% נתרן כלורי להזרקה דרך מאגר V4.
- אסוף את התמיסה הסופית בבקבוק הפורמולציה (~ 10 מ"ל) ועבור דרך מסנן חיטוי 0.22 מיקרומטר לבקבוקון זכוכית סטרילי, פירוגני, USP Type I 50 מ"ל שהורכב מראש, אטום במחיצת גומי ומכווץ עם מכסה אלומיניום.
- באמצעות telemanipulators, להסיר aliquot מבקבוקון המוצר הסופי כמדגם בקרת איכות (QC). יש להכפיף דגימה זו לבדיקות QC רבות כדי להבטיח התאמה למפרטים שנקבעו לפני שחרורה ומתן למטופל (ראה טבלה 2).
הערה: החל הליך זה של שיטת לולאה באמצעות [11C]CH3I עבור תיוג רדיו של (2); ליצור ולהשתמש [11C]CH3OTf כדי לייצר (3) ו- (4) (ראה קובץ משלים 1).- כדי לעקוב אחר ניתוח בקרת האיכות הטיפוסי שנערך במתקן, השתמש בטלמניפולטורים כדי להעביר דגימה מבקבוקון המוצר הסופי למזרק שחפת ולאחר מכן לחדר בקרת האיכות באמצעות מוביל מסוכך עופרת.
- באזור מסוכך עופרת (בלוק L), מוציאים את הדגימה לתוך צינור נטול פירוגן, ולאחר מכן מחלקים אותה לבקבוקוני זכוכית קטנים יותר (50-100 μL) לצורך ניתוח HPLC וכרומטוגרפיית גז (GC).
- יש לדלל דגימה שנייה במים נטולי פירוגן לריכוז המתאים לניתוח אנדוטוקסין חיידקי.
- חסן דגימה של תמיסת המוצר הסופי (הן במרק סויה טריפטי (TSB) והן במדיה תיוגליקולט בינוני נוזלי (FTM) כדגימת סטריליות). לדגור ולצפות דגימות אלה לצמיחה במשך 14 ימים.
- החל aliquot קטן על רצועת pH כדי לקבוע חזותית את החומציות/בסיסיות של הפתרון המוצר הסופי.
2. שיטת כלי תגובה לתיוג רדיו של [11C]ER-176 (1)
- ודא שהמודול מנוקה ביסודיות בהתאם לפרוטוקול הניקוי הפנימי.
- השתמש 1 N HCl, מים, אצטון ואצטוניטריל לניקוי חלק התגובה של המודול, ומים ואחריו אתנול כדי לנקות ולעקר את חלק הפורמולציה של המודול.
- מצב את תנור המתאן (CH4) ב 350 oC למשך 20 דקות עם זרימת גז מימן של 100 מ"ל / דקה לפני כל ההפקות שבוצעו על המודול. מצננים ל 45 מעלותצלזיוס לפני שתמשיכו.
- התנה את מלכודת CH4 ב 120 oC במשך 20 דקות עם זרימת גז הליום של 50 מ"ל / דקה לפני כל ההפקות שבוצעו על המודול. מצננים ל 70 מעלותצלזיוס לפני שתמשיכו.
- התנה את מלכודת ה- MeI ב- 190 oC למשך 20 דקות עם זרימת גז הליום של 50 מ"ל לדקה לפני כל ההפקות. מצננים ל-50 מעלותלפני שממשיכים. ודא שצינור ה-V8 מחובר למחט בכלי השיט.
- בצעו בדיקת דליפה באמצעות גז הליום, מהשסתום הקולט (V24 עד V16) ללולאת MeI הפנימית, ומ-V8 לכלי תוך שימוש ב-V23 כמקור לאטימה/פליטה.
- טעינת מגיב למודול:
- הוסף את הדברים הבאים: (R)-N-sec-butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide (1.0 ± 0.05 מ"ג) ב dimethyl sulfoxide-d6 (100 ± 10 μL) ו 6 N נתרן הידרוקסידי (4 μL) לכלי הכור.
- טען את מאגר V2 עם 1.0 מ"ל של 37:63 acetonitrile:20 mM אמוניום הידרוקסיד.
- טען את מאגר V4 עם 3.0 מ"ל של 0.9% נתרן כלורי להזרקה.
- טען את מאגר V5 עם 1.0 מ"ל של אתנול 200-proof .
- טען את מאגר V6 עם 10 מ"ל של מים סטריליים deionized.
- ממלאים את בקבוק הקבלה הגדול עם 25 מ"ל של מים סטריליים deionized.
- ממלאים את בקבוק הפורמולה ב-6.0 מ"ל של 0.9% נתרן כלורי להזרקה.
- ודא שקו האספקה מחובר לבקבוקון המוצר הסופי הסטרילי שהורכב מראש.
- מלא מאגר בפאזה ניידת HPLC (37:63 (v/v) אצטוניטריל: 20 mM אמוניום הידרוקסיד) והתחבר למשאבת HPLC.
הערה: עמודת ההכנה למחצה שבה נעשה שימוש זהה לזו שלעיל ומותנית מראש בפאזה הניידת (אמצעי אחסון של 4 עמודות).
- במהלך הכנת המודול האוטומטי, הפציץ מטרת ציקלוטרון פחמן-11 (1% חמצן, 99% חנקן) על ציקלוטרון 11 MeV ב 55 μA למשך 60-80 דקות על מטרות קרן כפולה כדי לייצר [11C] פחמן דו חמצני על ידי התגובה הגרעינית 14N(p,α) 11C.
- כ-20 דקות לפני פריקת [11C] פחמן דו-חמצני מהציקלוטרון למודול, התחל את רשימת הזמן המאומתת לסינתזה [11C]ER-176 על-ידי לחיצה על לחצן התחל . אפשרו לעמודת CH4 להתקרר ל-45 מעלותצלזיוס לפני קבלת פחמן דו-חמצני רדיואקטיבי [11C] (ראו איור 3). אפשר להשמנת עמודי קרבוספירה (מלכודת CH4 ) להתקרר לטמפרטורה של -75 מעלותצלזיוס
- תן לשיטה המוטמעת במודול להמרה של [11C] פחמן דו חמצני לתוך [11C]מתיל יודי, באמצעות תהליך כימי יבש, להמשיך כדלקמן:
- המרת פעילות [11C] פחמן דו-חמצני למתאן [11C] על-ידי תגובה עם גז מימן ב-350 oC על פני זרז ניקל (Shimalite-Nickel). שמרו על פחמן דו-חמצני שלא הומר [11C] ויצרו מים בעזרת מלכודת אסקריט (נתרן הידרוקסידי).
- לכוד [11C] מתאן על עמוד קרבוספירה ב -75 oC לטיהור וריכוז נוספים. כדי לשחרר את המתאן [11C], חממו את עמוד הקרבוספירה ל-80 מעלותצלזיוס.
- הגיבו למתאן המטוהר [11C] עם יוד יסודי ב-720 מעלותצלזיוס ליצירת [11C] מתיל יודיד באמצעות משאבת גז במחזור שבו מימן שנוצר על ידי אירוע נשמר על ידי מלכודת אסקריט אחרת בעוד שמתאן לא מומר [11C] חוזר לתהליך הסירקולציה, הנקרא מחזור לולאה פנימית.
- לכדו את המתיל יודיד שנוצר [11C] בטמפרטורת החדר על עמודת MeI שהצטברה במהלך תהליך המחזור.
- בסוף תהליך הסירקולציה, חממו את מלכודת הספיגה הפולימרית הנקבובית ל-190 מעלותצלזיוס תחת זרימת הליום (30 מ"ל/דקה) כדי לשחרר את המתיל יודיד שנאסף [11C] ולהנחות אותו דרך שסתום בדיקה לכלי התגובה של 3 מ"ל עבור תיוג הרדיו פחמן-11 של (1).
- לאחר שהייצור וההצטברות של [11C] מתיל יודיד התייצבו, עקפו את עמודת הטריפלטה הכסופה וכוונו את הגז הרדיואקטיבי דרך V8 לתוך כלי התגובה המכיל את תערובת הקודמן. אפשרו למתיל יודיד [11C] לבעבע למשך 3 דקות, ואז אטמו את כלי התגובה וחממו אותו בטמפרטורה של 80 מעלותצלזיוס למשך 5 דקות.
- לאחר השלמת התיוג, לאחר 5 דקות, לקרר את כלי התגובה ל 30 oC ולדלל עם 1 מ"ל של פאזה ניידת ממאגר V2.
- הזריקו את התערובת על עמודת HPLC מוכנה למחצה לטיהור בתנאי HPLC הבאים: פאזה ניידת של אצטוניטריל 37:63 (v/v): 20 mM אמוניום הידרוקסיד בקצב זרימה של 5.0 מ"ל/דקה ואורך גל UV של 235 ננומטר; tR של [11C]ER-176 (1): בערך 9-11 דקות, ראה איור 6.
- אספו את דגימת השבר לבקבוק המקבל הגדול המכיל 25 מ"ל מים סטריליים שעברו דה-יוניזציה. טען תערובת מדוללת זו על מחסנית SPE קלה C18 .
- שטפו את המוצר הלכוד (1) עם 10 מ"ל נוספים של מים סטריליים שעברו דה-יוניזציה.
- יש להסיר את המוצר הרצוי מה-C18 Light SPE באמצעות אתנול 200 הוכחה (1.0 מ"ל), המופנה לבקבוק פורמולציה טעון מראש עם 0.9% נתרן כלורי להזרקה (6.0 מ"ל).
- יש לשטוף את C18 Light SPE בתוספת של 3.0 מ"ל של 0.9% נתרן כלורי להזרקה.
- לאסוף את הפתרון הסופי בבקבוק ניסוח (~ 10 מ"ל). העבירו מדיה זו דרך מסנן חיטוי 0.22 מיקרומטר לתוך בקבוקון זכוכית סטרילי, אפירוגני, USP Type I 50 מ"ל שהורכב מראש, אטום במחיצת גומי ומכווץ עם מכסה אלומיניום.
- השתמש בטלמניפולטורים כדי להסיר aliquot מבקבוקון המוצר הסופי כדגימת בקרת איכות (QC) (ראה שלב 1.15). הכפפת הדגימה למספר בדיקות שבהן על הרדיוטרייסר לעבור את כל קריטריוני הקבלה לפני שחרורו ונתינתו למטופל (ראה טבלה 2).
הערה: החל שיטת כלי שיט זו של כור באמצעות [11C]CH3I עבור תיוג רדיו של (2); ליצור ולהשתמש [11C]CH3OTf כדי לייצר (3) ו- (4) (ראה קובץ משלים 1).
תוצאות
קבוצת הרדיוכימיה Langone Health (NYULH) של אוניברסיטת ניו יורק מספקת רדיוטרייסרים שונים של פחמן-11, פלואור-18 וגליום-68 המשמשים הן למחקר בבני אדם והן ליישומים פרה-קליניים. מספר שיטות משמשות לייצור רדיוטרייסרים PET. הצוות שלנו משתמש בשיטת הלולאה לסינתזה של (1), (2), (3) ו- (4) (ראו איור 1 ואיור 8). לאחר השלמת הייצור, aliquot מוסר בקבוקון המוצר הסופי סטרילי. דגימה זו משמשת הן לחיסון תמיסת המוצר הסופי (הן במרק סויה טריפטי (TSB) והן במדיה תיוגליקולט בינוני נוזלי (FTM) כדגימת סטריליות) וכן למדגם מייצג של התמיסה בתפזורת לבדיקות QC. כל רדיוטרייסר עובר בדיקות QC לפני שחרור המוצר לניהול (ראה טבלה 2).
בדיקות בקרת איכות כוללות הדמיה של מראה המוצר, אימות שלמות המסנן, קביעת זהות רדיונוקלידית, pH, זהות רדיוכימית (רדיו-HPLC), טוהר רדיוכימי (רדיו-HPLC), טוהר כימי (HPLC), פעילות מולרית, חוזק, ממס שיורי, אנדוטוקסינים וסטריליות (ראה טבלה 2). התוצאות הבאות התקבלו מהייצור הקליני של כל רדיוטרייסר שהוזכר לעיל (ראה טבלה 1).
לקבלת כרומטוגרמה אנליטית מייצגת של HPLC, ראה איור 7 וקובץ משלים 1. כל רדיוטרייסר נדרש לעבור את כל מפרטי בקרת האיכות (ראה טבלה 2) לפני שניתן לשחרר אותם ולתת אותם לנבדק.
עיין בקובץ המשלים 1 לקבלת כמויות של קודמן וריאגנטים, כמו גם בכרומטוגרמות HPLC האנליטיות של [11C]MRB (2) (איור משלים 1), [11C]mHED (3) (איור משלים 2), ו- [11C]PiB (4) (איור משלים 3).
| תרכובת | פרמטרים | שיטת לולאה (ממוצע ± std) | שיטת כור (ממוצע ± std) |
| [11ג]ER-176 | מספר הפקות | 25 | 6 |
| תחילת הסינתזה | 86 ± 5.0 ג'יגה-בתים | 52 ± 25.7 ג'יגה-בתים | |
| סוף הסינתזה | 5.4 ± 2.2 GBq | 1.6 ± 0.5 GBq | |
| טוהר רדיוכימי | 99.6 ± 0.6% | 99.9 ± 0.1% | |
| ריכוז ER-176 | 1.1 ± 0.5 מיקרוגרם/מ"ל | 0.63 ± 0.37 מיקרוגרם/מ"ל | |
| פעילות מולרית | 194 ± 66 ג'יגה-בתים/מיקרומול | 132 ± 78 ג'יגה-בתים/מיקרומול | |
| זמן סינתזה כולל | 36 ± 3 דקות | 44 ± 6 דקות | |
| [11ג]MRB | מספר הפקות | 70 | 6 |
| תחילת הסינתזה | 84 ± 5.4 ג'יגה-בתים | 39 ± 11.9 GBq | |
| סוף הסינתזה | 3.0 ± 1.2 GBq | 1.9 ± 0.7 GBq | |
| טוהר רדיוכימי | 99.5 ± 0.5% | 99.7 ± 0.8% | |
| ריכוז MRB | 0.52 ± 0.24 מיקרוגרם/מ"ל | 0.68 ± 0.41 מיקרוגרם/מ"ל | |
| פעילות מולרית | 190 ± 50 GBq/μmol | 99 ± 55 GBq/μmol | |
| זמן סינתזה כולל | 35 ± 3 דקות | 42 ± 3 דקות | |
| [11ג]מהד | מספר הפקות | 5 | 11 |
| תחילת הסינתזה | 69 ± 10.5 GBq | 82 ± 4.3 ג'יגה-בתים | |
| סוף הסינתזה | 5.5 ± 1.3 GBq | 3.3 ± 1.0 GBq | |
| טוהר רדיוכימי | 98.2 ± 1.3% | 99.1 ± 0.7% | |
| ריכוז mHED | 0.40 ± 0.10 מיקרוגרם/מ"ל | 0.52 ± 0.37 מיקרוגרם/מ"ל | |
| פעילות מולרית | 301 ± 48 GBq/μmol | 155 ± 77 ג'יגה-בתים/מיקרומול | |
| זמן סינתזה כולל | 27 ± 4 דקות | 32 ± 2 דקות | |
| [11ג]פיב | מספר הפקות | 51 | 10 |
| תחילת הסינתזה | 86 ± 5.4 ג'יגה-בתים | 57 ± 17.2 GBq | |
| סוף הסינתזה | 3.2 ± 0.8 GBq | 1.4 ± 0.2 GBq | |
| טוהר רדיוכימי | 97.0 ± 1.5% | 99.1 ± 1.4% | |
| ריכוז PiB | 0.22 ± 0.51 מיקרוגרם/מ"ל | 0.30 ± 0.24 מיקרוגרם/מ"ל | |
| פעילות מולרית | 201 ± 68 GBq/μmol | 207 ± 124 GBq/μmol | |
| זמן סינתזה כולל | 35 ± 2 דקות | 36 ± 5 דקות |
טבלה 1: תוצאות הייצור של [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3), ו- [11C]PiB (4) בדרך של שיטת לולאה או שיטת כלי תגובה. כל הערכים מדווחים בסוף הסינתזה. קיצורים: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-methylquinazoline-2-carboxamide; [11ג]MRB = (S,S)-[11C]methylreboxetine; [11ג]מHED = [11C]-meta-hydroxyephedrine; [11ג]PiB = 2-[4-[(11C)methylamino]phenyl]-1,3-benzothiazol-6-ol.
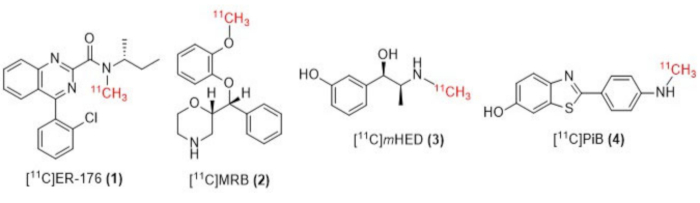
איור 1: מבנים של [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) ו-[11C]PiB (4). קיצורים: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-methylquinazoline-2-carboxamide; [11ג]MRB = (S,S)-[11C]methylreboxetine; [11ג]מHED = [11C]-meta-hydroxyephedrine; [11ג]PiB = 2-[4-[(11C)methylamino]phenyl]-1,3-benzothiazol-6-ol. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
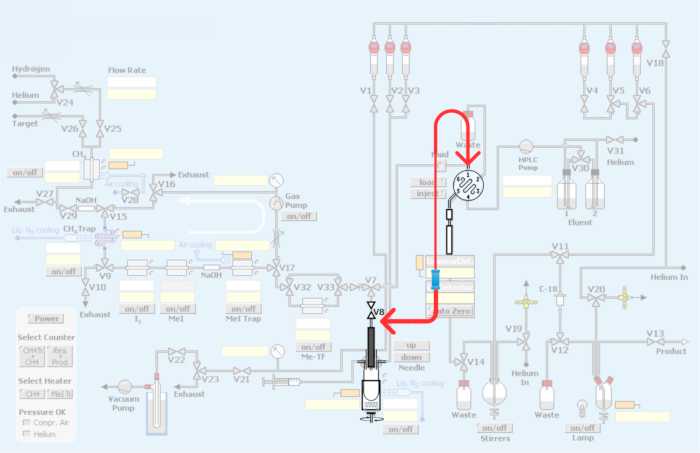
איור 3: שינויים שבוצעו במודול האוטומטי. באדום מייצג את הצנרת מחדש של מודול הסינתזה כדי לשלב את הלולאה לייצור רדיוטרייסרים PET בדרך של מתילציה פחמן-11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: צנרת מודול וצנרת מחדש כדי לשלב את שיטת הלולאה עבור מתילציה פחמן-11 של רדיוטרייסרים PET. (A) לולאת הזרקת HPLC עם מחברי איחוד. (B) שיטת כלי תגובה. החץ האדום מציג את חיבור V8. (C) שיטת לולאה צנרת מחדש, עקיפת כלי הכור. שים לב שחיבור V8 לכניסת HPLC עוקף את כלי התגובה, ומאפשר [11C]iodomethane או [11C]methyl triflate גישה ישירה ללולאת HPLC. (ד) מיקום האיחוד לגבי כלי שיט של כור. שים לב לחיבור ללולאת HPLC מנירוסטה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
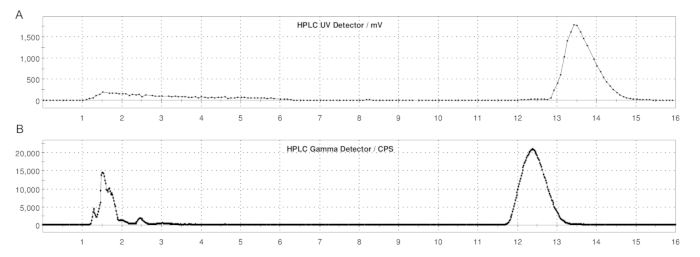
איור 5: פרופילי HPLC מוכנים למחצה של ER-176 ו-[11C]ER-176 עם ייצור שיטת לולאה. (A) פרופיל HPLC מוכן למחצה עבור ER-176 (1) בדרך של ייצור שיטת לולאה ב- UV = 235 ננומטר; tR = 13.2 דקות. (B) פרופיל רדיו-HPLC מוכן למחצה עבור [11C]ER-176 (1); tR = 12.4 דקות. תנאים: פאזה ניידת של 37:63 (v/v) אצטוניטריל: 20 mM אמוניום הידרוקסיד בקצב זרימה של 5.0 מ"ל/דקה. קיצור: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-methylquinazoline-2-carboxamide. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
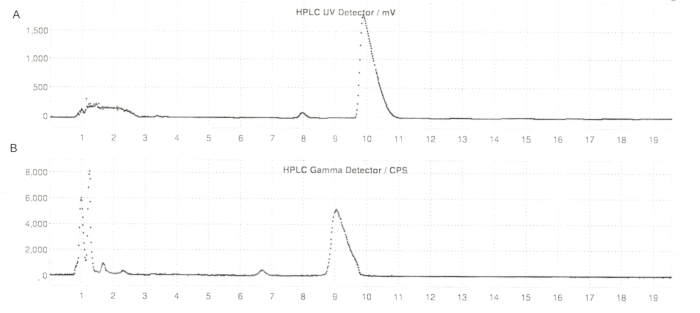
איור 6: פרופילי HPLC מוכנים למחצה של ER-176 ו-[11C]ER-176 עם ייצור בשיטת כור. (A) פרופיל HPLC מוכן למחצה עבור ER-176 (1) בדרך של ייצור שיטת כור ב- UV = 235 ננומטר; tR = 9.8 דקות. (B) פרופיל רדיו-HPLC מוכן למחצה עבור [11C]ER-176 (1); tR = 9.2 דקות. תנאים: פאזה ניידת של 37:63 (v/v) אצטוניטריל: 20 mM אמוניום הידרוקסיד בקצב זרימה של 5.5 מ"ל/דקה. קיצורים: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-methylquinazoline-2-carboxamide; tR = זמן שמירה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
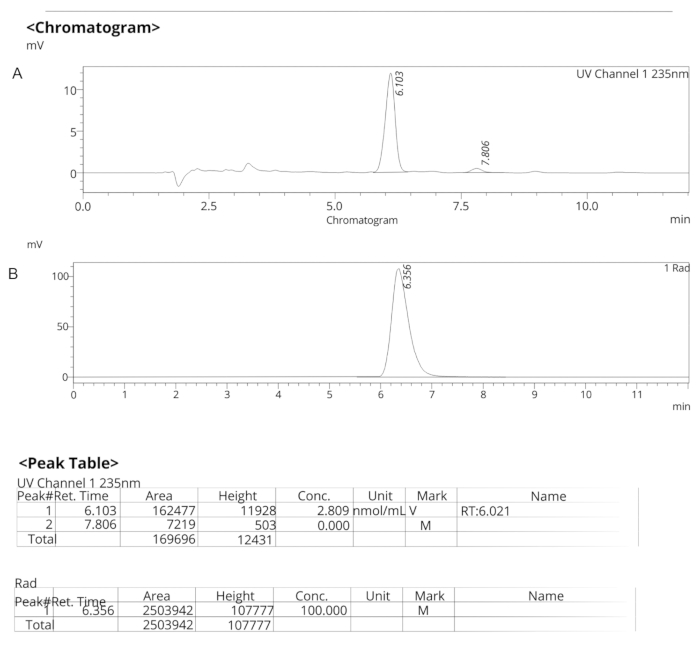
איור 7: פרופילי HPLC אנליטיים עבור ER-176. (A) פרופיל HPLC אנליטי של ספקטרום UV עבור ER-176 (1) ב-235 ננומטר; tR = 6.10 דקות. (B) פרופיל HPLC אנליטי של רדיוטרייסר עבור [11C]ER-176 (1); tR = 6.36 דקות. תנאים: 10 מיקרומטר C18 (2) 100  LC עמוד 250 x 4.6 מ"מ; מתנול/מים 74/26 עם קצב זרימה של 1.5 מ"ל/דקה. קיצור: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-methylquinazoline-2-carboxamide; tR = זמן שמירה לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
LC עמוד 250 x 4.6 מ"מ; מתנול/מים 74/26 עם קצב זרימה של 1.5 מ"ל/דקה. קיצור: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-methylquinazoline-2-carboxamide; tR = זמן שמירה לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
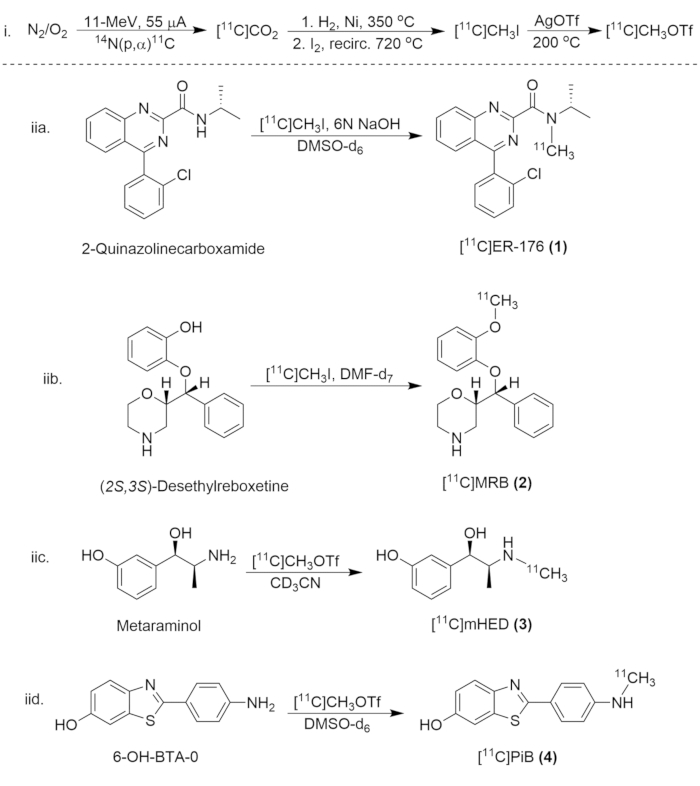
איור 8: סכימה סינתטית לסינתזה של תרכובות פחמן-11. (i) היווצרות [11C]CH3I ו-[11C]CH3OTf, ו-(iia.) תיוג רדיו של [11C]ER-176 (1), (iib.) [11ג]MRB (2), (iic.)[11ג]מהד (3), ו-(שם) [11ג]פי"ב (4). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| מבחן/פרמטרים | מפרטים |
| מראה (בדיקה חזותית) | תמיסה שקופה ונטולת צבע ללא חומר חלקיקי |
| תקינות מסנן הממברנה | ≥ 50 psi |
| pH | 4.5 - 8.0 |
| זהות רדיונוקלידית (זמן מחצית חיים) | 19.3 - 21.3 דקות |
| זהות רדיוכימית (רדיו-HPLC) | 0.90 ≤ tR Prod / t R סטנדט ≤ 1.10 |
| טוהר רדיוכימי (רדיו-HPLC) | ≥ 95.0%† |
| ריכוז תרופות (HPLC) | ראו הערות* |
| סה"כ זיהומים כימיים (HPLC) | ראו הערות** |
| פעילות מולרית (@ EOS) | > 9.25 GBq/μmol |
| שיורית אצטוניטריל (GC) | ≤ 410 דפים בדקה |
| אצטון שיורי (GC) | ≤ 5,000 דפים בדקה |
| דימתיל סולפוקסיד שיורי (GC) | ≤ 5,000 דפים בדקה |
| אתנול שיורי (GC) | ≤ 10% (V/V) |
| מתנול שיורי (GC) | ≤ 3,000 דפים בדקה |
| N,N-דימתילפורממיד (GC) | ≤ 880 עמודים לדקה |
| לימולוס אמבוציטים ליזט (LAL) | ≤ 17.5 האיחוד האירופי/מ"ל |
| סטריליות (להתחיל תוך 30 שעות) | סטרילי (14 ימים) |
| רשומות הכנה | שלם ומדויק |
| תוויות | שלם, מדויק, מפויס |
טבלה 2: קריטריונים לבקרת איכות לאישור או דחייה של רדיוטרייסרים פחמן-11. † טוהר רדיוכימי ≥ 90.0% עבור [11C]mHED; * ריכוז סמים: [11C]ER-176 ≤ 10 מיקרוגרם למנה; [11ג]MRB ≤ 10 מיקרוגרם למנה; [11ג]מHED ≤ 50 מיקרוגרם / מנה; [11ג]PiB ≤ 13.4 מיקרוגרם למנה; ** סה"כ זיהומים כימיים: [11C]ER-176 ≤ 1.0 מיקרוגרם למנה; [11ג]MRB ≤ 1.0 מיקרוגרם למנה; [11ג]מHED ≤ 5.0 מיקרוגרם / מנה; [11ג]PiB ≤ 1.34 מיקרוגרם למנה. קיצורים: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-methylquinazoline-2-carboxamide; [11ג]MRB = (S,S)-[11C]methylreboxetine; [11ג]מHED = [11C]-meta-hydroxyephedrine; [11ג]PiB = 2-[4-[(11C)methylamino]phenyl]-1,3-benzothiazol-6-ol; EOS = סוף הסינתזה; GC = כרומטוגרפיית גז; LAL = לימולוס אמבוציטים ליזט.
קובץ משלים 1: כימיקלים וחומרים, ריאגנטים המשמשים לשיטת לולאה או כלי ריאקטור, בדיקות בקרת איכות, כרומטוגרמות HPLC אנליטיות. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
תיוג רדיואקטיבי מסורתי של הטרואטומים טרמינליים עם יודומתאן פחמן-11 או מתיל טריפלטה כרוך בבעבוע הגז האלקטרופילי הרדיואקטיבי לתוך כלי תגובה, לכידתו, ומאפשר לתמיסה להגיב לפרקי זמן ממושכים18. המבעבע הקונבנציונלי של התגובה ההטרוגנית יכול להיות איטי ועשוי לדרוש חימום כדי להאיץ את קצב התגובה. לפני הטיהור, ייתכן שיהיה צורך בקירור אמצעי התגובה לטמפרטורת החדר, ולאחר מכן העברה ללולאת HPLC עם שימוש בממס (למשל, פאזה ניידת) לטיהור הרדיוטרייסר הרצוי. צעדים אלה גוזלים זמן, ומוצרים חולפים עם תווית רדיו עלולים ללכת לאיבוד במהלך העברת חומרים כאלה.
במתקן שלנו, הדגמנו את ההצדקה לשימוש בשיטת הלולאה, שבה הפתרון המקדים מצופה בלולאת נירוסטה HPLC, ותיוג הרדיו של התרכובת מתבצע בתוך הלולאה בטמפרטורת החדר. הלולאה קשורה בקו אחד עם העברת הרדיואקטיבי [11C]CH3I או [11C]CH3OTf ומחוברת ליציאת ההזרקה של מערכת HPLC. אין צורך בחימום כדי שהרדיותיוג יתרחש, ובכל המקרים המוצגים בכתב יד זה, התגובה מתרחשת תוך פחות מ-3 דקות.
נראה כי קצב הזרימה והגודל של לולאת HPLC מפלדת אל-חלד הם קריטיים כדי שתהליך זה יפעל ביעילות. הבדיקה החלה על ידי שינוי קצב הזרימה של הגז המוביל, הליום, מ-8.0 מ"ל/דקה ל-15.0 מ"ל/דקה כדי שהגז הרדיואקטיבי יועבר ללולאה. באקלי חקר את החשיבות של יישום קצב הזרימה הנכון וכן שימוש בחומר הממס והלולאה המתאימים15. עבור המערכת שלנו, קצב זרימה של 15 מ"ל/דקה עבור מינים אלקטרופיליים רדיואקטיביים של [11C]CH3I או [11C]CH3OTf מתפקד היטב עבור תיוג הרדיו של כל ארבעת נותבי הרדיו הנדונים בכתב יד זה. הלולאה המשמשת לכל הסינתזות היא לולאת הזרקת HPLC מנירוסטה ב -1.5 מ"ל בעלת OD של 1/16 אינץ 'ומזהה של 1 מ"מ.
בהשוואה בין שתי השיטות (שיטת כלי תגובה לעומת שיטת לולאה), בידינו, שיטת הלולאה הדגימה יעילות רדיואקטיבית מוגברת יחד עם עלייה משמעותית בפעילות המולרית בסוף הסינתזה (EOS) לייצור ארבעה רדיוטרייסרים שאושרו במחקר בבני אדם. לדוגמה, לרדיוטרייסר [11C]mHED (3) הייתה עלייה של פי 1.6 בפעילות המוצר הסופי המבודד יחד עם השגת פעילות מולרית כפולה ב-EOS. מגמה זו של פעילות כוללת מוגברת נצפית בכל ארבעת הרדיוטרייסרים (ראו טבלה 1). תוצאות חיוביות נוספות בעת שימוש בשיטת הלולאה כוללות קיצור זמן ההתקנה ב -5 דקות וללא צורך לנקות את כלי התגובה, חיסכון בזמן המפעיל ושימוש בממסים לפרוטוקול ניקוי.
כמה חסרונות למתודולוגיה זו כוללים את המגבלות שבהן radiotracers ניתן לתייג ביעילות באמצעות שיטת לולאה. אם יש צורך בחום עבור תיוג הרדיו, קשה לשנות מערכת זו כדי לאפשר חימום בתוך לולאת HPLC. מערכת זו דורשת שינויים בצנרת; תכונה זו של חוסר מוכנות "מחוץ לקופסה" עלולה להרתיע משתמשים אחרים מלבצע שינויים כאלה בפלטפורמה האוטומטית שלהם14. מאחר שנדרשים איחודי אינסטלציה ואיגודים משלימים לשיטה זו (ראה איור 4A-D), הפוטנציאל לאתרים נוספים לשחרור רדיואקטיבי גדל בעת הסימון בתנאים אלה. זה נבון לבצע בדיקת דליפה לפני כל ריצה על המודול.
הצוות שלנו יישם את שיטת הלולאה המשמשת בייצור מאושר של ארבעה נותבי פחמן 11 (Investigational New Drug Application (IND) והוועדה לחקר תרופות רדיואקטיביות (RDRC). בידינו, שיטה זו התגלתה כתהליך יעיל יותר ובעל תשואה גבוהה יותר משיטת כלי התגובה המסורתית. יש לשקול צנרת נוספת והתאמות לקצב הזרימה של גז ההליום המוביל בעת יישום שיטה זו על רוב המודולים האוטומטיים. לבסוף, לשיטה זו יש מגבלות והיא אינה מתאימה לרדיוטרייסרים מסוימים של פחמן-11, כגון [11C]UCB-J, הדורש הפעלה של פלדיום (II) ביניים וחימום24 של תערובת התגובה.
Disclosures
המחברים מצהירים כי אין להם אינטרסים רלוונטיים או פיננסיים הקשורים למחקר זה לחשוף.
Acknowledgements
ברצוננו להודות לחברי מעבדת הרדיוכימיה לשעבר של NYULH, ראול ג'קסון וגרייס יון, על עבודתם על המאמצים הראשוניים למתילציה פחמן-11 בשיטת לולאה.
Materials
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
References
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved