Method Article
Döngü Yöntemini Kullanarak Klinik Araştırmalar için Karbon-11 Radyoligandlarının Verimliliğini ve Radyoetiketleme Verimlerini Artırma
Bu Makalede
Özet
Bu protokol, "döngü yöntemi" [11 C] metilasyonu yoluyla dört karbon-11radyoizleyici hazırlamak için ayrıntılı bir prosedür sunar. [11C]ER-176'yı sentezleme prosedürünü, üç ek radyoizleyici için verilerle açıklıyoruz: [11C]MRB, [11C]mHED ve [11C]PiB. Döngü yöntemi, geleneksel reaksiyon kabı [11C] metilasyonuna karşı artan radyokimyasal verimlerle verimli bir sentez sağlar.
Özet
Karbon-11 radyoizleyicilerini içeren başarılı bir pozitron emisyon tomografisi görüntüleme programı, yerinde bir siklotron ve radyokimya grubunun yanı sıra karbon-11 radyonüklidinin benzersiz kısıtlamaları altında çalışmak üzere eğitilmiş klinik personel gerektiren hızlı, verimli ve güvenilir sentez yöntemleri gerektirir. Bu çalışma, [11C]ER-176, [11C]MRB, [11C]m HED ve [11C]PiB.
'Döngü yöntemi', aynı otomatik platformda aynı radyoizleyicilerin sentezlenmesi sırasında geleneksel reaktör tabanlı karbon-11 metilasyon yöntemiyle karşılaştırılır. Ayrıca, [11C] ER-176 radyoizleyicinin klinik araştırma hazırlığına tam bir genel bakış sunulmaktadır. [11C]ER-176 üretimi ile gösterildiği gibi, heterojen alkilasyonun tutsak çözücü 'döngü yönteminin' mükemmel radyokimyasal saflık (99.6 ± %0.6, n = 25), daha yüksek ve daha tutarlı radyokimyasal verim (sentez sonu (EOS) = 5.4 ± 2.2 GBq, n = 25) ile reaktör yöntemine kıyasla (EOS = 1.6 ± 0.5 GBq, n = 6) ile daha verimli olduğu kanıtlanmıştır, artan molar aktivite (döngü yöntemi = 194 ± 66 GBq/μmol, n = 25; reaktör yöntemi = 132 ± 78 GBq/μmol, n = 6), ortalama 5 dakika daha kısa reaksiyon dizisi ile birlikte.
Giriş
Moleküler görüntüleme modaliteleri arasında, pozitron emisyon tomografisi (PET), belirli fizyolojik hedefler veya ilgi alanları ile ilişkili biyokimyasal süreçlerin çözülme şekli açısından farklıdır 1,2. PET'in karakteristik duyarlılığı ve non-invaziv doğası, hastalık patofizyolojisinin in vivo görselleştirilmesi ve nicelleştirilmesi için kullanılır ve genellikle bilgisayarlı tomografi (BT)3 veya manyetik rezonans görüntüleme (MRI)4 gibi daha anatomik görüntüleme teknikleriyle görülemeyen hedefleri ortaya çıkarır. Çağdaş moleküler görüntüleme, PET'in yüksek kontrastlı çözünürlüğü ve ölçülebilir görüntüleme parametrelerinden yararlanarak son derece hassas zayıflama düzeltme haritaları (PET/CT) ve gelişmiş uzamsal çözünürlük (PET/MR)5 sağlamak için PET'in CT veya MR (sırasıyla PET/CT veya PET/MR) ile kombinasyonunu görür ve galyum-68 ve rubidyum-82 gibi radyonüklidlerden gelen pozitronların daha yüksek kinetik enerjilerindeki değişkenliğin sunduğu bazı engellerin üstesinden gelir6. Bu çift modaliteli görüntüleme teknikleri, klinisyenlere veya araştırmacılara çalışma konusu5 hakkında ortak kayıtlı anatomik ve biyokimyasal bilgiler sağlayarak her bir modalitenin ayırt edici özelliklerini kanalize eder.
Bu görüntüleme tekniğinin klinik uygulanabilirliği çok geniştir ve glikoz metabolizması 7,8, nörotransmitter reseptör bağlanması9, miyokard perfüzyonu10 ve çeşitli nörolojik durumlar11 gibi çeşitli moleküler düzeyde fizyolojik süreçlerin görselleştirilmesini ve ölçülmesini sağlar. Klinik kullanımın dışında, PET'in doğal özellikleri, tanısal ve terapötik ilaç geliştirmede ayrılmaz bir rol oynayacak şekilde hizalanır ve farmakoloji, farmakokinetik ve farmakodinamik etkileşiminin doğrudan gözlemlenmesiyle bağlanma potansiyeli (BP), biyodağılım, dağılım hacmi (VT) ve ilaç-reseptör doluluğu (RO%) gibi parametrelerin nicelleştirilmesine olanak tanır. Bu da, bir bileşiğin etkili bir doz (ED50) konsantrasyonunda bir hedefe ulaşıp ulaşmadığı, kan-beyin bariyerinin etkili penetrasyon derecesi, bileşiğin metabolik bütünlüğü ve uygun doz ve doz aralığı11 dahil olmak üzere belirlemelere katkıda bulunur.
PET görüntüleme için yararlı bir prob geliştirirken, uygun bir biyobelirteçin tanımlanması ve ilişkili bir ligandın seçilmesi üzerine, biyomolekülün uygun bir PET radyonüklid ile radyo-etiketlemesi, PET çalışması için radyoizleyici probu verir. Biyolojik, farmakolojik veya tıbbi soruları araştırmak için PET radyonüklidleri arasında, karbon-11, çeşitli biyomoleküller ve uygun ligandlar arasında yaygın olarak kullanılmasını sağlayan sentetik çok yönlülük ve uygun fiziksel özelliklerin bir kombinasyonunu sunar6. % 99.8 pozitron emisyonu ve 20.4 dakikalık yarılanma ömrü12 ile karbon-11, çok aşamalı sentezlere izin verirken deneklere kısa aralıklarla tekrarlanan uygulamaya izin verir. Bununla birlikte, bu avantajlar, yerinde siklotron ve radyokimya yeteneklerine sahip bir tesis gerektirir5.
Bu tür tesisler, genellikle elektrofilik [11C]iyodometan ([11C]CH3I) veya [11C]metil triflat ([11C]CH3OTf) substratı13 ile öncü moleküllerin radyo-etiketlenmesini sağlayan güvenilir, güçlü ve tekrarlanabilir metilasyon yöntemleri gerektirir. Üreticiden sağlanan bir radyosentez modülü, tipik olarak [11C] metilasyon reaksiyonlarına14 bir reaksiyon kabı yaklaşımı için yapılandırılır. Bu, teslimat sırasında etkili [11C] iyodometan veya [11C] metil triflate tutma için kabın soğutulmasını, reaksiyonu gerçekleştirmek için kabın kapatılmasını ve ısıtılmasını, söndürülmesini ve ardından reaksiyona giren içeriklerin yarı hazırlayıcı saflaştırma için yüksek performanslı bir sıvı kromatografisine (HPLC) aktarılmasınıiçerir 13. Etkili 15 olmakla birlikte, bu teknik, flakon septa, iğneler ve ilgili transfer hatlarını içeren çok sayıda potansiyel yapısal başarısızlık noktası sunar.
Daha güvenilir ve tekrarlanabilir bir metilasyon yöntemine duyulan ihtiyaç, karbon-11 radyoligand sentez protokollerimizin çoğunda sabit bir çözücü modifikasyonunun araştırılmasına ve araştırılmasına rehberlik etti. Bu yaklaşım, radyoetiketleme verimliliğini korurken veya geliştirirken geleneksel reaksiyon kabı yönteminin sınırlamalarını ele almayı amaçlar.
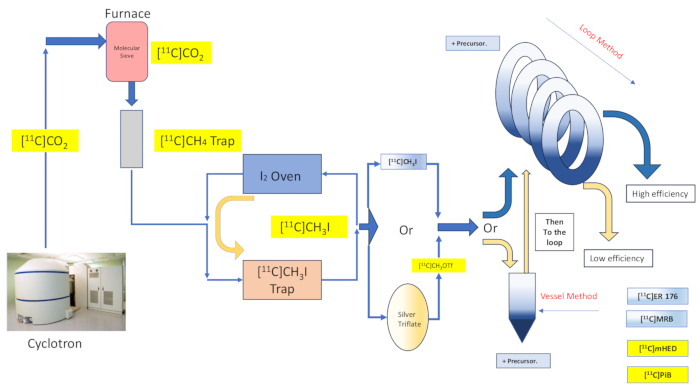
Şekil 2: Reaksiyon kabı sentezinin tasarımı ve akışı ve döngü yöntemi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tutsak çözücü kimyası, öncü çözeltinin bir destekleyici malzeme veya yapının geniş bir alanına yayılması ve ardından gaz halindeki etiketleme reaktifinin kaplanmış malzeme16,17 ile temas etmesi yoluyla radyo-etiketleme reaktifinin verimli bir şekilde yakalanması ve reaksiyona sokulması vaadini sunar. Bu, iki reaktan fazı16,18 arasındaki temasın kapsamını ve kalitesini arttırır. Bu tekniğin çok sayıda uygulaması ve varyasyonu 1985 16,17,18,19,20 gibi erken bir tarihte belgelenmiştir ve [11C]metil iyodür, [11C]metil triflat, ayrıca Grignard reaktifi [11C]karbondioksit radyoetiketleme reaksiyonları 20. Daha fazla arıtma, orijinal olarak Wilson ve diğerleri tarafından tanımlanan, HPLC saflaştırma döngüsü tarafından halihazırda sunulanlara herhangi bir ek destek veya reaksiyon ortamının ısıtılması veya soğutulmasıgerektirmeyen tutsak çözücü "döngü yöntemi" kimyasının tartışılmasıyla sunuldu 13. Esir Çözücü "döngü yöntemi" radyo etiketlemenin, minimum transfer kaybı, yüksek radyokimyasal verim, yüksek molar aktivite, azaltılmış reaksiyon süresi ve basitlik 7,21,22,23 ile iyodometan ve metil triflat [11 C] metilasyon reaksiyonları verdiği bulundu.
Burada, grubumuzun orijinal olarak Wilson13 tarafından tanımlanan "döngü yöntemi" [11C] metilasyon tekniğini ve daha sonradiğerleri 14,15,18,21,22,23'ü (bkz. Şekil 2) sentez modülümüze (bundan böyle Modül olarak anılacaktır) mekanik modifikasyon (bkz. Şekil 3) yoluyla uygulamasını açıklıyoruz). Mümkün olduğunca ilham verici basitlik anlayışına yakın bir şekilde, bu mekanik modifikasyonlar minimal ve erişilebilirdi, bu da mühendislik karmaşıklığının genel olarak azalmasına ve yalnızca modülün üreticisi tarafından varsayılan bir reaksiyon kabı radyoetiketleme düzenlemesiyle ilişkili olarak halihazırda kurulmuş olanlara temel bileşenlerin eklenmesine neden oldu. Bu, aşağıda açıklandığı gibi, modül üreticisi tarafından halihazırda sağlanan ve önceden kurulmuş olan ve incelenen sentezlerle uyumlu ve etkili olduğu kanıtlanan paslanmaz çelik HPLC saflaştırma döngüsünü kullanma kararında yansıtılmaktadır. Karbon-11 iyodometan kullanılarak radyoizleyici [11C] - (R) -N-sec-butil-4- (2-klorofenil) -N-metilkinazolin-2-karboksamid, [11C] ER-176 (1) sentezi için klinik araştırma üretiminde kullanılan eksiksiz ve doğrulanmış döngü yöntemi radyoetiketleme protokolünü tüm ayrıntılarıyla tartışıyoruz. Ayrıca, (S,S)-[11C]metilreboksetin ([11C]MRB (2)),[11C]-meta-hidroksiefedrin ([11C]mHED (3)) ve 2-[4-[(11C)metilamino]fenil]-1,3-benzotiyazol-6-ol ([11C]PiB (4)) sentezlenen partilerin analizi ile belirlendiği gibi tesisimizde geliştirilmiştir (bakınız Tablo 1 veŞekil 1 ). Bu karşılaştırma, radyokimya laboratuvarı için minimum maliyetle erişilebilir ve basit modül modifikasyonları ile sağlanan "döngü yöntemi" radyoetiketlemesinin uygulanmasıyla ilişkili radyokimyasal verim ve molar aktivite gibi parametrelere yönelik açık nimeti göstermektedir.
Protokol
NOT: Tüm ekipman ve sentezler, kurşun korumalı bir sıcak hücrede veya mini hücrede gerçekleştirilir. DİKKAT: Yüksek enerjili pozitron yayan parçacıklar siklotrondan üretilir ve kullanılır. Alan, kalibre edilmiş Geiger sayaçları ile izlenir ve bireyler radyasyon güvenliği tarafından verilen dozimetri halkaları ve rozetleri takarlar. Tüm personel yüksek enerjili radyoaktif maddelerle çalışmak üzere eğitilmiştir.
Tüm sentezler, dahili standart çalışma prosedürlerimize (SOP) göre temiz ve sterilize edilmiş bir Modül üzerinde gerçekleştirilir. Temizleme işlemi, Modülün reaksiyon kısmı için 1 N HCl, su, aseton ve asetonitril kullanımını içerir. Bu arada, Modülün formülasyon kısmı su ve etanol ile temizlenir ve sterilize edilir.
1. [ 11C ] ER-176 (1) 'in döngü yöntemi ile radyo-etiketlemesi
NOT: [11C]ER-176 (1) hazırlanırken kullanılan malzemelerin listesi için lütfen Malzeme Tablosuna bakınız.
- Döngü yöntemi üretimi için Modülü yeniden indirin (bkz. Şekil 4AD). Doğrudan HPLC döngüsüne bağlanan bir rakora bir V8 valfi takın. Bu, reaksiyon kabını atlayacaktır.
- Modül üzerinde gerçekleştirilen tüm üretimlerden önce metan (CH4) fırınını 350 °C'de 20 dakika boyunca 100 mL / dak hidrojen gazı akışıyla koşullandırın. Devam etmeden önce 45 °C'ye soğutun.
- Modülde gerçekleştirilen tüm üretimlerden önce CH4 kapanını 120 °C'de 20 dakika boyunca 50 mL/dk'lık bir helyum gazı akışıyla koşullandırın. Devam etmeden önce 70 °C'ye soğutun.
- Modülde gerçekleştirilen tüm üretimlerden önce metil iyodür tuzağını 190 °C'de 20 dakika boyunca 50 mL / dk'lık bir helyum gazı akışıyla koşullandırın. Devam etmeden önce 50 °C'ye soğutun.
- Modül için reaktif yükleme:
- 100 μL'lik bir şırınga kullanarak, aşağıdaki karışımı altı valfin dahili HPLC döngüsünün #1 konumundaki adaptörden enjekte edin: (R)-N-sn-butil-4- (2-klorofenil) -kinazolin-2-karboksamid (1.0 ± 0.05 mg) dimetil sülfoksit-d6 (100 ± 10 μL) ve 6 N sodyum hidroksit (4 μL).
NOT: Döteryumlu çözücüler, ampul formundaki mevcudiyetleri ve tipik olarak üretim sırasında damıtıldıkları için seçilmiştir, bu da su içermediklerinden emin olunmuştur. - V4 rezervuarını enjeksiyon için 3.0 mL% 0.9 sodyum klorür ile yükleyin.
- V5 rezervuarını 1.0 mL 200 geçirmez etanol ile doldurun.
- V6 rezervuarını 10 mL steril deiyonize su ile doldurun.
- Büyük şişeyi 25 mL steril deiyonize su ile doldurun.
- Formülasyon şişesini enjeksiyon için 6.0 mL% 0.9 sodyum klorür ile doldurun.
- Teslimat hattının steril, önceden monte edilmiş bir nihai ürün şişesine bağlı olduğundan emin olun.
- Mobil fazı 37:63 (h/h) asetonitril ve 20 mM amonyum hidroksit karışımı ile hazırlayın.
- Yarı hazırlık kolonunu dört kolon hacmi mobil faz ile koşullandırın.
NOT: Kullanılan kolon C18 100 mm x 10 mm ters fazlı kolondur.
- 100 μL'lik bir şırınga kullanarak, aşağıdaki karışımı altı valfin dahili HPLC döngüsünün #1 konumundaki adaptörden enjekte edin: (R)-N-sn-butil-4- (2-klorofenil) -kinazolin-2-karboksamid (1.0 ± 0.05 mg) dimetil sülfoksit-d6 (100 ± 10 μL) ve 6 N sodyum hidroksit (4 μL).
- Otomatik modülün hazırlanması sırasında, 14N(p,α)11 C nükleer reaksiyonla [11 C]karbondioksit üretmek için çift ışınlı hedeflerde 60-80 dakika boyunca 55 μA'da 11 MeV'lik bir siklotron üzerinde karbon-11siklotron hedefini (%1 oksijen, %99 azot) bombardıman edin.
- [11C]karbondioksiti siklotrondan Modüle boşaltmadan yaklaşık 20 dakika önce, başlat düğmesine tıklayarak [11C]ER-176 sentezi için doğrulanmış zaman listesini başlatın. Radyoaktif [11C] karbondioksit almadan önce CH45 sütununun45 o C'ye soğumasını bekleyin (bkz. Şekil 3). Karbosfer sütun tuzağının (CH4 kapanı) -75 ° C'yesoğumasına izin verin.
- [11C]karbondioksitin kuru kimya işlemi yoluyla [11C]metil iyodüre dönüştürülmesi için Modüle gömülü yöntem aşağıdaki gibi ilerlesin:
- Bir nikel katalizörü (Shimalit-Nikel) üzerinde 350 °C'de hidrojen gazı ile reaksiyona girerek [11° C] karbondioksit aktivitesini [11° C] metana dönüştürün. Dönüştürülmemiş [11C] karbondioksiti ve oluşan suyu tutmak için bir askarit tuzağı (sodyum hidroksit) kullanın.
- Daha fazla saflaştırma ve konsantrasyon için oluşan [11C] metanı -75 ° C'debir karbosfer sütun tuzağı (CH4 tuzağı) üzerine hapsedin. Sıkışan [11C] metanı serbest bırakmak için karbosfer sütununu 80 oC'ye ısıtın.
- Saflaştırılmış [11C] metanı 720 oC'de elementel iyot ile reaksiyona sokarak [11C] metil iyodür ([11C] CH3I) bir helyum devridaim gaz pompası yoluyla, olay tarafından üretilen hidrojen iyodür başka bir askarit tuzağı tarafından tutulurken dönüştürülmemiş [11C] metan dolaşım sürecine geri döner.
- Oluşan [11C] CH3I'yi oda sıcaklığında devridaim işlemi sırasında biriken metil iyodür (MeI) sütunu üzerine hapsedin.
- Sirkülasyon işleminin sonunda, toplanan [11C] CH3I'yi helyum akışı (15 mL / dak) altında 190 °C'ye ısıtarak, MeTf kolonundan baypas ederek ve bir çek valf aracılığıyla önceden yüklenmiş öncü çözeltiyi içeren 1.5 mL paslanmaz çelik halkaya yönlendirerek MeI tuzağından serbest bırakın (adım 1.5.1).
- [11C] CH3I, 180 saniye boyunca döngüden geçtikten sonra, reaksiyon karışımını saflaştırma için yarı hazırlıklı HPLC kolonuna enjekte edin. Aşağıdaki HPLC koşullarını kullanın: 37:63 (h/h) asetonitrilin mobil fazı: 5,0 mL/dak akış hızında ve 235 nm UV dalga boyunda 20 mM amonyum hidroksit; [11C] ER-176'nın tutma süresi (tR): yaklaşık 12-14 dakika. Şekil 5'e bakın.
- Fraksiyon örneğini 25 mL steril deiyonize su içeren büyük bir alıcı şişeye toplayın. Seyreltilmiş karışımı bir C18 hafif katı faz ekstraksiyonu (SPE) kartuşuna yükleyin.
- Ürünü (1) ilave 10 mL steril deiyonize su ile yıkayın.
- İstenilen ürünü 200 geçirmez etanol (1 mL) kullanarak C18 light SPE'den çıkarın. Bu elüsyonu, enjeksiyon için (6 mL) %0.9 sodyum klorür ile önceden yüklenmiş bir formülasyon şişesine yönlendirin.
- C18 light SPE'yi V4 rezervuarı yoluyla enjeksiyon için ek 3 mL %0,9 sodyum klorür ile daha fazla durulayın.
- Nihai çözeltiyi formülasyon şişesinde (~ 10 mL) toplayın ve 0.22 μm'lik bir sterilizasyon filtresinden önceden monte edilmiş steril, apirojenik, USP Tip I 50 mL'lik bir cam şişeye geçirin, kauçuk bir septum ile kapatılmış ve bir alüminyum kapakla kıvrılmış.
- Telemanipülatörleri kullanarak, kalite kontrol (QC) numunesi olarak nihai ürün şişesinden bir alikotu çıkarın. Bir hastaya serbest bırakılmadan ve uygulanmadan önce belirlenmiş spesifikasyonlara uygunluğu sağlamak için bu numuneyi çok sayıda QC testine tabi tutun (bkz. Tablo 2).
NOT: (11) 'nin radyoetiketlemesi için [3C] CH2I kullanarak bu döngü yöntemi prosedürünü uygulayın; (3) ve (4) üretmek için [11C]CH3 OTf oluşturun ve kullanın (bkz. Ek Dosya 1).- Tesiste gerçekleştirilen tipik kalite kontrol analizini takip etmek için, bir numuneyi nihai ürün şişesinden bir TB şırıngaya ve ardından kurşun korumalı bir taşıyıcı kullanarak Kalite Kontrol odasına aktarmak için telemanipülatörler kullanın.
- Kurşun korumalı bir alanda (L blok), numuneyi pirojen içermeyen bir tüpe boşaltın ve ardından HPLC ve gaz kromatografisi (GC) analizleri için daha küçük cam şişelere (50-100 μL) dağıtın.
- İkinci bir numuneyi bakteriyel endotoksin analizi için uygun konsantrasyona kadar pirojen içermeyen suyla seyreltin.
- Nihai ürün çözeltisinin bir örneğini (sterilite örneği olarak hem triptik soya suyu (TSB) hem de sıvı tiyoglikolat ortamı (FTM) ortamında) aşılayın). Bu örnekleri 14 gün boyunca büyüme için kuluçkaya yatırın ve gözlemleyin.
- Nihai ürün çözeltisinin asitliğini/bazlığını görsel olarak belirlemek için bir pH şeridine küçük bir alikot uygulayın.
2. [11C] ER-176 (1) 'in radyo-etiketlenmesi için reaksiyon kabı yöntemi
- Modülün iç temizlik protokolüne göre iyice temizlendiğinden emin olun.
- Modülün reaksiyon kısmını temizlemek için 1 N HCl, su, aseton ve asetonitril ve Modülün formülasyon kısmını temizlemek ve sterilize etmek için su ve ardından etanol kullanın.
- Modül üzerinde gerçekleştirilen tüm üretimlerden önce metan (CH4) fırınını 350 °C'de 20 dakika boyunca 100 mL / dak hidrojen gazı akışıyla koşullandırın. Devam etmeden önce 45 °C'ye soğutun.
- Modülde gerçekleştirilen tüm üretimlerden önce CH4 kapanını 120 °C'de 20 dakika boyunca 50 mL/dk'lık bir helyum gazı akışıyla koşullandırın. Devam etmeden önce 70 °C'ye soğutun.
- Tüm üretimlerden önce MeI tuzağını 190 °C'de 20 dakika boyunca 50 mL / dk'lık bir helyum gazı akışıyla koşullandırın. Devam etmeden önce 50 °C'ye soğutun. V8 hortumunun damardaki iğneye bağlı olduğundan emin olun.
- Helyum gazı kullanarak, alıcı valften (V24 ila V16) dahili MeI döngüsüne ve V8'den V23'ü sızdırmazlık/egzoz kaynağı olarak kullanarak kaba bir sızıntı testi yapın.
- Modül için reaktif yükleme:
- Aşağıdakileri ekleyin: (R)-N-sn-butil-4- (2-klorofenil)-kinazolin-2-karboksamid (1.0 ± 0.05 mg) dimetil sülfoksit-d6 (100 ± 10 μL) ve 6 N sodyum hidroksit (4 μL) reaktör kabına.
- V2 rezervuarını 1.0 mL 37:63 asetonitril:20 mM amonyum hidroksit ile doldurun.
- V4 rezervuarını enjeksiyon için 3.0 mL% 0.9 sodyum klorür ile yükleyin.
- V5 rezervuarını 1.0 mL 200 geçirmez etanol ile doldurun.
- V6 rezervuarını 10 mL steril deiyonize su ile doldurun.
- Büyük şişeyi 25 mL steril deiyonize su ile doldurun.
- Formülasyon şişesini enjeksiyon için 6.0 mL% 0.9 sodyum klorür ile doldurun.
- Teslimat hattının önceden monte edilmiş steril nihai ürün şişesine bağlı olduğundan emin olun.
- Bir rezervuarı HPLC mobil faz (37:63 (h/h) asetonitril:20 mM amonyum hidroksit) ile doldurun ve HPLC pompasına bağlayın.
NOT: Kullanılan yarı hazırlık sütunu yukarıdakiyle aynıdır ve mobil faz (4 sütun hacmi) ile ön koşullandırılmıştır.
- Otomatik modülün hazırlanması sırasında, 14N(p,α)11 C nükleer reaksiyonla [11 C]karbondioksit üretmek için çift ışınlı hedeflerde 60-80 dakika boyunca 55 μA'da 11 MeV'lik bir siklotron üzerinde karbon-11siklotron hedefini (%1 oksijen, %99 azot) bombardıman edin.
- [11C]karbondioksiti siklotrondan Modüle boşaltmadan yaklaşık 20 dakika önce, başlat düğmesine tıklayarak [11C]ER-176 sentezi için doğrulanmış zaman listesini başlatın. Radyoaktif [11C] karbondioksit almadan önce CH45 sütununun45 o C'ye soğumasını bekleyin (bkz. Şekil 3). Karbosfer sütun kapanının (CH4 kapanı) -75 ° C'yesoğumasına izin verin
- [11C]karbondioksitin kuru kimya işlemi yoluyla [11C]metil iyodüre dönüştürülmesi için Modüle gömülü yöntem aşağıdaki gibi ilerlesin:
- Bir nikel katalizörü (Shimalit-Nikel) üzerinde 350 °C'de hidrojen gazı ile reaksiyona girerek [11° C] karbondioksit aktivitesini [11° C] metana dönüştürün. Hem dönüştürülmemiş [11C] karbondioksiti hem de oluşmuş suyu bir askarit tuzağı (sodyum hidroksit) ile tutun.
- Daha fazla saflaştırma ve konsantrasyon için -75 ° C'debir karbosfer sütunu üzerinde [11° C] metanı hapsedin. [11C]metanı serbest bırakmak için karbosfer sütununu 80 oC'ye ısıtın.
- Saflaştırılmış [11C] metanı 720 oC'de elementel iyot ile reaksiyona sokmak için [11C] metil iyodür oluşturmak için, olay tarafından üretilen hidrojenin başka bir askarit tuzağı tarafından tutulduğu ve dönüştürülmemiş [11C] metanın iç döngü devridaim adı verilen dolaşım sürecine geri döndüğü bir devridaim gaz pompası vasıtasıyla reaksiyona sokun.
- Oluşan [11C] metil iyodürü oda sıcaklığında, devridaim işlemi sırasında biriken MeI sütunu üzerine hapsedin.
- Sirkülasyon işleminin sonunda, toplanan [11 C] metil iyodürü serbest bırakmak için gözenekli polimerik adsorban tuzağını helyum akışı (30 mL / dak) altında 190 °C'ye ısıtın ve bir çek valf aracılığıyla 3 mL'lik karbon-11 radyo-etiketleme için 11 mL reaksiyon kabına yönlendirin.
- [11C] metil iyodür üretimi ve birikimi plato haline geldiğinde, gümüş triflat kolonunu baypas edin ve radyoaktif gazı V8 üzerinden öncü karışımı içeren reaksiyon kabına yönlendirin. [11C] metil iyodürün 3 dakika köpürmesine izin verin, ardından reaksiyon kabını kapatın ve 80 ° C'de5 dakika ısıtın.
- Etiketleme tamamlandıktan sonra, 5 dakika sonra, reaksiyon kabını 30 °C'ye soğutun ve V2 rezervuarından 1 mL mobil faz ile seyreltin.
- Aşağıdaki HPLC koşullarını kullanarak saflaştırma için karışımı yarı hazırlıklı HPLC kolonuna enjekte edin: 37:63 (h/h) asetonitrilin mobil fazı: 5,0 mL/dak akış hızında 20 mM amonyum hidroksit ve 235 nm UV dalga boyu; tR / [11C]ER-176 (1): yaklaşık 9–11 dakika, bkz. Şekil 6.
- Fraksiyon örneğini 25 mL steril deiyonize su içeren büyük alıcı şişeye toplayın. Bu seyreltilmiş karışımı bir C18 hafif SPE kartuşuna yükleyin.
- Sıkışan ürünü (1) ilave 10 mL steril deiyonize su ile yıkayın.
- İstenilen ürünü, enjeksiyon için %0,9 sodyum klorür (6,0 mL) ile önceden yüklenmiş bir formülasyon şişesine yönlendirilmiş 200 geçirmez etanol (1,0 mL) kullanarak C18 hafif SPE'den çıkarın.
- C18 light SPE'yi enjeksiyon için ilave 3,0 mL %0,9 sodyum klorür ile durulayın.
- Nihai çözeltiyi formülasyon şişesinde (~ 10 mL) toplayın. Bu ortamı 0,22 μm'lik bir sterilizasyon filtresinden önceden monte edilmiş steril, apirojenik, USP Tip I 50 mL'lik bir cam şişeye geçirin, kauçuk bir septum ile kapatın ve bir alüminyum kapakla kıvrın.
- Kalite kontrol (QC) numunesi olarak nihai ürün şişesinden bir alikotu çıkarmak için telemanipülatörler kullanın (bkz. adım 1.15). Numuneyi, radyoizleyicinin serbest bırakılmadan ve bir hastaya uygulanmadan önce tüm kabul kriterlerini geçmesi gereken birkaç teste tabi tutun (bkz. Tablo 2).
NOT: (11)'nin radyoetiketlemesi için [3C]CH2I kullanarak bu reaktör kabı yöntemini uygulayın; (3) ve (4) üretmek için [11C]CH3 OTf oluşturun ve kullanın (bkz. Ek Dosya 1).
Sonuçlar
New York Üniversitesi Langone Health (NYULH) Radyokimya grubu, hem insan araştırmaları hem de klinik öncesi uygulamalar için kullanılan çeşitli karbon-11, flor-18 ve galyum-68 radyoizleyicileri sağlar. PET radyoizleyicilerin üretimi için çeşitli yöntemler kullanılmaktadır. Ekibimiz (1), (2), (3) ve (4)' ün sentezi için döngü yöntemini kullanır (bkz. Şekil 1 ve Şekil 8). Üretim tamamlandıktan sonra, steril nihai ürün şişesinden bir alikot çıkarılır. Bu numune, hem nihai ürün çözeltisinin aşılanması (hem triptik soya suyu (TSB) hem de sterilite numunesi olarak sıvı tiyoglikolat ortamı (FTM) ortamında) hem de kalite kontrol testleri için toplu çözeltinin temsili bir numunesi için kullanılır. Her bir radyoizleyici, ürün uygulama için serbest bırakılmadan önce QC testlerine tabi tutulur (bkz. Tablo 2).
Kalite kontrol testi, ürün görünümünün görselleştirilmesini, filtre bütünlüğünün doğrulanmasını, radyonüklidik kimliğin, pH'ın, radyokimyasal kimliğin (radyo-HPLC), radyokimyasal saflığın (radyo-HPLC), kimyasal saflığın (HPLC), molar aktivitenin, mukavemetin, artık çözücünün, endotoksinlerin ve sterilitenin belirlenmesini içerir (bkz. Tablo 2). Yukarıda belirtilen her bir radyoizleyicinin klinik üretiminden aşağıdaki sonuçlar elde edilmiştir (bakınız Tablo 1).
Temsili bir analitik HPLC kromatogramı için Şekil 7'ye ve Ek Dosya 1'e bakın. Her radyoizleyicinin, bir deneğe serbest bırakılmadan ve uygulanmadan önce tüm kalite kontrol spesifikasyonlarını (bakınız Tablo 2) geçmesi gerekir.
[11C]MRB (2) (Ek Şekil 1), [11C]m HED (3) (Ek Şekil 2) ve [11C]PiB (4) (Ek Şekil 3).
| Bileşik | Parametre | Döngü Yöntemi (ort. ± standart) | Reaktör Yöntemi (ort. ± standart) |
| [11C]ER-176 Serisi | Prodüksiyon sayısı | 25 | 6 |
| Sentezin başlangıcı | 86 ± 5.0 GBq | 52 ± 25,7 GBq | |
| Sentezin Sonu | 5,4 ± 2,2 GBq | 1,6 ± 0,5 GBq | |
| Radyokimyasal Saflık | 99,6 ± 0,6% | 99.9 ± %0.1 | |
| ER-176 konsantrasyonu | 1,1 ± 0,5 μg/mL | 0,63 ± 0,37 μg/mL | |
| molar aktivite | 194 ± 66 GBq/μmol | 132 ± 78 GBq/μmol | |
| Toplam Sentez Süresi | 36 ± 3 dk | 44 ± 6 dk | |
| [11C]MRB (Türkçe) | Prodüksiyon sayısı | 70 | 6 |
| Sentezin başlangıcı | 84 ± 5,4 GBq | 39 ± 11,9 GBq | |
| Sentezin Sonu | 3.0 ± 1.2 GBq | 1,9 ± 0,7 GBq | |
| Radyokimyasal Saflık | %99,5 ± %0,5 | 99,7 ± %0,8 | |
| MRB konsantrasyonu | 0,52 ± 0,24 μg/mL | 0,68 ± 0,41 μg/mL | |
| molar aktivite | 190 ± 50 GBq/μmol | 99 ± 55 GBq/μmol | |
| Toplam Sentez Süresi | 35 ± 3 dk | 42 ± 3 dk | |
| [11C]mHED | Prodüksiyon sayısı | 5 | 11 |
| Sentezin başlangıcı | 69 ± 10,5 GBq | 82 ± 4.3 GBq | |
| Sentezin Sonu | 5.5 ± 1.3 GBq | 3.3 ± 1.0 GBq | |
| Radyokimyasal Saflık | 98,2 ± %1,3 | 99.1 ± 0.7% | |
| mHED konsantrasyonu | 0,40 ± 0,10 μg/mL | 0,52 ± 0,37 μg/mL | |
| molar aktivite | 301 ± 48 GBq/μmol | 155 ± 77 GBq/μmol | |
| Toplam Sentez Süresi | 27 ± 4 dk | 32 ± 2 dk | |
| [11C]PiB | Prodüksiyon sayısı | 51 | 10 |
| Sentezin başlangıcı | 86 ± 5,4 GBq | 57 ± 17,2 GBq | |
| Sentezin Sonu | 3.2 ± 0.8 GBq | 1.4 ± 0.2 GBq | |
| Radyokimyasal Saflık | 97.0 ± 1.5% | 99.1 ± %1.4 | |
| PiB konsantrasyonu | 0,22 ± 0,51 μg/mL | 0,30 ± 0,24 μg/mL | |
| molar aktivite | 201 ± 68 GBq/μmol | 207 ± 124 GBq/μmol | |
| Toplam Sentez Süresi | 35 ± 2 dk | 36 ± 5 dk |
Tablo 1: [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) ve [11C]PiB (4) 'ün döngü yöntemi veya reaksiyon kabı yöntemi yoluyla üretilmesinden elde edilen sonuçlar. Tüm değerler sentez sonunda rapor edilir. Kısaltmalar: [11C] ER-176 = [11C] - (R) -N-sec-butil-4- (2-klorofenil) -N-metilkinazolin-2-karboksamid; [11C]MRB = (S,S)-[11C]metilreboksetin; [11C]mHED = [11C]-meta-hidroksiefedrin; [11C]PiB = 2-[4-[(11C)metilamino]fenil]-1,3-benzotiyazol-6-ol.
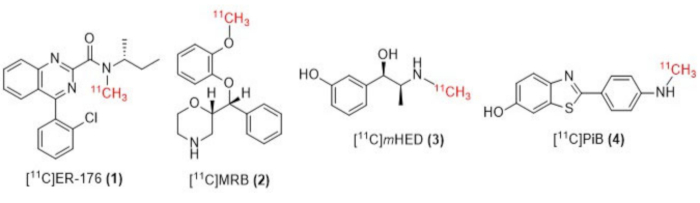
Şekil 1: [11C]ER-176 (1), [11C]MRB (2), [11C] m HED (3) ve [11C]PiB (4) yapıları. Kısaltmalar: [11C] ER-176 = [11C] - (R) -N-sec-butil-4- (2-klorofenil) -N-metilkinazolin-2-karboksamid; [11C]MRB = (S,S)-[11C]metilreboksetin; [11C]mHED = [11C]-meta-hidroksiefedrin; [11C]PiB = 2-[4-[(11C)metilamino]fenil]-1,3-benzotiyazol-6-ol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
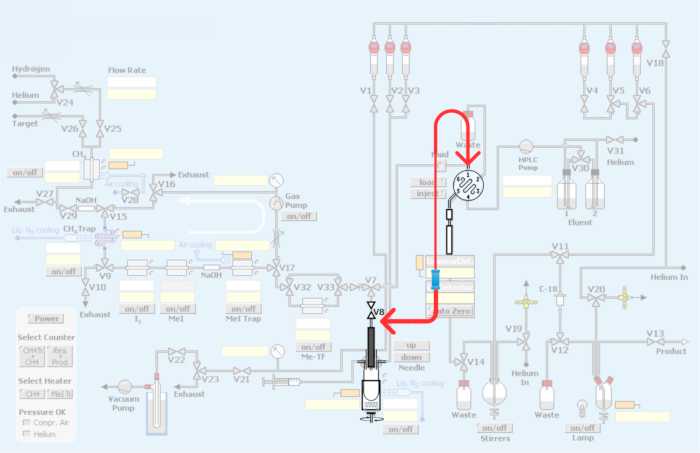
Şekil 3: Otomatik Modülde yapılan değişiklikler. Kırmızı, karbon-11 metilasyonu yoluyla PET radyoizleyicilerin üretimi için döngüyü dahil etmek üzere sentez modülünün yeniden tesisatını temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: PET radyoizleyicilerin karbon-11 metilasyonu için döngü yöntemini dahil etmek için modül tesisatı ve yeniden tesisat. (A) Rakor konektörlü HPLC enjeksiyon döngüsü. (B) Reaksiyon kabı yöntemi. V8 bağlantısını gösteren kırmızı ok. (C) Reaktör kabını baypas ederek döngü yöntemi yeniden tesisatı. HPLC girişine V8 bağlantısının reaksiyon kabını atladığını ve [11C] iyodometan veya [11C] metil triflatın HPLC döngüsüne doğrudan erişimine izin verdiğini unutmayın. (D) Reaktör kabı ile ilgili olarak birliğin yerleştirilmesi. Paslanmaz çelik HPLC döngüsüne olan bağlantıya dikkat edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
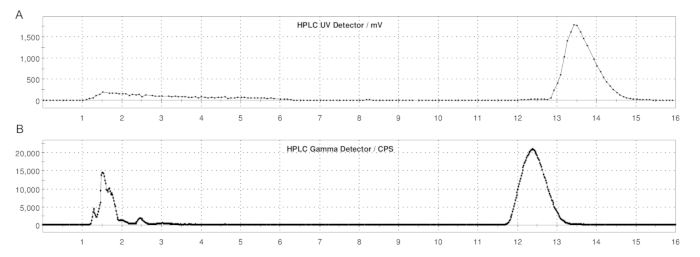
Şekil 5: ER-176 ve [11C]ER-176'nın döngü yöntemi üretimi ile yarı hazırlık HPLC profilleri. (A) ER-176 için yarı hazırlıklı HPLC profili (1) UV = 235 nm'de döngü yöntemi üretimi yoluyla; tR = 13.2 dk. (B) [11C]ER-176 (1) için yarı hazırlıklı radyo-HPLC profili; tR = 12.4 dk. Koşullar: 37:63 (h/h) asetonitril: 5,0 mL/dk akış hızında 20 mM amonyum hidroksit. Kısaltma: [11C] ER-176 = [11C] - (R) -N-sec-butil-4- (2-klorofenil) -N-metilkinazolin-2-karboksamid. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
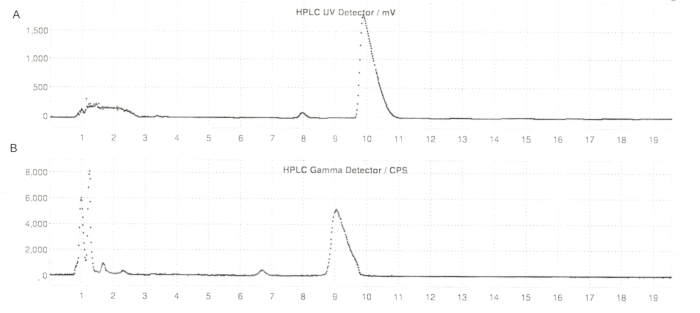
Şekil 6: ER-176 ve [11C]ER-176'nın reaktör yöntemi üretimi ile yarı hazırlık HPLC profilleri. (A) ER-176 için yarı hazırlık HPLC profili (1) UV = 235 nm'de reaktör yöntemi üretimi yoluyla; tR = 9.8 dk. (B) [11C]ER-176 (1) için yarı hazırlıklı radyo-HPLC profili; tR = 9.2 dk. Koşullar: 37:63 (h/h) asetonitril: 5,5 mL/dk akış hızında 20 mM amonyum hidroksit. Kısaltmalar: [11C] ER-176 = [11C] - (R) -N-sec-butil-4- (2-klorofenil) -N-metilkinazolin-2-karboksamid; tR = bekletme süresi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
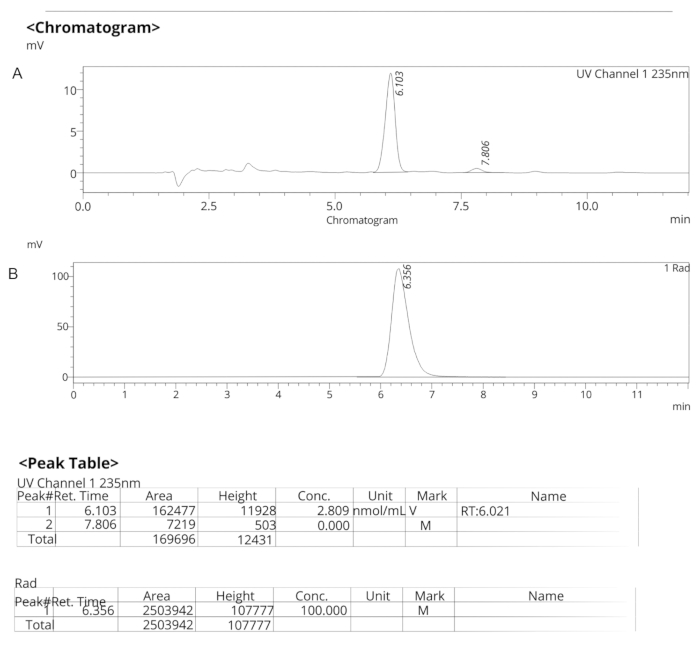
Şekil 7: ER-176 için analitik HPLC profilleri. (A) ER-176 için UV spektrumlarının analitik HPLC profili (1) 235 nm'de; tR = 6.10 dk. (B) [11C]ER-176 (1) için radyoizleyicinin analitik HPLC profili; tR = 6.36 dk. Koşullar: 10 μm C18 (2) 100  LC Sütun 250 x 4,6 mm; metanol/su 74/26, 1,5 mL/dk akış hızıyla. Kısaltma: [11C]ER-176 = [11C]-(R)-N-sn-butil-4- (2-klorofenil) -N-metilkinazolin-2-karboksamid; tR = bekletme süresi Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
LC Sütun 250 x 4,6 mm; metanol/su 74/26, 1,5 mL/dk akış hızıyla. Kısaltma: [11C]ER-176 = [11C]-(R)-N-sn-butil-4- (2-klorofenil) -N-metilkinazolin-2-karboksamid; tR = bekletme süresi Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
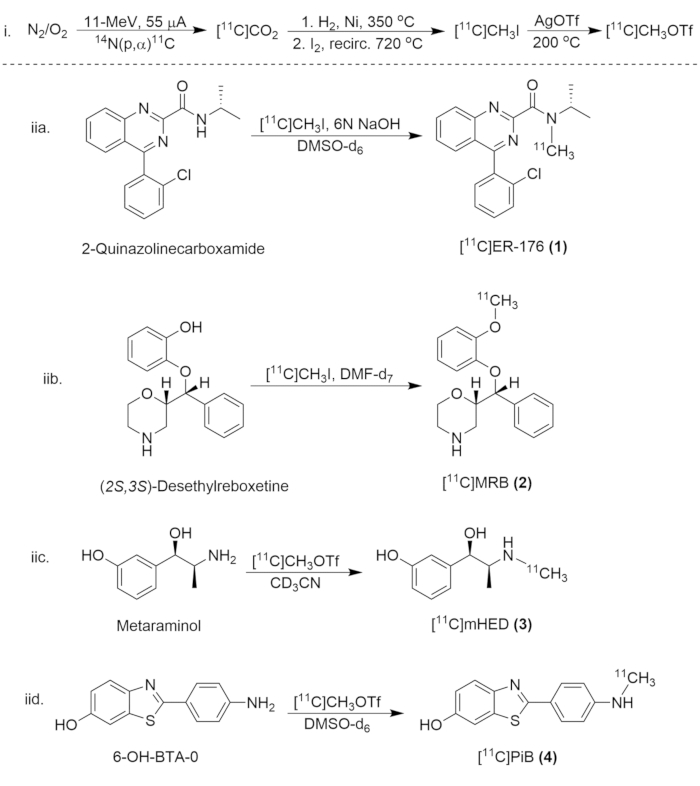
Şekil 8: Karbon-11 Bileşiklerinin Sentezi için Sentetik Şema. (i) [11C]CH3 I ve [11C]CH3OTf'nin oluşumu ve (iia.) [11C]ER-176'nın radyo-etiketlenmesi (1), (iib.) [11C]MRB (2), (iic.)[11C]mHED (3) ve (iid.) [11C]PiB (4). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Test/Parametreler | Özellikler |
| Görünüm (görsel inceleme) | Partikül madde içermeyen berrak, renksiz çözelti |
| Membran filtre bütünlüğü | ≥ 50 psi |
| Ph | 4.5 - 8.0 |
| Radyonüklidik kimlik (yarılanma ömrü) | 19,3 - 21,3 dk |
| Radyokimyasal kimlik (radyo-HPLC) | 0.90 ≤ tR Ürün / t R Std ≤ 1.10 |
| Radyokimyasal saflık (radyo-HPLC) | ≥ %95.0† |
| İlaç konsantrasyonu (HPLC) | notlara bakın* |
| Toplam kimyasal safsızlıklar (HPLC) | notlara bakın** |
| Molar aktivite (@ EOS) | > 9,25 GBq/μmol |
| Artık asetonitril (GC) | ≤ 410 sayfa/dk |
| Artık aseton (GC) | ≤ 5.000 ppm |
| Artık dimetil sülfoksit (GC) | ≤ 5.000 ppm |
| Artık etanol (GC) | ≤ %10 (h/h) |
| Artık metanol (GC) | ≤ 3.000 ppm |
| Kalıntı N,N-dimetilformamid (GC) | ≤ 880 sayfa/dk |
| Limulus Amip Lizatı (LAL) | ≤ 17.5 AB/mL |
| Sterilite (30 saat içinde başlar) | Steril (14 gün) |
| Hazırlık kayıtları | Eksiksiz ve doğru |
| Etiket | Eksiksiz, doğru, uzlaştırılmış |
Tablo 2: Karbon-11 radyoizleyicilerin onaylanması veya reddedilmesi için kalite kontrol kriterleri. † Radyokimyasal saflık [11C]mHED için %90,0'≥; * İlaç Konsantrasyonu: [11C] ER-176 ≤ 10 μg / doz; [11C]MRB ≤ 10 μg / doz; [11C]mHED ≤ 50 μg / doz; [11C]PiB ≤ 13.4 μg / doz; ** Toplam kimyasal safsızlıklar: [11C] ER-176 ≤ 1.0 μg / doz; [11C]MRB ≤ 1.0 μg / doz; [11C]mHED ≤ 5.0 μg / doz; [11C]PiB ≤ 1.34 μg / doz. Kısaltmalar: [11C] ER-176 = [11C] - (R) -N-sec-butil-4- (2-klorofenil) -N-metilkinazolin-2-karboksamid; [11C]MRB = (S,S)-[11C]metilreboksetin; [11C]mHED = [11C]-meta-hidroksiefedrin; [11C]PiB = 2- [4- [(11C) metilamino]fenil]-1,3-benzotiyazol-6-ol; EOS = sentezin sonu; GC = gaz kromatografisi; LAL = Limulus Amebosit Lizatı.
Ek Dosya 1: Kimyasallar ve malzemeler, döngü veya reaktör kabı yöntemi için kullanılan reaktifler, Kalite Kontrol testi, analitik HPLC kromatogramları. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Karbon-11 iyodometan veya metil triflat ile terminal heteroatomların geleneksel radyo-etiketlemesi, radyoaktif elektrofilik gazın bir reaksiyon kabına köpürtülmesini, yakalanmasını ve çözeltinin uzun süre reaksiyona girmesine izin verilmesini içerir18. Heterojen reaksiyonun konvansiyonel köpürmesi yavaş olabilir ve reaksiyon hızını hızlandırmak için ısıtma gerektirebilir. Saflaştırmadan önce, reaksiyon ortamının oda sıcaklığına soğutulması gerekebilir, ardından istenen radyoizleyicinin saflaştırılması için çözücü (örn. mobil faz) kullanılarak bir HPLC döngüsüne aktarılması gerekebilir. Bu adımlar zaman alıcıdır ve bu tür malzemelerin transferi sırasında geçici radyo etiketli ürünler kaybolabilir.
Tesisimizde, öncü çözeltinin bir HPLC paslanmaz çelik halka üzerine kaplandığı ve bileşiğin radyo-etiketlemesinin oda sıcaklığında döngü içinde gerçekleştiği döngü yönteminin kullanılmasının gerekçesini gösterdik. Döngü, radyoaktif [11C] CH3I veya [11C ] CH3OTf'nin iletimi ile aynı hizada bağlanır ve bir HPLC sisteminin enjeksiyon portuna bağlanır. Radyoetiketlemenin gerçekleşmesi için herhangi bir ısıtma gerekmez ve bu yazıda gösterilen tüm durumlar için reaksiyon 3 dakikadan kısa sürede gerçekleşir.
Paslanmaz çelik HPLC döngüsünün akış hızı ve boyutu, bu işlemin verimli bir şekilde çalışması için kritik görünmektedir. Test, radyoaktif gazın döngüye iletilmesi için taşıyıcı gaz olan helyumun akış hızının 8.0 mL/dk'dan 15.0 mL/dk'ya değiştirilmesiyle başladı. Buckley, doğru akış hızının uygulanmasının yanı sıra uygun çözücü ve döngü malzemesininkullanılmasının önemini inceledi 15. Sistemimiz için, [11C]CH3I veya [11 C]CH3OTf'nin radyoaktif elektrofilik türleri için 15mL/dk'lık akış hızı, bu yazıda tartışılan dört radyoizleyicinin tümünün radyo-etiketlemesi için iyi performans gösterir. Tüm sentezler için kullanılan döngü, 1/16 inçlik bir OD'ye ve 1 mm'lik bir ID'ye sahip 1.5 mL'lik paslanmaz çelik bir HPLC enjeksiyon döngüsüdür.
İki yöntemi (reaksiyon kabına karşı döngü yöntemi) karşılaştırdığımızda, elimizde, döngü yöntemi, insan araştırması tarafından onaylanmış dört radyoizleyicinin üretimi için sentez sonunda molar aktivitede (EOS) önemli bir artışla birlikte artan radyoetiketleme verimliliğini gösterdi. Örnek olarak, radyoizleyici [11C]mHED (3), EOS'ta molar aktivitenin iki katına çıkmanın yanı sıra, izole edilmiş nihai ürün aktivitesinde 1.6 kat artışa sahipti. Bu artan genel aktivite eğilimi, dört radyoizleyicinin hepsinde gözlenir (bakınız Tablo 1). Döngü yöntemini kullanırken elde edilen diğer olumlu sonuçlar arasında kurulum süresinin 5 dakika kısalması ve reaksiyon kabını temizlemeye gerek kalmaması, operatörün zamanından tasarruf etmesi ve temizleme protokolü için solvent kullanması yer alır.
Bu metodolojinin bazı dezavantajları, radyo izleyicilerin döngü yöntemi kullanılarak etkili bir şekilde etiketlenebileceği sınırları içerir. Radyoetiketleme için ısı gerekliyse, bu sistemi HPLC döngüsü içinde ısıtmaya izin verecek şekilde değiştirmek zordur. Bu sistem sıhhi tesisatta değişiklik yapılmasını gerektirir; 'Kutudan çıkar çıkmaz' hazır olmama özelliği, diğer kullanıcıları otomatik platformlarında bu tür değişiklikler yapmaktan caydırabilir14. Bu yöntem için ek tesisat ve rakorlar gerektiğinden (bkz. Şekil 4A-D), bu koşullar altında etiketleme yapıldığında radyoaktif salınımlar için ek alanlar için potansiyel artar. Modül üzerinde her çalıştırmadan önce bir sızıntı kontrolü yapmak akıllıca olacaktır.
Ekibimiz, Araştırma Amaçlı Yeni İlaç Uygulaması (IND) ve Radyoaktif İlaç Araştırma Komitesi (RDRC) onaylı dört adet karbon-11 radyoizleyici üretiminde kullanılan döngü yöntemini hayata geçirmiştir. Elimizde bu yöntemin geleneksel reaksiyon kabı yönteminden daha verimli ve daha yüksek verimli bir süreç olduğu kanıtlandı. Bu yöntem çoğu otomatik Modüle uygulanırken ek tesisat ve taşıyıcı helyum gazının akış hızında ayarlamalar dikkate alınmalıdır. Son olarak, bu yöntemin sınırlamaları vardır ve paladyum (II) ara maddesinin aktivasyonunu ve reaksiyon karışımının 24'ünün ısıtılmasını gerektiren [11C]UCB-J gibi belirlikarbon-11 radyoizleyiciler için uygun değildir.
Açıklamalar
Yazarlar, bu araştırmayla ilgili olarak ifşa edecekleri ilgili veya mali çıkarları olmadığını beyan ederler.
Teşekkürler
Eski NYULH Radyokimya laboratuvarı üyeleri Raul Jackson ve Grace Yoon'a, bir döngü yöntemi kullanarak karbon-11 metilasyonu için ilk çabaları üzerindeki çalışmaları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
Referanslar
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır