Method Article
ループ法を用いた臨床研究のための炭素11放射性配位子の効率と放射性標識収率の向上
要約
このプロトコルは、「ループ法」[11C]メチル化によって4つの炭素11放射性トレーサーを調製する詳細な手順を示しています。[11C]ER-176を合成する手順を、[11C]MRB、[11C]mHED、および[11C]PiBの3つの追加の放射性トレーサーのデータとともに説明します。ループ法は、従来の反応容器[11C]メチル化に対して放射化学的収率を高め、効率的な合成を提供します。
要約
炭素11放射性トレーサーを用いた陽電子放出断層撮影イメージングプログラムを成功させるには、迅速、効率的、かつ信頼性の高い合成方法が必要であり、現場のサイクロトロンおよび放射化学グループ、および炭素11放射性核種の独自の制約の下で運用するための訓練を受けた臨床スタッフが必要です。この研究では、4つのトレーサーを炭素-11放射性核種で放射性標識し、放射性配位子[11C]ER-176、[11C]MRB、[11C]mHED、および[11C]PiBを生成するキャプティブ溶媒「ループ法」のメリットと利点を調べます。
「ループ法」は、同一の自動化プラットフォーム上で同じ放射性トレーサーを合成する過程で、従来の反応器ベースの炭素11メチル化法と比較されます。さらに、[11C]ER-176放射性トレーサーの臨床研究準備の完全な概要を示します。[11C]ER-176の製造で実証されたように、不均一アルキル化のキャプティブ溶媒「ループ法」は、反応器法(EOS = 1.6 ± 0.5 GBq、n = 6)と比較して、優れた放射化学的純度(99.6 ± 0.6%、n = 25)、より高く、より一貫した放射性化学的収率(合成終了時(EOS)= 5.4 ± 2.2 GBq、n = 25)で、より効率的であることが証明されました。 モル活性の増加(ループ法= 194 ± 66 GBq/μmol、n = 25、反応器法= 132 ± 78 GBq/μmol、n = 6)、反応シーケンスが平均5分短縮されました。
概要
分子イメージングのモダリティの中で、陽電子放出断層撮影法(PET)は、特定の生理学的標的または関心領域に関連する生化学的プロセスの分解能において独特です1,2。PETの特徴的な感度と非侵襲性は、疾患の病態生理学のin vivoでの視覚化と定量化に利用され、コンピューター断層撮影法(CT)3や磁気共鳴画像法(MRI)4などのより解剖学的イメージング技術では見えない標的を明らかにすることがよくあります。現代の分子イメージングでは、PETとCTまたはMRI(PET/CT、またはPET/MR)の組み合わせが見られ、PETの高コントラスト分解能と定量化可能なイメージングパラメータを活用して、高精度の減衰補正マップ(PET/CT)と空間分解能の向上(PET/MR)5を提供し、ガリウム68やルビジウム82などの放射性核種からの陽電子の高運動エネルギーの変動によってもたらされるいくつかのハードルを克服しています 6.これらのデュアルモダリティイメージング技術は、個々のモダリティの特徴を導き、臨床医や研究者に、研究対象5に対する共同登録された解剖学的および生化学的洞察を豊富に提供します。
このイメージング技術の臨床応用性は広大であり、グルコース代謝7,8、神経伝達物質受容体結合9、心筋灌流10、およびさまざまな神経学的状態11など、さまざまな分子レベルの生理学的プロセスの視覚化と測定を提供します。臨床使用以外では、PETの固有の特性は、診断および治療薬の開発に不可欠な役割を果たすように調整されており、薬理学、薬物動態学、および薬力学の相互作用を直接観察することにより、結合電位(BP)、生体分布、分布容積(VT)、薬物受容体占有率(RO%)などのパラメーターの定量化を可能にします。これは、次に、化合物が有効用量(ED50)濃度で目標に到達するかどうか、血液脳関門の有効浸透の程度、化合物の代謝完全性、および適切な用量と投与間隔11を含む決定に貢献します。
PETイメージングに有用なプローブを開発する際には、適切なバイオマーカーを同定し、関連するリガンドを選択した後、適切なPET放射性核種による生体分子の放射性標識により、PET研究用の放射性トレーサープローブが得られます。生物学的、薬理学的、または医学的な問題を調査するためのPET放射性核種の中で、炭素11は、合成の多様性と良好な物理的特性の組み合わせを提供し、多様な生体分子および適格なリガンド6で広く使用できます。99.8%の陽電子放出と20.4分の半減期12を持つ炭素11は、短時間で被験者に繰り返し投与することを可能にする一方で、多段階の合成を可能にします。しかし、これらの利点には、サイクロトロンと放射化学の能力を備えた施設が必要です5。
このような施設には、多くの場合、求電子性の[11C]ヨードメタン([11C]CH3I)または[11C]メチルトリフラート([11C]CH3OTf)基質13を用いて、前駆体分子の放射性標識を可能にする、信頼性、強力、再現性のあるメチル化方法が必要です。製造業者から供給される放射性合成モジュールは、典型的には[11C]メチル化反応14への反応容器アプローチ用に構成される。これには、送達時に効果的な[11C]ヨードメタンまたは[11C]メチルトリフラート保持のために容器を冷却し、反応を成立させるために容器を密閉および加熱し、急冷し、次いで反応内容物を高速液体クロマトグラフィー(HPLC)システムに移して半分取精製13を行うことが含まれる。この手法は効果的ですが15 、バイアルセプタム、針、および関連するトランスファー ラインを含む、多数の潜在的な構造的障害点を示します。
より信頼性と再現性のあるメチル化法の必要性が、当社の多くの炭素-11放射性リガンド合成プロトコルに対するキャプティブ溶媒修飾の調査と追求を導きました。このアプローチは、従来の反応容器法の限界に対処しながら、放射性標識効率を維持または向上させることを目的としています。
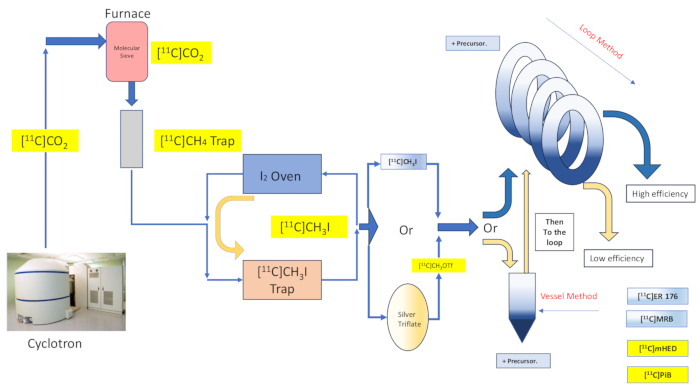
図2:反応容器合成とループ法の設計と流れ。この図の拡大版を表示するには、ここをクリックしてください。
キャプティブ溶媒化学は、支持材料または構造の広い領域に前駆体溶液を広げ、次いでガス状標識試薬を被覆材料16,17と接触させることにより、放射性標識試薬の効率的な捕捉および反応の約束を提供する。これにより、2つの反応物相16,18間の接触の範囲と質が向上する。この技術の数多くの実装とバリエーションは、1985年という早い時期に文書化されており、16,17,18,19,20、および[11C]メチルヨウ化物、[11C]メチルトリフラート、およびグリニャール試薬[11C]二酸化炭素放射性標識反応20への応用が見出されています.Wilsonらによって最初に記載されたキャプティブ溶媒「ループ法」化学の議論によってさらなる改良が提示されたが、これは、HPLC精製ループによって既に提供されているものに対する追加の支持も、反応環境の加熱または冷却も必要としない13。キャプティブソルベントの「ループ法」放射性標識は、ヨドメタンおよびメチルトリフラート[11C]メチル化反応に、最小限の移動損失、高い放射性化学的収率、高いモル活性、反応時間の短縮、および簡便性という長所を付与することがわかりました7,21,22,23。
ここでは、Wilson13によって最初に記載された「ループ法」[11 C]メチル化技術、およびその後の14,15,18,21,22,23(図2参照)の合成モジュール(以下、モジュールと呼ぶ)への機械的変更(図3参照)による「ループ法」[11C]メチル化技術の実装について説明します).シンプルさという野心的な精神にできるだけ近づき、これらの機械的な変更は最小限でアクセス可能であり、エンジニアリングの複雑さを全体的に軽減し、デフォルトの反応容器の放射性標識配置に関連するモジュールメーカーによってすでに設置されているコンポーネントに重要なコンポーネントを追加するだけでした。これは、以下で説明するように、モジュールメーカーがすでに供給およびプリインストールしているステンレス鋼HPLC精製ループを利用するという決定に反映されており、調査した合成と互換性があり、効果的であることが証明されました。我々は、放射性トレーサー[11C]-(R)-N-sec-ブチル-4-(2-クロロフェニル)-N-メチルキナゾリン-2-カルボキサミド[11C]ER-176(1)の合成のための臨床研究生産で利用された完全で検証されたループ法の放射性標識プロトコルについて、完全に詳細に議論します。さらに、リアクター法とループ法の両方で実施される放射性標識効率に関連する多数の属性を、(S,S)-[11C]メチルレボキセチン ([11C]MRB (2)),[11C]-メタ-ヒドロキシエフェドリン ([11C]mHED (3))、2-[4-[(11C)メチルアミノ]フェニル]-1,3-ベンゾチアゾール-6-オール ([11C]PiB (4) の 3 つの追加の放射性リガンドで比較します)は、合成されたバッチの分析によって決定されたように、当社の施設で開発されました(表1および図1 を参照)。この比較は、「ループ法」放射性標識の実施に関連する放射性化学的収量やモル活性などのパラメータに明らかな恩恵をもたらし、放射化学実験室にとって最小限のコストでアクセス可能で簡単なモジュールの変更によってもたらされることを示しています。
プロトコル
注:すべての機器と合成は、鉛シールドホットセルまたはミニセルのいずれかで実行されます。注意:サイクロトロンから高エネルギーの陽電子放出粒子が生成され、使用されます。エリアは校正されたガイガーカウンターで監視され、個人は放射線安全装置が発行した線量測定リングとバッジを着用します。すべての職員は、高エネルギー放射性物質を扱うための訓練を受けています。
すべての合成は、当社の内部標準作業手順(SOP)に従って、清潔で滅菌されたモジュールで行われます。洗浄プロセスには、モジュールの反応部分に1 N HCl、水、アセトン、およびアセトニトリルの使用が含まれます。一方、モジュールの製剤部分は、水とエタノールで洗浄および滅菌されます。
1. ループ法による[ 11C]ER-176 (1) の放射性標識
注:[11C]ER-176 (1)の調製に使用した材料のリストについては、 材料の表を参照してください。
- ループメソッドの生産のためにモジュールを配管し直します( 図4ADを参照)。V8バルブを、HPLCループに直接接続するユニオンに取り付けます。これにより、反応容器がバイパスされます。
- モジュールですべての生産を行う前に、メタン(CH4)炉を350 °Cで20分間、水素ガスの流れ100mL /分でコンディショニングします。先に進む前に45 °Cに冷ましてください。
- モジュールですべての生産を実行する前に、CH4 トラップを120 °Cで20分間、ヘリウムガス流量50mL/minでコンディショニングします。70 °Cまで冷ましてから続行します。
- モジュールですべての生産を行う前に、ヨウ化メチルトラップを190 °Cで20分間、ヘリウムガスの流れで50mL / minでコンディショニングします。先に進む前に50 °Cに冷ましてください。
- モジュールの試薬ローディング:
- 100 μL シリンジを使用して、アダプターの 6 ポート バルブ内部 HPLC ループの位置 #1 に、次の混合物を注入します: (R)-N-sec-ブチル-4-(2-クロロフェニル)-キナゾリン-2-カルボキサミド (1.0 ± 0.05 mg) ジメチルスルホキシド-d6 (100 ± 10 μL) および 6 N 水酸化ナトリウム (4 μL) に注入します。
注:重水素化溶媒は、アンプルの形で入手可能であり、通常は製造中に蒸留され、水を含まないことが保証されているため、選択されました。 - V4リザーバーに3.0mLの0.9%塩化ナトリウムを注入用に入れます。
- V5リザーバーに1.0mLの200プルーフエタノールをロードします。
- V6リザーバーに10mLの滅菌脱イオン水を入れます。
- 大きなレシーブフラスコに25mLの滅菌脱イオン水を入れます。
- 製剤フラスコに6.0mLの0.9%塩化ナトリウムを注入用に入れます。.
- デリバリーラインが滅菌済みの組み立て済み最終製品バイアルに取り付けられていることを確認します。
- アセトニトリルと 20 mM 水酸化アンモニウムの 37:63(v/v)混合物で移動相を調製します。
- セミプレップカラムを4カラム容量の移動相でコンディショニングします。
注:使用するカラムは、C18 100 mm x 10 mmの逆相カラムです。
- 100 μL シリンジを使用して、アダプターの 6 ポート バルブ内部 HPLC ループの位置 #1 に、次の混合物を注入します: (R)-N-sec-ブチル-4-(2-クロロフェニル)-キナゾリン-2-カルボキサミド (1.0 ± 0.05 mg) ジメチルスルホキシド-d6 (100 ± 10 μL) および 6 N 水酸化ナトリウム (4 μL) に注入します。
- 自動化モジュールの準備中に、炭素11サイクロトロンターゲット(1%酸素、99%窒素)を11MeVサイクロトロンに55μAで60〜80分間デュアルビームターゲットに照射し、14N(p,α)11C核反応によって[11C]二酸化炭素を生成します。
- サイクロトロンからモジュールに[11C]二酸化炭素をアンロードする約20分前に、スタートボタンをクリックして[11C]ER-176合成のバリデーションタイムリストを開始します。CH4カラムを45°Cまで冷ましてから、放射性[11°C]二酸化炭素を受け取ります(図3を参照)。カーボスフィアカラムトラップ(CH4トラップ)を-75°Cまで冷まします。
- モジュールに埋め込まれた[11C]二酸化炭素を[11C]メチルヨウ化物に変換する方法を、ドライケミストリープロセスによって次のように進めます。
- ニッケル触媒(Shimalite-Nickel)で350°Cの水素ガスと反応させることにより、[11C]二酸化炭素活性を[11C]メタンに変換します。アスカライトトラップ(水酸化ナトリウム)を使用して、未変換の[11C]二酸化炭素と形成された水を保持します。
- 形成された[11C]メタンを-75°Cの炭素圏カラムトラップ(CH4トラップ)に閉じ込めて、さらに精製および濃縮します。閉じ込められた[11C]メタンを放出するには、カーボスフィアカラムを80°Cに加熱します。
- 精製した[11C]メタンを720 °Cで元素状ヨウ素と反応させて[11C]メチルヨウ化物([11C]CH3I)を形成するには、ヘリウム再循環ガスポンプを介して、インシデント生成したヨウ化水素が別のアスカリトラップによって保持され、未変換の[11C]メタンが循環プロセスに戻ります。
- 形成された[11C]CH3Iを室温で、再循環プロセス中に蓄積したヨウ化メチル(MeI)カラムにトラップします。
- 循環プロセスの最後に、回収した [11C]CH3I をヘリウム流 (15 mL/min) で 190 °C に加熱し、MeTf カラムからバイパスして MeT カラムからバイパスし、チェックバルブを通ってプリロードされたプリカーサー溶液を含む 1.5 mL のステンレス鋼ループに導きます (ステップ 1.5.1)。
- [11C]CH3I がループを 180 秒間通過したら、反応混合物をセミプレップ HPLC カラムに注入して精製します。以下のHPLC条件を使用してください:移動相37:63(v/v)アセトニトリル:20 mM水酸化アンモニウム、流速5.0 mL/分、UV波長235 nm;[11C]ER-176の保持時間(t R):約12〜14分図 5 を参照してください。
- フラクションサンプルを、25 mLの滅菌脱イオン水が入った大きなセレシーブフラスコに集めます。希釈した混合物を C18 軽固相抽出 (SPE) カートリッジにロードします。
- 製品 (1) を追加の滅菌脱イオン水10 mLで洗浄します。
- C18 light SPE から目的の製品を 200 プルーフエタノール(1 mL)を使用して溶出します。この溶出液を、0.9%塩化ナトリウムをあらかじめ充填した注入用フラスコ(6 mL)に流します。
- さらに、C18 light SPE を 0.9% 塩化ナトリウム 3 mL でさらにすすぎ、V4 リザーバーを介して注入します。
- 最終溶液を製剤フラスコ(~10 mL)に集め、0.22 μmの滅菌フィルターを通過させて、組み立て済みの滅菌済み、非発熱性、USP Type I 50 mLガラスバイアルに入れ、ゴム製セプタムで密封し、アルミニウムキャップで圧着します。
- テレマニピュレーターを使用して、品質管理(QC)サンプルとして最終製品のバイアルからアリコートを取り出します。このサンプルを多数のQCテストにかけ、患者にリリースして投与する前に、確立された仕様への適合性を確認します( 表2を参照)。
注:(2)の放射性標識に[11C]CH3Iを使用して、このループ法手順を適用します。[11C]CH3OTf を生成して使用し、(3) と (4) を生成します (補足ファイル 1 を参照)。- 施設で実施される一般的な品質管理分析に従うには、テレマニピュレーターを使用して、最終製品のバイアルからTBシリンジにサンプルを移し、次に鉛シールドキャリアを使用して品質管理室に移します。
- 鉛シールドエリア(Lブロック)で、サンプルをパイロジェンフリーチューブに排出し、HPLCおよびガスクロマトグラフィー(GC)分析用の小さなガラスバイアル(50〜100 μL)に分注します。
- 2番目のサンプルをパイロジェンフリーの水で、細菌のエンドトキシン分析に適した濃度に希釈します。
- 最終製品溶液のサンプル(トリプシン性大豆ブロス(TSB)と液体チオグリコール酸培地(FTM)の両方)を無菌サンプルとして接種します。これらのサンプルをインキュベートし、14日間にわたって増殖を観察します。
- pHストリップに少量のアリコートを塗布して、最終製品溶液の酸性度/塩基性度を視覚的に測定します。
2. [11C]ER-176の放射性標識のための反応容器法(1)
- モジュールが内部クリーニングプロトコルに従って完全にクリーニングされていることを確認してください。
- モジュールの反応部分の洗浄には1 N HCl、水、アセトン、アセトニトリルを使用し、モジュールの製剤部分の洗浄と滅菌には水とエタノールを使用します。
- モジュールですべての生産を行う前に、メタン(CH4)炉を350 °Cで20分間、水素ガスの流れ100mL /分でコンディショニングします。先に進む前に45 °Cに冷ましてください。
- モジュールですべての生産を実行する前に、CH4 トラップを120 °Cで20分間、ヘリウムガス流量50mL/minでコンディショニングします。70 °Cまで冷ましてから続行します。
- すべての生産に先立ち、MeIトラップを190 °Cで20分間、ヘリウムガス流量50mL/minでコンディショニングします。先に進む前に50 °Cに冷ましてください。V8チューブが容器内の針に接続されていることを確認します。
- ヘリウムガスを使用して、受入バルブ(V24からV16)から内部MeIループまで、V8から容器までV23をシール/排気源としてリークテストを行います。
- モジュールの試薬ローディング:
- 以下を追加します:(R)-N-sec-ブチル-4-(2-クロロフェニル)-キナゾリン-2-カルボキサミド(1.0 ± 0.05 mg)をジメチルスルホキシド-d6 (100 ± 10 μL)および6 N水酸化ナトリウム(4 μL)で反応器容器に追加します。
- V2リザーバーに37:63 acetonitrile:20 mM ammonium hydroxide 1.0 mLをロードします。
- V4リザーバーに3.0mLの0.9%塩化ナトリウムを注入用に入れます。
- V5リザーバーに1.0mLの200プルーフエタノールをロードします。
- V6リザーバーに10mLの滅菌脱イオン水を入れます。
- 大きなレシーブフラスコに25mLの滅菌脱イオン水を入れます。
- 製剤フラスコに6.0mLの0.9%塩化ナトリウムを注入用に入れます。.
- デリバリーラインが組み立て済みの滅菌最終製品バイアルに接続されていることを確認します。
- HPLC移動相(37:63(v/v)アセトニトリル:20 mM水酸化アンモニウム)をリザーバーに充填し、HPLCポンプに接続します。
注:使用するセミプレップカラムは上記と同じで、移動相(4カラム容量)で前処理されています。
- 自動化モジュールの準備中に、炭素11サイクロトロンターゲット(1%酸素、99%窒素)を11MeVサイクロトロンに55μAで60〜80分間デュアルビームターゲットに照射し、14N(p,α)11C核反応によって[11C]二酸化炭素を生成します。
- サイクロトロンからモジュールに[11C]二酸化炭素をアンロードする約20分前に、スタートボタンをクリックして[11C]ER-176合成のバリデーションタイムリストを開始します。CH4カラムを45°Cまで冷ましてから、放射性[11°C]二酸化炭素を受け取ります(図3を参照)。カーボスフィアカラムトラップ(CH4トラップ)を-75°Cまで冷まします
- モジュールに埋め込まれた[11C]二酸化炭素を[11C]メチルヨウ化物に変換する方法を、ドライケミストリープロセスによって次のように進めます。
- ニッケル触媒(Shimalite-Nickel)で350°Cの水素ガスと反応させることにより、[11C]二酸化炭素活性を[11C]メタンに変換します。未変換の[11C]二酸化炭素と形成された水の両方をアスカライトトラップ(水酸化ナトリウム)で保持します。
- -75°Cのカルボスフェアカラムに[11C]メタンを閉じ込めて、さらに精製および濃縮します。[11C]メタンを放出するには、カーボスフィアカラムを80°Cに加熱します。
- 精製した[11C]メタンを720 °Cで単体ヨウ素と反応させて[11 C]ヨウ化メチルを生成するには、再循環ガスポンプを使用して[11C]メチルヨウ化物を生成します。ここで、インシデント生成の水素は別のアスカリトラップによって保持され、変換されていない[11C]メタンは内部ループ再循環と呼ばれる循環プロセスに戻ります。
- 形成された[11C]ヨウ化メチルを室温で、再循環プロセス中に蓄積したMeIカラムに閉じ込めます。
- 循環プロセスの最後に、多孔質高分子吸着剤トラップをヘリウム流(30mL / min)で190 °Cに加熱して、収集した[11C]ヨウ化メチルを放出し、チェックバルブを介して3 mL反応容器に導きます( 1)の炭素11放射性標識用。
- [11C]メチルヨウ化物の生成と蓄積が頭打ちになったら、銀トリフラートカラムをバイパスし、放射性ガスをV8を介して前駆体混合物を含む反応容器に導きます。[11C]ヨウ化メチルを3分間泡立たせた後、反応容器を密封し、80 °Cで5分間加熱します。
- 標識が完了したら、5分後に反応容器を30 °Cに冷却し、V2リザーバーから1 mLの移動相で希釈します。
- 混合物をセミプレップHPLCカラムに注入し、以下のHPLC条件を使用して精製します:移動相37:63(v / v)アセトニトリル:20 mM水酸化アンモニウム、流速5.0 mL / min、UV波長235 nm。[11C]ER-176 (1) のt R: 約 9 - 11 分、図 6 を参照。
- フラクションサンプルを、25 mLの滅菌脱イオン水が入った大きな受入フラスコに集めます。この希釈した混合物を C18 light SPE カートリッジにロードします。
- 閉じ込められた製品 (1) を追加の10mLの滅菌脱イオン水で洗浄します。.
- 200プルーフエタノール(1.0 mL)を使用してC18 light SPEから目的の製品を溶出し、0.9%塩化ナトリウムをあらかじめ注入用フラスコに注入します(6.0 mL)。
- C18 light SPE を 0.9% 塩化ナトリウム 3.0 mL で洗い流して注射します。
- 最終溶液を製剤フラスコ(~10 mL)に集めます。この培地を0.22μmの滅菌フィルターに通し、組み立て済みの滅菌済み非発熱性USPタイプI 50 mLガラスバイアルに入れ、ゴム製のセプタムで密封し、アルミニウムキャップで圧着します。
- テレマニピュレーターを使用して、品質管理(QC)サンプルとして最終製品のバイアルからアリコートを取り出します(ステップ1.15を参照)。放射性トレーサーが放出および患者への投与前にすべての許容基準に合格しなければならないいくつかの試験にサンプルをさらします( 表2を参照)。
注:(2)の放射性標識には、[11C]CH3Iを使用してこの原子炉容器法を適用してください。[11C]CH3OTf を生成して使用し、(3) と (4) を生成します (補足ファイル 1 を参照)。
結果
ニューヨーク大学ランゴーンヘルス(NYULH)の放射化学グループは、ヒト研究と前臨床応用の両方に使用されるさまざまな炭素11、フッ素18、およびガリウム68放射性トレーサーを提供しています。PET放射性トレーサーの製造には、いくつかの方法が利用されています。私たちのチームでは、(1)、(2)、(3)、(4)の合成にループ法を採用しています(図1、図8参照)。製造が完了した後、滅菌された最終製品のバイアルからアリコートが取り出されます。このサンプルは、最終製品溶液(トリプシン大豆ブロス(TSB)と液体チオグリコール酸培地(FTM)の両方の無菌サンプル)の接種と、QC試験用のバルク溶液の代表サンプルの両方に使用されます。各放射性トレーサーは、製品が投与のためにリリースされる前にQCテストを受けます(表2を参照)。
品質管理試験には、製品外観の可視化、フィルターの完全性の検証、放射性核種同一性、pH、放射性化学的同一性(無線HPLC)、放射性化学的純度(無線HPLC)、化学的純度(HPLC)、分子活性、強度、残留溶媒、エンドトキシン、および無菌性( 表2を参照)が含まれます。以下の結果は、上記の各放射性トレーサーの臨床生産から得られた( 表1参照)。
代表的な分析 HPLC クロマトグラムについては、図 7 および 補足ファイル 1 を参照してください。すべての放射性トレーサーは、放出して被験者に投与する前に、すべての品質管理仕様( 表2を参照)に合格する必要があります。
[11C]MRB (2) (補足図 1)、[11C]mHED (3) (補足図 2)、[11 C]PiB (4) (補足図 3) の前駆体および試薬の量、および [11C]PiB (4) の分析 HPLC クロマトグラムについては、補足ファイル 1 を参照してください。
| 化合物 | パラメーター | ループ方式 (avg ± std) | リアクトル法(平均±標準) |
| [11C]ER-176 | 作品数 | 25 | 6 |
| 合成開始 | 86 ± 5.0 GBq | 52 ± 25.7 GBq | |
| 合成終了 | 5.4 ± 2.2 GBq | 1.6 ± 0.5 GBq | |
| 放射性化学的純度 | 99.6±0.6% | 99.9±0.1% | |
| ER-176濃度 | 1.1 ± 0.5 μg/mL | 0.63 ± 0.37 μg/mL | |
| モル活性 | 194 ± 66 GBq/μmol | 132 ± 78 GBq/μmol | |
| Total Synthesis Time(トータルシンセシスタイム) | 36 ± 3分 | 44±6分 | |
| [11C]MRBの | 作品数 | 70 | 6 |
| 合成開始 | 84 ± 5.4 GBq | 39 ± 11.9 GBq | |
| 合成終了 | 3.0 ± 1.2 GBq | 1.9 ± 0.7 GBq | |
| 放射性化学的純度 | 99.5±0.5% | 99.7±0.8% | |
| MRB濃度 | 0.52 ± 0.24 μg/mL | 0.68 ± 0.41 μg/mL | |
| モル活性 | 190 ± 50 GBq/μmol | 99 ± 55 GBq/μmol | |
| Total Synthesis Time(トータルシンセシスタイム) | 35 ± 3分 | 42 ± 3分 | |
| [11C]mHED | 作品数 | 5 | 11 |
| 合成開始 | 69 ± 10.5 GBq | 82 ± 4.3 GBq | |
| 合成終了 | 5.5 ± 1.3 GBq | 3.3 ± 1.0 GBq | |
| 放射性化学的純度 | 98.2±1.3% | 99.1±0.7% | |
| mHED濃度 | 0.40 ± 0.10 μg/mL | 0.52 ± 0.37 μg/mL | |
| モル活性 | 301 ± 48 GBq/μmol | 155 ± 77 GBq/μmol | |
| Total Synthesis Time(トータルシンセシスタイム) | 27±4分 | 32 ± 2分 | |
| [11C]PiBの | 作品数 | 51 | 10 |
| 合成開始 | 86 ± 5.4 GBq | 57 ± 17.2 GBq | |
| 合成終了 | 3.2 ± 0.8 GBq | 1.4 ± 0.2 GBq | |
| 放射性化学的純度 | 97.0±1.5% | 99.1±1.4% | |
| PiB濃度 | 0.22 ± 0.51 μg/mL | 0.30 ± 0.24 μg/mL | |
| モル活性 | 201 ± 68 GBq/μmol | 207 ± 124 GBq/μmol | |
| Total Synthesis Time(トータルシンセシスタイム) | 35 ± 2分 | 36 ± 5分 |
表1:ループ法または反応容器法による[11C]ER-176(1)、[11C]MRB(2)、[11C]m HED(3)、および[11C]PiB(4)の製造結果。すべての値は合成終了時にレポートされます。略語:[11C]ER-176 = [11C]-(R)-N-sec-ブチル-4-(2-クロロフェニル)-N-メチルキナゾリン-2-カルボキサミド;[11C]MRB =(S、S)-[11C]メチルレボキセチン;[11C]メートルHED = [11C]-メタ-ヒドロキシエフェドリン;[11C]PiB = 2-[4-[(11C)メチルアミノ]フェニル]-1,3-ベンゾチアゾール-6-オール。
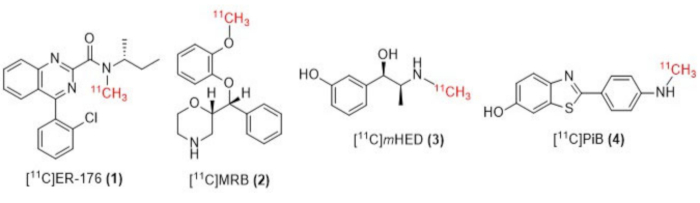
図1:[11C]ER-176(1)、[11C]MRB(2)、[11C]m HED(3)、[11C]PiB(4)の構造。 略語:[11C]ER-176 = [11C]-(R)-N-sec-ブチル-4-(2-クロロフェニル)-N-メチルキナゾリン-2-カルボキサミド;[11C]MRB =(S、S)-[11C]メチルレボキセチン;[11C]メートルHED = [11C]-メタ-ヒドロキシエフェドリン;[11C]PiB = 2-[4-[(11C)メチルアミノ]フェニル]-1,3-ベンゾチアゾール-6-オール。この図の拡大版を表示するには、ここをクリックしてください。
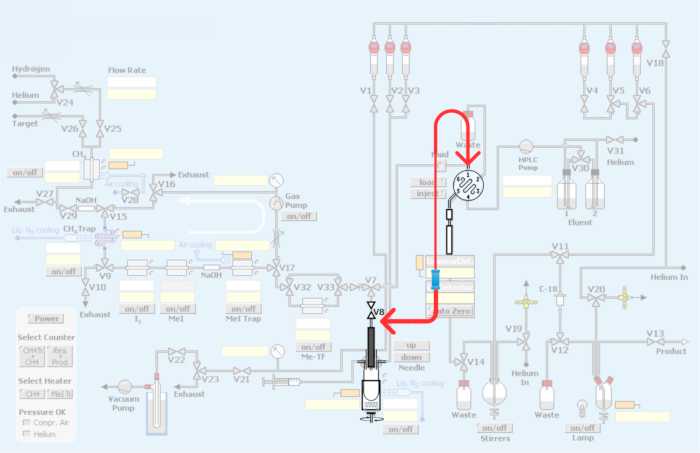
図3:自動モジュールに加えられた変更。 赤は、炭素11メチル化によるPET放射性トレーサーの製造のためのループを組み込むための合成モジュールの配管の再構築を表しています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:PET放射性トレーサーの炭素11メチル化のループ法を組み込むためのモジュールの配管と再配管(A)ユニオンコネクタ付きのHPLC注入ループ。(B)反応容器法。V8 接続を示す赤い矢印。(C)原子炉容器をバイパスするループ方式の再配管。HPLCインレットへのV8接続は反応容器をバイパスし、[11C]iodomethaneまたは[11C]methyl triflateがHPLCループに直接アクセスできることに注意してください。(D)原子炉容器に関する組合の配置ステンレス鋼のHPLCループへの接続に注意してください。この図の拡大版を表示するには、ここをクリックしてください。
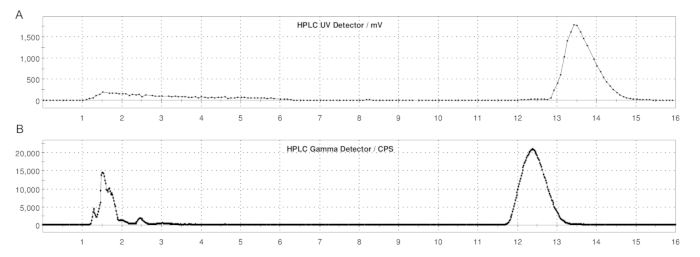
図5:ER-176および[11C]ER-176のループ法によるセミプレップHPLCプロファイル (A)ER-176のセミプレップHPLCプロファイル (1)UV = 235 nmでのループ法による作製。tR = 13.2 分 (B) [11C]ER-176 のセミプレップ無線 HPLC プロファイル (1);tR = 12.4分条件:37:63(v/v)アセトニトリルの移動相:20 mM水酸化アンモニウム、流速5.0 mL/min。略語:[11C]ER-176 = [11C]-(R)-N-sec-ブチル-4-(2-クロロフェニル)-N-メチルキナゾリン-2-カルボキサミド。この図の拡大版を表示するには、ここをクリックしてください。
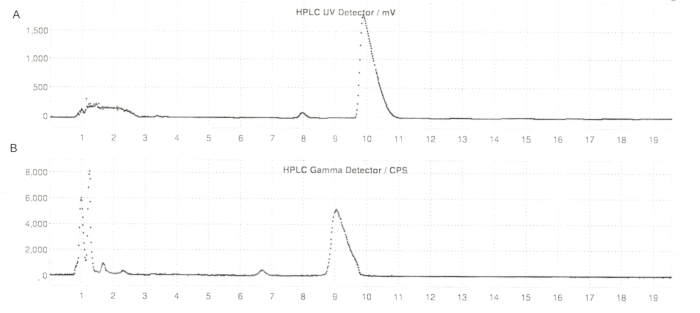
図6:反応器法によるER-176および[11C]ER-176のセミプレップHPLCプロファイル (A)ER-176のセミプレップHPLCプロファイル (1)UV = 235 nmでのリアクター法による作製方法。tR = 9.8 分 (B) [11C]ER-176 のセミプレップ無線 HPLC プロファイル (1);tR = 9.2 分条件:37:63(v / v)アセトニトリルの移動相:5.5 mL / minの流速で20 mM水酸化アンモニウム。略語:[11C]ER-176 = [11C]-(R)-N-sec-ブチル-4-(2-クロロフェニル)-N-メチルキナゾリン-2-カルボキサミド;tR = 保持時間。この図の拡大版を表示するには、ここをクリックしてください。
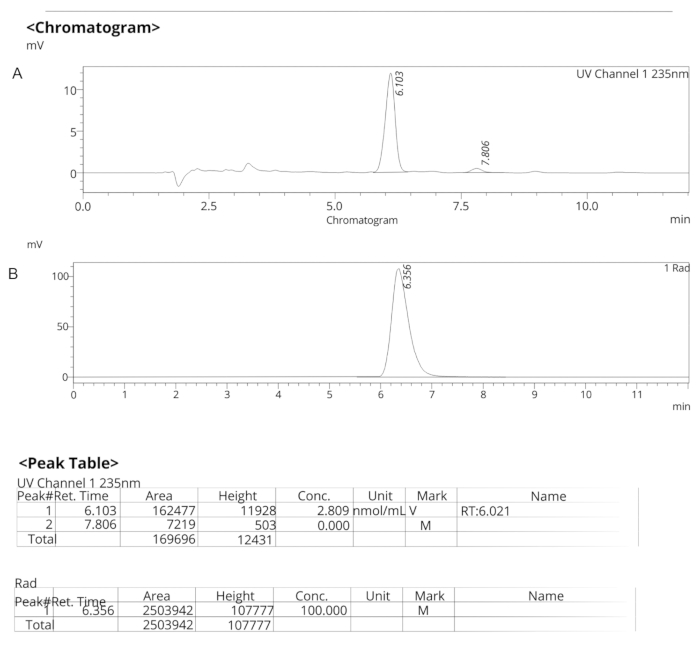
図7:ER-176の分析HPLCプロファイル (A)ER-176のUVスペクトルの分析HPLCプロファイル (1)235 nm;tR = 6.10 分 (B) [11C]ER-176 の放射性トレーサーの分析 HPLC プロファイル (1);tR = 6.36 分条件: 10 μm C18 (2) 100  LC カラム 250 x 4.6 mm; メタノール/水 74/26、流速 1.5 mL/分 略称: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-methylquinazoline-2-carboxamide; tR = 保持時間 この図の拡大版を表示するには、ここをクリックしてください。
LC カラム 250 x 4.6 mm; メタノール/水 74/26、流速 1.5 mL/分 略称: [11C]ER-176 = [11C]-(R)-N-sec-butyl-4-(2-chlorophenyl)-N-methylquinazoline-2-carboxamide; tR = 保持時間 この図の拡大版を表示するには、ここをクリックしてください。
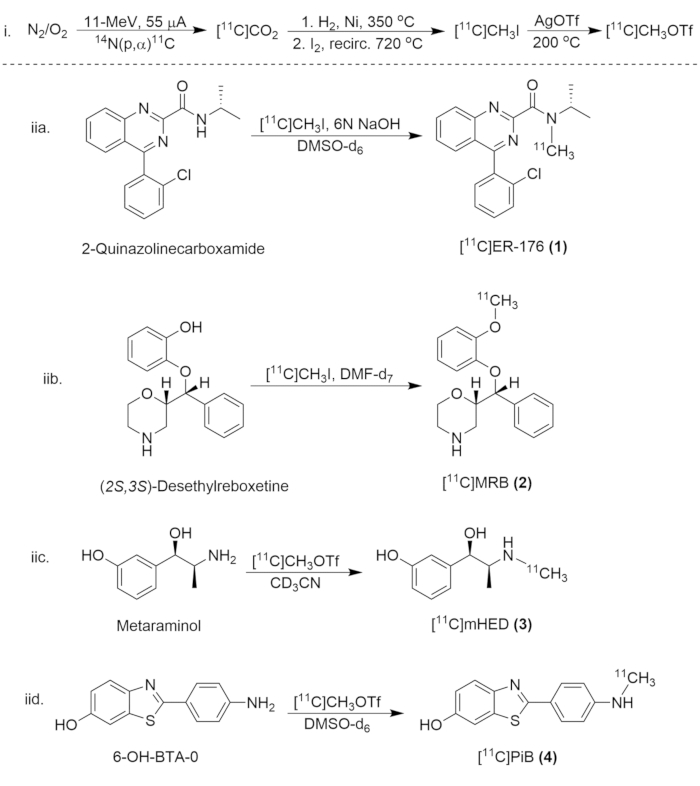
図8:炭素11化合物の合成のための合成スキーム (i)[11C]CH3Iおよび[11C]CH3OTfの形成、および(iia)[11C]ER-176の放射性標識(1)、(iib.)[11C]MRB (2)、(iic.)[11C]メートルHED(3)、および(iid。[11C]PiB(4)です。 この図の拡大版を表示するには、ここをクリックしてください。
| テスト/パラメータ | 仕様 |
| 外観(目視検査) | 粒子状物質を含まない無色透明の溶液 |
| メンブレンフィルターの完全性 | ≥ 50 psi |
| pHの | 4.5 - 8.0 |
| 放射性核種の同一性(半減期) | 19.3 - 21.3 分 |
| 放射性化学的同一性(radio-HPLC) | 0.90 ≤t R Prod / t R Std ≤ 1.10 |
| 放射性化学的純度(無線HPLC) | ≥95.0%† |
| 薬物濃度(HPLC) | 注を参照* |
| 全化学不純物(HPLC) | 注を参照** |
| モル活性(@EOS) | > 9.25 GBq/μmol |
| 残留アセトニトリル(GC) | ≤ 410 ppm |
| 残留アセトン(GC) | ≤ 5,000 ppm |
| 残留ジメチルスルホキシド(GC) | ≤ 5,000 ppm |
| 残留エタノール(GC) | ≤ 10% (v/v) |
| 残留メタノール(GC) | ≤ 3,000 ppm |
| 残留N、N-ジメチルホルムアミド(GC) | ≤ 880 ppm |
| Limulusアメーボサイトライセート(LAL) | ≤ 17.5 EU/mL |
| 無菌性(30時間以内に開始) | 滅菌済み(14日) |
| 準備記録 | 完全で正確 |
| ラベル | 完全、正確、調整済み |
表2:炭素11放射性トレーサーの承認または拒否に関する品質管理基準。 † [11C]mHEDの放射化学的純度≥90.0%。*薬物濃度:[11C]ER-176 ≤ 10μg/用量;[11C]MRB ≤ 10 μg/用量;[11C]メートルHED≤50μg/用量;[11C]PiB ≤ 13.4 μg/用量;**総化学不純物:[11C]ER-176 ≤ 1.0μg/用量;[11C]MRB ≤ 1.0 μg/用量;[11C]メートルHED≤5.0μg/用量;[11C]PiB≤1.34μg/用量です。略語:[11C]ER-176 = [11C]-(R)-N-sec-ブチル-4-(2-クロロフェニル)-N-メチルキナゾリン-2-カルボキサミド;[11C]MRB =(S、S)-[11C]メチルレボキセチン;[11C]メートルHED = [11C]-メタ-ヒドロキシエフェドリン;[11C]PiB = 2-[4-[(11C)メチルアミノ]フェニル]-1,3-ベンゾチアゾール-6-オール;EOS = 合成の終了。GC = ガスクロマトグラフィー;LAL = Limulus 変形細胞溶解物。
補足ファイル1: 薬品および材料、ループまたはリアクター容器法に使用される試薬、品質管理試験、分析HPLCクロマトグラム。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
炭素11ヨードメタンまたはメチルトリフラートによる末端ヘテロ原子の従来の放射性標識は、放射性求電子ガスを反応容器にバブリングし、それをトラップし、溶液を長時間反応させることを含む18。従来の不均一反応のバブリングは緩慢であり、反応速度を加速するために加熱が必要になる場合があります。精製前に、反応媒体を室温まで冷却し、その後、溶媒(移動相など)を使用してHPLCループに移し、目的の放射性トレーサーを精製する必要があります。これらのステップは時間がかかり、そのような材料の転送中に一瞬の放射性標識製品が失われる可能性があります。
私たちの施設では、前駆体溶液をHPLCステンレス鋼ループにコーティングし、化合物の放射性標識を室温でループ内で行うループ法の使用の正当性を実証しました。このループは、放射性物質である [11C]CH3I または [11C]CH3OTf の送達と一直線に結び付けられ、HPLC システムの注入ポートに接続されています。放射性標識が起こるために加熱する必要はなく、この原稿に示されているすべてのケースで、反応は3分以内に起こります。
ステンレス鋼のHPLCループの流量とサイズは、このプロセスが効率的に機能するために重要であるようです。まず、キャリアガスであるヘリウムの流量を8.0mL/minから15.0mL/minに変化させ、ループに送達する放射性ガスの流速を試験しました。Buckleyは、適切な流量を適用すること、および適切な溶媒とループ材料を使用することの重要性を研究しました15。私たちのシステムでは、[11C]CH3I または [11C]CH3OTf の放射性求電子種のいずれかに対する 15 mL/分の流速は、この原稿で説明した 4 つの放射性トレーサーすべての放射性標識に良好に機能します。すべての合成に使用されるループは、外径が 1/16 インチ、内径が 1 mm の 1.5 mL のステンレス製 HPLC 注入ループです。
2つの方法(反応容器法とループ法)を比較したところ、ループ法は、ヒト研究で承認された4つの放射性トレーサーを作製するための合成終了時(EOS)での分子活性の大幅な増加とともに、放射性標識効率の向上を示しました。一例として、放射性トレーサー[11C]mHED(3)は、単離された最終生成物の活性が1.6倍に増加し、EOSでモル活性が2倍になりました。この全体的な放射能の増加傾向は、4つの放射性トレーサーすべてで観察されます(表1を参照)。ループ法を使用すると、セットアップ時間が5分短縮され、反応容器を洗浄する必要がないため、オペレーターの時間と洗浄プロトコルのための溶媒の使用を節約できるという利点もあります。
この方法論のいくつかの欠点には、ループ法を使用して放射性トレーサーを効果的に標識できる制限が含まれます。放射性標識に熱が必要な場合、HPLCループ内の加熱を可能にするためにこのシステムを変更することは困難です。このシステムでは、配管を変更する必要があります。「箱から出して」準備ができていないというこの機能は、他のユーザーが自分の自動化されたプラットフォーム14に対してそのような変更を行うことを思いとどまらせる可能性がある。この方法では補助的な配管とユニオンが必要なため (図 4A-D を参照)、これらの条件下でラベルを付けると、放射性物質が放出される場所が追加される可能性が高くなります。モジュールでの実行前に毎回リークチェックを実行することが賢明です。
私たちのチームは、治験薬申請(IND)および放射性医薬品研究委員会(RDRC)が承認した4つの炭素11放射性トレーサーの製造に使用されたループ法を実装しました。私たちの手によって、この方法は従来の反応容器法よりも効率的で高収率のプロセスであることが証明されました。この方法をほとんどの自動化モジュールに適用する際には、キャリアヘリウムガスの流量に対する追加の配管と調整を考慮する必要があります。最後に、この方法には限界があり、パラジウム(II)中間体の活性化と反応混合物の加熱24を必要とする[11C]UCB-Jなどの特定の炭素11放射性トレーサーには適していません。
開示事項
著者らは、この研究に関連する、または開示すべき金銭的利益がないことを宣言します。
謝辞
NYULH放射化学研究室の元メンバーであるRaul Jackson氏とGrace Yoon氏には、ループ法を用いた炭素11メチル化の初期の取り組みについて感謝の意を表します。
資料
| Name | Company | Catalog Number | Comments |
| 2-(4'-Aminophenyl)-6-hydroxybenzothiazole | ABX | 5101 | Precursor for PiB synthesis (6-OH-BTA-0) |
| (2S,3S)-Desethylreboxetine | ABX | 4407 | Precursor for MRB synthesis |
| Acetic acid | Sigma Aldrich | 695092 | Reagent used for the synthesis of [11C]PiB |
| Acetone-d6 | Sigma Aldrich | 444863 | Solvent used for the synthesis of [11C]PiB |
| Acetonitrile, HPLC-grade | Sigma Aldrich | 34998 | Various concentrations used in the mobile phase for radiotracer productions |
| Acetonitrile-d3 | Sigma Aldrich | 151807 | Solvent used for the synthesis of [11C]mHED |
| Ammonium formate | Sigma Aldrich | 798568 | Reagent used for the synthesis of [11C]MRB |
| Ammonium hydroxide | Ricca Chemical | 642-16 | Reagent used for the synthesis of [11C]ER-176 |
| Analytical balance | Mettler Toledo | M-XS104 | Balance used to weigh out materials for productions |
| Ascarite II | Thermo Fisher | CN-C049U90 | Used in drying columns for FxC Pro Module |
| Biosafety cabinet | Comecer | M-BH4 | Used for FPV assembly |
| (R)-N-sec-Butyl-4-(2-chlorophenyl)-quinazoline-2-carboxamide | ABX | 1665.0001 | ER-176 precursor |
| C18 Light Sep-Pak cartridge | WATERS | WAT023501 | Solid phase extraction cartridge used in the synthesis of carbon-11 radiotracers |
| Carboxen, 60 – 80 mesh | Supelco | CN-10478-U | Used in the FxC Pro Module |
| Compressed – NOS (99% nitrogen/1% oxygen) | Airgas | CN-X02NI99C3003091 | Target gas used in cyclotron bombardment |
| Dispensing hot cell (DHC) | Comecer | M-MIP1-1390 | Dispensing radiotracers |
| Dose calibrator | Capintec | M-CRC-55t | Measuring activity of radiotracers |
| Endosafe nexgen-PTS | Charles River | PTS150 | Endosafe PTS, portable test sytem |
| Endotoxin PTS - Limulus Amebocyte Lysate (LAL) Test Cartridge | Charles River | PTS20F | LAL cartridges used to test endotin levels on radiotracers |
| Ethanol, 200 proof, HPLC-grade | Sigma Aldrich | 459828 | Used for final product and mobile phase of ER, MRB, mHED and PiB |
| Gas Chromatogram 2030 | Shimadzu | M-GC-2030 | Measure excipients from radiotracer productions |
| Graphpac | Supelco, Millipore Sigma | 10258 | Used in FxC Pro Module for the synthesis of [11C]ER-176, [11C]MRB, [11C]mHED and [11C]PiB |
| Helium, research grade | Airgas | CN-HER-300 | Helium tank, 99.9999% (research grade tank) |
| Shimadzu LC-20 Series | Shimadzu | Various | Analytical HPLC system |
| Hydrogen, ultra high purity grade | Airgas | CN-HYUHP-300 | Hydrogen tank used for the FxC Pro Module |
| Iodine | Thermo Fisher | I35 | Used in FxC Pro Module, conversion of [11C]CH4 to [11C]CH3I |
| Luna 10 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4253-N0 | Semi-prep column for MRB synthesis |
| Luna 5 mm C18 (2) 100 Å 250 x 10 mm column | Phenomenex | 00G-4252-N0 | Semi-prep column for PiB synthesis |
| Macherey-Nagel MN VP 250/10 Nucleosil 100-5 C18 Nautilus column | Macherey-Nagel | 715412.1 | Semi-prep column for mHED synthesis |
| Metaraminol (free base) | ABX | 3380.0001 | Precursor used in the production of [11C]mHED |
| Milli-Q Direct 8 DI system | Millipore | M-ZROQ00800 | De-ionized water system |
| N,N-Dimethylformamide-d7 | Sigma Aldrich | 189979 | Solvent used for the synthesis of [11C]MRB |
| Needle, 18 G x 1 | Becton Dickinson | BD 305195 | Needles used at various stages of production setup |
| Needle, 20 G x 1-1/2” | Becton Dickinson | BD 305176 | Needles used at various stages of production setup |
| Needle, 22 G x 4”, Spinal | Air-Tite Products | N224 | Needles used at various stages of production setup |
| Onyx Monolithic C18 100 x 10 mm column | Phenomenex | CH0-7878 | Semi-prep column for ER-176 synthesis |
| Phosphorus Pentoxide with Sicapent indicator | Sigma Aldrich | 79610 | Used in the synthesis Modules for carbon-11 radiotracer productions |
| Porapak N | Waters | WAT027047 | Material used to pack MeI column in FxC Pro Module |
| Pressure gauge | Omega | M-DPG1100B-100G | Used for filter integrity test |
| Shimalite-Ni | Shimadzu Corporation | 221-66062 | Material packed in CH4 oven of FxCPro Module for conversion from [11C]CO2 to [11C]CH4 |
| Siemens Eclipse 11-MeV cyclotron | Siemens | RDS 111 | Particle accelerator used to generate [11C]CO2 gas for carbon-11 productions |
| Silver Triflate | Sigma Aldrich | 483346 | Material packed in triflate column of the FxC Pro Module for the production of [11C]mHED and [11C]PiB |
| Sodium chloride injection (saline, 0.9%), 50 mL | Hospira | 0409-4888-50 | Saline used in the formulation process of radiotracers |
| Sodium chloride injection (saline, 0.9% ), 500 mL | Braun | L8001 | Reagent used in the synthesis of [11C]mHED, and mobile phase. |
| Sodium hydroxide | Sigma Aldrich | 221465 | Reagent used in the synthesis of [11C]ER-176 and other components at different concentration. |
| Sodium iodide detector | Eckert & Ziegler | PMT/Na-BFC3200 | Gamma detector used in-line with HPLC unit |
| Sterile vial, 50 mL | ALK Allergy | SEV50 | 50 mL sterile vials used as the |
| Stainless steel loop | GE | 980314/IEG-005118 | HPLC injection loop at 1.5 mL possessing an OD 1/16”, ID: 1 mm. |
| Syringe, 1 mL | Braun | NJ-9166017-02 | Syringe used at various stages of production set-up |
| Syringe, 10 mL | Henke Sass Wolf | 4100-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 20 mL | Henke Sass Wolf | 4200-X00V0 | Syringe used at various stages of production set-up |
| Syringe, 5 mL | Becton Dickinson | 309632 | Syringe used at various stages of production set-up |
| TracerLab FX2C Module | GE | M-P5360QB | Automated module of production of carbon-11 radiotracers |
| Triethylamine | Sigma Aldrich | 471283 | Reagent used for the synthesis of [11C]PiB |
| Tuberculin Syringe, with 21 G x 1 Needle, Single-Use, Sterile (1 mL) | Becton Dickinson | BD 309624 | Syringe used in pre-assembled final product vials |
参考文献
- Bailey, D. L., Townsend, D. W., Valk, P. E., Maisey, M. N. Positron emission tomography: Basic sciences. , Springer. 223-231 (2005).
- Berger, A. How does it work? Positron emission tomography. BMJ. 326 (7404), 1449(2003).
- Seeram, E. Computed tomography: A technical review. Radiol Technol. 89 (3), 279CT-302CT (2018).
- Grover, V. P., et al. Magnetic resonance imaging: Principles and techniques: Lessons for clinicians. J Clin Exp Hepatol. 5 (3), 246-255 (2015).
- Rowe, S. P. P., Martin, G. Molecular imaging in oncology: Current impact and future directions. CA Cancer J Clin. 72 (4), 333-352 (2022).
- Ziessman, H. A., O'Malley, J. P., Thrall, J. H. Nuclear medicine: The requisites. , Fourth edn, Saunders. (2014).
- Cochran, B. J., et al. Determining glucose metabolism kinetics using 18F-FDG micro-PET/CT. J Vis Exp. (123), e55184(2017).
- Pantel, A. R., Bae, S. -W., Li, E. J., O′Brien, S. R., Manning, H. C. PET imaging of metabolism, perfusion, and hypoxia: FDG and beyond. Cancer J. (Philadelphia, PA, U. S.). 30 (3), 159-169 (2024).
- Hansen, J. Y., et al. Mapping neurotransmitter systems to the structural and functional organization of the human neocortex. Nat Neurosci. 25 (11), 1569-1581 (2022).
- Valenta, I. S., Thomas, H. PET-determined myocardial perfusion and flow in coronary artery disease characterization. J Med Imaging Radiat Sci. 55 (2S), S44-S50 (2024).
- Nerella, S. G., Singh, P., Sanam, T., Digwal, C. S. PET Molecular Imaging in Drug Development: The Imaging and Chemistry Perspective. Front Med (Lausanne). 9, 812270(2022).
- Dolle, F. Carbon-11 and fluorine-18 chemistry devoted to molecular probes for imaging the brain with positron emission tomography. J Label Compd Radiopharm. 56 (3-4), 65-67 (2013).
- Wilson, A. A., Garcia, A., Jin, L., Houle, S. Radiotracer synthesis from [11C]-iodomethane: A remarkably simple captive solvent method. Nucl Med Biol. 27 (6), 529-532 (2000).
- Bruton, L., Scott, P. J., Kilbourn, M. Automated synthesis modules for PET radiochemistry. Handb Radiopharm. (2nd Ed.). , 437-456 (2021).
- Studenov, A. R., Jivan, S., Adam, M. J., Ruth, T. J., Buckley, K. R. Studies of the mechanism of the in-loop synthesis of radiopharmaceuticals. Appl Radiat Isot. 61 (6), 1195-1201 (2004).
- Jewett, D. M., Ehrenkaufer, R. L., Ram, S. A captive solvent method for rapid radiosynthesis: application to the synthesis of [1-11C]palmitic acid. Int J Appl Radiat Isot. 36 (8), 672-674 (1985).
- Watkins, G. L., Jewett, D. M., Mulholland, G. K., Kilbourn, M. R., Toorongian, S. A. A captive solvent method for rapid N-[11C]methylation of secondary amides: application to the benzodiazepine, 4'-chlorodiazepam (RO5-4864). Appl Radiat Isot. 39 (5), 441-444 (1988).
- Iwata, R., et al. A simple loop method for the automated preparation of [11C]raclopride from [11C]methyl triflate. Appl Radiat Isot. 55 (1), 17-22 (2001).
- Iwata, R., et al. On-line [11C]methylation using [11C]methyl iodide for the automated preparation of 11C-radiopharmaceuticals. Appl Radiat Isot. 43 (9), 1083-1088 (1992).
- Mccarron, J. A., Turton, D. R., Pike, V. W., Poole, K. G. Remotely-controlled production of the 5-HT1A receptor radioligand [carbonyl-11C]WAY-100635. J Labelled Compd Radiopharm. 38 (10), 941-953 (1996).
- Shao, X., et al. Highlighting the versatility of the Tracerlab synthesis modules. Part 2: fully automated production of [11C]-labeled radiopharmaceuticals using a Tracerlab FXC-Pro. J Labelled Compd Radiopharm. 54 (14), 819-838 (2011).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clin Transl Imaging. 5 (3), 275-289 (2017).
- Shao, X., Schnau, P. L., Fawaz, M. V., Scott, P. J. Enhanced radiosyntheses of [C]raclopride and [C]DASB using ethanolic loop chemistry. Nucl Med Biol. 40 (1), 109-116 (2013).
- Milicevic Sephton, S., et al. Automated radiosynthesis of [11C]UCB-J for imaging synaptic density by positron emission tomography. J Label Compd Radiopharm. 63 (3), 151-158 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved