Calcul du pH pour les solutions de titrage : acide fort/base forte
Un titrage de 25,00 ml de HCl 0,100 M (acide fort) avec une base forte NaOH de 0,100 M est effectué. Le pH aux différents volumes de solution de base ajoutée peut être calculé comme suit :
(A) Volume du titrant = 0 ml. Le pH de la solution est dû à l'ionisation de l’acide de HCl. Comme il s'agit d'un acide fort, l'ionisation est totale et la molarité de l'ion hydronium est de 0,100 M. le pH de la solution est alors :

(b) Volume du titrant = 12,50 mL. Comme l'échantillon d'acide et la base titrante sont monoprotiques et de concentrations égales, cette addition de titrant implique une quantité de base inférieure à une quantité stœchiométrique et il est donc complètement consommé par réaction avec l'excès d'acide dans l'échantillon. La concentration d'acide restant est calculée en soustrayant la quantité consommée de la quantité initiale, puis en divisant par le volume de solution :
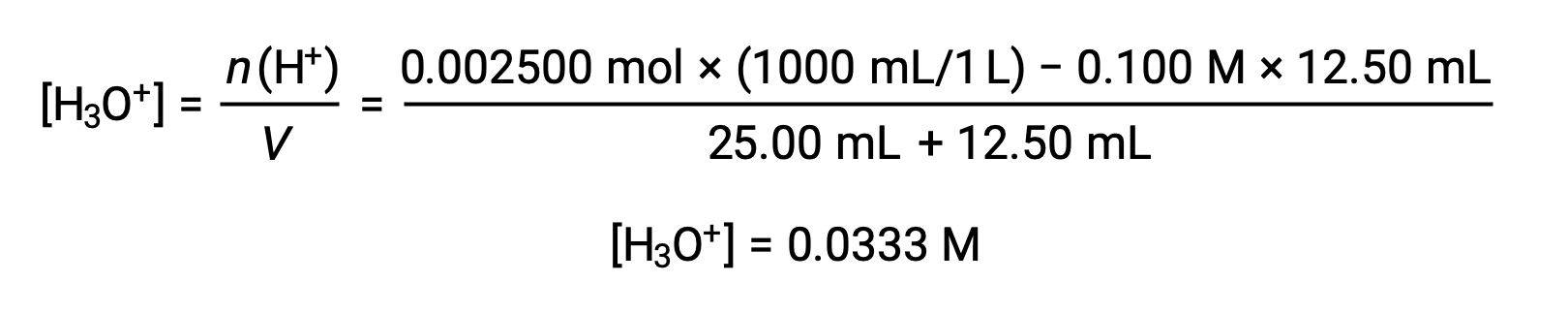
(c) Volume du titrant = 25,00 mL. Cette addition de titrant implique une quantité stœchiométrique de base (le point d'équivalence), et donc seuls les produits de la réaction de neutralisation sont en solution (eau et NaCl). Ni le cation ni l'anion de ce sel ne subissent une ionisation acide-base ; le seul processus générant des ions hydronium est l'autoprolyse de l'eau. La solution est neutre, ayant un pH = 7,00.
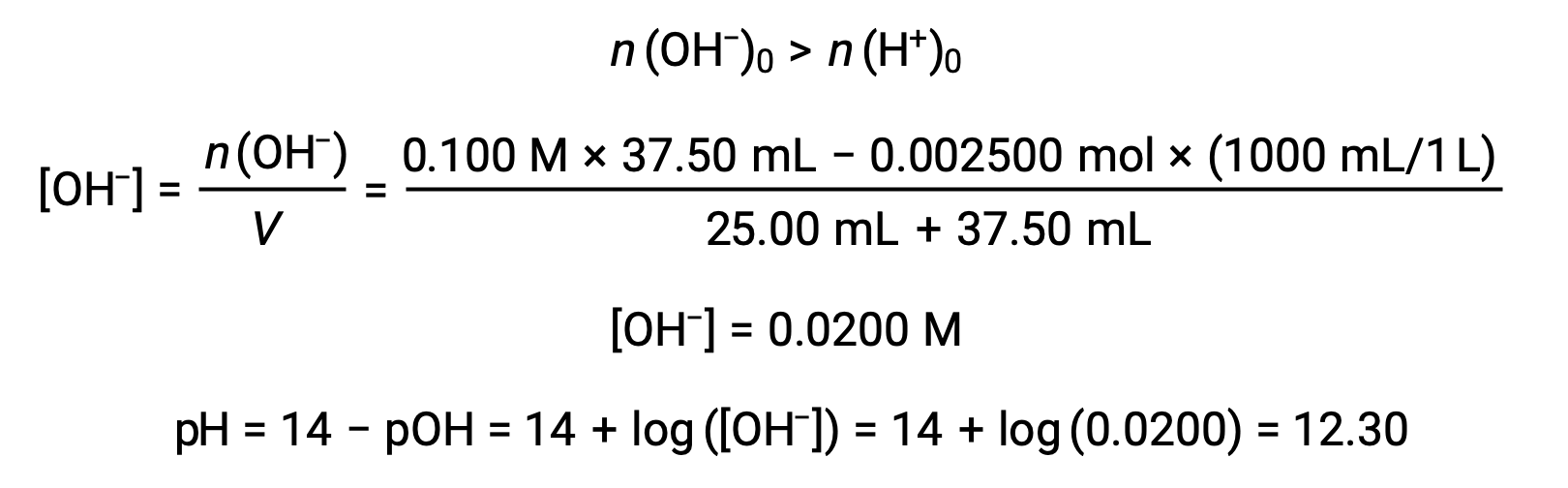
(d) Volume du titrant = 37,50 mL. Cela implique l'ajout de titrant au-delà du point d'équivalence. Le pH de la solution est ensuite calculé à l'aide de la concentration d'ion hydroxyde :
Ce texte est adapté de Openstax, Chimie 2e, Section 14.7 : Titrages acido-basiques.
Du chapitre 16:

Now Playing
16.6 : Calculs de titrage : acide fort - base forte
Réactions acido-basiques et produit de solubilité
28.2K Vues

16.1 : Effet d'ion commun
Réactions acido-basiques et produit de solubilité
40.3K Vues

16.2 : Solutions tampons
Réactions acido-basiques et produit de solubilité
162.6K Vues

16.3 : Équation de Henderson-Hasselbalch
Réactions acido-basiques et produit de solubilité
67.3K Vues

16.4 : Calcul des changements de pH dans une solution tampon
Réactions acido-basiques et produit de solubilité
52.0K Vues

16.5 : Efficacité d'un tampon
Réactions acido-basiques et produit de solubilité
47.9K Vues

16.7 : Calculs de titrage : acide faible - base forte
Réactions acido-basiques et produit de solubilité
42.8K Vues

16.8 : Indicateurs de pH
Réactions acido-basiques et produit de solubilité
47.3K Vues

16.9 : Titrage d'un polyacide
Réactions acido-basiques et produit de solubilité
95.2K Vues

16.10 : Équilibre de solubilité
Réactions acido-basiques et produit de solubilité
50.3K Vues

16.11 : Facteurs affectant la solubilité
Réactions acido-basiques et produit de solubilité
32.6K Vues

16.12 : Formation d'ions complexes
Réactions acido-basiques et produit de solubilité
22.8K Vues

16.13 : Précipitation d'ions
Réactions acido-basiques et produit de solubilité
27.1K Vues

16.14 : Analyse qualitative inorganique
Réactions acido-basiques et produit de solubilité
19.2K Vues

16.15 : Courbes de titrage acide-base
Réactions acido-basiques et produit de solubilité
124.4K Vues