Method Article
Établir intracrânienne xénogreffes tumorales du cerveau avec analyse ultérieure de la croissance tumorale et la réponse à la thérapie à l'aide d'imagerie par bioluminescence
Dans cet article
Résumé
Luciférase modifiée xénogreffes de tumeurs humaines du cerveau peut être établie par voie intracrânienne chez des souris athymiques, avec un suivi ultérieur de la croissance tumorale et la réponse au traitement en utilisant l'imagerie par bioluminescence. En combinaison avec une analyse de survie, de surveillance bioluminescence est un outil de recherche indispensable pour les essais pré-cliniques de thérapies envisagées pour le traitement des tumeurs cérébrales.
Résumé
Transplantation des modèles utilisant des cellules tumorales humaines du cerveau ont servi une fonction essentielle dans la neuro-oncologie de recherche depuis de nombreuses années. Dans le passé, la procédure la plus couramment utilisée pour l'établissement de xénogreffes de tumeurs humaines se composait de la collection de cellules provenant de flacons de culture, suivie par l'injection sous-cutanée des cellules recueillies dans des souris immunodéprimées. Considérant que cette approche voit encore un usage fréquent dans de nombreux laboratoires, il ya eu un changement important dans l'accent au cours de la dernière décennie vers l'établissement de xénogreffes orthotopique, ce qui, dans le cas de tumeurs cérébrales, nécessite l'injection de cellules tumorales dans des structures appropriées neuroanatomiques. Parce que l'établissement de xénogreffes intracrânienne élimine la possibilité de surveiller la croissance tumorale par mesure directe, comme par l'utilisation d'étriers, la réorientation vers des modèles de xénogreffes de tumeurs cérébrales orthotopique a nécessité l'utilisation de l'imagerie non invasive pour évaluer la charge tumorale chez les animaux hôtes. Parmi les méthodes d'imagerie actuellement disponibles, la surveillance est généralement considéré comme la bioluminescence pour offrir la meilleure combinaison de sensibilité, de l'opportunisme, et le coût. Ici, nous allons démontrer les procédures de création de tumeur cérébrale orthotopique, et pour le suivi la croissance tumorale et la réponse au traitement lors du test de thérapies expérimentales.
Protocole
1. Préparation des cellules tumorales.
Cellules pour xénogreffes de tumeurs humaines du cerveau peuvent être générés à partir de tumeurs propagées comme des excroissances sous-cutanée chez des souris athymiques, ou à partir de culture cellulaire. L'utilisation des deux sources de cellules est discutée ci-dessous, avec la démonstration d'une méthode d'implantation des cellules.
Pour préparer les cellules de tumeurs sous-cutanées pour le transfert vers le compartiment intracrânienne, tumeurs flanc excisées sont placés dans des boîtes de culture, où le tissu est d'abord haché avec un scalpel puis mécaniquement perturbées par pipetage répétitifs pour créer une suspension totale des cellules 1. La suspension totale de cellules est ensuite passée à travers une maille de nylon filtre 70 uM pour produire une suspension cellulaire unique approprié pour l'injection intracrânienne. La suspension cellulaire est centrifugée à 1000 rpm pendant 10 minutes à 4 ° C, et le surnageant aspiré avant la remise en suspension du culot cellulaire dans un volume approprié de milieu sans sérum pour obtenir une concentration de travail finale (voir ci-dessous). Pour la préparation de lignées cellulaires établies pour l'implantation intracrânienne, les cellules sont récoltées par trypsinisation monocouches, ou par une collecte des cultures en suspension Neurosphère, puis centrifugation et remise en suspension des cellules, comme indiqué ci-dessus 2. Le nombre de cellules injectées est la variable dépendante sur l'emplacement de l'injection neuroanatomiques. Pour les injections nous avons l'habitude d'injecter supratentorielle 3-5 x 10 5 cellules dans 3 ul de milieu sans sérum (DMEM), tandis que pour les injections de 3 tronc cérébral, aussi peu que 5 x 10 4 cellules sont injectées dans 0,5 ul. L'injection de volumes plus importants que ceux recommandés peut entraîner le reflux des cellules tumorales dans le tractus aiguille, avec exophytiques résultante (figure 1), plutôt que la croissance des tumeurs intracrâniennes. Après le retrait de l'échantillon pour l'injection intracrânienne, la suspension de cellules restantes devraient être placés dans la glace, avec des contenus mixtes fréquemment pour maintenir la concentration appropriée tout en complétant l'établissement tumeur intracrânienne parmi les membres d'une série d'injection.
2. L'implantation des cellules tumorales
Remarque, toutes les procédures décrites ci-dessous ont été examinés et approuvés par l'utilisation des animaux et du Comité institutionnel de soins à l'Université de Californie à San Francisco.
- La zone chirurgicale doit être préparé par pulvérisation toutes les surfaces avec un désinfectant, comme solution de chlorhexidine à 2%. Après l'utilisation du désinfectant, du matériel suivant doit être placé dans la zone chirurgicale:
- Coussin chauffant pour maintenir la température du corps de la souris
- Deux petites boîtes de Pétri, l'un contenant du peroxyde d'hydrogène à 3%, et un contenant de la chlorhexidine à 2%
- Tampons de gaze stérile et le coton
- Stérile scalpels jetables
- Autoclavés agrafeuse chirurgicale
- Pour l'anesthésie une anesthésie injectée doit être utilisée; typiquement un mélange kétamine-xylazine.
- Une fois que la souris est anesthésiée, le cuir chevelu est préparé par écouvillonnage à plusieurs reprises avec un morceau de gaze stérile trempée dans la solution de chlorhexidine. Pommade ophtalmique doit être appliqué pour maintenir une humidité adéquate pendant la procédure. Avec un scalpel stérile, remplir une incision sagittale sur l'os pariéto-occipitale, environ 1 cm de long. La surface du crâne exposée est ensuite nettoyé avec un coton-tige trempé dans une solution de peroxyde d'hydrogène à 3%. Le bregma devrait être évident à ce stade (voir vidéo).
- Les coordonnées pour l'injection de cellules tumorales varient selon l'endroit désiré pour l'établissement des tumeurs. Ce qui suit représente la procédure que nous utilisons pour l'établissement des tumeurs intracérébrales 2 dans un endroit neuroanatomiques au cours de laquelle de nombreux patients atteints de tumeurs cérébrales expérience dans le développement tumoral. Autres lieux d'intérêt dans la recherche comprennent la tumeur au cerveau Pons, pour la modélisation anatomique du tronc cérébral des tumeurs 3, et les injections sous-dural pour la modélisation de la localisation des tumeurs méningées 4. Avant l'injection de cellules tumorales, utiliser une aiguille de calibre 25 stériles pointu pour perforer le crâne à 2 mm à la droite du bregma et 1 mm en avant de la suture coronale, créant ainsi une ouverture pour l'injection de cellules tumorales (voir vidéo). Cette procédure fonctionne bien pour les souris et les rats (22 aiguille de la jauge pour les rats).
- Avant de dessiner des cellules dans la seringue, mélanger le contenu de la suspension cellulaire en tapotant avec le doigt. Charger la seringue avec la quantité désirée de cellules en suspension, en prenant soin d'éviter de créer des bulles d'air. L'extérieur de la seringue doit ensuite être nettoyé avec une compresse imbibée d'alcool pour nettoyer l'extérieur sans aucun cellules adhérentes, ce qui aidera à prévenir les tumeurs extracrâniennes création et la croissance (figure 1A). Afin de s'assurer que la profondeur d'injection approprié est atteint, utiliser un scalpel pour couper 3mm de l'extrémité pointue d'une pointe de P20 pipetteman. Cette section de la pointe peut être monté sur la seringue et agira pour limiter la profondeur d'injection, et sera en outre s'assurer que les tip de l'aiguille de la seringue est de 3 mm de la face inférieure du crâne. Placez la seringue perpendiculairement au crâne et dans le trou créé précédemment, et injecter lentement la suspension de cellules (une suspension 3μL doit être injecté sur une période de 1 minute). Un angle d'insertion inappropriée seringue peut conduire à une injection intraventriculaire de cellules et de la diffusion ultérieure vertébrale (Fig. 1B: Droit) Après avoir terminé l'injection, laissez l'aiguille en place pendant une minute, puis retirer lentement (voir vidéo): ces mesures contribueront à réduire le reflux des cellules tumorales.
- Comme une alternative à l'approche sans assistance ou main libre pour l'implantation des cellules tumorales intracrâniennes 5, on peut utiliser un cadre stéréotaxique pour petits animaux (F panel d'aperçu schématique), qui favorise généralement l'emplacement d'injection plus cohérent, mais au détriment de quantités importantes de le temps de procédure. Dans notre expérience, deux membres du personnel chirurgical peut injecter jusqu'à 60 souris / heure lors de l'utilisation de l'approche main-libre, alors que le taux d'injection maximal avec un cadre stéréotaxique petit animal est d'environ 15 souris / heure. L'opportunisme de procédure est une considération importante lors de l'injection de grandes séries de souris, et aide à réduire le délai dans lequel les cellules tumorales, à injecter, sont laissés sur la glace.
- Nettoyer le crâne avec du peroxyde d'hydrogène à 3% et sec à l'aide d'un écouvillon de coton stérile sec. Appliquez la cire d'os stérile pour le trou. En utilisant une pince, tirer sur le cuir chevelu ainsi que sur le crâne et l'agrafer à fermer. Pour une cicatrisation optimale, le cuir chevelu doit être agrafé avec le derme de chaque côté du crâne les uns contre les autres (face contre face). Le cuir chevelu agrafés doivent être nettoyés en utilisant une solution de chlorhexidine, et la buprénorphine alors administrée par injection sous-cutanée pour soulager la douleur post-opératoire.
- Surveiller toutes les souris post-opératoire jusqu'à ce qu'ils deviennent ambulants et de conserver une activité normale. Typiquement, le temps de récupération est d'environ 30 minutes.
3. Surveillance bioluminescence de la croissance tumorale
- Contexte. L'imagerie par bioluminescence (BLI) est basé sur l'oxydation de la luciférine [D-(-) -2 - (60-hydroxy-20-benzothiazolyle)-thiazone-4-carboxylique] en présence d'oxygène et de l'adénosine triphosphate (ATP). Cette réaction est catalysée par l'enzyme luciférase, qui convertit l'énergie chimique en photons avec une émission résultante de la lumière. Les cellules humaines peuvent être modifiées pour exprimer la luciférase (voir ci-dessous), avec seulement luciférase exprimant des cellules capables d'émettre de la lumière, en présence du substrat luciférine. Il ya de luminescence de fond minimal à partir d'animaux traités avec des hôtes luciférine, tel qu'il ya une très favorable signal-bruit pour détecter les émissions de luminescence de luciférase modifiée cellules tumorales, permettant un suivi très sensible de la croissance tumorale et la réponse au traitement in vivo. Par ailleurs, la luciférase et de son substrat, la luciférine, se sont avérés être non toxique pour les cellules de mammifères, et nous n'avons pas observé de différences fonctionnelles entre les cellules exprimant la luciférase relatives aux cellules non modifiées correspondantes. Luciférine traverse facilement les membranes cellulaires et la barrière hémato-encéphalique après administration intrapéritonéale (ip) ou intraveineuse (iv) l'injection chez la souris, permettant ainsi à l'imagerie de chaque compartiment qui contient la luciférase cellules modifiées. Le niveau d'émission de photons et le spectre de la lumière émise par la luciférase modifiée cellules est suffisante pour pénétrer les tissus des animaux de recherche de petites, comme les souris et les rats, et peut être détecté à l'extérieur avec des caméras d'imagerie de faible luminosité. Le caractère non invasif de l'imagerie par bioluminescence permet la surveillance répétée de la croissance tumorale et la réponse au traitement chez des sujets animaux individuels.
- Sources de cellules implantées doivent être modifiés de façon stable pour Firefly expression de la luciférase. Ces sources de cellules peuvent être achetés ou produits dans des laboratoires différents utilisant des lentivirus qui ont été construites pour l'expression constitutive de la luciférase. Nous recommandons fortement l'utilisation de cellules modifiées avec des lentivirus encodage luciférase, plutôt que de plasmide, pour assurer la stabilité de l'expression cellulaire de la luciférase in vivo, ce qui est nécessaire pour l'imagerie de luminescence quantitatifs pour fournir une indication précise des changements dans la charge tumorale chez les sujets animaux individuels qui sont reprises imagés au cours d'une expérience.
- Surveillance de BLI. Nous recommandons la réalisation d'imagerie par bioluminescence quantitatives (qBLI) 1x-2x par semaine, en commençant une semaine après l'injection de cellules tumorales. Notre qBLI est réalisé en utilisant l'imagerie IVIS Lumina gare (Caliper Life Sciences), et nos résultats indiquent des données similaires sont obtenus en utilisant la Lumina IVIS, l'IVIS 150, ou la station d'imagerie IVIS 200. En préparation pour l'imagerie, les souris sont simultanément anesthésiés avec kétamine / xylazine et administré luciférine (sel de potassium D-luciférine, 150 mg / kg, Caliper Life Sciences) par injection intrapéritonéale, aux souris imagé 12 minutes après l'injection. La pharmacocinétique de la luciférine indiquent que le temps entre les admitration de la luciférine et la détermination de la luminescence cellule devrait être entre 10-15 minutes après l'injection de luciférine, en vue d'obtenir émission de luminescence maximale et la plus grande sensibilité de détection. La longueur du temps choisi dans l'intervalle de 10-15 minutes de temps doit être maintenue aussi constante parmi les animaux qui sont imagés. Il est extrêmement important de maintenir la cohérence de la durée de temps entre l'injection de luciférine et obtenir des lectures de BLI. Régions d'intérêt englobant la région intracrânienne du signal sont définies en utilisant le logiciel image vivante (figure 2), et le photons/s/sr/cm2 total (photons par seconde et par stéradian par centimètre carré) sont enregistrées (voir vidéo).
- L'analyse des données. Alors que la croissance tumorale et la réponse thérapeutique sont surveillés chez des animaux individuels, nous recommandons fortement les groupes de traitement d'au moins 8 pour augmenter la certitude statistique de conclusions concernant la réponse tumorale, ou son absence, à la thérapie. En ce qui concerne la présentation des résultats qBLI, des lectures de luminescence sont converties en valeurs normalisées en divisant la luminescence chaque souris s, obtenue pendant et après la réalisation de schéma thérapeutique, avec sa luminescence prétraitement correspondant maximale de lecture 6,7. Pour une analyse de survie, l'estimateur de Kaplan-Meier 8 est utilisé, et dont les courbes de survie sont générées, et les valeurs de survie médiane déterminée. Différences entre les courbes de survie sont comparées en utilisant un test du log-rank 9.
- Récupération du cerveau pour une analyse ultérieure de la tumeur traitée et non traitée. Sur l'euthanasie des animaux, le cerveau de la souris doit être rapidement excisée (voir vidéo), et soit placé dans le formol pour analyse ultérieure de la morphologie de la tumeur et l'immunohistochimie, ou devrait être monté dans un PTOM, pour la congélation des échantillons.
4. Les résultats représentatifs
Dans l'exemple illustré à la figure 3A, les souris recevant intracrânienne injection de cellules tumorales ont été suivis pour la luminescence intracrânienne jusqu'en valeurs successives de luminescence moyenne indiquée croissance tumorale progressive, et à laquelle une thérapie de temps a été lancé (début flèche grise au jour 34: l'erlotinib administré quotidiennement à 150 mg / kg jusqu'à l'euthanasie obligatoire). Les valeurs de luminescence pour chaque souris est fixé à une valeur normalisée de 1 au moment de l'instauration du traitement, avec des lectures ultérieures de luminescence pour chaque souris normalisée à sa valeur pré-traitement d'imagerie finale. À titre d'exemple, une souris avec une lecture de luminescence de pré-traitement final de 2,0 x 10 7 photons / sec à 34 jours, dont la luminescence était passé à 6,0 x 10 7 photons / sec à 38 jours, aurait un jour 38 la valeur de luminescence normalisées de 3,0. Moyenne normalisée de bioluminescence et correspondant d'erreur standard pour le contrôle et les groupes de traitement sont tracées pour chaque point de l'imagerie en temps. Dans cet exemple, une différence significative dans la luminescence moyenne normalisée est évident au point de l'imagerie en temps une première récidive à l'initiation du traitement (jour 38), à la différence de la luminescence moyenne du groupe montrant augmenter encore à des temps ultérieurs. Dans la plupart des cas, activité anti-tumorale de la thérapie, comme indiqué par qBLI, est accompagné par une différence significative de survie correspondantes (ie, p <0,05), comme c'est le cas ici (figure 3B). Panneaux 3C et 3D montrent adjacentes hématoxyline & éosine et anti-EGFR coupes colorées de cerveau de souris obtenues au moment de l'euthanasie, après le placement du cerveau réséqué dans de la paraffine-enrobage formol et ultérieures pour la coupe.
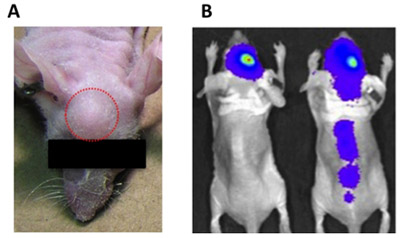
Figure 1. Indications d'erreurs d'injection intracrânienne. Une croissance) exophytique tumeur (extracrâniennes) (cercle rouge) peut être causée par un trop grand volume d'injection, suspension cellulaire résiduelle fixée à la seringue, ou de retirer la seringue trop rapidement après l'injection des cellules tumorales. B) injecter des cellules tumorales dans les ventricules peuvent causer la diffusion d'une tumeur vertébrale (souris vers la droite), contrairement à bien injecté des cellules tumorales, le signal pour qui reste localisée au site d'injection (souris vers la gauche).
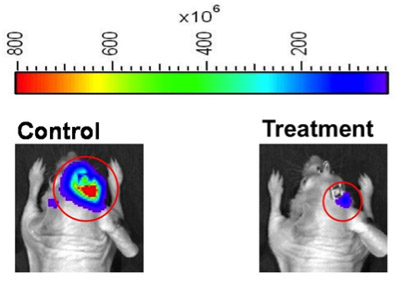
Figure 2. Représentations chaleur carte-image de l'intensité de bioluminescence pour les souris représentant de contrôle (à gauche) et traitement (droite) des groupes d'une expérience de la réponse thérapeutique. Le logiciel Image habitable peut être réglé afin de définir des régions d'intérêt (cercles rouges), ou les opérateurs instrument peut définir des régions d'intérêt manuellement. Pour utiliser des images comme celles-ci pour la construction de la figure, nous recommandons que l'opérateur de l'instrument montre des images carte de la chaleur en utilisant la gamme de bioluminescence même carte de chaleur (partie supérieure de la figure), pour fournir une représentation visuelle de l'étendue de la différence entre les sujets de bioluminescence des animaux.
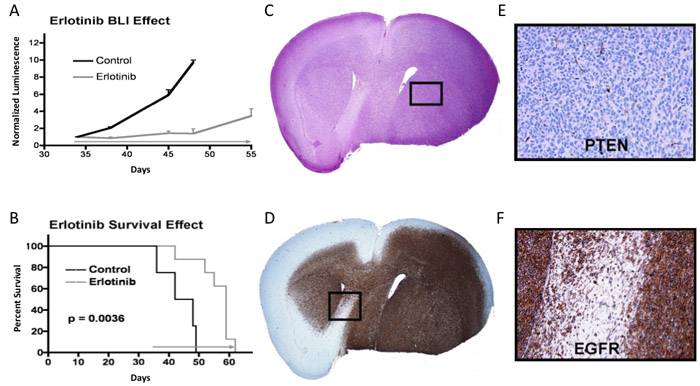
Figure 3. Bioluminescence, la survie et l'analyse des tissus tumoraux à partir d'une expérience dans laquelle la réponse thérapeutique est évidente. A Plot) des lectures bioluminescence signifie pour le contrôle et la souris du groupe de traitement, avec une erreur standard indiqué pour chaque point de l'imagerie. B) parcelle de survie pour les mêmes souris, p-valeur déterminée par l'utilisation du log-rank test 7. C) l'article H & E tachés de cerveau de souris ayant une tumeur. D) L'EGFR section tachés. E et F) des grossissements de zones indiquées par des panneaux C et D, respectivement, avec E panneau montrant une coloration négative protéine suppresseur de tumeur PTEN.
Discussion
Orthotopique (intracrâniens) l'établissement de xénogreffes de tumeurs cérébrales offre un microenvironnement approprié 10 pour la modélisation du cancer du SNC pour être testés pour la réponse thérapeutique. Ce type de modélisation fournit également des informations concernant l'accès thérapeutiques au cerveau et tumeur au cerveau, ce qui est extrêmement important de déterminer si un agent expérimental devrait être avancée à l'évaluation des essais cliniques chez les patients. Parce que la quantité de tumeur intracrânienne xénogreffe ne peut pas être mesurée directement, comme par des étriers, un suivi longitudinal de la croissance tumorale intracrânienne et la réponse au traitement nécessite l'imagerie non invasive, l'imagerie par bioluminescence avec nos expériences indiquant que l'approche la plus pratique pour des expériences dont l'objectif principal consiste à évaluer l'étendue de la réponse tumorale au traitement. Lorsque les résultats de l'imagerie par bioluminescence sont combinés avec une analyse de survie animal en question, les deux ensembles de données fournissent une approche puissante et fiable pour évaluer l'efficacité thérapeutique expérimentale.
Enfin, il est extrêmement important que intracrânienne xénogreffes tumorales du cerveau sont récoltées à partir de sujets animaux euthanasiés afin d'évaluer les effets morphologiques et moléculaires de la thérapie, et pour ce que nous préférons une résection ensemble du cerveau au moment de l'euthanasie, avec la préservation du cerveau réséqué pour une analyse ultérieure.
Considérant que la présentation qui précède a été faite spécifiques à la recherche de tumeurs cérébrales, les concepts ne sont certainement généralisables à d'autres cancers humains qui se prêtent à la modélisation orthotopique chez les rongeurs.
Déclarations de divulgation
Remerciements
matériels
| Name | Company | Catalog Number | Comments |
| Disposable Scapels | Feather Safety Razor Co, Ltd. | 2975 | No.21 |
| Heating Pad | Dunlap | HP950 | |
| Gauze | Fisher Scientific | 22028563 | |
| Cotton Swabs | Fisher Scientific | 23-400-100 | |
| 2% Chlorhexidine | Fisher Scientific | NC9756995 | |
| 3% Hydrogen Peroxide | Fisher Scientific | H312P-4 | |
| 25g Needle | BD Biosciences | 305122 | |
| 10ul Hamilton Sharp Microsyringe | Hamilton Co | 20734 | |
| Skin Stapler and Staples | Stoelting Co. | 59020 | |
| Stereotaxic Frame | Stoelting Co. | 51725 | |
| Living Image Software |  Caliper Life Sciences Caliper Life Sciences | ||
| D-luciferin | Gold Biotechnology | LUCK-1G | Potassium Salt |
| Xenogen Lumina |  Caliper Life Sciences Caliper Life Sciences |
Références
- Giannini, C., Sarkaria, J. N., Saito, A., Uhm, J. H., Galanis, E., Carlson, B. L., Schroeder, M. A., James, C. D. Patient Tumor EGFR and PDGFRA Gene Amplifications Retained in an Invasive Intracranial Xenograft Model of GBM. Neuro-Oncol. 7, 164-176 (2005).
- Ozawa, T., Wang, J., Hu, L. J., Bollen, A. W., Lamborn, K. R., Deen, D. F. Growth of human glioblastomas as xenografts in the brains of athymic rats. In Vivo. 1, 55-60 (2002).
- Hashizume, R., Ozawa, T., Dinca, E. B., Banerjee, A., Prados, M. D., James, C. D., Gupta, N. A human brainstem glioma xenograft model enabled for bioluminescence imaging. J Neurooncol. , (2009).
- Baia, G. S., Dinca, E. B., Ozawa, T., Kimura, E. T., McDermott, M. W., James, C. D., VandenBerg, S. R., Lal, A. An orthotopic skull base model of malignant meningioma. Brain Pathol. 2, 172-179 (2007).
- Ozawa, T., James, C. D., Van Meir, E. Human Brain Tumor Cell and Tumor Tissue Transplantation Models. CNS Cancer: Models, Markers, Prognostic Factors, Targets, and Therapeutic Approaches. , 147-162 (2009).
- Sarkaria, J. N., Yang, L., Grogan, P. T., Kitange, G. J., Carlson, B. L., Schroeder, M. A., Galanis, E., Giannini, C., Wu, W., Dinca, E. B., James, C. D. Identification of Molecular Characteristics Correlated with Glioblastoma Sensitivity to EGFR Kinase Inhibition Through Use of an Intracranial Xenograft Test Panel. Mol. Cancer Ther. 6, 1167-1174 (2007).
- Dinca, E. B., Sarkaria, J. N., Schroeder, M. A., Carlson, B. L., Voicu, R., Gupta, N., Berger, M. S., James, C. D. Bioluminescence Monitoring of Intracranial Glioblastoma Xenograft Response to Primary and Salvage Temozolomide Therapy. J. Neurosurg. 107, 610-616 (2007).
- Kaplan, E. L., Meier, P. Non-parametric estimation from incomplete observations. J. Am. Stat. Assoc. 53, 457-481 (1958).
- Peto, R., Peto, J. Asymptotically efficient rank invariant procedures. J. R. Stat. Soc. Ser. A. Stat. Soc. 135, 185-207 (1972).
- Camphausen, K., Purow, B., Sproull, M., Scott, T., Ozawa, T., Deen, D. F., Tofilon, P. J. Influence of in vivo growth on human glioma cell line gene expression: convergent profiles under orthotopic conditions. Proc. Natl. Acad. Sci. U. S. A.. 102, 8287-8292 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon