Method Article
Estabelecer xenoenxertos tumor intracraniano Cérebro com posterior análise do crescimento tumoral e resposta à terapia com imagem Bioluminescência
Neste Artigo
Resumo
Luciferase modificados xenotransplantes tumorais humanos cerebral intracraniana pode ser estabelecida em camundongos atímicos, com posterior acompanhamento do crescimento tumoral e resposta à terapia com imagem de bioluminescência. Em combinação com a análise de sobrevivência, o monitoramento bioluminescência é uma ferramenta de pesquisa essencial para ensaios pré-clínicos de terapias sendo considerado para o tratamento de tumores cerebrais.
Resumo
Modelos de transplante usando células tumorais do cérebro humano têm servido uma função essencial em neuro-oncologia pesquisas por muitos anos. No passado, o procedimento mais comumente utilizado para o estabelecimento xenoenxerto humana tumor consistiu na coleta de células de frascos de cultura, seguida pela injeção subcutânea das células coletadas em camundongos imunocomprometidos. Considerando que esta abordagem ainda vê o uso freqüente em muitos laboratórios, tem havido uma mudança significativa de ênfase na última década para a criação xenoenxerto ortotópico, que, no caso de tumores cerebrais, requer a injeção de células tumorais em estruturas apropriadas neuroanatômicas. Porque estabelecimento xenoenxerto intracraniana elimina a capacidade de monitorar o crescimento do tumor através de medição direta, como por uso de pinças, a mudança de ênfase para ortotópico cérebro modelos xenoenxerto tumor exigiu a utilização de não-invasivos de imagem para avaliar a carga tumoral em animais hospedeiros. Dos métodos de imagem disponíveis atualmente, o monitoramento bioluminescência é geralmente considerada a oferecer a melhor combinação de sensibilidade, conveniência e custo. Aqui, iremos demonstrar os procedimentos para o estabelecimento ortotópico de tumor cerebral, e para monitorar o crescimento do tumor ea resposta ao tratamento ao testar terapias experimentais.
Protocolo
1. Preparação de células tumorais.
Células para xenotransplantes tumorais do cérebro humano pode ser obtida quer a partir de tumores propagada como crescimentos subcutânea em camundongos atímicos, ou de cultura de células. Utilização de ambas as fontes de células é discutido abaixo, juntamente com a demonstração de um método para implante de células.
Para preparar células de tumores subcutâneos para transferência para o compartimento intracraniano, tumor extirpado flanco são colocados em placas de cultura, onde o tecido é inicialmente picada com um bisturi e, em seguida mecanicamente interrompidos por pipetagem repetitiva para criar uma suspensão total de células 1. A suspensão total da célula é então passado através de uma malha de nylon 70 mM filtro para produzir uma suspensão de células único adequado para injeção intracraniana. A suspensão celular é centrifugado a 1000 rpm por 10 minutos a 4 ° C, eo sobrenadante aspirado antes de ressuspender o pellet celular em um volume adequado de soro livre de mídia para obter uma concentração de trabalho final (veja abaixo). Para preparar linhas celulares estabelecidas para a implantação intracraniana, as células são colhidas por monocamadas trypsinizing, ou através da recolha de culturas em suspensão neurosphere, seguida de centrifugação e ressuspensão das células conforme indicado acima 2. O número de células injetadas é variável dependente da localização neuroanatômica da injeção. Para injectáveis supratentorial rotineiramente injetar 3-5 x 10 5 células em 3 mL de soro livre de media (DMEM), enquanto que para brainstem injeções 3, sómente 5 x 10 4 células são injetadas em 0,5 mL. Injetando volumes maiores do que o recomendado pode resultar em refluxo de células tumorais através do trato agulha, com exofíticas resultante (Figura 1), em vez de o crescimento do tumor intracraniano. Após a retirada de amostra para injeção intracraniana, a suspensão de células restantes devem ser colocados no gelo, com conteúdo misturado com freqüência para manter a concentração adequada ao completar estabelecimento tumor intracraniano entre os membros de uma série de injeção.
2. O implante de células tumorais
Note, todos os procedimentos descritos abaixo foram analisados e aprovados pelo Uso de Animais Institucional e Comitê de Cuidados na Universidade da Califórnia em San Francisco.
- A área cirúrgica deve ser preparado por pulverização todas as superfícies com um desinfectante, como solução de clorexidina 2%. Depois de usar o desinfetante, o seguinte material deve ser colocado na área cirúrgica:
- Almofada de aquecimento para manter a temperatura corporal do rato
- Duas pequenas placas de Petri, um contendo peróxido de hidrogênio 3% e uma contendo clorexidina a 2%
- Swabs estéreis gaze e algodão
- Estéril bisturis descartáveis
- Grampeador cirúrgico autoclavado
- Para anestesia um anestésico injetado deve ser usado, normalmente uma mistura de cetamina-xilazina.
- Uma vez que um rato é anestesiado, o couro cabeludo é preparada limpando várias vezes com um pedaço de gaze estéril embebida em solução de clorexidina. Pomada deve ser aplicada para manter a umidade adequada durante o procedimento. Utilizando um escalpelo esterilizado, completa uma incisão sagital sobre o osso parieto-occipital, cerca de um centímetro de comprimento. A superfície exposta do crânio é então limpo com um cotonete embebido em uma solução de 3% de peróxido de hidrogênio. O bregma deve ser aparente neste ponto (ver vídeo).
- As coordenadas para injeção de células tumorais irá variar de acordo com o site desejado para o estabelecimento tumor. A seguir representa o processo que usamos para o estabelecimento tumor intracerebral 2 em uma localização neuroanatômica em que pacientes com tumor cerebral muitas experiência em desenvolvimento de tumor. Outros locais de interesse em pesquisa tumor no cérebro incluem a ponte, para a modelagem anatômica do tronco cerebral tumores 3, e injeções subdural para a modelagem de localização de tumores das meninges 4. Antes da injeção das células tumorais, use uma agulha estéril 25 afiada para perfurar o crânio de 2 mm à direita do bregma e 1 mm anterior à sutura coronal, criando assim uma abertura para a injeção de células tumorais (ver vídeo). Este procedimento funciona bem para ambos os camundongos e ratos (22 agulha para ratos).
- Antes da elaboração células dentro da seringa, misture o conteúdo da suspensão celular tocando com o dedo. Carregar a seringa com a quantidade desejada de suspensão celular, tomando cuidado para evitar a criação de bolhas de ar. A parte externa da seringa deve ser limpo com um algodão embebido em álcool para limpar o exterior livre de quaisquer células aderentes, o que ajudará a prevenir estabelecimento tumor extra e crescimento (Figura 1A). Para garantir que a profundidade de injeção adequado é atingido, usar um bisturi para cortar três milímetros fora da ponta de uma ponta pipetteman P20. Esta seção da ponta pode ser colocada sobre a seringa e vai agir para limitar a profundidade da injeção, e ainda irá garantir que a tip da agulha da seringa é 3mm da parte inferior do crânio. Coloque a seringa perpendicular ao crânio e no buraco criado anteriormente, e injecte lentamente a suspensão de células (uma suspensão 3μL deve ser injectado ao longo de um período de 1 minuto). Um ângulo inadequado de inserção seringa pode resultar em injeção intraventricular de células e disseminação da coluna posterior (Fig. 1B: Direita) Ao completar a injecção, deixe a agulha no lugar por mais um minuto, em seguida, lentamente retirar (ver vídeo): estes passos ajudará a reduzir refluxo de células tumorais.
- Como uma alternativa para a abordagem sem ajuda ou free-mão para implante de células do tumor intracraniano 5, pode-se usar uma moldura estereotáxica pequeno animal (F painel de visão geral esquemática), que geralmente promove local de injeção mais consistente, mas à custa de quantidades substanciais de tempo processual. Em nossa experiência, dois equipe cirúrgica pode injetar cerca de 60 ratos / hora quando se utiliza a abordagem à mão livre, que a taxa máxima de injeção com um quadro de pequenos animais estereotáxica é de aproximadamente 15 ratos / hora. Expediente processual é uma consideração importante ao injetar grandes séries de ratos, e ajuda a reduzir o tempo em que as células tumorais, a ser injetado, são deixados no gelo.
- Limpe o crânio com peróxido de hidrogênio 3% e seco com um cotonete estéril seco. Aplicar cera de osso estéril para o buraco. Usando uma pinça, tirar o couro cabeludo em conjunto sobre o crânio e grampos para fechar. Para a cura ideal, o couro cabeludo deve ser grampeado com a derme de cada lado do couro cabeludo contra os outros (baixo contra baixo). O couro cabeludo grampeado deve ser limpo com solução de clorexidina, e buprenorfina, em seguida, administradas por injecção subcutânea no pós-operatório alívio da dor.
- Monitorar todos os ratos pós-operatório até que se tornem ambulantes e manter atividade normal. Normalmente, o tempo de recuperação é de cerca de 30 minutos.
3. Monitoramento bioluminescência do crescimento tumoral
- Fundo. Imagem de bioluminescência (BLI) é baseado na oxidação da luciferina [d-(-) -2 - (60-hidroxi-20-benzothiazolyl)-thiazone-4-carboxílico] na presença de oxigênio e trifosfato de adenosina (ATP). Esta reação é catalisada pela enzima luciferase, que converte energia química em fótons com emissão resultante da luz. Células humanas podem ser modificados para expressar luciferase (veja abaixo), com apenas luciferase células que expressam capaz de emitir luz na presença do substrato luciferina. Há luminescência de fundo mínimo de animais tratados com hosts luciferina, de modo que há uma muito favorável relação sinal-ruído para detectar as emissões de luminescência da luciferase modificados células tumorais, permitindo o monitoramento altamente sensível do crescimento do tumor e resposta terapêutica in vivo. Além disso, luciferase e seu substrato, a luciferina, foram mostrados para ser não-tóxico para células de mamíferos, e temos observado nenhuma diferença funcional entre células que expressam em relação a luciferase correspondentes células não modificado. Luciferina atravessa facilmente as membranas celulares e da barreira hemato-encefálica após intraperitoneal (ip) ou injecção intravenosa (iv) em ratos, permitindo que imagens de cada compartimento que contém luciferase modificados células. O nível de emissão de fótons e do espectro da luz emitida luciferase modificados células é suficiente para penetrar nos tecidos de animais de pesquisa de pequeno porte, como camundongos e ratos, e pode ser detectado externamente com câmeras de baixa luminosidade de imagem. O caráter não-invasivo de imagem de bioluminescência permite a monitorização repetida de crescimento do tumor e resposta terapêutica em indivíduos animal individual.
- Fontes de células devem ser implantadas de forma estável modificado para firefly expressão luciferase. Como fontes de células podem ser comprados ou produzidos em laboratórios individuais usando lentivírus que foram construídos para a expressão constitutiva da luciferase. Recomendamos fortemente o uso de células modificadas com lentivírus codificação luciferase, em vez de plasmídeo, para garantir a expressão celular estável de luciferase in vivo, que é necessário para imagens de luminescência quantitativa para fornecer indicação precisa de mudanças na carga tumoral para assuntos individuais dos animais que são repetidamente imaged durante o curso de um experimento.
- Monitoramento BLI. Recomendamos a realização de imagem de bioluminescência quantitativos (qBLI) 1x-2x por semana, começando uma semana após a injeção das células tumorais. Nosso qBLI seja efectuada utilizando os IVIS Lumina imagem estação (Caliper Life Sciences), e nossos resultados indicam dados semelhantes são obtidos em usar o Lumina IVIS, o IVIS 150, ou o IVIS estação de imagens 200. Em preparação para a imagem latente, os ratos são, simultaneamente, anestesiados com cetamina / xilazina e luciferina administrados (D-Luciferina sal de potássio, 150 mg / kg, Caliper Life Sciences), através de injeção intraperitoneal, com camundongos imaged 12 minutos após a injeção. A farmacocinética da luciferina indicam que o tempo entre a administraçãoconcentração de luciferina e determinação da luminescência célula deve ser entre 10-15 minutos após a injeção de luciferina, a fim de obter de emissão de luminescência máxima e maior sensibilidade de detecção. O período de tempo selecionados dentro do intervalo de tempo de 10-15 minutos deve ser mantida o mais constante entre os animais que estão sendo fotografada. É extremamente importante para manter a consistência no período de tempo entre a injeção de luciferina ea obtenção de leituras de BLI. Regiões de interesse abrangendo a área intracraniana de sinal são definidos usando software Vivendo Imagem (Figura 2), e os photons/s/sr/cm2 total (fótons por segundo por esterradiano por centímetro quadrado) são registados (ver vídeo).
- Análise de dados. Considerando o crescimento do tumor e resposta terapêutica são monitorados em animais individuais, recomendamos os grupos de tratamento de pelo menos 8 para aumentar a certeza estatística de conclusões sobre a resposta do tumor, ou a falta dela, à terapia. Com relação aos resultados apresentando qBLI, as leituras de luminescência são convertidos para valores normalizados dividindo-se luminescência cada rato s, obtidos durante e após a conclusão do esquema terapêutico, com a sua luminescência de pré-tratamento correspondente máxima de leitura 6,7. Para análise de sobrevivência, o estimador Kaplan-Meier 8 é usado, ea partir do qual as curvas de sobrevivência são gerados, e os valores médio de sobrevida determinada. Diferenças entre as curvas de sobrevida são comparadas através de um teste de log-rank 9.
- Recuperação do cérebro para a análise posterior de tumor tratados e não tratados. Após a eutanásia animal, o cérebro do rato deve ser rapidamente retirado (ver vídeo), e ou colocado em formol para posterior análise da morfologia do tumor e imuno-histoquímica, ou deveria ser montado em outubro para o congelamento da amostra.
4. Resultados representante
No exemplo mostrado na Figura 3A, camundongos que receberam injeção de células de tumor intracraniano foram monitorados por luminescência intracraniana até sucessivos valores de luminescência significa indicou crescimento tumoral progressivo, e em que a terapia foi iniciada tempo (início seta cinza no dia 34: erlotinib administrada diariamente a 150 mg / kg, até a eutanásia necessário). Valores de luminescência para cada rato estão definidas para um valor normalizado de 1 no tempo do início da terapêutica, com leituras de luminescência subseqüentes para cada rato normalizado para o valor final de pré-tratamento de imagem. Como exemplo, um mouse com uma leitura de luminescência finais de pré-tratamento de 2,0 x 10 7 fótons / seg no dia 34, cuja luminescência aumentou para 6,0 x 10 7 fótons / seg no dia 38, teria um dia 38 de luminescência valor normalizado de 3,0. A média de bioluminescência normalizado e correspondente erro padrão para os grupos controle e tratamento são plotados para cada tempo de imagem. Neste exemplo, uma diferença significativa na luminescência normalizado dizer é aparente no primeiro ponto imagem em tempo posterior ao início do tratamento (dia 38), com a diferença de luminescência média de grupo mostrando aumento em momentos subseqüentes. Na maioria dos casos, atividade anti-tumoral de terapia, como indicado por qBLI, é acompanhada por uma diferença significativa na sobrevida correspondente (ie, p <0,05), como é o caso aqui (Figura 3B). Painéis 3C e 3D mostram hematoxilina & eosina adjacentes e anti-EGFR cortes corados de cérebro de camundongo obtido no momento da eutanásia, após a colocação do cérebro ressecado em formalina e posterior inclusão em parafina para corte.
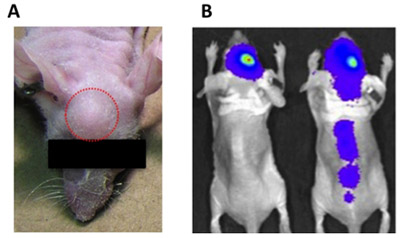
Figura 1. Indicações de erros de injeção intracraniana. A) o crescimento do tumor exofítico (extracraniana) (círculo vermelho) pode ser causada por uma injeção muito grande volume, suspensão de células residuais anexado à seringa, ou de retirar a seringa muito rapidamente após a injeção das células tumorais. B) A injeção de células tumorais para os ventrículos pode causar disseminação do tumor espinhal (mouse para a direita), em contraste com adequadamente injetado células tumorais, o sinal para que permaneça no local da injeção (mouse para a esquerda).
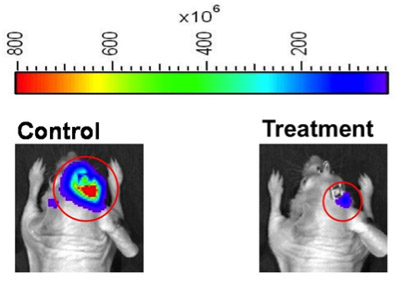
Figura 2. Representações de calor mapa de imagem de bioluminescência intensidade para ratos representante de controle (esquerda) e tratamento (direita) grupos de um experimento de resposta terapêutica. A imagem viva software pode ser configurado para definir regiões de interesse (círculos vermelhos), ou operadores de instrumento pode definir as regiões de interesse manualmente. Para a utilização de imagens como estas para a construção de figura, recomendamos que o operador de instrumento mostra imagens de mapa de calor usando a mesma faixa de bioluminescência mapa de calor (parte superior da figura), para fornecer uma representação visual do grau de diferença entre a bioluminescência assuntos animal.
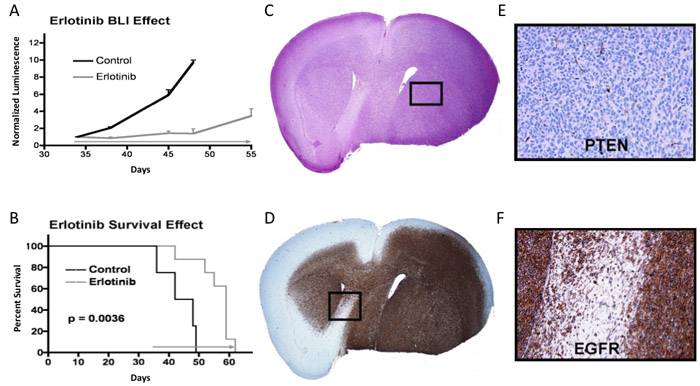
Figura 3. Bioluminescência, sobrevivência e análise de tecido tumoral a partir de um experimento no qual a resposta terapêutica é evidente. A Plot) de leituras bioluminescência significa para o controle de ratos e grupo de tratamento, com erro padrão indicado para cada ponto de imagem. B) Gráfico de Sobrevivência para os ratos mesmo, p-valor determinado através da utilização de log-rank 7. C) seção H & E manchada de cérebro de camundongos com tumor. D) seção EGFR manchado. E e F) ampliações de áreas indicadas a partir de painéis C e D, respectivamente, com painel E mostrando coloração negativa para a proteína PTEN supressor de tumor.
Discussão
Ortotópico (intracraniana) cérebro estabelecimento xenoenxerto tumor fornece um microambiente apropriado 10 para o câncer do SNC de modelagem para ser testado para resposta terapêutica. Este tipo de modelagem, adicionalmente, fornece informações sobre o acesso terapêutica para o cérebro e tumor cerebral, que é criticamente importante para determinar se um agente experimental deve ser avançado para a avaliação de ensaios clínicos em pacientes. Porque a quantidade de tumor intracraniano xenoenxerto não podem ser diretamente medidos, como por pinças, acompanhamento longitudinal do crescimento do tumor intracraniano e resposta à terapia requer não-invasiva por imagem, com a nossa imagem de bioluminescência experiência indica como a abordagem mais prática para os experimentos, cujo principal objectivo está avaliando extensão da resposta do tumor à terapia. Quando os resultados de imagem de bioluminescência são combinados com análise de sobrevida de animais assunto, os dois conjuntos de dados oferecem uma abordagem poderosa e confiável para avaliar a eficácia terapêutica experimental.
Finalmente, é extremamente importante que xenoenxertos tumor intracraniano cérebro são colhidos de indivíduos animais sacrificados, a fim de avaliar os efeitos morfológicos e moleculares da terapia, e para isso nós preferimos ressecção cérebro inteiro no momento da eutanásia, com a preservação do cérebro ressecado para análise posterior.
Considerando que a apresentação anterior foi feita específicas para a investigação tumor no cérebro, os conceitos são certamente generalizáveis a outros cânceres humanos que são passíveis de modelagem ortotópico em roedores.
Divulgações
Agradecimentos
Materiais
| Name | Company | Catalog Number | Comments |
| Disposable Scapels | Feather Safety Razor Co, Ltd. | 2975 | No.21 |
| Heating Pad | Dunlap | HP950 | |
| Gauze | Fisher Scientific | 22028563 | |
| Cotton Swabs | Fisher Scientific | 23-400-100 | |
| 2% Chlorhexidine | Fisher Scientific | NC9756995 | |
| 3% Hydrogen Peroxide | Fisher Scientific | H312P-4 | |
| 25g Needle | BD Biosciences | 305122 | |
| 10ul Hamilton Sharp Microsyringe | Hamilton Co | 20734 | |
| Skin Stapler and Staples | Stoelting Co. | 59020 | |
| Stereotaxic Frame | Stoelting Co. | 51725 | |
| Living Image Software |  Caliper Life Sciences Caliper Life Sciences | ||
| D-luciferin | Gold Biotechnology | LUCK-1G | Potassium Salt |
| Xenogen Lumina |  Caliper Life Sciences Caliper Life Sciences |
Referências
- Giannini, C., Sarkaria, J. N., Saito, A., Uhm, J. H., Galanis, E., Carlson, B. L., Schroeder, M. A., James, C. D. Patient Tumor EGFR and PDGFRA Gene Amplifications Retained in an Invasive Intracranial Xenograft Model of GBM. Neuro-Oncol. 7, 164-176 (2005).
- Ozawa, T., Wang, J., Hu, L. J., Bollen, A. W., Lamborn, K. R., Deen, D. F. Growth of human glioblastomas as xenografts in the brains of athymic rats. In Vivo. 1, 55-60 (2002).
- Hashizume, R., Ozawa, T., Dinca, E. B., Banerjee, A., Prados, M. D., James, C. D., Gupta, N. A human brainstem glioma xenograft model enabled for bioluminescence imaging. J Neurooncol. , (2009).
- Baia, G. S., Dinca, E. B., Ozawa, T., Kimura, E. T., McDermott, M. W., James, C. D., VandenBerg, S. R., Lal, A. An orthotopic skull base model of malignant meningioma. Brain Pathol. 2, 172-179 (2007).
- Ozawa, T., James, C. D., Van Meir, E. Human Brain Tumor Cell and Tumor Tissue Transplantation Models. CNS Cancer: Models, Markers, Prognostic Factors, Targets, and Therapeutic Approaches. , 147-162 (2009).
- Sarkaria, J. N., Yang, L., Grogan, P. T., Kitange, G. J., Carlson, B. L., Schroeder, M. A., Galanis, E., Giannini, C., Wu, W., Dinca, E. B., James, C. D. Identification of Molecular Characteristics Correlated with Glioblastoma Sensitivity to EGFR Kinase Inhibition Through Use of an Intracranial Xenograft Test Panel. Mol. Cancer Ther. 6, 1167-1174 (2007).
- Dinca, E. B., Sarkaria, J. N., Schroeder, M. A., Carlson, B. L., Voicu, R., Gupta, N., Berger, M. S., James, C. D. Bioluminescence Monitoring of Intracranial Glioblastoma Xenograft Response to Primary and Salvage Temozolomide Therapy. J. Neurosurg. 107, 610-616 (2007).
- Kaplan, E. L., Meier, P. Non-parametric estimation from incomplete observations. J. Am. Stat. Assoc. 53, 457-481 (1958).
- Peto, R., Peto, J. Asymptotically efficient rank invariant procedures. J. R. Stat. Soc. Ser. A. Stat. Soc. 135, 185-207 (1972).
- Camphausen, K., Purow, B., Sproull, M., Scott, T., Ozawa, T., Deen, D. F., Tofilon, P. J. Influence of in vivo growth on human glioma cell line gene expression: convergent profiles under orthotopic conditions. Proc. Natl. Acad. Sci. U. S. A.. 102, 8287-8292 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados