Method Article
Создание Внутричерепное ксенотрансплантаты опухолей мозга с последующим анализом роста опухоли и ответ на терапию использования биолюминесценции изображений
В этой статье
Резюме
Люциферазы модифицированного человека ксенотрансплантаты опухоли головного мозга могут быть установлены в интракраниально athymic мышей, с последующим мониторингом роста опухоли и ответ на терапию использованием биолюминесценции изображений. В сочетании с анализа выживаемости, биолюминесценции мониторинг является важным инструментом исследования для доклинических испытаний лечения рассматривается для лечения опухолей головного мозга.
Аннотация
Трансплантация моделей с использованием человеческих клеток опухоли головного мозга служил важнейшей функции в нейро-онкологии исследования на протяжении многих лет. В прошлом, наиболее часто используемые процедуры для создания человеческой опухоли ксенотрансплантата состоял из коллекции клеток из культуры колбах, затем подкожно собранных клеток иммунитета мышей. В то время как этот подход все еще видит частое использование во многих лабораториях, наблюдается значительное смещение акцентов в последнее десятилетие к ортотопической создание ксенотрансплантата, которые, в случае, опухолей головного мозга, опухоли требует инъекции клеток в соответствующей нейроанатомической структур. Потому что внутричерепное создание ксенотрансплантата исключает возможность контролировать рост опухоли путем прямых измерений, например, путем использования суппорты, смещение акцентов в сторону ортотопической модели опухоли головного мозга ксенотрансплантата потребовало использование неинвазивной визуализации для оценки опухолевой массы в животных-хозяев. Из имеющихся в настоящее время методы обработки изображений, биолюминесценции мониторинга как правило, считается предложить наилучшее сочетание чувствительности, целесообразности и стоимости. Здесь мы продемонстрируем процедуры создания ортотопической опухоли головного мозга, а также для контроля роста опухоли и ответ на лечение во время тестирования экспериментальной терапии.
протокол
1. Опухоль Подготовка Cell.
Клетки для человека ксенотрансплантаты опухоли головного мозга могут быть получены либо из опухолей распространяется как подкожный рост в athymic мышей, или из клеточной культуры. Использование обеих клеточных источников обсуждается ниже, наряду с демонстрацией метода для сотовых имплантации.
Для подготовки клетки из опухолей подкожной для передачи внутричерепного отсек, вырезали опухоль фланге находятся в культуре блюда, где ткань изначально фарш со скальпелем, а затем механически нарушены повторяющихся пипетки для создания суспензии клеток совокупности 1. Суспензии клеток агрегат затем пропускается через 70 мкМ нейлоновая сетка фильтра для получения суспензии отдельных клеток, пригодных для внутричерепных инъекций. Клеточной суспензии центрифугируют при 1000 оборотов в минуту в течение 10 минут при температуре 4 ° С, а супернатант атмосферный перед ресуспендированием осадок клеток в соответствующий объем сыворотки среде для получения конечной концентрации работы (см. ниже). Для подготовки установленных клеточных линий для внутричерепных имплантации, клетки собирают по trypsinizing монослоев, либо путем сбора neurosphere культур подвески, то центрифугирования и ресуспендирования клетки, как указано выше 2. Количество клеток вводят переменная зависит от нейроанатомической месте инъекции. Для супратенториальных инъекции мы обычно вводят 3-5 х 10 5 клеток в 3 мкл сыворотки среде (DMEM), тогда как для мозга инъекций 3, всего лишь 5 х 10 4 клетки вводятся в 0,5 мкл. Потребители инъекционных больших объемах, чем рекомендовано может привести к опухоли рефлюкс клетку через иглу-кишечного тракта, с последующей экзофитных (рис. 1), а не внутричерепного рост опухоли. После снятия пробы для внутричерепного инъекции, остальные клеточной суспензии должны быть помещены в лед, с содержанием смешанных часто для поддержания соответствующей концентрации при заполнении внутричерепного создание опухоли среди членов инъекций серии.
2. Имплантации опухоли сотовый
Обратите внимание, что все процедуры, описанные ниже, были рассмотрены и одобрены Институциональные Использование животных и уход комитета в Калифорнийском университете в Сан-Франциско.
- Хирургических области должны быть готовы, обливая всех поверхностей с дезинфицирующим средством, например, 2% раствором хлоргексидина. После использования дезинфицирующего средства, следующие поставки должен быть помещен в хирургическое площадь:
- Грелки для поддержания температуры тела мыши
- Два маленьких чашках Петри, один, содержащий 3% перекиси водорода, а один, содержащий 2% хлоргексидина
- Стерильные тампоны марли и хлопка
- Стерильные одноразовые скальпели
- Автоклавного хирургического степлером
- Для анестезии вводится анестетик следует использовать; обычно кетамин-ксилазина смеси.
- После того, как мышь под наркозом, головы готовят моечные несколько раз кусок стерильной марли, смоченной в раствором хлоргексидина. Глазная мазь следует применять для поддержания адекватного уровня влажности во время процедуры. Используя стерильный скальпель, полный сагиттальный разрез через теменно-затылочной кости, примерно 1 см в длину. Подвергаются поверхности черепа, затем очистить с помощью ватного тампона, пропитанную 3% раствором перекиси водорода. Брегмы должно быть очевидно, в этой точке (см. видео).
- Координаты для инъекций опухолевых клеток будет меняться в зависимости от желаемого сайта для создания опухоли. Следующие представляет процедуры мы используем для внутримозговых опухолей создание 2 в нейроанатомической место, в котором у многих пациентов опухоли головного мозга опыт развития опухоли. Другие пункты интереса к изучению мозга опухоли включают моста, для анатомического моделирования мозга опухоли 3, и субдуральной инъекции для моделирования расположения менингеальных опухолей 4. До инъекции опухоли клетки, использование стерильных 25 калибр острая игла для прокола черепа в 2 мм справа от брегмы и 1 мм впереди венечный шов, тем самым создавая отверстие для введения опухолевых клеток (см. видео). Эта процедура хорошо работает как для мышей и крыс (22 иглы для крыс).
- До рисования клеток в шприце, смешать содержимое клеточной суспензии, нажав пальцем. Нагрузка шприц необходимое количество суспензии клеток, соблюдая осторожность, чтобы избежать создания пузырьков воздуха. Вне шприц Затем следует чистить спиртом стереть внешние без каких-либо прилипшие клетки, которая поможет предотвратить создание экстракраниальных опухолей и роста (рис. 1А). Чтобы гарантировать, что соответствующие глубины инъекции достигается, используйте скальпель, чтобы сократить 3 мм от заостренный конец наконечника P20 pipetteman. В этом разделе наконечник может быть рассчитана для помещения в шприц и будет действовать ограничить инъекции глубину, и дополнительно обеспечить тир шприц иглой 3 мм от нижней части черепа. Место шприца перпендикулярно черепа и в отверстии ранее созданные, и медленно вводят клеточной суспензии (3μL подвеска должна быть введена в течение 1 минуты периода). Неуместными угол шприц вставки могут привести к внутрижелудочковой инъекции клеток и последующее распространение спинного (рис. 1В: Right) По окончании инъекции, оставить иглу на месте в течение другой минуты, затем медленно снимать (см. видео): эти шаги будут способствовать снижению Опухоль рефлюкс клетки.
- В качестве альтернативы без посторонней помощи или от руки подход к внутричерепной имплантации опухоли ячейка 5, можно использовать небольшие размеры стереотаксической животных (группа F схематических обзор), которые в целом способствует более последовательной инъекции месте, но за счет значительного количества процедурного времени. По нашему опыту, два хирургических сотрудники могут вводить до 60 мышей / час при использовании свободной руки подход, в то время как максимальная скорость впрыска с небольшой кадр стереотаксической животного составляет приблизительно 15 мышей / час. Процедурные целесообразности является важным фактором при введении большой серии мышей, а также помогает сократить время, в котором опухолевые клетки, для инъекций, остаются на льду.
- Чистая череп с 3% перекиси водорода и вытереть их насухо стерильной сухим ватным тампоном. Применить стерильный воска кости отверстие. Использование щипцов, рисовать кожу головы вместе над черепом и основных закрыть. Для оптимального лечения, кожа головы должна быть скреплены с дермой каждой стороны головы друг против друга (нижняя против нижней). Сшитые кожи головы должны быть очищены использованием Хлоргексидин раствор, и бупренорфин, то в ведении подкожных инъекций для послеоперационного обезболивания.
- Контроль всех мышей после операции пока они не станут амбулаторного и сохранить нормальную активность. Как правило, время восстановления составляет около 30 минут.
3. Биолюминесценция Мониторинг роста опухоли
- История вопроса. Биолюминесценция томография (BLI) основан на окислении люциферин [D-(-) -2 - (60-гидрокси-20-бензотиазолил)-thiazone-4-карбоновой кислоты] в присутствии кислорода и аденозинтрифосфат (АТФ). Эта реакция катализируется ферментом люциферазы, который преобразует химическую энергию в фотоны с вытекающим излучением света. В клетках человека могут быть модифицированы, чтобы выразить люциферазы (см. ниже), и только люциферазы, экспрессирующих клеток, способных излучать свет в присутствии субстрата люциферин. Существует минимальное свечение фона от животных хостов получавших люциферин, например, что есть очень благоприятные сигнал-шум для обнаружения люминесценции выбросов люциферазы модифицированных опухолевых клеток, что позволяет очень чувствительны мониторинга роста опухоли и реакции на лечение в естественных условиях. Более того, люциферазы и ее субстратом, люциферин, было показано, что не токсичен для клеток млекопитающих, и мы наблюдали никаких функциональных различий между клеток, экспрессирующих люциферазы по сравнению с соответствующим немодифицированных клеток. Люциферин легко проникает через клеточные мембраны и гематоэнцефалический барьер, после внутрибрюшинного (ф) или внутривенно (IV), инъекции в мышей, тем самым позволяя изображений каждый отсек, в котором люциферазы модифицированных клеток. Уровень излучения фотонов и спектр излучаемого света от люциферазы-модифицированные клетки достаточно проникнуть тканей мелких животных исследований, таких как мыши и крысы, и может быть обнаружена наружно при низкой освещенности камер. Неинвазивный характер биолюминесценции изображения позволяет повторять мониторинга роста опухоли и реакции на лечение в отдельных предметов животного.
- Имплантированное источников ячейка должна быть стабильно модифицирован для люциферазы светляков выражения. Такие источники ячейки могут быть куплены, или производятся в отдельных лабораторий, использующих лентивирус, которые были построены для конститутивной экспрессии люциферазы. Мы настоятельно рекомендуем использование клеток модифицированный люциферазы лентивирус кодирования, а не плазмиды, для обеспечения стабильной клеточной экспрессии люциферазы в живом организме, которая необходима для количественной визуализации свечения предоставлять точную указанием изменений в опухолевых бремя для отдельных предметов, животных, которые неоднократно отображаемого в ходе эксперимента.
- BLI мониторинга. Мы рекомендуем проводить количественные изображений биолюминесценции (qBLI) 1x-2x еженедельно, начиная с одной недели после инъекции опухолевых клеток. Наши qBLI проводится с использованием ИВИС Lumina изображений станции (суппорт науки о жизни), и наши результаты показывают, аналогичные данные получены при использовании ИВИС Lumina, ИВИС 150, или 200 изображений ИВИС станции. В процессе подготовки для работы с изображениями, мыши одновременно с наркозом кетамин / Ксилазин и администрируется люциферин (D-люциферин соли калия, 150 мг / кг, калибр науки о жизни) с помощью внутрибрюшинного введения мышам с отображаемого 12 минут после инъекции. Фармакокинетика люциферин показывают, что время между администКонцентрация люциферин и определение клеточной люминесценции должна быть в пределах 10-15 минут после инъекции люциферин, с целью получения максимального излучения люминесценции и наибольшей чувствительностью обнаружения. Период времени в течение выбранного интервала времени 10-15 минут должны быть сохранены в качестве постоянного среди животных, которые в образ. Крайне важно сохранять последовательность в промежуток времени между инъекцией люциферин и получения BLI чтениях. Интересующие регионы охватывает внутричерепного области сигнала определяются с помощью живой образ программного обеспечения (рис. 2), а общее photons/s/sr/cm2 (фотонов в секунду на стерадиан на сантиметр квадратный), отражаются (см. видео).
- Данные анализа. В то время как рост опухоли и терапии ответ контролируются в отдельных животных, мы настоятельно рекомендуем группами лечения не менее 8 для повышения статистической достоверности выводов относительно ответа опухоли, или отсутствие таковых, к терапии. Что касается представления результатов qBLI, люминесценция показаний превращаются в нормированные значения путем деления люминесценции каждой мыши с, полученной в ходе и после завершения лечебного режима, с соответствующей предварительной обработки максимального свечения чтение 6,7. Для анализа выживаемости, Каплан-Майера оценка 8 используется, и от которых кривые выживаемости генерируются, а медиана выживаемости значения определены. Различия между выживанием кривые сравнивали с помощью лог-рангового критерия 9.
- Восстановление мозг для последующего анализа обработанных и необработанных опухолей. По животное эвтаназии, мозг мыши должны быть быстро вырезали (см. видео), и либо помещен в формалин для последующего анализа опухолевых морфологии и иммуногистохимии, или должны быть установлены в октябре для образца замораживания.
4. Представитель Результаты
В примере, показанном на рисунке 3A, мышей, получавших инъекции внутричерепного опухолевых клеток наблюдали в течение внутричерепного люминесценции до последовательных средних значений люминесценции указанных прогрессивного роста опухоли, и в какое время терапия была начата (серая стрелка в начале дня 34: эрлотиниб вводят ежедневно по 150 мг / кг, пока требуется эвтаназия). Люминесценция значения для каждой мыши устанавливаются нормированные значения 1 на момент начала терапии, с последующим показания свечения для каждой мыши нормированная на ее окончательное значение изображений предварительной обработки. Как, например, мышь с окончательным предварительной обработки люминесценция чтение 2,0 х 10 7 фотон / сек в день 34,, люминесцентные увеличилось до 6,0 х 10 7 фотон / сек в день 38, будет иметь день 38 нормализованное значение люминесценции 3.0. Средняя нормированная биолюминесценции и соответствующие стандартные ошибки для контроля и лечения групп построены для каждой точки времени визуализации. В этом примере, значительная разница в средних нормированного люминесценции очевидно, в первой точке времени изображений после начала терапии (день 38), с той разницей, среднего люминесценции группы показывает дальнейшее увеличение в последующие моменты времени. В большинстве случаев противоопухолевой активностью терапии, о чем свидетельствует qBLI, сопровождается соответствующей существенной разницы в выживаемости (т. е. р <0,05), как в данном случае (рис. 3В). Панели 3C и 3D шоу смежных гематоксилином и эозином и анти-EGFR окрашенных срезах мозга мышей получены во время эвтаназии, после размещения резекции мозга в формалине и последующих парафино-вложение для секционирования.
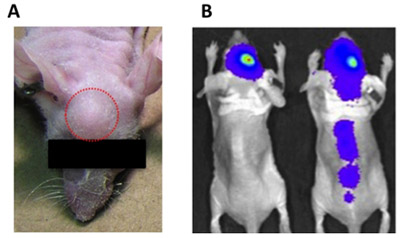
Рисунок 1. Показания внутричерепного ошибки инъекции. ) Экзофитных (экстракраниальных) рост опухоли (красный круг) может быть вызвано слишком большим объемом впрыска, остаточные клеточной суспензии прилагается к шприцу, или от снятия шприца слишком быстро после введения опухолевых клеток. Б) Потребители инъекционных опухолевых клеток в желудочки могут вызвать спинного распространение опухоли (мышь вправо), в отличие от правильно вводили опухолевые клетки, сигнал для которых остается локализованной в месте инъекции (курсор влево).
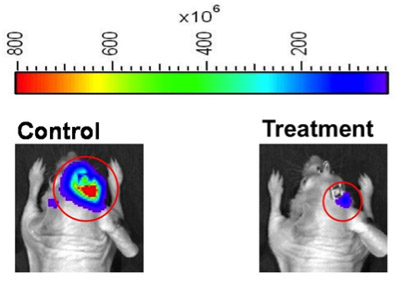
Рисунок 2. Тепло изображение карты представления интенсивности биолюминесценции для представителя мышей из контрольной (слева) и лечения (справа) группы эксперимент ответ терапии. Программное обеспечение Жизнь изображение может быть установлена для определения областей интереса (красные кружки), или инструмент операторы могут определить области интереса вручную. Для использования изображений, таких как эти для фигурного строительства, мы рекомендуем, чтобы прибор показывает оператору тепла изображений карт с использованием тех же биолюминесценции тепловая карта диапазон (верхняя часть рисунка), чтобы обеспечить наглядное представление о степени биолюминесценции разницы между животным предметам.
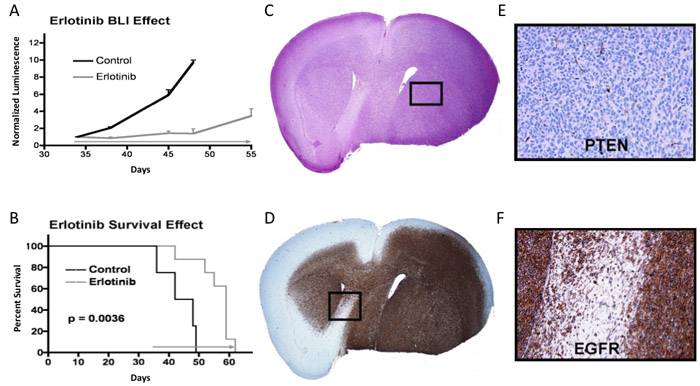
Рисунок 3. Биолюминесценции, выживание, и опухолевых тканей анализ эксперимента, в котором терапевтический ответ очевиден. ) Земельный означают показания биолюминесценции для контроля и мышей лечение группе, со стандартной ошибкой, указанной в каждой точке изображения. Б) Выживание же сюжет для мышей; р-величина, определяемая путем использования лог-рангового критерия 7. С), H & E окрашенные части мозга мышей с опухолью. D) EGFR окрашенных разделе. E и F) увеличениях указанных областях из панелей C и D, соответственно, с панелью E показывает отрицательную окрашивание на супрессоров опухолей PTEN белка.
Обсуждение
Ортотопическая (внутричерепное) опухоли головного мозга ксенотрансплантата учреждение обеспечивает соответствующее микроокружение 10 для моделирования рака ЦНС пройти тестирование на терапевтический эффект. Этот тип моделирования дополнительно предоставляет информацию о терапевтических доступ к мозгу и опухоли головного мозга, который имеет огромное значение для определения того, экспериментальные агент должен быть выдвинуты к клинической оценке исследовании у пациентов. Поскольку количество внутричерепных опухолей ксенотрансплантата не может быть измерен, например, путем суппорты, продольный мониторинг внутричерепного рост опухоли и реакции на лечение требует неинвазивной визуализации, с нашим опытом указывает биолюминесценции изображений как наиболее практичный подход для экспериментов, основная цель является оценка степени ответа опухоли на терапию. Когда результаты биолюминесценции визуализации в сочетании с животными анализа выживания субъекта, два набора данных обеспечивает мощный и надежный подход к оценке экспериментальных терапевтической эффективности.
Наконец, крайне важно, что внутричерепное ксенотрансплантаты опухоли головного мозга отлов животных усыпляют субъектов с целью оценки морфологических и молекулярных эффектов терапии, и для этого мы предпочитаем все резекции мозга во время эвтаназии, с сохранением мозга резекции для последующего анализа.
В то время как предыдущие презентации был сделан на конкретные исследования мозга опухолью, концепций, безусловно, generalizeable других человеческих раковых заболеваний, которые поддаются ортотопической моделирования у грызунов.
Раскрытие информации
Благодарности
Материалы
| Name | Company | Catalog Number | Comments |
| Disposable Scapels | Feather Safety Razor Co, Ltd. | 2975 | No.21 |
| Heating Pad | Dunlap | HP950 | |
| Gauze | Fisher Scientific | 22028563 | |
| Cotton Swabs | Fisher Scientific | 23-400-100 | |
| 2% Chlorhexidine | Fisher Scientific | NC9756995 | |
| 3% Hydrogen Peroxide | Fisher Scientific | H312P-4 | |
| 25g Needle | BD Biosciences | 305122 | |
| 10ul Hamilton Sharp Microsyringe | Hamilton Co | 20734 | |
| Skin Stapler and Staples | Stoelting Co. | 59020 | |
| Stereotaxic Frame | Stoelting Co. | 51725 | |
| Living Image Software |  Caliper Life Sciences Caliper Life Sciences | ||
| D-luciferin | Gold Biotechnology | LUCK-1G | Potassium Salt |
| Xenogen Lumina |  Caliper Life Sciences Caliper Life Sciences |
Ссылки
- Giannini, C., Sarkaria, J. N., Saito, A., Uhm, J. H., Galanis, E., Carlson, B. L., Schroeder, M. A., James, C. D. Patient Tumor EGFR and PDGFRA Gene Amplifications Retained in an Invasive Intracranial Xenograft Model of GBM. Neuro-Oncol. 7, 164-176 (2005).
- Ozawa, T., Wang, J., Hu, L. J., Bollen, A. W., Lamborn, K. R., Deen, D. F. Growth of human glioblastomas as xenografts in the brains of athymic rats. In Vivo. 1, 55-60 (2002).
- Hashizume, R., Ozawa, T., Dinca, E. B., Banerjee, A., Prados, M. D., James, C. D., Gupta, N. A human brainstem glioma xenograft model enabled for bioluminescence imaging. J Neurooncol. , (2009).
- Baia, G. S., Dinca, E. B., Ozawa, T., Kimura, E. T., McDermott, M. W., James, C. D., VandenBerg, S. R., Lal, A. An orthotopic skull base model of malignant meningioma. Brain Pathol. 2, 172-179 (2007).
- Ozawa, T., James, C. D., Van Meir, E. Human Brain Tumor Cell and Tumor Tissue Transplantation Models. CNS Cancer: Models, Markers, Prognostic Factors, Targets, and Therapeutic Approaches. , 147-162 (2009).
- Sarkaria, J. N., Yang, L., Grogan, P. T., Kitange, G. J., Carlson, B. L., Schroeder, M. A., Galanis, E., Giannini, C., Wu, W., Dinca, E. B., James, C. D. Identification of Molecular Characteristics Correlated with Glioblastoma Sensitivity to EGFR Kinase Inhibition Through Use of an Intracranial Xenograft Test Panel. Mol. Cancer Ther. 6, 1167-1174 (2007).
- Dinca, E. B., Sarkaria, J. N., Schroeder, M. A., Carlson, B. L., Voicu, R., Gupta, N., Berger, M. S., James, C. D. Bioluminescence Monitoring of Intracranial Glioblastoma Xenograft Response to Primary and Salvage Temozolomide Therapy. J. Neurosurg. 107, 610-616 (2007).
- Kaplan, E. L., Meier, P. Non-parametric estimation from incomplete observations. J. Am. Stat. Assoc. 53, 457-481 (1958).
- Peto, R., Peto, J. Asymptotically efficient rank invariant procedures. J. R. Stat. Soc. Ser. A. Stat. Soc. 135, 185-207 (1972).
- Camphausen, K., Purow, B., Sproull, M., Scott, T., Ozawa, T., Deen, D. F., Tofilon, P. J. Influence of in vivo growth on human glioma cell line gene expression: convergent profiles under orthotopic conditions. Proc. Natl. Acad. Sci. U. S. A.. 102, 8287-8292 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены