Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dissection d'un oeil de la souris pour un mont entiers de l'épithélium pigmentaire rétinien
Dans cet article
Résumé
Une démonstration formelle de la dissection d'un oeil de la souris, résultant en une monture ensemble de l'épithélium pigmentaire rétinien.
Résumé
L'épithélium pigmentaire rétinien (EPR) se trouve à l'arrière de l'œil chez les mammifères, juste sous la rétine neurale, qui contient les photorécepteurs (cônes et bâtonnets). L'EPR est une monocouche de cellules cubiques pigmentaires et associés étroitement avec la rétine neurale juste au dessus. Cette association fait l'EPR de grand intérêt pour les chercheurs qui étudient les maladies rétiniennes. L'EPR est aussi le site d'un essai in vivo d'homologie dirigée réparation de l'ADN, le test p ONU. L'oeil de la souris est particulièrement difficile de disséquer en raison de sa petite taille (environ 3,5 mm de diamètre) et sa forme sphérique. Cet article montre en détail une procédure pour la dissection de l'œil entraînant une monture ensemble de l'EPR. Dans cette procédure, nous montrons comment travailler avec, plutôt que contre, la structure sphérique de l'œil. En bref, le tissu conjonctif, des muscles et du nerf optique sont retirés du fond de l'œil. Ensuite, la cornée et le cristallin sont supprimés. Ensuite, coupures stratégiques sont prises qui aboutissent à un aplatissement significatif du tissu restant. Enfin, la rétine neurale est délicatement soulevé, révélant une RPE intacte, ce qui est encore attaché à la choroïde sous-jacente et la sclère. Ce support entière peut être utilisé pour effectuer le test p ONU ou de l'évaluation immunohistochimie ou immunofluorescence du tissu EPR.
Protocole
1. Enlever les tissus étrangères de l'extérieur de l'œil
- Verser PBS 1X dans le couvercle d'une boîte de 35mm. Le niveau doit être juste en dessous de la lèvre du couvercle.
- En utilisant des pinces droites, des yeux de transfert (s) du tube de stockage pour le plat de 35mm. Les yeux sont immergés dans du PBS pour deux raisons: 1. Les tissus étrangers seront "flotter" loin de l'œil ainsi vous pouvez voir et de les retirer facilement, et 2. Pendant la dissection, l'œil va naturellement de maintenir sa forme sphérique tout en suspension, vous permettant de travailler avec cette forme plutôt que contre elle.
- L'utilisation des deux paires de pinces à angle (45 ° et 15 °), retirer délicatement le muscle et le tissu conjonctif bien que possible, en tirant le tissu contre le grain (c'est à dire vers la cornée). Certains tissus conjonctifs restera. Un effort devrait être fait pour presser le globe oculaire aussi peu que possible.
- Echangez votre pince à 15 ° pour ciseaux printemps. Tout en tenant l'œil stable avec 45 pinces °, utiliser les ciseaux pour couper le printemps musculaires restantes et des tissus conjonctifs, ainsi que le nerf optique. * Astuce: Utilisez le bord extérieur de la paire de ciseaux pour pousser le tissu contre le grain (vers le fossé cornéo-scléral) et puis découper. Continuez jusqu'à ce que tous les tissus étrangers a été retiré de l'œil.
2. Retirez la cornée et le cristallin
- Avec la cornée vers le haut, utilisez la pince pour pincer ° 45 jusqu'à un petit pli dans le centre de la cornée.
- En utilisant les ciseaux à ressort, faire une petite incision à la base du lambeau. Lâchez le rabat.
- Tenir les yeux encore avec votre pince, insérez la lame inférieure de ciseaux dans et perpendiculaire à l'incision et faire une coupe vers le fossé cornéo-scléral. Essayez de garder votre lame inférieure sous l'iris afin que les deux de la cornée et l'iris sont coupés. Ne pas couper tout le chemin à la fracture cornéo-scléral. Gardez les ciseaux insérés dans les yeux.
- En utilisant votre pince ° 45, soigneusement tourner de l'œil afin que vos ciseaux sont parallèles à la fracture cornéo-scléral et de faire une petite coupure. Lentement tourner le · Oeil 360, faisant de petites incisions sur tout le pourtour. Encore une fois, essayer de garder la lame inférieure des ciseaux à ressort sous l'iris afin que les deux l'iris et la cornée sont coupés. Soulevez l'iris et la cornée loin du reste de l'œil et les jeter.
- Inclinez l'œil sur son côté et appuyez doucement sur la moitié postérieure de l'œil, ce qui oblige le cristallin à. Jeter de la lentille. L'intérieur de l'œilleton restante est bordée par la rétine neurale, ce qui devrait look lisse et opaque.
3. Trimestre de l'œilleton résultant, résultant en un 4 - "pétales", fleur-comme la structure
- L'œil doit être positionné de telle sorte que l'ouverture de l'œilleton est perpendiculaire à votre corps. Utilisez votre pince ° 45 à la régulière et la position de l'œilleton.
- Tenir vos ciseaux à ressort en face de vous afin qu'ils soient perpendiculaires à votre corps, insérer la lame inférieure des ciseaux à ressort dans le bord supérieur de la coupe à yeux ouverts. En utilisant votre pince à 45 °, aligner soigneusement la tasse oeil de sorte qu'un seul, coupe droite peut être faite de la fracture cornéo-scléral vers la tête du nerf optique. Toutes les coupes doivent être perpendiculaires à la fracture cornéo-scléral et sauf indication contraire, doit aller au plus près à la tête du nerf optique que possible sans couper dedans.
- Tournez l'œilleton de 180 °, en maintenant sa perpendicularité avec votre corps. Utiliser une technique à l'étape 3.2 pour faire une coupe perpendiculaire secondes.
- Tournez l'œilleton et répéter la technique décrite au paragraphe 3.2 de faire deux coupes plus. Les quatre coupes devraient être aussi proche de 90 ° que possible. Gardez à l'esprit que l'œil n'est pas parfaitement sphérique il y aura donc une certaine variabilité.
4. Couper chacun des quatre «pétales» de moitié, résultant en une à huit pétales de fleur-comme la structure
- Transfert l'œilleton quartiers de l'antenne de 35mm sur une lame propre. Avec l'œilleton vers le haut, scoop dessous avec les 45 pince °. Soigneusement le sortir du liquide et le placer sur une lame propre.
- L'utilisation des deux paires de pinces à angle, ouvrir doucement sur l'oeil, avec la rétine neurale vers le haut. NE PAS RETIRER LA RÉTINE NEURONES-il aide l'œil maintenir certaines de sa forme sphérique de sorte que vous ne travaillez pas contre elle. Elle protège également l'EPR d'être accidentellement endommagés dans les procédures suivantes.
- Tournez le glisser jusqu'à l'un des pétales est perpendiculaire à votre corps.
- Utilisez votre pince à 15 °, délicatement attraper au coin de la pétale. Le coin du pétale doit être cornée, rétine neurale pas ou RPE. Soulevez délicatement sur le coin, lui permettant de conserver sa courbure.
- Insérez la lame en bas de votre paire de ciseaux à ressort entre les pétales et la diapositive. Alignez vos ciseaux de telle sorte qu'une seule, droite, coupe perpendiculaire peut être faite de la fracture cornéo-scléral vers la tête du nerf optique. Coupez le plus près de la tête du nerf optique que withou possiblest de coupe dedans. Lâchez le pétale, lui permettant de se coucher sur la diapositive.
- Tournez la lame à 90 °, de sorte que le pétale suivant est perpendiculaire à votre corps. Répétez l'étape 4.5.
- Répétez les étapes 4,5 et 4,6 fois plus. La structure résultante devrait ressembler à une fleur à huit pétales.
5. Retirez la rétine neurale
- Pipeter 100 à 200 ul de PBS 1X sur le spécimen. Cela permettra d'éviter la rétine neurale de coller comme vous le retirer de l'EPR.
- Typiquement la rétine neurale est lâchement attaché à l'EPR. Toutefois, il ne prendra la pratique et l'habileté de ne supprimer que la rétine neurale et non l'EPR. Saisir délicatement un pétale de la rétine neuronale avec une paire de pince à angle tout en stabilisant (maintenant) le reste de l'œil avec l'autre paire de pince coudée. Tirez sur la rétine neurale loin du reste de l'œil. Continuez cette procédure jusqu'à ce que la rétine entière de neurones a été supprimée. * Astuce: coller le bout de votre pince à 15 ° dans la tête du nerf optique d'ancrer l'œil. Ensuite, utilisez la pince à 45 ° pour balayer sous la rétine neuronale et l'enlever et de loin. Il est généralement préférable de soulever la rétine neurale de la tête du nerf optique vers le fossé cornéo-scléral. Soyez sûr de détacher les restes lâche de l'iris. L'iris est assez collante et peut par ailleurs se coincer à l'EPR.
- Rincer l'éprouvette avec du PBS 1X. Pipeter 100 à 200 ul de PBS 1X dans l'échantillon et le sucer sauvegarder. Jeter le PBS. Répéter au besoin pour enlever la poussière et les débris.
6. Mont-vous spécimen (s) sur une lame
- Pipeter 80 à 90 uL de glycérol 90% sur une nouvelle diapositive dans une forme rectangulaire. Utilisez le côté de la pointe de la pipette pour faire une même frottis rectangulaire de glycérol. (Ceci est la procédure à suivre pour le montage de deux EPR sur une diapositive.)
- Insérez le bras inférieur de 15 ° sous une pince le spécimen. Soulevez doucement le spécimen de la lame de dissection.
- Abaissez doucement le spécimen dans la glycérine. Doucement bouger la pince que vous les sortez de sous le spécimen.
- Répétez les étapes 6.1 à 6.3 pour l'autre spécimen.
- Tourner la lame de sorte que le côté le plus long est perpendiculaire à votre corps. Tenez votre couvercle en verre à un angle de 45 ° à la diapositive de sorte qu'il est de toucher la lame. Déplacez-le vers le frottis de glycérol jusqu'à ce qu'ils touchent. Maintenir le contact entre le couvercle en verre et faire glisser, déplacer lentement le couvercle en verre loin de la diffamation, vers le bord de la diapositive. Alignez les côtés de la lame et le couvercle en verre afin qu'elles soient parallèles. Tenez les coins de la vitre couvercle entre le pouce et l'index.
- Ramassez la pince 15 ° dans l'autre main. Berceau de la partie supérieure (gratuit) bord du verre de couverture dans le creux du bras. Très lentement, baissez le couvercle en verre. Lorsqu'un contact est établi entre le couvercle en verre et le glycérol, s'arrêter et attendre pour le glycérol pour migrer. Répétez cette descente et attendre les monts RPE entiers sont entièrement couverts. Ceci, pour éviter le glycérol très visqueux de la capture de bulles d'air. NE PAS pousser sur la lamelle - le glycérol sera squeeze out de dessous, ce qui rend l'adhérence très faible.
- Avec vernis à ongles transparent, peinture sur le périmètre où le couvercle en verre et faites glisser rencontrer.
- Placer la lame sur le dessus d'un rack vide à sec.
7. Les résultats représentatifs:
Le résultat de cette procédure doit être une structure qui ressemble à une fleur et devrait être assez symétrique.

Figure 1. Whole EPR de montage d'une souris de type sauvage C67Bl/6J. RPE du noir ou des animaux agouti doit être de couleur brun foncé et doit avoir une surface lisse. Il est normal de constater des ondulations dans la topographie des pétales. La pigmentation sur tout spécimen donnent peut-être quelque peu variable, en raison de la densité variable de la pigmentation des deux EPR et la choroïde sous-jacente. Les flèches blanches point à hypopigmentées «canaux» - ce qui est normal et est dû à la vascularisation sous-jacente de l'œil. Flèche bleue à des dommages physiques à la fois à l'EPR et la choroïde sous-jacente.

Figure 2. Whole EPR de montage d'une souris diluer. Spécimens récoltés à partir d'animaux peut diluer la couleur va du presque transparent au café au lait et tout spécimen ci est comme avoir une variabilité au sein, avait indiqué dans les cercles noirs ici. En général, les RPE récoltés à partir des animaux plus jeunes sont plus légers et ceux récoltés provenant d'animaux âgés sont plus sombres. Les flèches noires indiquent certains de la vascularisation sous-jacente, qui apparaît hypopigmentées.
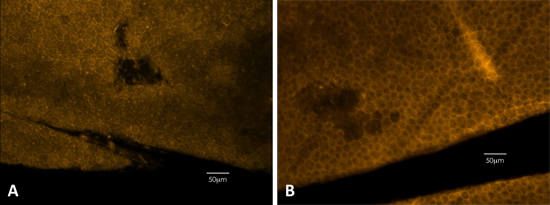
Figure 3. Phalloïdine coloration peut être utilisée pour détecter des dommages physiques à l'EPR. Coloration phalloïdine expose clairement les membranes cellulaires, montrant la forme hexagonale de l'épithélium. (A) Exemple d'une souris noire. (B) Exemple d'une souris diluer.
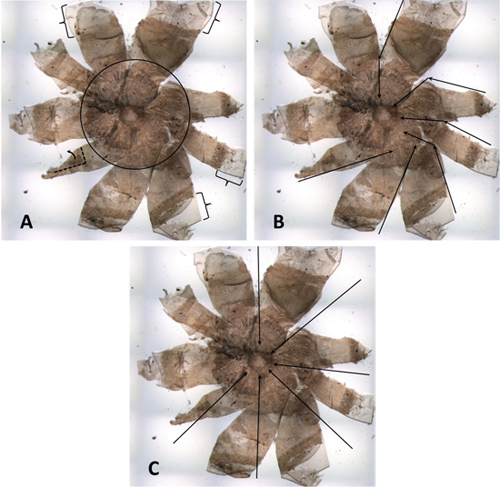
Figure 4. Un EPR mal disséqué d'une souris diluer. (A) Les parenthèses indiquent les marges de la cornée qui sont trop larges, ce qui peut provoquer le flambement et / ou de pliage. Dans le cercle noir que vous pouvez voir des quantités excessives de tissu étranger qui n'ont pas été retirés de l'arrière de l'œil. Ils sont particulièrement évidentes car l'échantillon est d'un animal diluer. Le pétale en bas à gauche est partiellement repliée. (B) Ce support a toute l'apparence d'un moulinet. Les flèches noires indiquent certaines des réductions qui ont été faites. Beaucoup de coupures de la fracture cornéo-scléral vers la tête du nerf optique ne sont pas en conformité avec le diamètre. (C) Les flèches noires indiquent la manière dont les coupes devraient avoir été faites, en ligne avec le diamètre et la perpendiculaire à la tangente.
Discussion
L'EPR est le site de l'essai p de l'ONU, un essai in vivo d'homologie dirigée réparation. Le dosage de l'ONU p a été utilisé pour étudier les effets des dommages d'ADN différentes 1,2 et de signalisation des dommages de l'ADN et les gènes de réparation 3,4,5 sur la fréquence d'homologie dirigée réparation. Ce test est très sensible, en détectant une seule cellule événements sur l'EPR 1. I...
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par l'Institut national des sciences de la santé environnementale [K22ES012264 d'AJRB] et une American Cancer Society InstitutionalResearch Grant [ACS-GRI-00-173-04] pilotes projectaward [à AJRB]. Nous remercions également les membres du laboratoire de l'évêque pour la lecture critique du manuscrit et des commentaires sur la vidéo et Adam Brown, en particulier, pour l'exemple de quoi ne pas faire. Nous remercions le Dr Donald McEwen, de l'Institut Greehey enfants recherche sur le cancer pour nous avoir permis l'utilisation de son champ de dissection / vidéo de la caméra set-up pour le tournage de la vidéo de dissection. Nous remercions Daron Brown à Corte Instruments pour l'affûtage et la réparation de nos outils de microdissection.
matériels
| Name | Company | Catalog Number | Comments |
| straight forceps | Roboz Surgical Instruments Co. | RS-4903 | tip: .08 x .04 mm material: INOX |
| 45° forceps | Roboz Surgical Instruments Co. | RS-5005 | tip: .05 x.01 mm material: INOX |
| 15° "up" forceps | Roboz Surgical Instruments Co. | RS-5045A | tip: .1 x.06 mm material: INOX |
| spring scissors | Roboz Surgical Instruments Co. | RS-5604 | comb. tip width 0.3mm cutting edge length 3mm material: stainless steel |
| binocular dissecting microscope | Carl Zeiss, Inc. | Discovery V.8 | use reflected light source |
| phalloidin | Invitrogen | A22283 | Alexa Fluor 546 |
Références
- Bishop, A. J., Kosaras, B., Sidman, R. L., Scheistl, R. H. Benzo(a)pyrene andX-rays induce reversions of the pink-eyed unstable mutation in the retinal pigmentepithelium of mice. Mutat. Res.. 457, 31-31 (2000).
- Reliene, R. H. l. a. v. a. c. o. v. e., Mahadevan, A., Baird, B., M, W., Schiestl, R. H. Diesel exhaust particles cause increased levels of DNA deletions after transplacental exposure in mice. Mutat. Res. 570, 245-2452 (2005).
- Bishop, A. J., Barlow, C., Wynshaw-Boris, A. J., Scheistl, R. H. Atm deficiency causes increased frequency of intrachromosomal homologous recombination in mice. Cancer Res. 60, 395-399 (2000).
- Brown, A. D., Claybon, A. B., Bishop, A. J. Mouse WRN helicase domain is not required for spontaneous homologous recombination-mediated DNA deletion. J. Nucleic Acids. , (2010).
- Claybon, A., Karia, B., Bruce, C., Bishop, A. J. PARP1 suppresses homologous recombination events in mice in vivo. Nucleic Acids Res. , (2010).
- Bishop, A. J. p53-, and Gadd45a-deficient mice show an increased frequency ofhomologous recombination at different stages during development. Cancer Res. 63, 5335-5343 (2003).
- Bodenstein, L., Sidman, R. L. Growth and development of the mouse retinalpigment epithelium. Part I. Cell and tissue morphometrics and topography of mitoticactivity. Dev Biol. 121, 192-204 (1987).
- Burke, J. M. Epithelial phenotype and the RPE: is the answer blowing in the Wnt?. Prog Retin. Eye Res. 27, 579-595 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon