Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Препарирование Мышь Око за полного горе пигментный эпителий сетчатки
В этой статье
Резюме
Формальных демонстрации вскрытия мыши глаз, в результате чего целые горы пигментный эпителий сетчатки.
Аннотация
Пигментный эпителий сетчатки (ПЭС), лежит в задней части глаза у млекопитающих, как раз под нейронных сетчатку, которая содержит фоторецепторы (палочки и колбочки). РПЭ является монослой пигментированные кубический клеток и в тесном сотрудничестве с партнерами нейронных сетчатки прямо над ним. Эта связь позволяет НПП представляет большой интерес для исследователей, изучающих заболеваний сетчатки. НПП также сайт в естественных условиях анализа гомологии направленной репарации ДНК, анализ р ед. Мышь глаз особенно трудно анализировать из-за своего небольшого размера (около 3,5 мм в диаметре) и его сферическую форму. В этой статье показано подробно процедура вскрытия глаз в результате чего целые горы ППД. В этой процедуре, мы покажем, как работать, а не против, сферические структуры глаза. Короче говоря, соединительной ткани, мышц и зрительного нерва, удаляются из задней части глаза. Затем, роговица и хрусталик удаляют. Далее, сокращения стратегических сделаны, что приводит к значительным уплощение остальные ткани. Наконец, нейронные сетчатки плавно взлетел, открывая нетронутыми ПЭС, которая по-прежнему присоединены к основному сосудистой оболочки и склеры. Вся эта установка может быть использована для выполнения анализа р ООН или для иммуногистохимии и иммунофлуоресценции оценки НПП ткани.
протокол
1. Удалить посторонние ткани вне глаз
- Налейте 1X PBS в крышку 35мм блюдо. Уровень должен быть чуть ниже губы крышкой.
- Использование прямых щипцов, передача глаз (а) из хранилища трубки 35 мм блюдо. Глаза погружены в PBS по двум причинам: 1. Посторонних тканей будет "плавать" от глаз, чтобы вы могли увидеть и удалить их с легкостью, и 2. Во время вскрытия, глаз будет естественно сохранить свою сферическую форму в то время как во взвешенном состоянии, что позволяет работать с этой формой, а не против него.
- Использование обе пары угловых щипцы (45 ° и 15 °), осторожно удалить как можно больше мышц и соединительной ткани, насколько это возможно, потянув ткани против зерна (то есть в сторону роговицы). Некоторые соединительной ткани останется. Усилия должны быть направлены на сжатие глазного яблока как можно меньше.
- Торговля ваши 15 ° щипцы для весны ножницами. Удерживая глаз устойчивая с 45 пинцетов °, использовать весной ножницы, чтобы вырезать оставшихся мышц и соединительной ткани, а также зрительного нерва. * Совет: Использование внешнего края ножницами, чтобы подтолкнуть ткани против зерна (в сторону Corneo-склеры деление), а затем отделкой. Продолжайте, пока все посторонние ткань была удалена из глаза.
2. Удалить роговицы и хрусталика
- С роговицы вверх, использование щипцов 45 ° до щепотку небольшую раз в центре роговицы.
- Использование весной ножницами, сделать небольшой надрез в основании лоскута. Отпусти лоскут.
- Холдинг глаза все еще с щипцы, вставьте нижнюю ножниц лезвие в и перпендикулярно разрез и сделать разрез на Corneo-склеры разрыва. Старайтесь, чтобы нижняя лопасть под диафрагмой, так что и роговицы и радужной оболочки глаза режутся. Ничего не вырезано все пути к Corneo-склеры разрыва. Держите ножницы вставляется в глаз.
- Использование щипцов 45 °, осторожно поверните глаза так, чтобы Ваши ножницы параллельно Corneo-склеры разделить и сделать небольшой надрез. Медленно вращать · Eye 360, что делает небольшие надрезы по всему периметру. Опять же, стараюсь держать нижнюю лезвие ножниц ваш весной под диафрагмой, так что и радужной оболочки и роговицы срезаются. Поднимите радужной оболочки и роговицы от остальной части глаза и отменить их.
- Tilt глаза на свою сторону и давить мягко на задней половины глаза, заставляя линзу из. Откажитесь от объектива. Внутри оставшихся наглазник выстлана нейронных сетчатки, которая должна выглядеть гладкой и непрозрачным.
3. Четверть результате наглазник, в результате чего 4 - "лепестками", цветок-подобную структуру
- Глаза должны быть расположены так, что открытие наглазник перпендикулярно к телу. Используйте свой 45 пинцетов ° до устойчивой и положение наглазник.
- Холдинг ваши ножницы Весной перед вами так они перпендикулярны к телу, вставьте нижнюю лезвие ножниц ваш весной в верхний край в открытом тигле глаз. Использование щипцов 45 °, тщательно выровнять глаза чашки так, чтобы один, прямой разрез может быть сделан из Corneo-склеры разделить сторону зрительного нерва. Все сокращения должны быть перпендикулярны Corneo-склеры разделяй и, если не указано, должны идти как можно ближе к головке зрительного нерва возможно, не сокращая в нее.
- Вращайте наглазник 180 °, сохраняя перпендикулярность с вашим телом. Использование техники в п. 3.2, чтобы сделать второй разрез перпендикулярно.
- Вращайте наглазник и повторить методике, описанной в 3.2, чтобы сделать еще два сокращения. Все четыре сокращения должны быть как можно ближе к 90 ° друг от друга, насколько возможно. Имейте в виду, что глаз не идеально сферической, так что будут какие-то изменчивости.
4. Разрежьте каждый из четырех «лепестков» в два раза, в результате чего восемь лепестков цветка-подобную структуру
- Передача расквартированы наглазник от 35мм блюдо на чистую слайда. С наглазник вверх, совок под ним с 45 пинцетов °. Аккуратно выньте его из жидкости и поместите его на чистую слайда.
- Использование обе пары угловых пинцетом, осторожно открываются глаза, с нейронных сетчатки вверх. НЕ СНИМАТЬ НЕЙРОННЫХ сетчатки помогает глазу поддерживать некоторые из его сферической формы, чтобы вы не работаете с ним. Она также защищает от НПП случайно поврежден в следующих процедурах.
- Вращайте слайд, пока один из лепестков перпендикулярно к телу.
- Используйте свой 15 пинцетов °, мягко захватите угол лепестка. Угол лепестка должно быть роговицы, не нейронных сетчатки или ППД. Поднимите на углу аккуратно, что позволяет ему сохранять свою кривизну.
- Вставьте нижнюю лезвие вашей весны ножниц между лепестком и слайдов. Выстроить ваших ножниц так, что один, прямой, перпендикулярной разрез может быть сделан из Corneo-склеры разделить сторону зрительного нерва. Вырезать как можно ближе к головке зрительного нерва возможно, не сокращая в нее. Отпустилепесток, позволяя ему лечь на слайде.
- Вращайте слайд 90 °, так что следующий лепесток перпендикулярно к телу. Повторите шаг 4.5.
- Повторите шаги 4,5 и 4,6 раза больше. В результате должна выглядеть структура восьми лепестков цветка.
5. Удалить нейронных сетчатки
- Внесите 100-200 мкл 1X PBS на образце. Это позволит предотвратить нервный сетчатку от прилипания, как вы очистите это прочь ППД.
- Обычно нейронная сетчатка косвенное отношение к НПП. Однако, это требует практики и навыков, чтобы удалить только нейронные сетчатку и не ППД. Аккуратно понять лепесток нейронных сетчатки с одной парой угловых щипцов при стабилизации (удерживая) Остальные глаз с другой пары угловых щипцами. Вытяните нейронных сетчатку от остальной части глаза. Продолжайте эту процедуру, пока все нейронные сетчатки была удалена. * Совет: палка кончиком 15 ° щипцов в головке зрительного нерва на якорь глаз. Затем с помощью щипцов 45 ° до подмести под нейронных сетчатки и снимите ее с телефона и на выезде. Как правило, лучше снять нервный сетчатку от зрительного нерва к Corneo-склеры разрыва. Будьте уверены, чтобы вырваться любые свободные остатки диафрагмы. Радужная оболочка довольно липким и в противном случае могут застрять в ППД.
- Промыть образец с 1X PBS. Внесите 100-200 мкл 1X PBS в образец и сосать его обратно вверх. Отменить PBS. При необходимости повторите для удаления пыли и мусора.
6. Горе вам экземпляр (ы) на слайде
- Внесите 80-90 мкл 90% глицерина на новый слайд в прямоугольной форме. Используйте стороне кончика пипетки, чтобы даже, прямоугольные мазка глицерина. (Это процедура для установки двух ПЭС на одном слайде.)
- Вставьте нижний рычаг на 15 ° щипцов под образцом. Аккуратно поднимите образца от вскрытия слайда.
- Медленно опустите образца в глицерин. Аккуратно шевелить щипцов, как вы вытащите их из-под образца.
- Повторите шаги 6.1-6.3 для другого образца.
- Вращайте слайд так, чтобы длинная сторона перпендикулярна к своему телу. Держите крышку стекла при углом 45 ° к слайд так, чтобы она трогательно слайда. Переместить его в сторону глицерина мазка, пока они не коснуться. Поддержание контактов между стеклянной крышкой и слайд, медленно перемещайте покровного стекла от мазка, к краю слайда. Выстроить длинных сторон слайдов и покровного стекла, чтобы они были параллельны. Держите углам покровного стекла между большим и указательным пальцами.
- Возьмите 15 пинцетов ° в другую руку. Колыбель верхнего (свободного) края покровного стекла на сгибе руки. Очень медленно, нижняя крышка стекла. Когда контакт между стеклянной крышкой и глицерина, остановитесь и подождите, глицерин для миграции. Повторите это снижение и ждать, пока НПП тотальных полностью покрываются. Это сделано для предотвращения вязкие глицерина из захвата пузырьков воздуха. НЕ нажимайте на покровного стекла - глицерин будет выдавить из-под нее, что делает очень плохой адгезией.
- С ясными лак для ногтей, краски по периметру, где стеклянные панели и сдвиньте с концами.
- Место слайд в верхней части пустой стойке, чтобы высохнуть.
7. Представитель Результаты:
Результатом этой процедуры должна быть структура, которая выглядит как цветок, и должны быть достаточно симметрично.

Рисунок 1. Всего НПП смонтировать мыши дикого типа C67Bl/6J. РПЭ из черного или агути животные должны быть темно-коричневого цвета и иметь гладкую поверхность. Это нормально замечать неровности в топографии лепестков. Пигментация на любом дать образец может быть несколько переменных, из-за переменной плотности пигментации и ПЭС и сосудистой оболочки основной. Белые стрелки указывают на гипопигментированные "каналов" - это нормально и связано с основной сосудистой оболочки глаза. Синяя стрелка указывает на физический ущерб как ПЭС и сосудистой оболочки основной.

Рисунок 2. Всего НПП смонтировать разбавленный мыши. Образцы собраны из разбавленных животных может варьироваться по цвету от почти прозрачного до кофе с молоком и любой образец хотели бы иметь изменчивость в пределах этого, указанные в черные кружки здесь. В общем, НПП собран из молодых животных легче и тех, собранных из старых животных темнее. Черные стрелки указывают некоторые из основных сосудистой сети, которая появляется гипопигментированные.
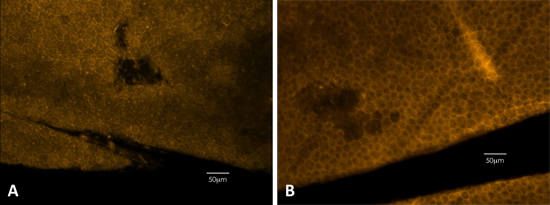
Рисунок 3. Фаллоидином окрашивание может быть использован для обнаружения физических повреждений ППД. Фаллоидином окрашивания четко определяет ячейкумембран, показывая гексагональную форму эпителия. () Пример из черной мыши. (B) Пример из разбавленного мыши.
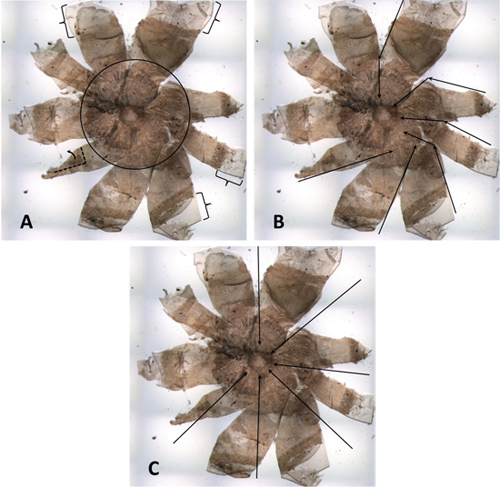
Рисунок 4. Слабо расчлененные РПЭ из разбавленного мыши. () Скобки указывают на полях роговицы, которые являются слишком широким, что может привести к потере устойчивости и / или складные. В черный круг, который вы можете видеть чрезмерное количество посторонних тканей, которые не были удалены из задней части глаза. Они особенно очевидна, так как образец из разбавленного животного. Лепестка в левом нижнем углу частично загибают. (B) Вся эта гора имеет вид вертушки. Черные стрелки указывают некоторые сокращения, которые были сделаны. Многие из порезы от Corneo-склеры разделить на зрительного нерва, не в соответствии с диаметром. (C) Черные стрелки показывают, как сокращение должно было быть принято в соответствии с диаметром и перпендикулярно касательной.
Обсуждение
РПЭ является местом р ООН анализа, в естественных условиях анализа гомологии направленного ремонта. Анализ р ООН была использована для исследования влияния различных повреждений ДНК и ДНК 1,2 сигнализации повреждения и ремонт генов 3,4,5 от частоты ?...
Раскрытие информации
Благодарности
Работа выполнена при поддержке Национального института гигиены окружающей среды наук [K22ES012264 к AJRB] и Американского онкологического общества InstitutionalResearch Грант [ACS-IRG-00-173-04] пилот projectaward [к AJRB]. Мы также благодарим членов лаборатории епископа для критическое прочтение рукописи и замечания по видео-и Адам Браун в частности, для примера того, что не надо делать. Мы благодарим д-р Дональд McEwen исследования рака Greehey Детский Института позволяет нам использовать его рассекает сферу / видео настройки камеры для съемки вскрытия видео. Мы благодарим Дарон Брауна в Корте Инструменты для заточки и ремонта наши инструменты микродиссекции.
Материалы
| Name | Company | Catalog Number | Comments |
| straight forceps | Roboz Surgical Instruments Co. | RS-4903 | tip: .08 x .04 mm material: INOX |
| 45° forceps | Roboz Surgical Instruments Co. | RS-5005 | tip: .05 x.01 mm material: INOX |
| 15° "up" forceps | Roboz Surgical Instruments Co. | RS-5045A | tip: .1 x.06 mm material: INOX |
| spring scissors | Roboz Surgical Instruments Co. | RS-5604 | comb. tip width 0.3mm cutting edge length 3mm material: stainless steel |
| binocular dissecting microscope | Carl Zeiss, Inc. | Discovery V.8 | use reflected light source |
| phalloidin | Invitrogen | A22283 | Alexa Fluor 546 |
Ссылки
- Bishop, A. J., Kosaras, B., Sidman, R. L., Scheistl, R. H. Benzo(a)pyrene andX-rays induce reversions of the pink-eyed unstable mutation in the retinal pigmentepithelium of mice. Mutat. Res.. 457, 31-31 (2000).
- Reliene, R. H. l. a. v. a. c. o. v. e., Mahadevan, A., Baird, B., M, W., Schiestl, R. H. Diesel exhaust particles cause increased levels of DNA deletions after transplacental exposure in mice. Mutat. Res. 570, 245-2452 (2005).
- Bishop, A. J., Barlow, C., Wynshaw-Boris, A. J., Scheistl, R. H. Atm deficiency causes increased frequency of intrachromosomal homologous recombination in mice. Cancer Res. 60, 395-399 (2000).
- Brown, A. D., Claybon, A. B., Bishop, A. J. Mouse WRN helicase domain is not required for spontaneous homologous recombination-mediated DNA deletion. J. Nucleic Acids. , (2010).
- Claybon, A., Karia, B., Bruce, C., Bishop, A. J. PARP1 suppresses homologous recombination events in mice in vivo. Nucleic Acids Res. , (2010).
- Bishop, A. J. p53-, and Gadd45a-deficient mice show an increased frequency ofhomologous recombination at different stages during development. Cancer Res. 63, 5335-5343 (2003).
- Bodenstein, L., Sidman, R. L. Growth and development of the mouse retinalpigment epithelium. Part I. Cell and tissue morphometrics and topography of mitoticactivity. Dev Biol. 121, 192-204 (1987).
- Burke, J. M. Epithelial phenotype and the RPE: is the answer blowing in the Wnt?. Prog Retin. Eye Res. 27, 579-595 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены