È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Dissezione di un occhio mouse per un monte intero di dell'epitelio pigmentato retinico
In questo articolo
Riepilogo
Una dimostrazione formale della dissezione di un occhio del mouse, per un monte di tutto l'epitelio pigmentato retinico.
Abstract
L'epitelio pigmentato retinico (RPE) si trova nella parte posteriore dell'occhio dei mammiferi, appena sotto la retina neurale, che contiene i fotorecettori (coni e bastoncelli). La RPE è un monostrato di cellule pigmentate cuboidali e associa a stretto contatto con la retina neurale sopra di esso. Questa associazione fa la RPE di grande interesse per i ricercatori che studiano le malattie della retina. La RPE è anche il luogo di un test in vivo di omologia-diretto di riparazione del DNA, il test p Nazioni Unite. L'occhio del mouse è particolarmente difficile da analizzare per le sue ridotte dimensioni (circa 3,5 millimetri di diametro) e la sua forma sferica. Questo articolo illustra in dettaglio una procedura per la dissezione degli occhi con conseguente montare tutta la RPE. In questa procedura, si mostra come lavorare con e non contro, la struttura sferica dell'occhio. In breve, il tessuto connettivo, muscolare e del nervo ottico vengono rimossi dalla parte posteriore dell'occhio. Poi, la cornea e la lente sono stati rimossi. Successivamente, tagli strategici sono realizzati che si traducono in appiattimento significativa del tessuto residuo. Infine, la retina neurale è leggermente sollevato, rivelando una RPE intatto, che è ancora collegato al sottostante coroide e sclera. Questo monte intera può essere utilizzato per eseguire il test p Nazioni Unite o per la valutazione immunoistochimica o immunofluorescenza del tessuto RPE.
Protocollo
1. Rimuovere il tessuto estranea dalla parte esterna dell'occhio
- Versare 1X PBS nel coperchio di un piatto da 35 mm. Il livello dovrebbe essere appena sotto il bordo del coperchio.
- Utilizzando pinze dritto, occhio di trasferimento (s) dal tubo di stoccaggio per il piatto da 35 mm. Gli occhi sono immersi in PBS per due motivi: 1. I tessuti estranei si "galleggiare" lontano dagli occhi in modo da poter vedere e rimuovere facilmente, e 2. Durante la dissezione, l'occhio naturalmente mantenere la sua forma sferica, mentre in sospensione, che consente di lavorare con questa forma, piuttosto che contro di essa.
- Utilizzando entrambe le coppie di pinze ad angolo (45 ° e 15 °), rimuovere delicatamente il muscolo e del tessuto connettivo più possibile, tirando il tessuto contro il grano (cioè verso la cornea). Alcuni tessuto connettivo rimarrà. Sforzo dovrebbe essere fatto per spremere il bulbo oculare il meno possibile.
- Commercio tuoi 15 ° per le forbici pinze a molla. Mentre si tiene l'occhio fisso con 45 pinze °, usare le forbici per tagliare via primavera muscolare residua e del tessuto connettivo, così come il nervo ottico. * Suggerimento: utilizzare il bordo esterno delle forbici per spingere il tessuto contro il grano (verso il Corneo-sclerale divisione) e poi tagliare. Continuare fino a tutto il tessuto estraneo è stata rimossa dall'occhio.
2. Togliere la cornea e la lente
- Con la cornea rivolta verso l'alto, usare il forcipe 45 ° a pizzicare una piega piccola al centro della cornea.
- Utilizzando le forbici primavera, fare una piccola incisione alla base del lembo. Lascia andare il lembo.
- Tenendo gli occhi ancora con il forcipe, inserire la lama inferiore a forbice e in perpendicolare l'incisione ed effettuare un taglio verso il Corneo-sclerale dividere. Cercate di mantenere la vostra lama inferiore sotto l'iride così sia la cornea e iride sono tagliati. Non tagliare fino al Corneo-sclerale dividere. Tenere le forbici inserito negli occhi.
- Utilizzando il forcipe 45 °, con attenzione ruotare l'occhio in modo che le forbici siano parallele al Corneo-sclerale dividere e fare un piccolo taglio. Ruotare lentamente I ° occhio 360, facendo piccole incisioni tutto intorno. Ancora una volta, cercare di mantenere la lama inferiore del forbici primavera sotto l'iride in modo che sia l'iride e la cornea vengono tagliati. Sollevare l'iride e la cornea lontano dal resto dell'occhio e disfarsene.
- Inclinare l'occhio su un lato e premere leggermente sulla metà posteriore dell'occhio, costringendo la lente fuori. Eliminare l'obiettivo. L'interno della conchiglia oculare rimanente è rivestita dalla retina neurale, che dovrebbe apparire liscio e opaco.
3. Quarto l'oculare con conseguente, risultando in un 4 - "petali", fiore-come la struttura
- L'occhio deve essere posizionato in modo tale che l'apertura della conchiglia oculare è perpendicolare al vostro corpo. Usa la tua pinza 45 ° posizione stabile e il paraocchi.
- Tenendo le forbici primavera di fronte a voi in modo che siano perpendicolari al vostro corpo, inserire la lama inferiore del forbici molla nel bordo superiore della coppa occhio aperto. Utilizzando il forcipe 45 °, con attenzione allineare l'oculare in modo che un unico taglio dritto può essere fatta dal Corneo-sclerale dividere verso la testa del nervo ottico. Tutti i tagli devono essere perpendicolari alla Corneo-sclerale dividono e se non specificato, dovrebbe andare il più vicino alla testa del nervo ottico possibile senza il taglio in esso.
- Ruotare di 180 ° oculare, mantenendo la sua perpendicolarità con il tuo corpo. Usare la tecnica al punto 3.2 per fare un secondo taglio perpendicolare.
- Ruotare l'oculare e ripetere la tecnica descritta al punto 3.2 per fare due tagli più. Tutti e quattro i tagli dovrebbero essere il più vicino a 90 ° di distanza possibile. Tenete a mente che l'occhio non è perfettamente sferica quindi non ci sarà una certa variabilità.
4. Tagliare ciascuno dei quattro "petali" a metà, con un conseguente otto petali di fiori come la struttura
- Trasferire il oculare squartato dal piatto 35mm a un vetrino pulito. Con l'oculare rivolto verso l'alto, scoop sotto di essa a pinze a 45 °. Delicatamente sollevare il liquido e metterlo su un vetrino pulito.
- Utilizzando entrambe le coppie di pinze ad angolo, con delicatezza si aprono gli occhi, con la retina neurale verso l'alto. NON RIMUOVERE LA RETINA-NEURALI aiuta l'occhio mantenere alcune delle sue forma sferica in modo che non sta lavorando contro di essa. Inoltre protegge il RPE di essere accidentalmente danneggiato nelle seguenti procedure.
- Ruotare la diapositiva fino a quando uno dei petali è perpendicolare al vostro corpo.
- Usa la tua pinza 15 °, con delicatezza afferrare l'angolo del petalo. L'angolo del petalo dovrebbe essere cornea, non retina neurale o RPE. Sollevare l'angolo dolcemente, permettendo così di mantenere la sua curvatura.
- Inserire la lama inferiore della forbice molla tra il petalo e la diapositiva. Allineare le forbici in modo che un singolo, dritto, perpendicolare taglio può essere fatto dal Corneo-sclerale dividere verso la testa del nervo ottico. Tagliati il più vicino alla testa del nervo ottico come withou possibilet taglio in esso. Lascia andare il petalo, permettendo così di mentire sulla diapositiva.
- Ruotare la diapositiva 90 °, in modo che il petalo successivo è perpendicolare al vostro corpo. Ripetere il punto 4.5.
- Ripetere i passi 4.5 e 4.6 volte di più. La struttura risultante dovrebbe essere simile a un otto petali di fiore.
5. Rimuovere la retina neurale
- Pipetta 100-200 ml di PBS 1X sul campione. Questo consentirà di evitare la retina neurale di attaccarsi come staccatelo della RPE.
- Di solito la retina neurale è vagamente collegato al RPE. Tuttavia, ci vuole pratica e abilità per rimuovere solo la retina neurale e non l'RPE. Afferrare un petalo della retina neurale con un paio di pinze ad angolo, mentre la stabilizzazione (tenendo premuto) il resto degli occhi con l'altra coppia di pinze ad angolo. Tirare la retina neurale lontano dal resto dell'occhio. Continuare questa procedura fino a quando l'intera retina neurale è stato rimosso. * Suggerimento: bastone la punta delle pinze 15 ° nella testa del nervo ottico per ancorare l'occhio. Quindi utilizzare le pinze 45 ° a spazzare sotto la retina neurale e sollevarlo e via. Di solito è meglio per sollevare la retina neurale dalla testa del nervo ottico verso la Corneo-sclerale dividere. Assicurati di tirare fuori ogni residuo sciolto dell'iride. L'iride è molto appiccicosa e può altrimenti si blocca al RPE.
- Lavare il campione con PBS 1X. Pipetta 100-200 ml di PBS 1X nel campione e succhiare il backup. Gettare la PBS. Ripetere se necessario per rimuovere la polvere e detriti.
6. Mount che si provino (s) su un vetrino
- Pipettare 80-90 ml di glicerolo al 90% su un vetrino nuovo in una forma rettangolare. Utilizzare la parte del puntale per fare un pari, striscio rettangolare di glicerolo. (Questa è la procedura per il montaggio di due RPE su una diapositiva.)
- Inserire il braccio inferiore di 15 ° sotto forcipe il campione. Sollevare delicatamente il campione dal vetrino dissezione.
- Abbassare lentamente il campione in glicerolo. Muovere delicatamente la pinza come li tira fuori da sotto il provino.
- Ripetere i passaggi 6,1-6,3 per il campione di altri.
- Ruotare la diapositiva in modo che il lato lungo è perpendicolare al vostro corpo. Tenere il vetro di copertura ad un angolo di 45 ° alla diapositiva in modo che tocca la diapositiva. Spostarlo verso il glicerolo striscio fino a quando non toccano. Mantenendo il contatto tra il vetro di copertura e far scorrere, spostare lentamente il vetro coperchio dalla macchia, verso il bordo della diapositiva. Allineare i lati lunghi della diapositiva e il vetro di copertura in modo che siano paralleli. Afferrare gli angoli del vetro di copertura tra il pollice e l'indice.
- Raccogliete i 15 ° in pinza l'altra mano. Culla in alto (gratuito) bordi del vetro di copertura nell'incavo del braccio. Molto lentamente, abbassare il vetro di copertura. Quando avviene il contatto tra il vetro di copertura e il glicerolo, fermarsi e attendere che il glicerolo a migrare. Ripetere questo abbassamento e in attesa fino a quando i monti RPE suo complesso sono completamente coperti. Questo per evitare che il glicerolo altamente viscosi dalla cattura bolle d'aria. NON spingere il vetrino - il glicerolo si spremere fuori da sotto, rendendo l'adesione molto povera.
- Con chiaro smalto, vernice intorno al perimetro in cui il vetro di copertura e far scorrere incontrano.
- Mettere il vetrino in cima di un rack vuoto ad asciugare.
7. Rappresentante dei risultati:
Il risultato di questa procedura dovrebbe essere una struttura che sembra un fiore e dovrebbe essere abbastanza simmetrico.

Figura 1. Tutto RPE montare da un mouse tipo selvatico C67Bl/6J. RPE da nero o agouti animali devono essere di colore bruno scuro e dovrebbe avere una superficie liscia. E 'normale notare ondulazioni nella topografia dei petali. La pigmentazione su qualsiasi campione danno può essere un po 'variabile, a causa della densità variabile di pigmentazione sia del RPE e la coroide sottostante. Frecce bianche indicano ipopigmentate "canali" - questo è normale ed è dovuto alla vascolarizzazione di fondo dell'occhio. Freccia blu per danni fisici sia per l'EPR e la coroide sottostante.

Figura 2. Tutto RPE montare da un topo diluito. I campioni raccolti da animali diluite può variare di colore dal quasi trasparente al café au lait e qualunque esemplare è come avere variabilità al suo interno, indicato in cerchi neri qui. In generale, RPE raccolti da animali più giovani sono più leggeri e quelli raccolti da animali più vecchi sono più scuri. Frecce nere indicano alcuni dei vasi sottostanti, che appare ipopigmentate.
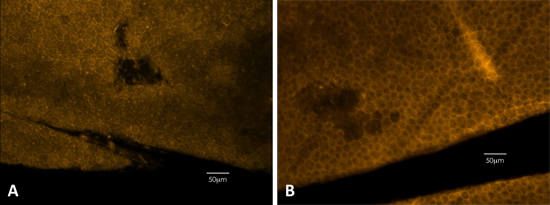
Figura 3. Falloidina colorazione può essere utilizzato per rilevare i danni fisici al RPE. Colorazione falloidina delinea chiaramente le membrane cellulari, che mostra la forma esagonale dell'epitelio. (A) Esempio di un topo nero. (B) Esempio di un topo diluito.
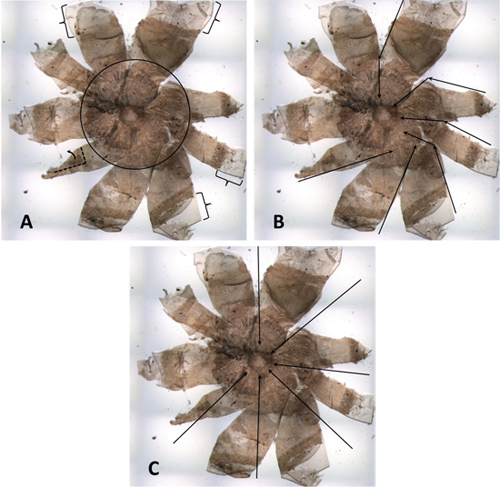
Figura 4. Un RPE poco sezionato da un topo diluito. (A) Le parentesi indicano i margini di cornea che sono troppo larghi, che possono causare deformazioni e / o pieghevoli. All'interno del cerchio nero si possono vedere una quantità eccessiva di tessuto estraneo che non sono stati rimossi dalla parte posteriore dell'occhio. Sono particolarmente evidenti perché il campione è da un animale diluita. Il petalo in basso a sinistra è parzialmente ripiegato. (B) Questa montare tutto ha l'aspetto di una girandola. Frecce nere indicano alcuni dei tagli che sono state fatte. Molti dei tagli dal Corneo-sclerale dividere verso la testa del nervo ottico non sono in linea con il diametro. (C), le frecce nere indicano come i tagli avrebbero dovuto essere effettuati, in linea con il diametro e perpendicolare alla tangente.
Discussione
La RPE è il sito delle Nazioni Unite p test, un test in vivo di omologia-diretto di riparazione. Il saggio p ONU è stata usata per studiare gli effetti dei danni del DNA diverso 1,2 e segnalazione danni del DNA e geni di riparazione 3,4,5 sulla frequenza di omologia-diretto di riparazione. Questo test è molto sensibile, rileva cella singola eventi sulla RPE 1. Si può anche rilevare le differenze nei tempi di omologia-diretto eventi di ...
Divulgazioni
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institute of Environmental Health Sciences [K22ES012264 a AJRB] e un American Cancer Society InstitutionalResearch Grant [ACS-IRG-00-173-04] pilota projectaward [a AJRB]. Ringraziamo anche i membri del laboratorio Vescovo per la lettura critica del manoscritto e commenti sul video e Adam Brown in particolare, per l'esempio di cosa non fare. Ringraziamo il Dr. Donald McEwen del Cancro Greehey per bambini Istituto di Ricerca per averci permesso l'uso della sua portata dissezione / videocamera set-up per le riprese del video dissezione. Ringraziamo Daron Brown Corte strumenti per l'affilatura e la riparazione dei nostri strumenti di microdissezione.
Materiali
| Name | Company | Catalog Number | Comments |
| straight forceps | Roboz Surgical Instruments Co. | RS-4903 | tip: .08 x .04 mm material: INOX |
| 45° forceps | Roboz Surgical Instruments Co. | RS-5005 | tip: .05 x.01 mm material: INOX |
| 15° "up" forceps | Roboz Surgical Instruments Co. | RS-5045A | tip: .1 x.06 mm material: INOX |
| spring scissors | Roboz Surgical Instruments Co. | RS-5604 | comb. tip width 0.3mm cutting edge length 3mm material: stainless steel |
| binocular dissecting microscope | Carl Zeiss, Inc. | Discovery V.8 | use reflected light source |
| phalloidin | Invitrogen | A22283 | Alexa Fluor 546 |
Riferimenti
- Bishop, A. J., Kosaras, B., Sidman, R. L., Scheistl, R. H. Benzo(a)pyrene andX-rays induce reversions of the pink-eyed unstable mutation in the retinal pigmentepithelium of mice. Mutat. Res.. 457, 31-31 (2000).
- Reliene, R. H. l. a. v. a. c. o. v. e., Mahadevan, A., Baird, B., M, W., Schiestl, R. H. Diesel exhaust particles cause increased levels of DNA deletions after transplacental exposure in mice. Mutat. Res. 570, 245-2452 (2005).
- Bishop, A. J., Barlow, C., Wynshaw-Boris, A. J., Scheistl, R. H. Atm deficiency causes increased frequency of intrachromosomal homologous recombination in mice. Cancer Res. 60, 395-399 (2000).
- Brown, A. D., Claybon, A. B., Bishop, A. J. Mouse WRN helicase domain is not required for spontaneous homologous recombination-mediated DNA deletion. J. Nucleic Acids. , (2010).
- Claybon, A., Karia, B., Bruce, C., Bishop, A. J. PARP1 suppresses homologous recombination events in mice in vivo. Nucleic Acids Res. , (2010).
- Bishop, A. J. p53-, and Gadd45a-deficient mice show an increased frequency ofhomologous recombination at different stages during development. Cancer Res. 63, 5335-5343 (2003).
- Bodenstein, L., Sidman, R. L. Growth and development of the mouse retinalpigment epithelium. Part I. Cell and tissue morphometrics and topography of mitoticactivity. Dev Biol. 121, 192-204 (1987).
- Burke, J. M. Epithelial phenotype and the RPE: is the answer blowing in the Wnt?. Prog Retin. Eye Res. 27, 579-595 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon