Method Article
In vivo double Substrat Bioluminescent Imaging
Dans cet article
Résumé
Ici, nous décrivons les méthodes pour construire, visualiser et quantifier les réactions bioluminescentes à la fois luciole et la luciférase Renilla enzymes exprimées en cellules cancéreuses mammaires métastatiques au cours de leur croissance et les métastases In vivo.
Résumé
Notre compréhension de comment et quand les cellules du cancer du sein de transit établies à partir de tumeurs primaires vers des sites métastatiques a augmenté à un rythme exceptionnel depuis l'avènement des technologies de bioluminescence in vivo d'imagerie 1-3. En effet, la capacité de localiser et de quantifier la croissance tumorale longitudinalement dans une seule cohorte de l'animal à l'achèvement de l'étude, par opposition à sacrifier certains groupes d'animaux en période d'essai spécifiques a révolutionné la façon dont les chercheurs étudient les métastases du cancer du sein. Malheureusement, les méthodes actuelles obstacle à l'évaluation en temps réel des changements cruciaux qui transpirent dans les systèmes de signalisation cellulaire que les cellules cancéreuses du sein (i) l'évolution au sein des tumeurs primaires, (ii) diffuser dans tout le corps, et (iii) relancer les programmes de prolifération des sites d'une lésion métastatique. Toutefois, les progrès récents de l'imagerie bioluminescente, il est maintenant possible de quantifier simultanément spatiotempor spécifiqueal modifications de l'expression génique en fonction du développement et la progression tumorale métastatique via l'utilisation de deux substrats réactions de luminescence. Pour ce faire, les chercheurs de profiter de deux enzymes produisant de la lumière luciférase isolé de la luciole (Photinus pyralis) et de la mer pensée (Renilla reniformis), toutes deux réagissent sur des substrats mutuellement exclusifs qui, auparavant, ont facilité leur large utilisation dans in vitro de cellules basées sur des tests de gènes rapporteurs 4. Ici, nous démontrons l'utilitaire vivo de ces deux enzymes telles qu'une réaction de luminescence marque précisément la taille et l'emplacement d'une tumeur en développement, tandis que la deuxième réaction luminescente est un moyen de visualiser l'état d'activation des systèmes de signalisation spécifiques au cours des étapes distinctes de la tumeur développement des métastases et l'. Ainsi, les objectifs de cette étude sont de deux ordres. Tout d'abord, nous allons décrire les étapes nécessaires à la construction double ligne de bioluminescence de cellules rapporteurs, ainsi que ceux nécessaires pour faciliter leur utilisation dans la visualisation de la régulation spatio-temporelle de l'expression des gènes au cours des étapes spécifiques de la cascade métastatique. En utilisant le modèle 4T1 de métastases du cancer du sein, nous montrons que l'activité in vivo d'un élément de liaison synthétique Smad (SBE) promoteur a diminué de façon spectaculaire dans les métastases pulmonaires par rapport à celle mesurée dans la tumeur primaire 4-6. Récemment, les métastases du cancer du sein a été montré pour être régulée par des changements dans le microenvironnement tumoral et du stroma primaire réactive, y compris ceux qui se produisent dans les fibroblastes et les cellules immunitaires infiltrant 7-9. Ainsi, notre deuxième objectif sera de démontrer l'utilité des deux techniques bioluminescentes dans le suivi de la croissance et de la localisation des deux populations de cellules uniques abrités au sein d'un seul animal pendant la croissance du cancer du sein et des métastases.
Protocole
1. Stabilité de l'expression de la luciférase Renilla CMV-Driven
- Transfection et sélection d'une population stable clonale est la méthode préférée pour l'expression de la luciférase Renilla ce journaliste. Cette approche donne une approche plus cohérente et uniforme expression renilla luciférase après l'introduction ultérieure d'autres constructions rapporteurs secondaires (par exemple, la luciférase de luciole ou des protéines fluorescentes).
- Transfecter des cellules malignes d'intérêt avec la luciférase Renilla vecteur d'expression codant, comme pcDNA3.1-Hygro ou un autre plasmide hébergeant un marqueur de sélection.
- Après la transfection, les cellules transfectées placer sous une concentration optimisée de plusieurs antibiotiques-à-jour de semaine de faciliter l'isolement des colonies individuelles, qui sont ensuite isolés individuellement et repiquées.
- Sélectionnez ≥ 10 individuels luciférase de Renilla exprimant colonies de surveiller l'étendue de l'expression renilla.
- Colonies exprimant des quantités élevées de la luciférase de Renilla sont ensuite soumis à une analyse fonctionnelle afin de s'assurer que les propriétés (i) physiopathologiques de leurs homologues parentaux sont conservés, et (ii) des valeurs d'expression de Renilla ne s'écartent pas ou changer au fil du temps. Ces étapes sont absolument essentiels pour éviter d'isoler et d'étudier des variantes clonales / déviants, et de valider la bonne intégration de la construction renilla dans le génome.
- Une fois un transfectant stable est isolé et vérifié, on peut enlever la pression de sélection et d'être assuré que l'expression de la luciférase Renilla restera constante sur de longues périodes de temps à la fois in vitro et in vivo.
2. D'expression, de sélection et de vérification fonctionnelle du promoteur inductible luciférase Firefly-Driven
- Sous-cloner le promoteur de l'intérêt dans un rapporteur luciférase-pGL4 plasmide hébergeant un marqueur de sélection (par exemple, PURomycin) qui est distinct de celui utilisé pour sélectionner pour l'expression stable de Renilla (par exemple, hygromycine).
- Transfecter des cellules malignes comme à l'étape I, et ensuite sélectionner une population stable polyclonal de la luciférase de luciole cellules exprimant. Parce que l'endroit où un gène rapport s'intègre dans le génome peut provoquer des effets erronées relatives à son expression et de la régulation, il est fortement recommandé de choisir des populations polyclonales de la luciférase de luciole cellules exprimant plutôt que des populations clonales de s'assurer que (i) l'expression du gène rapporteur reflète plus précisément celle du gène endogène dans les cellules parentales, et (ii) l'intégration des effets sur l'expression génique sont moyennées et diminué dans la population cellulaire hétérogène.
- Les cellules malignes conçues pour exprimer de manière stable à la fois renilla et luciférases de luciole sont collectivement appelés les deux cellules rapporteuses bioluminescentes, ou des cellules DBR.
- Utilisation in vitro de cellules à base de luciférase dosages de gènes rapporteurs, vérifier que les cellules DBR réglementer expression de la luciférase de luciole, que ce soit positivement ou négativement, de manière concordante avec celle observée dans les cellules parentales transfectées de façon transitoire avec ces vecteurs. De même, vérifiez que le CMV axée sur l'expression de renilla n'est pas réglementé par des stimulations cellulaires ou de conditions différentes de traitement.
- Pour ce faire, la culture et DBR cellules parentales dans des plaques 24 puits, et par la suite de façon transitoire co-transfecter des cellules parentales avec l'original CMV-Renilla et promoteur-firefly constructions utilisées pour générer des cellules DBR.
- Par la suite, traiter DBR et des cellules transfectées avec des facteurs parentaux ou d'agents pharmacologiques connus pour réguler le promoteur de l'intérêt, et par la suite quantifier luciole et la luminescence renilla l'aide du kit Promega Luciferase Assay double.
3. Établir 4T1 tumeurs mammaires primaires
- Métastatique des cellules 4T1 carcinome mammaire que nousre trouve à des agents pathogènes manque de rongeurs adventice ont été conçus pour exprimer de manière stable une luciférase Renilla CMV-commandé (pcDNA3.1-CMV-Renilla luciférase-hygro) et une SBE axée sur la luciférase de luciole (pGL4.2-SBE-luciférase de luciole-puro) comme décrit ci-dessus. Greffe orthotopique de ces résultats les cellules cancéreuses du sein dans la formation de métastases spontanées, principalement dans les poumons.
- Cellules 4T1 devraient pas être autorisés à atteindre la confluence au cours de leur propagation dans traditionnels 2-dimensions des systèmes de culture de tissus, et ils doivent être repiquées la veille de leur inoculation dans vivo.
- Les cellules 4T1 doit être dissocié par traitement à la trypsine, lavées soigneusement dans un milieu de croissance, et dilué dans du PBS à une concentration de 2x10 5 cellules / ml et stocké immédiatement sur de la glace.
- Femelles Balb / C femelles (4-6 semaines) devrait être anesthésiés par une dose d'induction de 3% d'isoflurane et maintenu sous anesthésie à la dose de 1% d'isoflurane. Préparez le site d'injection en tamponnant avec70% d'alcool isopropylique. En utilisant une pince, pincez doucement et soulevez le 4 pad inguinale mammaire. Avec précaution, placer un côté aiguille de calibre 27,5 biseau vers le haut et injecter dans le tampon graisse mammaire directement sous le mamelon, en prenant soin de ne pas enfoncer l'aiguille dans la cavité abdominale. Relâchez la glande et injecter lentement 50 ul de la suspension cellulaire (1x10 4 cellules) dans le tampon de graisse mammaire.
4. Initiale Dual Imaging luminescent
- Immédiatement après greffe des cellules 4T1 sur le bloc de graisse mammaire et tandis que les souris sont toujours anesthésié, injecter 100 ml de coelentérazine RediJect dans la veine latérale de la queue. Il s'agit de la concentration du substrat optimal recommandé par le fournisseur et le mieux toléré par l'animal.
- Immédiatement placer la souris dans le cône de nez isoflurane dans le système IVIS-200 d'imagerie et d'acquérir une image de 0,5 à 1 minute luminescent. Efficacité entre l'injection et l'acquisition des images est très important, car le signalpour la luciférase Renilla descend abruptement à 30 secondes après l'injection. Placez la souris de nouveau dans sa cage et lui permettre de récupérer pendant ≥ 1 heure, ce qui garantit que tout signal résiduel luciférase Renilla s'est dissipée et que la souris a complètement récupéré de l'anesthésie.
- Administrer 150 mg / kg de sel de potassium de D-luciférine par injection IP et attendez 5 minutes. Il s'agit de la concentration optimale de D-luciférine, qui fournit un signal luminescent stable pendant 5-15 minutes qui suivent son injection dans des animaux de laboratoire. Anesthésier la souris à l'aide isoflourane et remplacer dans le IVIS-200, en prenant soin de placer l'animal dans une position très similaire par rapport à l'acquisition initiale renilla. L'intensité globale de ce signal luciole dépendre de l'activité du promoteur de l'intérêt, et en tant que telle, l'activité luciférase de luciole visualisation peut exiger de longues durées d'acquisition.
- En utilisant le logiciel Image IVIS Salon réglé sur "photons" mode, établir précieuxes à la fois pour l'renilla et acquisitions luciole comme un moyen d'établir des ratios de base relatives de luminescence (RLR).
5. Luminescent longitudinale d'imagerie
- Cellules 4T1 sont très agressifs, tels que l'inoculation de 1x10 4 cellules conduit généralement à la formation de tumeurs palpables dans 1 semaine, et à la létalité de l'animal dans les 4-5 semaines. Tumeurs 4T1 ont une propension inhérente s'ulcèrent de la semaine 4. La croissance et le maintien des tumeurs ulcérées peut exiger l'approbation distincte IACUC. Les études présentées ici 4T1 tumorales ont été approuvés par le IACUC à la Case Western Reserve University.
- Comme décrit ci-dessus, les souris doit être injecté par semaine avec coelentérazine RediJect pour surveiller la croissance tumorale et les métastases en général, ainsi qu'avec la D-luciférine de suivre la voie de signalisation spécifique à divers stades de développement de la tumeur. Veillez à chaque fois pour assurer le signal de Renilla luciférase a complètement disparu avant l'acquisitionle signal de la luciférase de luciole.
- Comme les tumeurs 4T1 évoluer et progresser Renilla luciférase acquisitions doivent être normalisées aux valeurs initiales mesurées Renilla au moment de l'inoculation des cellules tumorales comme un moyen de normaliser et de suivre la croissance de la tumeur primaire. Plus important encore, le calcul des valeurs RLR au fil du temps mettra en place la régulation temporelle de différents systèmes de signalisation relatifs à la croissance et la progression tumorale.
- Manifeste métastase pulmonaire apparaît dans un délai de 3-4 semaines après la prise de greffe de cellules 4T1 sur le bloc de graisse mammaire. En comparant les valeurs RLR pulmonaires par rapport à ceux calculés pour la tumeur primaire établit la régulation spatiale des différents systèmes de signalisation relatifs à la croissance tumorale et les métastases.
6. Double imagerie bioluminescente de deux types de cellules uniques chez un seul animal
- Ingénieur une lignée cellulaire de cancer du sein à la luciférase Renilla expression stable au CMV axée sur la manière décrite ci-dessus. Répétez cetteprocessus d'ingénierie en utilisant CMV-luciférase de luciole axée sur une deuxième ligne distincte des cellules cancéreuses du sein.
- Ici, nous mixte renilla cellules exprimant la luciférase avec leurs 4T1 non métastatiques et isogéniques exprimant la luciférase de luciole homologues 4T07 10, 11. Des proportions variables de ces populations de cellules cancéreuses du sein mixtes sont ensuite injectés dans le coussinet de graisse mammaire comme décrit ci-dessus.
- Immédiatement acquérir à la fois luciole et la luciférase Renilla images d'établir initial représentant SRRL d'un mélange de cellules inoculées donné.
- Longitudinale d'imagerie bioluminescente sera double de visualiser et de suivre les changements dans la composition cellulaire dans la tumeur primaire, ainsi que la métastase spatio-temporelle de chaque dérivé du cancer du sein par rapport à la croissance et la progression tumorale.
- Alternativement, chaque populations cellulaires du cancer du sein peut être inoculé à des endroits différents chez la souris (c.-à droite et à gauche abdominaux mammaires coussinets adipeux)d'évaluer les influences systémiques de ces deux populations présentent une sur l'autre au cours de différentes étapes de la croissance tumorale et les métastases.
7. Les résultats représentatifs:
Un atout majeur de l'imagerie bioluminescente double réside dans le fait que chaque image est cohérente et contrôlée, de sorte que les signaux continus provenant de la fonction de tumeur primitive comme une mesure importante pour évaluer le succès ou l'échec de chaque renilla et l'acquisition de luciole. Cet aspect de la procédure d'imagerie est particulièrement important lors de l'acquisition de l'activité de la luciférase Renilla, dont coelentérazine substrat est très sensible à l'oxydation qui se traduit par sa capacité à auto-luminescence. La figure 1A montre un exemple de cet effet secondaire, qui se manifeste d'emblée comme non spécifiques des signaux luminescents provenant de l'intestin, et non la tumeur primaire établie. En général, ces coelentérazine non spécifique signale transpirélectronique suivante échoué injections intraveineuses de ce substrat renilla luciférase. Cependant, une fois robustes signaux primaires Renilla dérivées de tumeurs ont été obtenus (figure 1B, image de gauche), il est prudent de procéder à la capture des mesures de signalisation voie-spécifiques issus de l'imagerie luciférase de luciole (figure 1B, panneau de droite), dont la D-luciférine substrat est très stable lors de l'injection IP et produit des niveaux négligeables d'origine auto-luminescence.
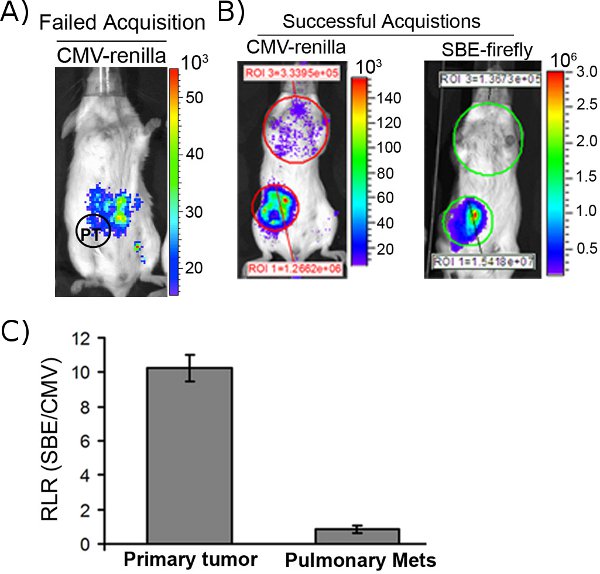
Figure 1. Acquisition renilla et lucioles dérivée images bioluminescentes de calculer SRRL in vivo. (A) Un exemple d'une injection IV de coelentérazine échoué entraînant signal non spécifique dans le tractus intestinal. Cercle et PT indiquent l'emplacement approximatif de la tumeur primitive. (B) Une acquisition réussie de renilla une souris portant une tumeur 4T1 primaire et pmétastases ulmonary (panneau de gauche; 4WK après une greffe du coussinet adipeux). L'acquisition correspondant luciole permet de calculer à la fois SRRL de la tumeur primitive et ses métastases pulmonaires. (C) Représentation graphique de la tumeur primitive et des métastases pulmonaires SRRL calculée à partir des souris indiquées dans la partie B (n = 4).
Discussion
Le pouvoir absolu des techniques d'imagerie bioluminescente réside dans leur capacité à quantifier la croissance tumorale et les métastases dans les études longitudinales complexes, qui présente impliquait l'utilisation de cellules 4T1 agressifs de cancer du sein. Parce que ces procédures s'appuient sur l'intégration stable des deux constructions rapporteurs luciférase, ces techniques peuvent être aisément adaptés et traduits dans d'autres lignées de cellules cancéreuses de différentes latences tumorales et les capacités métastatiques. Comme pour les résultats présentés ici, le calcul SRRL spécifiques à l'intérieur se développe lentement tumeurs primaires et leurs métastases éventuelles permet d'identifier en temps réel spatio-temporelle des événements précis de signalisation qui transpirent pendant la progression métastatique des tumeurs quelle que soit la durée de leur temps de latence. Lors de l'identification des événements promoteur réglementaires spécifiques, il est important d'exciser la fois la tumeur primitive et ses métastases à l'accomplissement de immunohistochimiques standard et différenciationl analyse d'expression génique pour vérifier régulation similaire du gène endogène et / ou une protéine.
Techniquement parlant, le principal défi des deux analyses bioluminescentes réside dans la durée relativement courte des signaux luciférase de Renilla. En tant que tel, cette technique d'imagerie nécessite une optimisation significative de la procédure d'injection queue veine, ainsi que l'imagerie immédiat des animaux injectés individuellement, un processus qui prend du temps et relativement peu efficace à l'imagerie luciférase de luciole. Récemment, Promega introduit "Viviren», ce qui représente un substrat de deuxième génération luciférase dont les sites d'oxydation sont bloqués par estérification jusqu'à ce que les gains de cette molécule entrée dans les cellules, à quel point la molécule est rapidement désestérifié. Collectivement, ce nouveau substrat permet de réduire efficacement la modification auto-luminescence et non spécifique et / ou la dégradation couplée à renilla induite par l'auto-luminescence 12. Ce faisant, cette nouvelle renillun substrat de luciférase produit brillantes signaux luminescents, mais les coûts excessifs liés à l'acquisition et à l'utilisation de «Viviren" ont fourni relativement peu d'études nécessaires pour évaluer l'utilité globale de ce substrat dans deux analyses bioluminescentes. Enfin, la sensibilité de tout essai bioluminescent dépend essentiellement de la caméra CCD opérant dans l'acquisition des unités individuelles de lumière. En effet, comme ces technologies améliorent, nous prévoyons un moment dans le futur où notre capacité à visualiser complexes lumière des réactions à médiation bioluminescentes peuvent transpirer efficacement sans déplacement des animaux 13.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
WPS a été soutenu en partie par des subventions du National Institutes of Health (CA129359), la Susan G. Komen pour la Cure Foundation (BCTR0706967), le Département de la Défense (BC084561), et le Seidman Cancer Center, tandis que MKW a été soutenue par une bourse de l'American Cancer Society (PF-09-120-01). Un soutien supplémentaire pour ce travail a été fourni par le Centre Case for Imaging Research, le Centre du cancer de cas complète (P30 CA43703), et le Centre de la fibrose kystique (P30 DK027651).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
|---|---|---|---|
| pGL4.2-Puro [luc2 / Puro] Vecteur | Promega | E6751 | |
| Glomax Mult-idection système | Promega | ||
| IVIS série 200 | Caliper Life Sciences | ||
| Double système de dosage de luciférase reporter | Promega | E1960 | |
| Rediject coelentérazine-h | Caliper Life Sciences | 760506 | |
| D-luciférine K-Sel | Caliper Life Sciences | 122796 |
Références
- Wetterwald, A. Optical imaging of cancer metastasis to bone marrow: a mouse model of minimal residual disease. Am. J. Pathol. 160, 1143-1153 (2002).
- Wendt, M. K., Drury, L. J., Vongsa, R. A., Dwinell, M. B. Constitutive CXCL12 Expression Induces Anoikis in Colorectal Carcinoma Cells. Gastroenterology. 135, 508-508 (2008).
- Wendt, M., Schiemann, W. Therapeutic targeting of the focal adhesion complex prevents oncogenic TGF-beta signaling and metastasis. Breast Cancer Research. 11, R68-R68 (2009).
- Korpal, M. Imaging transforming growth factor-beta signaling dynamics and therapeutic response in breast cancer bone metastasis. Nat Med. , (2009).
- Giampieri, S. Localized and reversible TGFbeta signalling switches breast cancer cells from cohesive to single cell motility. Nat Cell Biol. 11, 1287-1296 (2009).
- Giampieri, S., Pinner, S., Sahai, E. Intravital imaging illuminates transforming growth factor beta signaling switches during metastasis. Cancer Res. 70, 3435-3439 (2010).
- DeNardo, D. G. CD4(+) T cells regulate pulmonary metastasis of mammary carcinomas by enhancing protumor properties of macrophages. Cancer Cell. 16, 91-102 (2009).
- Wyckoff, J. A Paracrine Loop between Tumor Cells and Macrophages Is Required for Tumor Cell Migration in Mammary Tumors. Cancer Res. 64, 7022-7029 (2004).
- Kim, M. Y. Tumor self-seeding by circulating cancer cells. Cell. 139, 1315-1326 (2009).
- Aslakson, C. J., Miller, F. R. Selective events in the metastatic process defined by analysis of the sequential dissemination of subpopulations of a mouse mammary tumor. Cancer Res. 52, 1399-1405 (1992).
- Wendt, M. K., Smith, J. A., Schiemann, W. P. Transforming growth factor-beta-induced epithelial-mesenchymal transition facilitates epidermal growth factor-dependent breast cancer progression. Oncogene. 29, 6485-6498 (2010).
- Hawkins, E., Unch, J., Murhpy, N., Vidugiriene, J., Scurria, M., Klaubert, D., Wood, K. Bright Light, No Lysis. Measuring Renilla Luciferase Luminescence in Living Cells. , (2005).
- Roncali, E. New device for real-time bioluminescence imaging in moving rodents. J. Biomed. Opt. 13, 054035-054035 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon