Method Article
Une méthode à haut débit pour la mesure de débit de filtration glomérulaire chez des souris conscientes
Dans cet article
Résumé
Mesure du débit de filtration glomérulaire (GFR) est la norme d'or pour l'évaluation de la fonction rénale. Nous décrivons ici une méthode à haut débit qui permet la détermination du DFG chez des souris conscientes en utilisant une seule injection en bolus, la détermination de l'isothiocyanate de fluorescéine (FITC)-inuline dans le plasma et le calcul du taux de filtration glomérulaire par un modèle de décroissance exponentielle en deux phases.
Résumé
La mesure du débit de filtration glomérulaire (DFG) est l'étalon-or dans l'évaluation de la fonction rénale. Actuellement, les enquêteurs déterminent GFR en mesurant le niveau de la créatinine endogène ou exogène biomarqueur appliquée radioactive inuline marquée (3 H ou 14 C). Créatinine présente l'inconvénient important que proximales comptes tubulaires de sécrétion de ~ 50% de l'excrétion totale de la créatinine et donc de la créatinine n'est pas un marqueur fiable GFR. Selon l'expérience réalisée, la clairance de l'inuline peut être déterminée par une injection unique en bolus intraveineux ou par perfusion continue (minipompe intraveineuse ou osmotique). Les deux approches nécessitent la collecte de plasma ou plasma et l'urine, respectivement. Autres inconvénients de l'inuline marquée radioactive comprennent l'utilisation d'isotopes, le temps de préparation chirurgicale de consommer des animaux, et l'exigence d'une expérience de terminal. Nous décrivons ici une méthode qui utilise une seule injection d'un bolus del'isothiocyanate de fluorescéine (FITC), l'inuline marquée et la mesure de sa fluorescence dans 2.1 l de plasma dilué. En appliquant un modèle à deux compartiments, avec 8 collectes de sang par souris, il est possible de mesurer GFR dans un maximum de 24 souris par jour en utilisant un protocole de flux de travail spécial. Cette méthode ne nécessite brève anesthésie isoflurane avec tous les échantillons de sang sont prélevés chez une souris non-retenue et éveillé. Un autre avantage est qu'il est possible de suivre la souris sur une période de plusieurs mois et traitements (c.-à faire des expériences appariées avec des changements alimentaires ou des applications de la drogue). Nous espérons que cette technique de mesure du DFG est utile à d'autres chercheurs qui étudient la fonction rénale de la souris et remplacera des méthodes moins précises pour estimer la fonction rénale, comme la créatinine plasmatique et de l'urée sanguine.
Introduction
Le taux de formation de plasma ultrafiltré par le glomérule est devenue la base pour évaluer la fonction rénale (débit de filtration glomérulaire, DFG). Le marqueur idéal pour déterminer GFR doit être librement filtrée, ni sécrétée ou réabsorbé et non métabolisé. Un tel comportement a été trouvé pour être vrai pour l'inuline, et clairance de l'inuline est devenu une référence pour la détermination du DFG 3. Alors que la clairance de la créatininémie est largement utilisé comme une mesure du DFG chez les humains et les animaux, de la créatinine ne satisfait pas aux exigences d'un marqueur GFR idéal. Environ 10 - 40% de la clairance de la créatinine chez les humains est la conséquence de la sécrétion tubulaire active 1, 11, et la sécrétion rénale de la créatinine est également importante chez les souris et les rats 4, 7, 9, 22. Dysfonction rénale est connue pour augmenter la sécrétion tubulaire de la créatinine qui limite sa valeur comme marqueur du DFG 1, 2. Nous avons précédemment montré que les composés organiques anion transporteur isoforme3 (OAT3) contribue à murin sécrétion de la créatinine 22. Cependant, la clairance de l'inuline nécessite généralement l'utilisation de matières radioactives inuline marquée (3 H ou 14 C). La détermination radioactive de l'inuline peut être utilisée chez les souris anesthésiés et conscients, mais héberge les inconvénients de nombreuses règles de sécurité et les questions de manipulation strictes inhérentes à l'utilisation des isotopes radioactifs. Le long de ces lignes, les préparatifs de dédouanement chirurgicaux pour la détermination du taux de filtration glomérulaire sont coûteux en temps ainsi que la borne dans la nature. En 1999, Lorenz et al. 12 introduit FITC-inuline comme marqueur de la seule nephron GFR chez la souris anesthésiés. Cinq ans plus tard Qi et al. 15 déterminée ensemble GFR du rein chez les souris conscients en utilisant FITC-inuline. Des protocoles alternatifs utilisent maintenant FITC-inuline comme un marqueur exogène pour mesurer GFR chez la souris conscients et anesthésiés. Ces protocoles conservent la sensibilité de l'inuline radioactive en utilisant la fluorescence DETECTIsur et contourner les inconvénients de travailler avec un marqueur radioactif marqué. Le test FITC-inuline a été modifié par d'autres 7, 8 et nous 22, 23 pour profiter de la capacité microvolume du NanoDrop 3300 fluorospectromètre. Cela permet de réduire le volume de l'échantillon total nécessaire pour <100 ul de sang par mesure GFR.
Avec la méthode et le protocole à haut débit fourni dans cette publication, nous démontrons la faisabilité de la mesure du DFG chez jusqu'à 24 souris conscientes par jour. Cette technique pourrait être utile à d'autres chercheurs qui étudient murin GFR et nous espérons qu'il va remplacer les méthodes moins précises que les indices de la fonction rénale, comme la créatinine et de l'urée sanguine.
Protocole
1. Solutions
- 0,85% NaCl: 8,5 g de NaCl / 1 l trou DDH 2 O (8,5 g / L).
- 0,5 mol / L HEPES pH 7,4 (dissoudre 59,6 g d'HEPES dans 0,5 L de trou DDH 2 0 et ajuster le pH à 7,4 avec NaOH 10 N).
2. Préparation de la solution d'injection FITC-inuline
- Peser FITC-inuline pour préparer une solution à 5% et se dissoudre dans NaCl à 0,85% (généralement 100 mg / 2 ml de NaCl à 0,85%) par chauffage à 90 ° C jusqu'à dissolution complète.
- Peser dissous solution FITC-inuline et le poids de la note.
- Coupez un morceau de 20 cm membrane de dialyse (poids moléculaire de coupure: 1000) et mettre dans le trou DDH 2 O pendant 30 min pour éliminer les résidus de NaN3 de la membrane et rincez plusieurs fois par la suite.
- Remplissez dissous FITC-inuline dans la membrane de dialyse et sceller correctement avec des fermetures.
- Peser toute membrane de dialyse.
- Mettez la membrane de dialyse dans une solution de 1 L à 0,85% de NaCl et remuer lentement protégé par la lumière pendant 24 heures à rotempérature om.
- Peser à nouveau toute la membrane de dialyse et calculer la nouvelle concentration (eau osmotique se déplacer dans la membrane et FITC non lié, ou liés au FITC inuline <1,000 poids moléculaire se déplace hors de la membrane, ainsi, la concentration de FITC-inuline diminue sensiblement) .
- La nouvelle concentration FITC inuline (c) est calculé selon la formule suivante: C = N / V, où n = initiale montant FITC-inuline, V = nouveau volume (différence de poids d'un tube de dialyse, avant et après la dialyse ainsi que le volume de départ solution FITC-inuline).
- Avant d'utiliser stériliser dialysée solution FITC-inuline par filtration à travers un filtre à seringue de 0,22 um.
- Conserver le FITC-inuline abri de la lumière (feuille d'aluminium) à 4 ° C. Dialysée et stérilisée FITC-inuline peut être utilisé pour un maximum de 2 semaines. A participé au FITC inuline peut être dissoute par réchauffage à 90 ° C pendant quelques minutes.
Remarque: si vous utilisezFITC-sinistrine 16-18, qui ne nécessite pas de dialyse, toutes les mesures nécessaires pour la dialyse peuvent être ignorés.
3. Injection et de prélèvement sanguin
- Prendre du poids corporel (pc) de la souris avant l'expérience.
- Anesthésier la souris brièvement avec l'isoflurane.
- Pour haut-débit de 6 souris s'il vous plaît suivre le protocole prévu dans la figure 3.
- Injecter 2 pl / g de poids corporel de dialyse FITC-inuline dans le plexus rétro-orbital 24 en utilisant un G30 ½ en aiguille (enlever les bulles d'air de 100 pi seringue Hamilton en utilisant d'abord un G26 ½ en aiguille, puis de passer à un G30 ½ à aiguille pour injection).
- Coupez 1 mm de la queue de la souris avec des ciseaux une fois et prélever du sang à 3, 5, 7, 10, 15, 35, 56 et 75 min après injection dans Na-héparine minicapillaries. Seal minicapillaries après la collecte de sang avec Cha-joint.
- Conserver les échantillons à l'abri de la lumière.
- Mettez scellé minicapillaries intérieur hématoCritique capillaires et centrifuger pendant 5 min.
- Casser minicapillaries en utilisant un tailleur de diamants et tout transfert de plasma à la pipette dans un tube de 0,2 ml.
- Faire une dilution de 1:10 à l'aide de 2 pi de plasma et 18 pi de 0,5 mol / L HEPES (pH 7,4) dans le nouveau tube de 0,2 ml (échantillons peuvent être conservés pendant une nuit à 4 ° C pour les mesures de fluorescence).
- Mesurer 2 ul d'échantillon dilué avec NanoDrop 3300 en double. La description et l'utilisation de l'instrument est décrit ici 5.
4. Préparation des étalons
- Recueillir le sang des souris de la même souche de fond dans de l'héparine revêtu hématocrite capillaires, ralentit et diluer à 1:10 avec 0,5 mol / L HEPES (pH 7,4), le plus souvent 80 plasmatiques pl + 720 pl HEPES.
- Diluer la solution d'injection FITC-inuline avec plasma dilué de la souris pour obtenir les dilutions standards suivants:
01h10: 10 pl solution FITC-inuline non dilué + 90 pl plasma dilué de souris
1:100: 10 & mu, L (1:10) solution + 90 pl plasma dilué de souris
1:1000: 10 pi (1:100) solution + 90 pl plasma dilué de souris
1:2000: 30 pl (1:1) solution + 30 pl plasma dilué de souris
1:10.000: 10 pl (1:5) solution + 40 pl plasma dilué de souris
1:20.000: 20 pl (1:1) solution + 20 pl plasma dilué de souris
1/100.000: 10 pl (1:5) solution + 40 pl plasma dilué de souris
La concentration des normes dépendra de la dialyse et sera toujours différent pour chaque préparation de FITC-inuline. Il est nécessaire d'entrer la concentration de la courbe standard nouveau à chaque fois. - Analyser les données pour calculer GFR avec un logiciel approprié (par exemple GraphPad Prism) en utilisant une fonction de décroissance exponentielle en deux phases comme décrit ici 15, 20 et montré dans la section des résultats représentatifs.
Résultats
GFR sera calculé selon la formule suivante:
GFR = n / (A/K1 + B/K2), où
n = quantité injectée (n = c • V, où c = concentration FITC-inuline, V = volume injecté)
A = span1, ordonnée à l'origine de l'élimination
K1 = constante d'élimination décroissance
B = span2, ordonnée à l'origine de la distribution
K2 = constante de décroissance de la distribution
Note: A, K1, K2 et B sont des abréviations donnés par GraphPad Prism, chaque logiciel capable d'analyser décroissance exponentielle en deux phases peuvent être utilisés, cependant, un autre logiciel scientifique peut utiliser des abréviations différentes.
En utilisant un ajustement de la courbe de décroissance exponentielle en deux phases, qui est basé sur les concentrations plasmatiques de FITC-inuline, une courbe comparable à celui montré à la figure 1 doit être obtenu. Calcul GFR par la formule ci-dessus (et comme décrit ici 20) permet de détecter une insuffisance de la fonction rénale ou 15 hyperfiltration glomérulaire 8, 23 que l'on trouve chez la souris avec diabète de type 1 (figure 2).
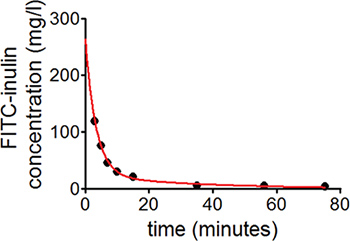
Figure 1. Pour mesurer GFR chez des souris conscientes, cinétique plasmatique de FITC-inuline après une injection intraveineuse d'une dose unique est utilisé. Pour le calcul du taux de filtration glomérulaire, un modèle à deux compartiments est utilisé. Dans le modèle à deux compartiments, la phase de décroissance rapide initiale représente la redistribution de FITC-inuline à partir du compartiment intravasculaire pour le fluide extracellulaire. La phase ultérieure, avec décroissance plus lente de la concentration FITC-inuline, reflète principalement la clairance systémique du plasma.
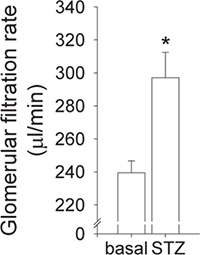
Figure 2. Detection de hyperfiltration diabétique chez les souris de type sauvage. diabète de type I a été induite par l'application intrapéritonéale de streptozotocine (STZ, 50 mg / kg pendant 5 jours consécutifs). GFR a été déterminée avant (basale) et 5 semaines après l'induction du diabète. Grâce aux commentaires des tubuloglomérulaire, une augmentation primaire dans la réabsorption proximale provoque début hyperfiltration diabétique 21, un constat qui est reproductible chez les souris de type sauvage (n = 10, p <0,01 vs basale même souris).
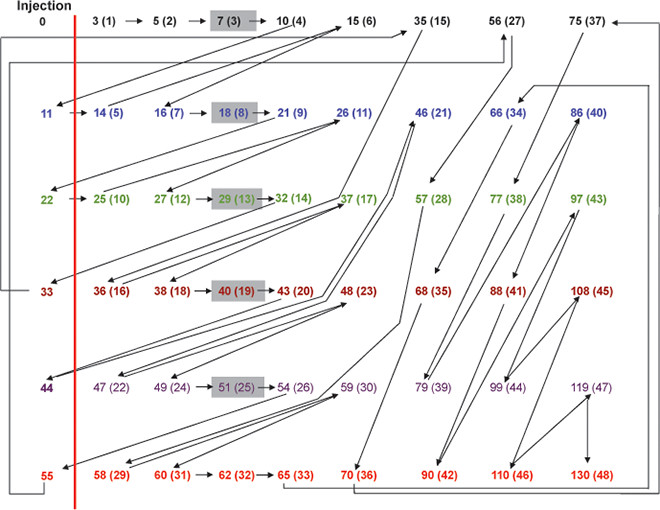
Figure 3. Organigramme pour la mesure du DFG dans un ensemble de 6 souris. Pour mesurer toute GFR du rein par la méthode de l'injection d'un bolus unique, 8 échantillons de sang doivent être prélevés à 3, 5, 7, 10, 15, 35, 56 et 75 min après injection FITC-inuline. Les chiffres indiquent points dans le temps. Les chiffres entre parenthèses indiquent le nombre d'échantillons. points de Temps restant de la ligne verticale rouge indiquent injectionpoints dans le temps (à 0, 11, 22, 33, 44 et 55 min). Chaque souris est marqué avec une couleur différente. Pour obtenir des collectes de sang séquentielles suivre les flèches. Les cases grises indiquent quand le prochain souris doit être préparé pour isoflurane avant l'injection. En utilisant ce protocole le temps minimum entre 2 collectes de sang à partir de différentes souris est de 1 min.
Discussion
La présente étude décrit une technique pour la détermination du taux de filtration glomérulaire chez des souris conscientes par injection bolus unique et l'analyse de la fluorescence dans 8 échantillons sanguins en décroissance exponentielle en deux phases. A mesure GFR à 1 souris prend 75 min. En utilisant un organigramme spécial, il est possible de mesurer le taux de filtration glomérulaire de 6 souris en 130 min. Il est possible de répéter ce protocole organigramme jusqu'à 4 fois par jour et de mesurer GFR à 24 souris. Nous avons modifié cette méthode de sorte qu'il est possible de prélever du sang à partir d'une petite queue snip plutôt que de veine de la queue crevaison, ce qui est plus rapide et plus facile pour les enquêteurs à effectuer par rapport à la veine caudale crevaison. En utilisant 10 pl hématocrite capillaires et une dilution de 1:10, il est possible de réduire la quantité totale de sang nécessaire à <100 pi. Enfin, la fluorescence est mesurée à l'aide d'un NanoDrop 3300 fluorospectromètre, qui permet de déterminer la fluorescence dans 1-2 pi d'échantillon dilué. Cette méthode donnera le investigato intéresséra vraie valeur GFR. En revanche, les mesures de la créatinine chez les souris présentent plusieurs faiblesses dont "la créatinine zone aveugle» et les difficultés liées à la détermination spécifique et sensible. La «zone aveugle de la créatinine" limite sa fonction en tant que marqueur pour GFR parce que la créatinine sérique reste dans la fourchette normale jusqu'à 50% de la fonction rénale est perdue 19. Depuis plusieurs chercheurs utilisent des souris génétiquement modifiées dans leurs recherches pour étudier la physiologie rénale et la physiopathologie, cette porte le problème suivant: en supposant une souris knockout des gènes X aurait un taux de filtration glomérulaire significativement plus faible (de 40%) par rapport à une souris de type sauvage, un dépistage simple en comparant la créatinine plasmatique serait pas détecter cette différence. La nécessité d'une bonne méthode précise de détermination GFR devient plus critique plus les différences de taux de filtration glomérulaire devenir.
Les souris ont des concentrations élevées de chromagens non-créatinine dans le plasma et l'urine qui interfèrent avec le commercedosages de créatinine disponibles. En conséquence, les tests qui sont basés sur le picrate Jaffé réaction alcaline surestimation concentration de créatinine dans le plasma par rapport à la chromatographie liquide à haute performance (HPLC) détermination 6, 13. Une autre limitation est que la créatinine sérique est inférieure aux limites de détection de plusieurs tests disponibles dans le commerce par rapport à la détermination HPLC. Cependant, en utilisant des réactions enzymatiques enquêteurs ont pu déterminer la créatinine plasmatique chez les souris 10, 22.
GFR dans une fourchette similaire a été observée chez des souris conscientes utilisant un procédé d'injection bolus unique comparable ainsi que urinaire dégagement FITC-inuline 14. Contrairement à leur protocole, notre protocole utilisant snip de queue ne nécessite pas de précautions particulières afin de préserver l'intégrité du navire par rapport à la veine de la queue ou la ponction de la veine saphène. Pour la clairance urinaire / plasma basé FITC-inuline, il est nécessaire d'implanter chirurgicalement deux mi osmotiquenipumps. Deux pompes sont nécessaires pour atteindre plasma FITC-inuline concentrations à l'équilibre suffisamment élevées qui se distinguent clairement de l'arrière-plan. Cela nécessite également l'utilisation de cages métaboliques pour une collection complète et datés urine. Les cages doivent être rincés afin de tenir compte d'une perte de 25-37% de FITC-inuline, qui survient par ailleurs sans rinçage.
Les pièges de l'utilisation de cette méthode FITC-inuline sont limitées. Les enquêteurs doivent être conscients de ce qui suit: (i) assurer qu'il n'y a pas de bulles d'air dans la seringue utilisée pour l'injection de la solution de FITC, (ii) injection rétrobulbaire complet doit être réalisé parce que la quantité injectée détermine le taux de filtration glomérulaire calculé, et ( iii) Les souris seront plus susceptibles d'uriner pendant la min expérience GFR 75, de sorte d'éviter la contamination des échantillons de sang à l'urine, ce qui aura une concentration FITC-inuline très élevé en raison de la capacité de concentration des reins.
Avantages généraux of cette méthode FITC-inuline sont les suivants: (i) il s'agit d'une technique non-radioactive, (ii) il est possible de répéter les mesures plusieurs fois dans la même souris, (iii) le test peut être effectué sur des souris conscientes, ( iv) aucune collecte d'urine est nécessaire, et (v) une option à haut débit peut être utilisé. Inconvénients pour l'injection d'un bolus unique comprennent la nécessité d'une dialyse de FITC-inuline, qui peut être surmonté en utilisant une meilleure FITC-marqueur, FITC-sinistrine, qui est maintenant disponible et peut être mesurée par voie transcutanée en utilisant un dispositif miniaturisé spéciale 18. Même si GFR est mesurée, il n'est pas possible de mesurer les excrétions fractions de liquide ou ions avec cette méthode.
Dans l'ensemble, cette méthode fournit la faisabilité d'une méthode à haut débit pour la mesure du DFG chez des souris conscientes. Ainsi, cette technique pourrait être d'intérêt pour d'autres chercheurs qui sont intéressés à la détermination de la fonction rénale chez les souris.
Déclarations de divulgation
L'auteur a reçu des fonds pour couvrir les frais de cette publication par Thermo Fisher Scientific.
Remerciements
Je remercie le Dr Jessica Dominguez Rieg pour la lecture critique de ce manuscrit. Ce travail a été soutenu par l'American Heart Association (Scientist Development Grant 10SDG2610034), un Carl W. Gottschalk subvention de recherche de la Société américaine de néphrologie, l'Institut national du diabète et des maladies digestives et rénales O'Brien Center for Acute Kidney Injury Research ( P30DK079337), et le ministère des Anciens Combattants.
matériels
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma-Aldrich | S7653 | |
| FITC-inulin | Sigma-Aldrich | F3272 | |
| HEPES | Sigma-Aldrich | H7706 | |
| Isoflurane | Webster Veterinary | 78366551 | |
| Dialysis membrane (MWCO 1000) | Spectrum Laboratories | 132636 | |
| Membrane closure | Spectrum Laboratories | 132736 | |
| 80 μl Hematocrit capillaries | Drummond Scientific | 22362566 | |
| Hematocrit centrifuge | IEC | Micro-MB | |
| 10 μl Na+-Heparin minicaps | Hirschmann | 9000210 | |
| Syringe (100 μl) | Hamilton | 80601 | |
| Fluorospectrometer | Thermo-Fisher Scientific | NanoDrop 3300 | |
| Filter (0.22 μm) | Spectrum Laboratories | 880-26464-UE | |
| Sealant | Châ-seal | 510 | |
| Needles (G26 ½ and G30 ½) | Becton Dickinson | 305111 & 305106 |
Références
- Bauer, J. H., Brooks, C. S., Burch, R. N. Clinical appraisal of creatinine clearance as a measurement of glomerular filtration rate. Am. J. Kidney Dis. 2 (3), 337-346 (1982).
- Carrie, B. J., Golbetz, H. V., Michaels, A. S., Myers, B. D. Creatinine: an inadequate filtration marker in glomerular diseases. Am. J. Med. 69 (2), 177-182 (1980).
- Chasis, H., Ranges, H. A., Goldring, W., Smith, H. W. The Control of Renal Blood Flow and Glomerular Filtration in Normal Man. J. Clin. Invest. 17 (5), 683-697 (1938).
- Darling, I. M., Morris, M. E. Evaluation of "true" creatinine clearance in rats reveals extensive renal secretion. Pharm. Res. 8 (10), 1318-1322 (1991).
- Dunn, S. R., Qi, Z., Bottinger, E. P., Breyer, M. D., Sharma, K. Utility of endogenous creatinine clearance as a measure of renal function in mice. Kidney Int. 65 (5), 1959-1967 (2004).
- Eisner, C., Faulhaber-Walter, R., et al. Major contribution of tubular secretion to creatinine clearance in mice. Kidney Int. 77 (6), 519-526 (2010).
- Faulhaber-Walter, R., Chen, L., et al. Lack of A1 adenosine receptors augments diabetic hyperfiltration and glomerular injury. J. Am. Soc. Nephrol. 19 (4), 722-730 (2008).
- FINGL, E. Tubular excretion of creatinine in the rat. Am. J. Physiol. 169 (2), 357-362 (1952).
- Keppler, A., Gretz, N., et al. Plasma creatinine determination in mice and rats: an enzymatic method compares favorably with a high-performance liquid chromatography assay. Kidney Int. 71 (1), 74-78 (2007).
- Levey, A. S., Perrone, R. D., Madias, N. E. Serum creatinine and renal function. Annu. Rev. Med. 39, 465-490 (1988).
- Lorenz, J. N., Gruenstein, E. A simple, nonradioactive method for evaluating single-nephron filtration rate using FITC-inulin. Am. J. Physiol. 276, 172-177 (1999).
- Meyer, M. H., Meyer, R. A., Gray, R. W., Irwin, R. L. Picric acid methods greatly overestimate serum creatinine in mice: more accurate results with high-performance liquid chromatography. Anal. Biochem. 144 (1), 285-290 (1985).
- Qi, Z., Breyer, M. D. Measurement of glomerular filtration rate in conscious mice. Methods Mol. Biol. 466, 61-72 (2009).
- Qi, Z., Whitt, I., et al. Serial determination of glomerular filtration rate in conscious mice using FITC-inulin clearance. Am. J. Physiol. Renal Physiol. 286 (3), F590-F596 (2004).
- Schock-Kusch, D., Sadick, M., et al. Transcutaneous measurement of glomerular filtration rate using FITC-sinistrin in rats. Nephrol. Dial Transplant. 24 (10), 2997-3001 (2009).
- Schock-Kusch, D., Xie, Q., et al. Transcutaneous assessment of renal function in conscious rats with a device for measuring FITC-sinistrin disappearance curves. Kidney Int. 79 (11), 1254-1258 (2011).
- Schreiber, A., Shulhevich, Y., et al. Transcutaneous measurement of renal function in conscious mice. Am. J. Physiol. Renal Physiol. 303 (5), F783-F788 (2012).
- Shemesh, O., Golbetz, H., Kriss, J. P., Myers, B. D. Limitations of creatinine as a filtration marker in glomerulopathic patients. Kidney Int. 28 (5), 830-838 (1985).
- Sturgeon, C., Sam, A. D., Law, W. R. Rapid determination of glomerular filtration rate by single-bolus inulin: a comparison of estimation analyses. J. Appl. Physiol. 84 (6), 2154-2162 (1998).
- Vallon, V., Blantz, R. C., Thomson, S. Glomerular hyperfiltration and the salt paradox in early [corrected] type 1 diabetes mellitus: a tubulo-centric view. J. Am. Soc. Nephrol. 14 (2), 530-537 (2003).
- Vallon, V., Eraly, S. A., et al. A role for the organic anion transporter OAT3 in renal creatinine secretion in mice. Am. J. Physiol. Renal Physiol. 302 (10), F1293-F1299 (2012).
- Vallon, V., Schroth, J., et al. Adenosine A(1) receptors determine glomerular hyperfiltration and the salt paradox in early streptozotocin diabetes mellitus. Nephron. Physiol. 111 (1), 30-38 (2009).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Anim. (NY. 40 (5), 155-160 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon