Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un protocole IRM multicentrique pour l'évaluation et la quantification des thrombose veineuse profonde
Dans cet article
Résumé
The goal of this study is to use magnetic resonance venography with long-circulating gadolinium-based contrast agent and direct thrombus imaging for quantitative evaluation of DVT volume in a multicenter, clinical trial setting. Inter- and intra-observer variability assessments were conducted, and reproducibility of the protocol was determined.
Résumé
Nous avons évalué un phlébographie par résonance magnétique (MRV) approche avec gadofosveset à quantifier le total des variations de volume de thrombus que le principal critère de l'efficacité du traitement dans une étude multicentrique randomisée comparant la monothérapie edoxaban avec un régime héparine / warfarine pour aiguës, symptomatiques extrémités inférieures de thrombose veineuse profonde (TVP ) de traitement. Nous avons également utilisé une approche d'imagerie de thrombus directe (DTHi, sans l'utilisation d'un agent de contraste) pour quantifier thrombus frais. Nous avons ensuite cherché à évaluer la reproductibilité de la méthode d'analyse et de l'applicabilité de l'utilisation de la phlébographie par résonance magnétique 3D et l'imagerie de thrombus directe pour la quantification de la TVP dans un cadre d'un essai multicentrique. De 10 sujets sélectionnés au hasard participant à l'étude edoxaban thrombus réduction Imaging (Etris), volume de thrombus totale dans le système veineux profond du membre inférieur a été entièrement quantifié bilatéralement. Les sujets ont été imagées en utilisant des séquences 3D-T1 en écho de gradient avant (direct tImagerie hrombus, DTHi) et 5 min après injection de 0,03 mmol / kg de gadofosveset trisodique (de la phlébographie par résonance magnétique, MRV). Les marges de la TVP sur plusieurs plans, images axiales courbes correspondant reformatées ont été délimitées manuellement par deux observateurs pour obtenir des mesures volumétriques du thrombus veineux. MRV a été utilisé pour calculer le volume de TVP totale, alors que DTHi a été utilisé pour calculer le volume du thrombus frais. Corrélation intra-classe (CCI) et l'analyse Altman Bland ont été effectuées pour comparer la variabilité inter et intra-observateur de l'analyse. Le CPI de la variabilité inter et intra-observateur était excellent (0,99 et 0,98, p <0,001, respectivement) sans partialité de Bland-Altman analyse des images MRV. Pour les images DTHi, les résultats étaient légèrement inférieurs (ICC = respectivement 0,88 et 0,95, p <0,001), avec partialité des résultats inter-observateurs sur des parcelles de Bland-Altman. Cette étude a montré la faisabilité de l'estimation du volume de thrombus dans TVP utilisant MRV avec gadofosveset trisodique, avec une bonne intra et danster-observateur reproductibilité dans un cadre multicentrique.
Introduction
La thromboembolie veineuse (TEV) affecte 300,000-600,000 personnes aux États-Unis chaque année 1. La thrombose veineuse profonde (TVP) est la présentation la plus courante de TEV, et touche surtout le veau, la cuisse ou veines pelviennes. Le diagnostic, la gestion et le suivi des sujets souffrant de TVP ne peuvent pas être fondées uniquement sur des examens cliniques, car les signes et les symptômes de cette maladie sont non spécifique 2,3. Alors que les tests sanguins (tels que D-dimère) peuvent aider à éliminer le diagnostic de thrombose veineuse profonde, l'imagerie est nécessaire pour établir la présence d'une TVP 4. échographie de compression (CUS) est actuellement le test de l'imagerie la plus couramment utilisée dans le diagnostic de suspicion de thrombose veineuse profonde aiguë. CUS est peu coûteux et a une haute sensibilité et une spécificité pour détecter la thrombose veineuse profonde aiguë 5. Cependant, CUS ne peut pas évaluer de manière fiable les veines profondes dans le bassin 6. En outre, CUS ne peut quantifier directement le volume de thrombus et de la composition, qui sont importants pour distinguer entreen TVP aiguë (une source potentielle d'embolie pulmonaire (EP)) et TVP chronique (moins susceptibles d'embolisation) et pour l'évaluation de l'efficacité thérapeutique 7.
Contrairement à la tomodensitométrie (CT), l'imagerie par résonance magnétique (IRM) ne délivre pas de radiations ionisantes, et est donc adapté pour les examens de série afin d'évaluer l'évolution de thrombus ou de régression. Par rapport à la CUS, l'IRM permet de détecter la thrombose veineuse profonde pelvienne et peut définir plus précisément proximale (poplitée veine et ci-dessus) et de la jambe distale (ci-dessous poplitée veine) TVP 8, afin de mieux évaluer le risque de PE. L'IRM peut caractériser l'âge et de l'organisation thrombus, et peut aider à différencier aiguë de TVP chronique 9-11 (références actualisées). Quantification du volume de thrombus, une mesure importante pour évaluer l'évolution de la maladie et la réponse au traitement, est réalisable avec l'imagerie par résonance magnétique. Protocoles de phlébographie par résonance magnétique actuelles sont effectuées après injection de gadolinium (Gd) des agents de contraste à base 12. Cessont de petites molécules de poids moléculaire que extravaser rapidement après l'injection, et nécessitent une synchronisation soin de capturer la phase d'amélioration veineux nécessaire pour visualiser correctement le thrombus 13,14.
Une étude de preuve de concept, edoxaban réduction thrombus étude Imaging (Etris), en utilisant une conception de l'étiquette ouverte, a enquêté sur l'efficacité et l'innocuité de edoxaban 90 mg une fois par jour pendant 10 jours, suivie d'edoxaban 60 mg une fois par jour dans le traitement de aiguë, TVP symptomatique (ClinicalTrials.gov Identifier: NCT01662908). Etris traite si edoxaban monothérapie, sans concomitante d'héparine de bas poids moléculaire (LMW héparine) au moment de l'initiation du traitement, est plus efficace que le traitement standard avec LMW thérapie héparine / warfarine chez des sujets souffrant de TVP, telle qu'évaluée par le changement pour cent (%) de base de thrombus le volume / taille (mesurée par IRM) lors de la Journée 14-21.
Un autre objectif de Etris était de développer et de valider un MR simpleveinographie (MRV) d'acquisition d'image et le protocole d'analyse pour la quantification du volume d'un thrombus dans la thrombose veineuse profonde. Pour surmonter certains défis rencontrés par les protocoles actuels MRV en milieu multicentriques, nous avons utilisé une, longue durée de circulation, une piscine de sang agent de contraste à base de gadolinium récemment approuvé par la FDA (gadofosveset trisodique). Par rapport à l'utilisation de chélates extracellulaires base-Gd (par exemple, Gd-DTPA) pour MRV, gadofosveset a un temps de circulation significativement plus longue, ce qui permet l'utilisation d'un système d'acquisition de MR simple, sans aucune synchronisation des acquisitions. Gadofosveset trisodique est un agent de contraste IRM de la piscine de sang qui circule pendant 2-3 heures après l'injection intraveineuse 15,16. Son profil d'innocuité est semblable à ceux des agents extracellulaires extravasculaires traditionnelles de contraste IRM 17. Il permet l'imagerie à l'état stable de la vascularisation sur une période de 1 heure. Par conséquent, aucune synchronisation dépendant de l'acquisition de l'image de l'opérateur est nécessaire après injection de produit de contraste. L'avantage supplémentairede l'utilisation de cet agent de contraste est qu'il est une petite molécule (masse moléculaire 857 Da) 18 et peut pénétrer dans les côtés de même un thrombus complètement occlus, fournissant ainsi un excellent contraste de la thrombose veineuse profonde dans les zones environnantes de la MRV et permettant le calcul quantitatif de la thrombose veineuse profonde volumes. Des études antérieures ont établi la fiabilité inter-évaluateur des veines de visualisation utilisant la phlébographie MR Volume interpolée apnée examen (VIBE) en utilisant gadofosveset trisodique 19. Ici, nous utilisons une approche similaire dans un cadre clinique multicentrique d'essai pour évaluer la thrombose veineuse profonde et d'utiliser le volume de la TVP mesurée par IRM comme point final. Etris fournit une plate-forme idéale pour évaluer la faisabilité et la reproductibilité de l'analyse de l'approche d'imagerie MRV proposé ici, en utilisant un agent de contraste flaque de sang à base de Gd longue durée de circulation pour évaluer les volumes de TVP. Nous évaluons également l'utilisation d'une approche d'imagerie de thrombus directe (DTHi) pour quantifier l'ampleur de la TVP frais avantl'injection d'agents de contraste.
Deux examens IRM ont été réalisées au cours de l'étude: la première dans les 36 h après la randomisation dans le groupe de monothérapie ou edoxaban héparine / groupe warfarine, et la seconde entre 14 à 21 jours après la randomisation. Les analyses de l'ensemble des images ont été effectuées par un laboratoire central centralisée. Volume de thrombus frais est calculé à partir d'un thrombus Direct Imaging (DTHi) dans les jambes et le bassin inférieurs avant l'injection d'un agent de contraste. Le volume de thrombus totale (frais et vieux) est calculée à partir d'un poste contraste résonance magnétique veinographie (MRV) des images des veines dans les jambes et le bassin inférieur.
Protocole
Cette étude a été approuvée par les conseils d'examen institutionnels locaux à tous les centres participants. Tous les sujets de l'essai multicentrique ont donné par écrit leur consentement éclairé à participer à Etris dans leurs établissements respectifs.
1. Image Acquisition
- Effectuer l'imagerie par résonance magnétique sur un T scanner du corps entier de 1,5 T ou 3 en utilisant spécialisés bobines multi-éléments pour MRV comme une bobine vasculaire périphérique, bobines de la matrice du corps ou des bobines en run-off. Utiliser ces bobines en conjonction avec d'autres bobines de la matrice de bobines de corps ou de la colonne vertébrale. Si aucun bobines spécialisées appropriées sont disponibles, utilisez la bobine du corps à la place.
REMARQUE: Utilisez les scanners disponibles dans le commerce tels que Siemens Symphony, Sonata, etc.- sous réserve de l'écran, et le questionnaire de sécurité examen IRM avant de numériser. Avoir changement sujet dans une robe.
- Passer une ligne intraveineuse dans la veine du pli du coude du sujet pour l'injection de l'agent de contraste. Suivez proc de sécurité standardedures pour injecter un agent de contraste à base de gadolinium.
- Lieu objet en position couchée, les pieds première position dans la machine IRM et de la position des bobines appropriées sur les régions à numériser. Bobines sécurisées à l'aide des sangles velcro au besoin.
- Les jambes de réserve Fixer / pieds pour éviter les artefacts de mouvement au cours de la IRM.
- Allumez le laser de centrage et de déplacer la table jusqu'à ce que les traverses de laser sont situés juste en dessous des genoux du sujet (rotule). Veuillez agréer cette position pendant l'iso-centre du balayage et de déplacer la table de patient de la position du centre de l'alésage de scanner.
- Mesure de la clairance de la créatinine (ClCr) et de déterminer la dose de l'agent de contraste à utiliser pour le sujet sur la base du poids corporel. Si ClCr <30 ml / min, sous réserve sont exclus de l'étude. Pour les personnes ayant ClCr> 30 ml / min, mais inférieur à 45 ml / min, 0,01 mmol / kg de produit de contraste est utilisé. Pour les personnes ayant ClCr> 45 ml / min mais <60 ml / min, 0,02 mmol / kg de gadofosveset est injecté. Pour les personnes ayant une fonction rénale normale (clairance de la créatinine> 60 ml / min), la dose de 0,03 mmol / kg (0,12 ml / kg) gadofosveset trisodique est utilisé. Injecteur d'alimentation compatible IRM est utilisée pour injecter l'agent de contraste.
- Effectuer imagerie bilatéral des deux jambes et le bassin plus bas à une seule session d'examen d'une durée d'environ 60 min, comme indiqué dans le tableau 1 et décrite dans l'article de protocole IRM.
REMARQUE: Anonymize données du patient avant le transfert d'images à un laboratoire de noyau central pour analyse.
2. Protocole IRM
- Exécutez le protocole d'imagerie de la console du scanner en sélectionnant chaque étape du protocole de la fenêtre de protocole et le faisant glisser vers la liste d'exécution. Une fois prêt, exécuter la séquence en appuyant sur Numériser / Exécuter ou le bouton équivalent.
- Acquérir gradient 2D écho séquences base en utilisant des paramètres de séquence dans le tableau 1, dans les trois axes orthogonaux à l'image de la mi-molletdessus de la crête iliaque et l'utilisation comme localisateurs / scouts.
- Effectuer le temps de balayages vol (TOF) d'angiographie dans chaque segment tel que spécifié dans le tableau 1
NOTE: Ces analyses sont également utilisés comme localisateurs pour aider à différencier les artères de veines comme un agent de contraste à long circulant est utilisé dans l'état d'équilibre dans ce protocole. Cette vision de l'arbre artériel est assez limité et ne sert qu'à aider l'analyste d'image différencier les artères de la vascularisation veineuse et ne sert pas de l'angiographie à part entière. - Pour éviter l'acquisition d'images de mauvaise qualité à la mesure inférieure et supérieure du volume d'imagerie, d'acquérir trois coronales 40 cm segments dans le pied à direction de chevauchement de 10 cm de la tête pendant les balayages en écho de gradient 3D T1-pondérés.
NOTE: Ces trois segments englobent: a) mi-mollet pour dessus du genou b) ci-dessus du genou à la cuisse / partie inférieure du bassin, et c) la cuisse / bassin pour abdomen La figure 1 montre des exemples d'images avec les trois lieux d'acquisition.illustré. - Pour faire la distinction entre la thrombose veineuse aiguë et chronique, d'acquérir T1W imagerie directe d'un thrombus (DTHi) et en écho de gradient 3D (GRE) séquences en utilisant des paramètres dans le tableau 1.
NOTE: Ces 3 scans servent aussi de l'analyse pré-contraste pour l'acquisition MRV. L'étendue de la couverture de ces acquisitions est le même que les localisateurs initiales acquises dans les trois endroits indiqués sur la figure 1. Séquence GRE est également facilement réalisable sur différentes plates-formes et de balayage à travers des intensités de champ de formation d'image.
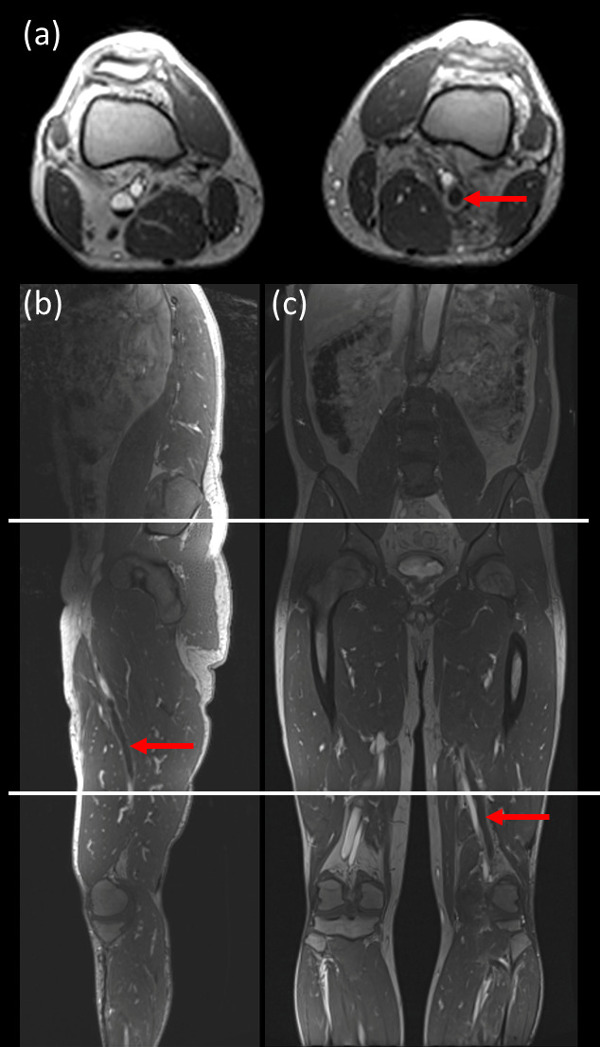
Figure 1:. Exemples d'images montrant l'emplacement d'acquisition pour les 3 stations utilisés pour l'imagerie Le champ de vision dans la direction coronale et axiale était de 40 cm pour chaque position du lit [acquisition: (mi-mollet pour dessus du genou), (ci-dessus les genoux à cuisse / bassin), (cuisse / pelvis à l'abdomen)] avec 10 cm de chevauchement entre chaque position de lit. (A) l'image axiale; (B) l'image sagittal et (c) l'image coronale. La flèche rouge indique la TVP. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
- Administrer l'agent de contraste (gadofosveset trisodique) à une dose de 0,03 mmol / kg (0,12 ml / kg) par voie intraveineuse dans le sujet à un débit de 2 ml / s et rincer avec 20 ml de solution saline. Que l'agent de contraste circuler pendant 5 min pour assurer un état stable dans la piscine de sang.
- Acquérir les images de MRV; après contraste gradient 3D séquences en écho à 3 endroits décrits précédemment. Voir les paramètres de la séquence dans le tableau 1 et le tableau 2. Utilisez ces images pour déterminer les emplacements et la taille du thrombus.
fichiers / ftp_upload / 52761 / 52761table1.jpg "/>
Tableau 1: Basse extrémité M. protocole phlébographie avec l'agent de contraste, gadofosveset trisodique, y compris l'imagerie de thrombus directe.
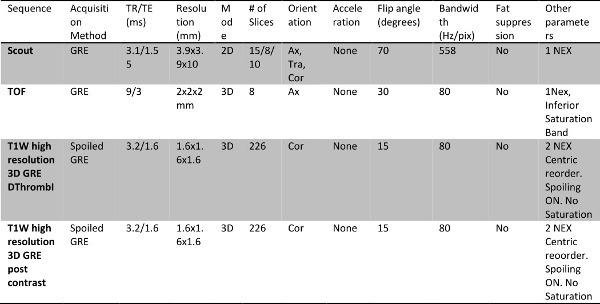
Tableau 2: Le paramètre d'imagerie spécifique pour chaque séquence acquise dans le protocole.
- Après analyse est terminée, retirez l'objet à partir du scanner IRM et sortir la ligne intraveineuse. Demandez au sujet de changer de robe et quitter l'établissement.
3. Analyse de l'image
- Effectuer l'analyse d'image sur un poste de travail d'analyse d'images dédié exécutant le logiciel approuvé par la FDA de traitement d'image open source tels que OsiriX MD 20, par 2 analystes d'images formés. Assurer les analystes ont un minimum de 3 ans d'expérience chacun.
- Aveugler temporairement toutes les images avant le transfert à l'imageanalyste poste de travail pour l'analyse.
- Assurez-vous que un radiologue évalue chaque IRM pour la présence et l'emplacement de thrombus. Fournir l'évaluation du radiologue à l'analyste de l'image pour être utilisé comme un guide tout au long de l'analyse.
- Charger toutes les images DICOM de deux visites d'IRM d'un objet dans le logiciel de traitement d'image en sélectionnant "importation", et de comparer les deux imagerie temps-points de la série MRV pour chaque sujet pour assurer une couverture spatiale adéquate et d'enregistrement à travers des points de temps.
- Sélectionnez l'outil "3D MPR" dans la visionneuse de fournir la navigation simultanée de données d'image en 3 vues orthogonales (axial, coronal et sagittal).
NOTE: le mode 3D de MPR Le logiciel de traitement d'image permet la visualisation des navires d'intérêt.
- Sélectionnez l'outil "3D MPR" dans la visionneuse de fournir la navigation simultanée de données d'image en 3 vues orthogonales (axial, coronal et sagittal).
- Analyser les bâtiments suivants TVP est présent: iliaque externe, fémorale commune, fémorale superficielle, fémorale profonde, poplité, tibial antérieur, tibial postérieur I &II, jumeau I & II, et péronier I & II veines. Toutes analyse se limite aux régions des vaisseaux qui sont présents dans les images de deux points dans le temps.
- Évaluer la qualité de l'image pour chaque veine avec TVP connu comme indiqué par l'évaluation du radiologue sur une échelle 0-5, avec 0-2 et 3-5 étant inanalysable étant analysable pour les deux séquences DTHi et MRV. Pour la ventilation du système de notation voir la figure 2.
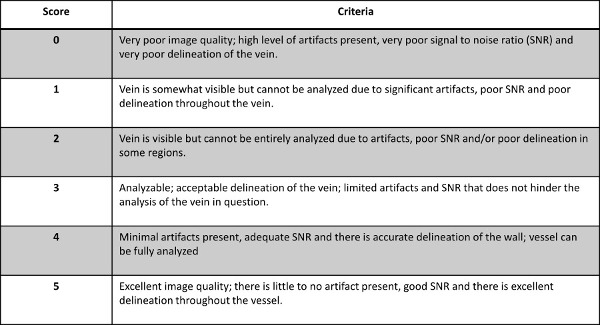
Figure 2: L'effondrement du système de notation utilisé pour évaluer la qualité des images pour chaque veine d'intérêt avec TVP connu.
- Pour l'analyse MRV, d'analyser chaque navire individuellement. Après la reconstruction multiplanaire courbe 3D, utilisez contours suivants de la ligne médiane de chaque veine, tracée par l'analyste, pour générer trajectoire courbe pour chaque veine et enregistrer dans un fichier.
- Établir la position du thrombus dans l'espace à trois dimensions. De l'avion MPR courbe, un trajet de Bézier 3D sera affiché.
- Délimiter la ligne médiane de la veine en sélectionnant du "Chemin Contour" outil "Mode Création".
- La place des points à plusieurs reprises sur l'un de la vue orthogonale MPR pour redresser le navire tout entier d'intérêt.
- Faire les ajustements nécessaires pour assurer que le navire est entièrement redressé en "mode d'édition"
- Lorsque le chemin de contour est délimité avec précision dans l'axe du bateau, sauf en sélectionnant l'icône "trajectoire courbe" pour exporter le fichier
- Générer 1 mm coupes axiales perpendiculaire à la trajectoire courbe et enregistrer en tant que fichiers DICOM (Figure 3). Observez la la trajectoire courbe, navire redressé, et les images axiales correspondantes pour quantifier la TVP à partir d'images de MRV.
REMARQUE: Les images rendues dans la visionneuse 3D Curved MPR doivent ensuite être exportés in le format DICOM et ajouté à la base de données comme une nouvelle série d'images.
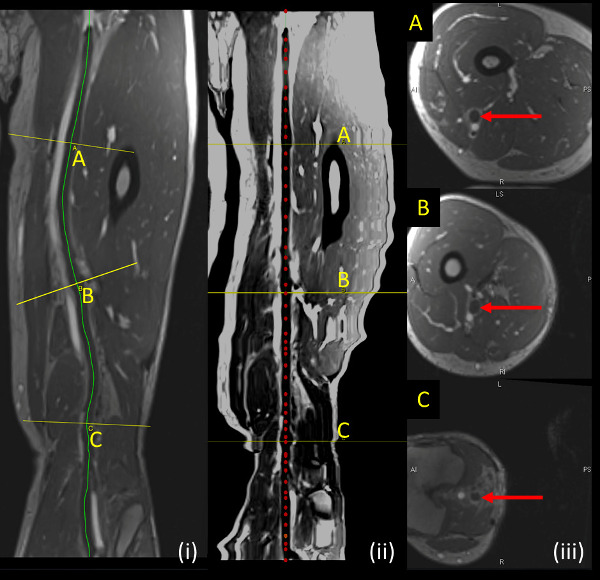
Figure 3:. TVP de l'échantillon représenté sur la séquence MRV (i, panneau de gauche) trajectoire courbe (ligne jaune) illustre le contour suivie par la veine en cours d'analyse. (Ii, panneau du milieu) navire Redresser le long axe du navire en cours d'analyse (ligne rouge pointillée) (iii, panneau de droite) montre coupes axiales perpendiculaire à la veine d'être analysés à des endroits indiqués par des lignes jaunes (A, B, C) sur des sections longitudinales. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
- Sur ces images DICOM axiales, manuellement des régions de segmentintérêt englobant le thrombus (voir Figure 4) en utilisant le "Polygone fermé ROI Tool". Enregistrer les régions d'intérêt à déposer en sélectionnant l'option "Enregistrer tous les ROI de cette série" situé dans le "retour sur investissement" dans le menu déroulant et enregistrer des mesures de ROI en naviguant dans le menu "Plugins" puis sélectionnez "Outils de ROI" suivi de "ROI à l'exportation ». Cela devrait être enregistré dans un format CSV.
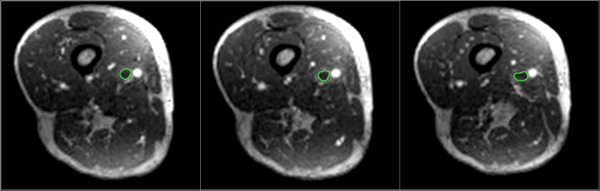
Figure 4:. Manuellement régions segmentées d'intérêt (vert) sont présentés englobant le thrombus sur axiales reformaté images DICOM S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
- Calculer le volume d'un thrombus en multipliant le ar ea sur chaque tranche analysé par l'épaisseur de la tranche (1 mm) en utilisant une coutume construit le script Matlab. Calculer le volume de thrombus totale dans chaque objet en ajoutant les volumes de thrombus dans chaque récipient.
- Pour l'analyse DTHi, identifier les thrombus frais comme les régions lumineuses sur pré-contraste en écho de gradient T1 3D scans 13 dans les régions de TVP segmentés par le MRV.
- Sur les images de pré-contraste axiales, calculer le volume du thrombus frais en dessinant des régions d'intérêt (ROI) manuellement comme représenté sur la Figure 5. Sur la figure 6, les images de l'échantillon mesurée par DVT indiquant DTHi en conjonction avec les images MRV sont représentés.
- Ouvrez les pré-et post-contraste contraste séquences côté de l'autre. Sélectionnez "axial" vue et de délimiter les régions lumineuses le long du navire d'intérêt en utilisant le "ROI outil de polygone fermé".
es / ftp_upload / 52761 / 52761fig5.jpg "/>
Figure 5: DVT l'échantillon présentée sur la séquence d'imagerie DTHi (a) coronale, (b) l'image axiale, et (c) l'image axiale montrant région d'intérêt (vert) tracée thrombus autour frais (flèches bleues) sur les images pré-contraste.. Les images DTHi sont acquises avant l'injection de produit de contraste et reposent sur le contenu met-hémoglobine du thrombus pour produire le signal lumineux.

Figure 6:. TVP échantillon montré sur la séquence d'imagerie DTHi Les panneaux de gauche montrent des images MRV avec des vides de signaux indiquant TVP totale (flèches vertes). Le spectacle de panneau de droite images DTHi correspondant avec un signal lumineux indiquant la présence d'un thrombus frais (flèches bleues). S'il vous plaît cliquer ici pour voir uneplus grande version de ce chiffre.
4. Évaluation de la reproductibilité
- Évaluer un sous-ensemble de dix sujets à la reproductibilité de l'analyse.
- Effectuer l'analyse, comme décrit ci-dessus, par deux analystes d'images séparées (primaires et secondaires) lecteurs à évaluer variabilité inter-observateur
- Assurez-vous que le lecteur primaire effectue également une seconde analyse d'image trois mois après la première analyse pour évaluer la variabilité intra-observateur des résultats.
- Calculer des coefficients intra-classe-corrélation (CPI) et d'effectuer une analyse de Bland-Altman pour évaluer inter et intra-observateur reproductibilité. Effectuer un test t un échantillon de regarder de biais sur l'analyse de Bland-Altman. CPI> 0,9 et pas de biais sur l'analyse de Bland-Altman sont jugés acceptables.
Résultats
Aux fins des évaluations de la reproductibilité, la ligne de base et le suivi des analyses ont été rassemblées et analysées comme des cas distincts. Depuis les 10 sujets choisis au hasard (2 visites chacun), il y avait 59 navires avec TVP identifiés en utilisant l'approche de MRV et 29 navires avec thrombus frais identifié par le DTHi. Dans le sous-ensemble de ces 10 sujets sélectionnés au hasard analysés pour les paramètres de reproductibilité, pas de vaisseaux présentant une TVP étaient réputés ê...
Discussion
Cette étude a démontré la faisabilité de la quantification de la thrombose veineuse profonde sur veinographie MR en utilisant gadofosveset trisodique comme agent de contraste, avec une excellente reproductibilité de l'analyse pour la quantification du volume d'un thrombus dans un cadre multicentrique. Pour calculer le volume de thrombus totale, la principale méthode utilisée post-contraste MRV analyse pour mesurer le volume de thrombus. La deuxième méthode utilisée est la méthode d'imagerie de thr...
Déclarations de divulgation
Venkatesh Mani has received research grants from Novartis. Nadia Alie, Sarayu Ramachandran, Cecilia Besa, Philip Robson and Bachir Taouli have nothing to disclose. Michele Mercuri and Michael Grosso are employees of Daiichi Sankyo. Greg Piazza has received research grants from Daiichi Sankyo, BMS, EKOS, and the Thrombosis Research Institute. Samuel Goldhaber has received grants from BMS, Daiichi Sankyo, EKOS, NHLBI and the Thrombosis Research Institute. He is a consultant for Ariad, Bayer, Boehringer Ingelheim, Bristol Myers Squibb, Daiichi Sankyo, Genentech, Janssen, Merck, Pfizer and Portola. Zahi Fayad has received research grants from Daiichi Sankyo, Roche, GlaxoSmithKline, Merck, VBL Therapeutics, Novartis, Bristol-Myers Squibb, and Via Pharmaceuticals.
Remerciements
The authors have no acknowledgements.
matériels
| Name | Company | Catalog Number | Comments |
| Ablavar (gadofosveset trisodium) | Lantheus | Contrast Agent | |
| 1.5 T or 3 T Scanners | GE, Siemens, or Phillips | GE (Horizon, Signa, Hdx, 750), Siemens (Symphony, Avanto, Sonata, Trio, Aera) or Philips (Intera, Achieva) |
Références
- Goldhaber, S. Z. Venous thromboembolism: epidemiology and magnitude of the problem. Best Pract Res Clin Haematol. 25, 235-242 (2012).
- Huisman, M. V., Klok, F. A. Diagnostic management of acute deep vein thrombosis and pulmonary embolism. J Thromb Haemost. 11, 412-422 (2013).
- Ramzi, D. W., Leeper, K. V. DVT and pulmonary embolism. Part I. Diagnosis. Am Fam Physician. 69, 2829-2836 (2004).
- Wilbur, J., Shian, B. Diagnosis of deep venous thrombosis and pulmonary embolism. Am Fam Physician. 86, 913-919 (2012).
- Goodacre, S., Sampson, F., Thomas, S., van Beek, E., Sutton, A. Systematic review and meta-analysis of the diagnostic accuracy of ultrasonography for deep vein thrombosis. BMC Med Imaging. 5, 6 (2005).
- Elias, A., et al. A single complete ultrasound investigation of the venous network for the diagnostic management of patients with a clinically suspected first episode of deep venous thrombosis of the lower limbs. Thromb Haemost. 89, 221-227 (2003).
- Farahmand, S., Farnia, M., Shahriaran, S., Khashayar, P. The accuracy of limited B-mode compression technique in diagnosing deep venous thrombosis in lower extremities. Am J Emerg Med. 29, 687-690 (2011).
- Sampson, F. C., Goodacre, S. W., Thomas, S. M., van Beek, E. J. The accuracy of MRI in diagnosis of suspected deep vein thrombosis: systematic review and meta-analysis. Eur Radiol. 17, 175-181 (2007).
- Moody, A. R. Direct imaging of deep-vein thrombosis with magnetic resonance imaging. Lancet. 350, 1073 (1997).
- Phinikaridou, A., et al. In vivo magnetization transfer and diffusion-weighted magnetic resonance imaging detects thrombus composition in a mouse model of deep vein thrombosis. Circ Cardiovasc Imaging. 6, 433-440 (2013).
- Phinikaridou, A., Qiao, Y., Giordano, N., Hamilton, J. A. Detection of thrombus size and protein content by ex vivo magnetization transfer and diffusion weighted MRI. J Cardiovasc Magn Reson. 14, 45 (2012).
- Carpenter, J. P., et al. Magnetic resonance venography for the detection of deep venous thrombosis: comparison with contrast venography and duplex Doppler ultrasonography. J Vasc Surg. 18, 734-741 (1993).
- Westerbeek, R. E., et al. Magnetic resonance direct thrombus imaging of the evolution of acute deep vein thrombosis of the leg. J Thromb Haemost. 6, 1087-1092 (2008).
- Koizumi, J., et al. Magnetic resonance venography of the lower limb. Int Angiol. 26, 171-182 (2007).
- Goyen, M. Gadofosveset: the first intravascular contrast agent EU-approved for use with magnetic resonance angiography. Future Cardiol. 3, 19-26 (2007).
- Aime, S., Caravan, P. Biodistribution of gadolinium-based contrast agents, including gadolinium deposition. J Magn Reson Imaging. 30, 1259-1267 (2009).
- Shamsi, K., Yucel, E. K., Chamberlin, P. A summary of safety of gadofosveset (MS-325) at 0.03 mmol/kg body weight dose: Phase II and Phase III clinical trials data. Invest Radiol. 41, 822-830 (2006).
- Zhang, H. Trisodium-[(2-(R)-[(4,4-diphenylcyclohexyl)phosphono-oxymethyl]-diethylenetriamin epentaacetato)(aquo)gadolinium(III). Gadofosveset. , (2004).
- Pfeil, A., et al. Magnetic resonance VIBE venography using the blood pool contrast agent gadofosveset trisodium--an interrater reliability study. Eur J Radiol. 81, 547-552 (2012).
- Rosset, A., Spadola, L., Ratib, O. OsiriX: an open-source software for navigating in multidimensional DICOM images. J Digit Imaging. 17, 205-216 (2004).
- Ouriel, K., Greenberg, R. K., Green, R. M., Massullo, J. M., Goines, D. R. A volumetric index for the quantification of deep venous thrombosis. J Vasc Surg. 30, 1060-1066 (1999).
- Elias, A., et al. A single complete ultrasound investigation of the venous network for the diagnostic management of patients with a clinically suspected first episode of deep venous thrombosis of the lower limbs. Thromb Haemost. 89, 221-227 (2003).
- Farahmand, S., Farnia, M., Shahriaran, S., Khashayar, P. The accuracy of limited B-mode compression technique in diagnosing deep venous thrombosis in lower extremities. Am J Emerg Med. 29, 687-690 (2011).
- Thomas, S. M., Goodacre, S. W., Sampson, F. C., van Beek, E. J. Diagnostic value of CT for deep vein thrombosis: results of a systematic review and meta-analysis. Clin Radiol. 63, 299-304 (2008).
- Heverhagen, J. T., Krombach, G. A., Gizewski, E. Application of Extracellular Gadolinium-based MRI Contrast Agents and the Risk of Nephrogenic Systemic Fibrosis. Rofo. , (2014).
- Alhadad, A., et al. Safety aspects of gadofosveset in clinical practice - analysis of acute and long-term complications. Magn Reson Imaging. , (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon