Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine multizentrische MRI-Protokoll für die Beurteilung und Quantifizierung von tiefen Venenthrombosen
In diesem Artikel
Zusammenfassung
The goal of this study is to use magnetic resonance venography with long-circulating gadolinium-based contrast agent and direct thrombus imaging for quantitative evaluation of DVT volume in a multicenter, clinical trial setting. Inter- and intra-observer variability assessments were conducted, and reproducibility of the protocol was determined.
Zusammenfassung
Wir untersuchten eine Magnetresonanz Phlebographie (MRV) Ansatz mit Gadofosveset bis Thrombus Volumenänderungen insgesamt als Hauptkriterium für die Wirksamkeit der Behandlung in einer multizentrische randomisierte Studie zum Vergleich Edoxaban Monotherapie mit Heparin / Warfarin-Therapie zur Behandlung von akuter, symptomatischer unteren Extremitäten tiefe Venenthrombose zu quantifizieren (DVT ) Behandlung. Wir haben auch eine direkte Abbildung von Thromben Ansatz (DTHi, ohne den Einsatz von Kontrastmittel) an die frische Thrombus zu quantifizieren. Wir haben dann versucht, die Reproduzierbarkeit der Analysemethodik und Anwendbarkeit der Verwendung von 3D-Magnetresonanz Phlebographie und direkte Abbildung von Thromben zur Quantifizierung von DVT in einer multizentrischen Studie Einstellung zu bewerten. Von 10 zufällig ausgewählten Probanden, die an der Edoxaban Thrombus Reduction Imaging Study (ETRIS) wurde Gesamt Thrombus Volumen in der gesamten unteren Extremität tiefe Venensystem bilateral quantifiziert. Die Probanden wurden mit Hilfe von 3D-T1W Gradientenechosequenzen vor (direkte t abgebildethrombus Bildgebung DTHi) und 5 min nach der Injektion von 0,03 mmol / kg Gadofosveset Trinatriumsalz (Magnetresonanz Phlebographie MRV). Die Ränder des DVT auf entsprechende axiale, gekrümmte multiplanare neu formatiert Bilder wurden von Hand durch zwei Beobachter abgegrenzt, um volumetrische Messung des venösen Thromben zu erhalten. MRV wurde verwendet, um insgesamt DVT Volumen zu berechnen, während DTHi wurde verwendet, um Volumen frischen Thrombus zu berechnen. Intra-Class-Korrelation (ICC) und Bland Altman-Analyse durchgeführt, um inter- und intra-observer Variabilität der Analyse zu vergleichen. Das ICC für inter und intra-observer Variabilität war ausgezeichnet (0,99 und 0,98, p <0,001) ohne Vorspannung an Bland-Altman-Analyse für MRV Bilder. Für DTHi Bilder, waren die Ergebnisse etwas niedriger (ICC = 0,88 und 0,95 bzw. p <0,001), mit Tendenz zur Interobserver-Ergebnisse auf Bland-Altman-Plots. Diese Studie zeigte, Machbarkeit der Thrombus Volumenschätzung in DVT mit MRV mit Gadofosveset Trinatriumsalz, mit guten intra- und inter-Beobachter Reproduzierbarkeit in einer multizentrischen Einstellung.
Einleitung
Venösen Thromboembolien (VTE) wirkt 300,000-600,000 Personen in den Vereinigten Staaten jedes Jahr 1. Tiefe Venenthrombose (DVT) ist die häufigste Darstellung von VTE und betrifft am häufigsten die Wade, Oberschenkel oder Beckenvenen. Die Diagnose, Management und Follow-up von Patienten mit DVT nicht allein auf klinische Untersuchungen beruhen, da die Anzeichen und Symptome dieser Erkrankung sind unspezifisch 2,3. Während Bluttests (wie zB D-Dimer) kann helfen, aus, die Diagnose von DVT wird Bildgebung erforderlich ist, um das Vorhandensein von DVT 4 etablieren. Compression Ultraschall (CUS) ist derzeit der am häufigsten verwendeten bildgebenden Test bei der Diagnose von akuter DVT vermutet. CUS ist billig und weist eine hohe Empfindlichkeit und Spezifität zu akuten TVT 5 detektieren. Allerdings kann CUS nicht zuverlässig beurteilen die tiefen Venen im Becken 6. Zusätzlich kann CUS nicht direkt zu quantifizieren Thrombus Volumen und Zusammensetzung, die bei der Unterscheidung zw wichtig sindeen akuten TVT (eine potentielle Quelle einer Lungenembolie (PE)) und chronisch DVT (weniger wahrscheinlich zu embolisieren) und zur Bewertung der therapeutischen Wirksamkeit 7.
Anders als Computertomographie (CT), Magnetresonanztomographie (MRI) liefert nicht ionisierende Strahlung, und ist daher für Reihenuntersuchungen zur Thrombusbildung Evolution oder Regression auswerten. Verglichen mit CUS, können MRI Becken DVT erkennen und genauer zu definieren proximalen (V. poplitea und höher) und distalen Schenkel (unten V. poplitea) DVT 8, zur besseren Bewertung der Gefahr von PE. MRI kann Thrombusalter und Organisation zu charakterisieren, und kann helfen, zu unterscheiden akuten chronischen DVT 9-11 (Ref aktualisiert). Die Quantifizierung der Thrombus Volumen, eine wichtige Kennzahl, um die Seuchenentwicklung und Reaktion auf die Behandlung zu bewerten, ist machbar mit MR-Bildgebung. Aktuelle Magnetresonanz Venographie Protokolle werden nach der Injektion von Gadolinium (Gd) Kontrastmittel 12 durchgeführt. Diesesind niedermolekulare Moleküle, die schnell extravasieren nach der Injektion, und erfordern eine sorgfältige Timing, die benötigt wird, um den Thrombus 13,14 richtig visualisieren Venenkontrastierung Phase zu erfassen.
Ein Proof-of-Concept-Studie, Edoxaban Thrombus Reduction Imaging Study (ETRIS), unter Verwendung einer Open-Label-Design, untersuchte die Wirksamkeit und Sicherheit von Edoxaban 90 mg einmal täglich über 10 Tage, gefolgt von Edoxaban 60 mg einmal täglich bei der Behandlung akuter, symptomatischer DVT (ClinicalTrials.gov Identifier: NCT01662908). ETRIS befasst, ob Edoxaban Monotherapie, ohne gleichzeitige niedermolekulares Heparin (NMH) zum Zeitpunkt der Einleitung der Behandlung, ist effektiver als Standard-Behandlung mit LMW Heparin / Warfarin-Therapie bei Patienten mit DVT, wie von der Prozent (%) Änderung von bewertet Baseline in Thrombus Volumen / Größe (MRT gemessen) an Tag 14-21.
Ein weiteres Ziel der ETRIS war die Entwicklung und Validierung eine einfache MRVenographie (MRV) Bildaufnahme und Analyse-Protokoll für die Quantifizierung von Thrombus Volumen DVT. Um einige Herausforderungen durch aktuelle MRV-Protokolle in Multicenter-Einstellungen, zu überwinden, verwendeten wir eine kürzlich von der FDA zugelassene, langfris zirkulierenden, Gadolinium-basierte Blutpool-Kontrastmittel (Gadofosveset Trinatriumsalz). Gegenüber der Verwendung von extrazellulären Gd-Chelate (zB Gd-DTPA) zur MRV hat Gadofosveset eine signifikant längere Zirkulationszeit, die Verwendung eines einfacheren MR Erfassungsschema erlaubt, ohne jede Zeit Akquisitionen. Gadofosveset Trinatriumsalz ist ein Blut-Pool-MRT-Kontrastmittel, die für 2-3 Stunden nach intravenöser Injektion 15,16 zirkuliert. Sicherheitsprofils ist ähnlich zu denen von herkömmlichen extravaskulären extrazellulären Kontrastmitteln 17. Es ermöglicht stationäre Abbildungs der Vaskulatur über einen Zeitraum von 1 Std. Daher ist keine bedienerabhängig Zeitpunkt der Bildaufnahme nach der Kontrastmittelinjektion erforderlich. Der zusätzliche Vorteil,für die Verwendung dieser Kontrastmittel ist, dass es ein kleines Molekül (Molekulargewicht 857 Da) 18 und die Seiten kann auch ein vollständig okkludierte Thrombus dringen, wodurch eine ausgezeichnete Kontrast des DVT aus der Umgebung auf der MRV und ermöglicht quantitative Berechnung der DVT Bände. Frühere Studien haben die Interrater-Reliabilität der Visualisierung von Venen mit Hilfe der MR Volume Interpolierte Apnoe-Prüfung (VIBE) Phlebographie mit Gadofosveset Trinatriumsalz 19 etabliert. Hier verwenden wir einen ähnlichen Ansatz in einer multizentrischen klinischen Studie Einstellung auf tiefe Venenthrombose zu bewerten und nutzen die Lautstärke der DVT von MRI als Endpunkt gemessen. ETRIS bietet eine ideale Plattform, um die Durchführbarkeit und Reproduzierbarkeit der Analyse der hier vorgeschlagenen MRV Bildgebung Ansatz zu bewerten, mit einem langfris zirkulierenden Gd-basierten Blutpool-Kontrastmittel für die Bewertung DVT Bände. Darüber hinaus bewerten wir die Verwendung einer direkten Abbildung von Thromben (DTHi) Ansatz, um das Ausmaß der frischen DVT vor der Quantifizierungdie Injektion von Kontrastmitteln.
Die erste innerhalb von 36 Stunden nach der Randomisierung in die Edoxaban Monotherapie-Gruppe oder Heparin / Warfarin-Gruppe und die zweite zwischen 14 bis 21 Tagen nach der Randomisierung: zwei MRT-Untersuchungen wurden im Rahmen der Studie durchgeführt. Die Analysen aller Bilder wurden von einem zentralen Kernlabor durchgeführt. Volumen frischen Thrombus wird aus einer Direkt Thrombus Imaging (DTHi) in den Beinen und unteren Becken vor der Injektion von jedem Kontrastmittel berechnet. Die Gesamt Thrombus Volumen (frisch und alt) aus einem Beitrag Gegensatz Magnetresonanz Phlebographie (MRV) Bilder der Venen in den Beinen und unteren Becken berechnet.
Protokoll
Diese Studie wurde von der lokalen Ethik Boards bei allen teilnehmenden Zentren zugelassen. Alle Patienten in der multizentrischen Studie mit schriftlicher Einwilligung in ETRIS an ihren jeweiligen Institutionen zu beteiligen.
1. Image Acquisition
- Führen Sie die MR-Bildgebung an einem 1,5 T oder 3 T-Ganzkörperscan mit spezialisierten Phased-Array-Spulen für MRV, wie eine periphere vaskuläre Spule, Körpermatrixspulen oder Ablaufspulen. Verwenden Sie diese Spulen in Verbindung mit anderen Körpermatrixspulen oder Spulen Wirbelsäule. Wenn keine geeigneten Fachspulen zur Verfügung stehen, verwenden Sie die Körperspule statt.
HINWEIS: Verwenden Sie handelsüblichen Scanner wie Siemens Symphonie, Sonata, usw.- Screen Thema, und schreiben MRI-Sicherheit Fragebogen vor scannen. Haben vorbehaltlich Änderung in ein Gewand.
- Ein intravenösen im Antekubitalvene der Gegenstand für die Injektion des Kontrastmittels. Folgen Sie Standardsicherheits procedures zum Einspritzen eines Gadolinium-basierte Kontrastmittel.
- Orten, an denen in Rückenlage, Füße erste Position in der MRT-Gerät und die Position geeigneten Spulen auf Bereiche gescannt werden soll. Sichere Spulen mit Klettverschlüssen, wie gebraucht.
- Befestigen Sie unterliegen Beine / Füße Bewegungsartefakte während der MRT-Untersuchung zu verhindern.
- Schalten Sie den Laser Zentrierung und bewegen Sie die Tabelle, bis die Laserquerbalken sind knapp unter die Knie des Patienten (Patella) entfernt. Übernehmen Sie diese Position für die iso-Zentrum der Scan und bewegen Sie den Patiententisch in die Mittelstellung des Scanners Bohrung.
- Messen Sie die Kreatinin-Clearance (CrCl) und bestimmen Sie die Dosis des Kontrastmittels, um das Thema auf der Grundlage Körpergewicht benutzt werden. Wenn Kreatinin-Clearance <30 ml / min, unterworfen wird von der Studie ausgeschlossen. Für Personen mit CrCl> 30 ml / min, aber weniger als 45 ml / min, 0,01 mmol / kg des Kontrastmittels verwendet. Für Personen mit CrCl> 45 ml / min, aber <60 ml / min, 0,02 mmol / kg gadofosveset injiziert wird. Für Personen mit normaler Nierenfunktion (Kreatinin-Clearance> 60 ml / min) wird eine Dosis von 0,03 mmol / kg (0,12 ml / kg) Gadofosveset Trinatriumsalz eingesetzt. Eine MRT-kompatiblen Power-Injektor verwendet wird, um das Kontrastmittel zu injizieren.
- Führen bilaterale Bildgebung beider Beine und unteren Becken in einem einzigen Prüfungssession Dauer ca. 60 min, wie in Tabelle 1 gezeigt und in MRI-Protokoll beschrieben.
HINWEIS: anonymisieren Patientendaten vor der Bilder für die Analyse zu übertragen, um einen zentralen Kern Labor.
2. MRI Protocol
- Führen Sie den Imaging-Protokoll aus dem Scanner-Konsole, indem Sie jedes Protokoll Schritt aus dem Protokoll-Fenster und ziehen Sie es an die Ausführungsliste. Einmal fertig, führen Sie die Reihenfolge, indem Sie Scan / Execute oder gleichwertige Taste.
- Erwerben Sie 2D-Gradienten Echo basierten Sequenzen unter Verwendung von Sequenzparameter in Tabelle 1, in der drei orthogonalen Achsen zu Bild aus zur Mitte der Wade zuüber dem Beckenkamm und Verwendung als Lokalisierer / Scouts.
- Führen der Flugzeit (TOF) Angiographie Scans in jedem Segment, wie in Tabelle 1 angegebenen
HINWEIS: Diese Scans sind auch als Lokalisierer verwendet werden, um zu helfen, zu unterscheiden von Arterien Venen als eine lange zirkulierenden Kontrastmittel im stationären Zustand in diesem Protokoll verwendet. Diese Ansicht des arteriellen Baum ist recht begrenzt und nur dazu dient, um zu helfen das Bild Analyst unterscheiden die Arterien aus dem venösen Gefäßsystem und nicht als vollwertige angiogram dienen. - Den Erwerb Bildern schlechter Qualität auf der unteren und oberen Umfang des Bildgebungsvolumens zu vermeiden, zu erwerben drei Kranzsegmente 40 cm in den Fuß, um den Kopf Richtung während der 3D-T1-gewichteten Gradientenecho-Scans lappend um 10 cm.
Hinweis: Diese drei Segmente umfasst: a) zur Mitte der Wade bis oberhalb des Knies b) über dem Knie bis zum Oberschenkel / untere Becken und c) Oberschenkel / Becken Abdomen 1 zeigt Beispielbilder mit den drei Standorten Erwerb.dargestellt. - Um zwischen akuten und chronischen Venenthrombose zu unterscheiden, zu erwerben T1W direkte Abbildung von Thromben (DTHi) und 3D-Gradientenecho (GRE) Sequenzen mit Hilfe von Parametern in Tabelle 1.
Hinweis: Diese 3-Scans auch als Vor-Kontrast-Scan für die MRV Nahme dienen. Der Umfang der Berichterstattung dieser Akquisitionen ist die gleiche wie die in den drei in Abbildung Standorten erworben Anfangs Lokalisierer 1. GRE-Sequenz ist auch auf verschiedene Scan-Plattformen und über bildgebende Feldstärken leicht implementierbar.
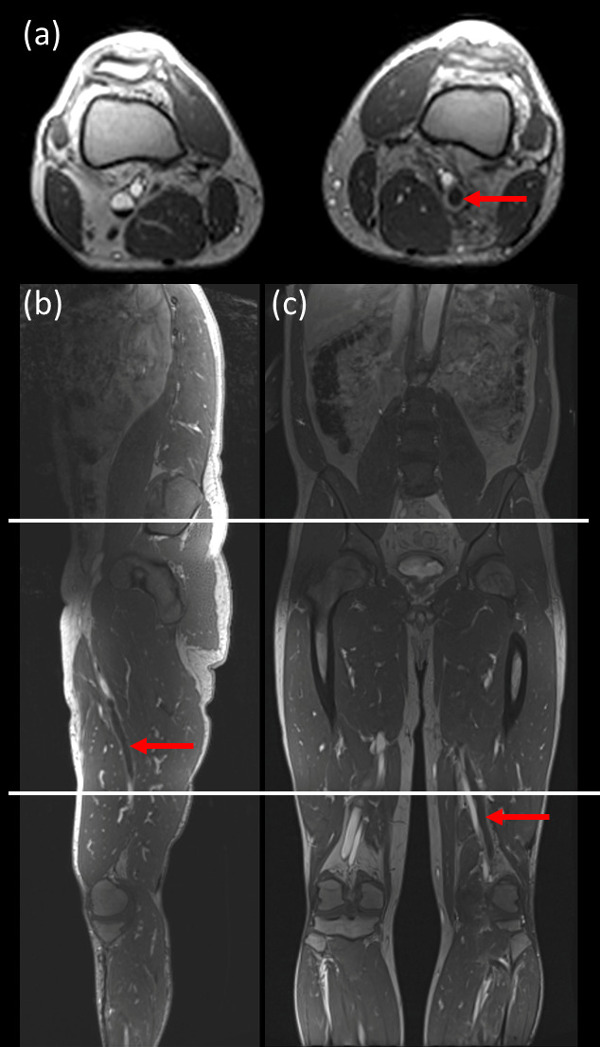
Abb. 1: Beispielbilder, die Standorte für die Akquisition 3 Stationen für die Bildgebung verwendet Das Sichtfeld in der Frontalrichtung und axialer Richtung war 40 cm für jedes Bett Position [Erwerb: (zur Mitte der Wade bis oberhalb des Knies), (oben Knie Oberschenkel / Becken), (Oberschenkel / Hüfte zum Abdomen)] mit 10 cm Überlappung zwischen den einzelnen Bettposition. (A) axiale Bild; (B) Sagittalbild und (c) koronalen Bild. Rote Pfeil zeigt DVT. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Verwalten des Kontrastmittels (Gadofosveset Trinatriumsalz) in einer Dosis von 0,03 mmol / kg (0,12 ml / kg) intravenös in den Patienten mit einer Geschwindigkeit von 2 ml / sec und bündig mit 20 ml Kochsalzlösung. Lassen Sie das Kontrastmittel zirkulieren für 5 min auf einen stabilen Zustand in den Blutpool zu sichern.
- Erwerben MRV Bilder; Beitrag Kontrast 3D-Gradienten-Echo-Sequenzen an 3 Standorten zuvor beschrieben. Siehe die Sequenz Parameter in Tabelle 1 und Tabelle 2. Verwenden Sie diese Bilder, um die Orte und die Größe der Thromben zu bestimmen.
Dateien / ftp_upload / 52761 / 52761table1.jpg "/>
Tabelle 1: Untere Extremität MR Venographie Protokoll mit dem Kontrastmittel Gadofosveset Trinatriumsalz, einschließlich der direkten Abbildung von Thromben.
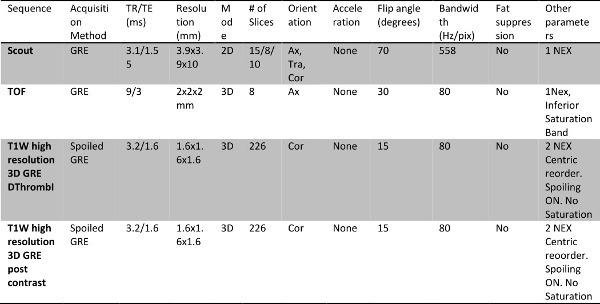
Tabelle 2: Die spezifische Bildaufnahmeparameter für jeden der erfassten Sequenz Protokoll.
- Nach der Scan abgeschlossen ist, entfernen Sie unterliegen der MRI-Scanner und nehmen Sie die Infusionsleitung. Ersucht den Patienten, von Kleid zu ändern und verlassen die Anlage.
3. Bildanalyse
- Führen Sie die Bildanalyse auf einem dedizierten Bildanalyse-Workstation mit der FDA zugelassene Open-Source-Bildbearbeitungssoftware wie OsiriX MD 20, um 2 ausgebildete Bild Analysten. Stellen Sie sicher, die Analysten haben mindestens 3 Jahre Berufserfahrung jeder.
- Alle Bilder vorübergehend blind vor der Übertragung auf das Bild,Analysten-Workstation für die Analyse.
- Stellen Sie sicher, dass ein Radiologe beurteilt jeder MRT-Untersuchung auf die Anwesenheit und Lage von Thromben. Bieten Einschätzung des Radiologen auf das Bild Analyst als Richtlinie in der gesamten Analyse verwendet werden.
- Laden Sie alle DICOM-Bilder von beiden MRI Besuche eines Subjekts in die Bildverarbeitungssoftware, indem Sie "Import" und vergleichen Sie die beiden bildgebenden Zeitpunkten der MRV-Serie für jedes Thema, um eine angemessene räumliche Abdeckung und Anmeldung über Zeitpunkte zu gewährleisten.
- Wählen Sie die "3D MPR" Werkzeug in Betrachter simultane Grasen von Bilddaten in 3 orthogonalen Ansichten (axial, koronal und sagittal) bereitzustellen.
Hinweis: 3D-MPR-Modus der Bildverarbeitungssoftware ermöglicht das Betrachten der Schiffe von Interesse.
- Wählen Sie die "3D MPR" Werkzeug in Betrachter simultane Grasen von Bilddaten in 3 orthogonalen Ansichten (axial, koronal und sagittal) bereitzustellen.
- Analysieren Sie die folgenden Schiffe, wenn DVT vorhanden ist: iliaca externa, femoralis, femoralis superficialis, tiefe Oberschenkel, Kniekehle, tibialis anterior, tibialis I &II, gastrocnemius I & II, und Wadenbein I & II Adern. All-Analyse wird auf Bereiche der Schiffe, die in Bildern von beiden Zeitpunkten vorhanden sind beschränkt.
- Bewerten Sie die Qualität des Bildes für jede Ader mit bekannten DVT wie von der Radiologe Einschätzung auf einer Skala von 0-5 angegeben ist, mit 0-2 als unzerlegbare und 3-5 ist zerlegbar für beide DTHi und MRV-Sequenzen. Für den Abbau von Scoring-System siehe Abbildung 2.
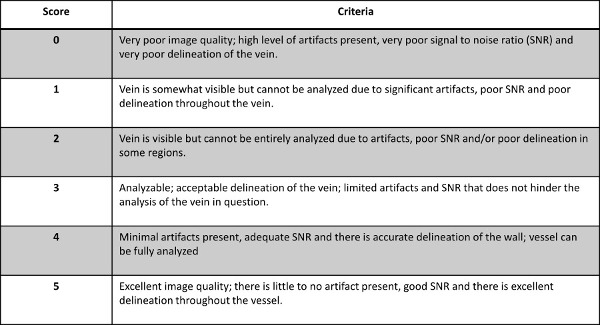
Abbildung 2: Der Zusammenbruch der Scoring-System zur Bewertung der Qualität der Bilder für jede Ader von Interesse mit bekannten DVT verwendet.
- Für MRV-Analyse, Analyse jedes Schiff einzeln. Nach der 3D-gekrümmte multiplanare Rekonstruktion, verwenden Konturen nach der Mittellinie jeder Ader des Analysten verfolgt, um gekrümmte Bahn für jede Ader zu erzeugen und zu speichern, um die Datei.
- Stellen die Position der Thrombusbildung in dem dreidimensionalen Raum. Von der Curved MPR-Ebene wird ein 3D-Bezier-Pfad angezeigt.
- Abgrenzung der Mittellinie der Vene durch Auswahl des "Contour Path" Tool in "Creation Mode".
- Ort Punkten wiederholt jede der orthogonalen MPR-Ansicht, die gesamte interessierende Gefäß begradigen.
- Korrigieren Sie, falls notwendig, um sicherzustellen, dass das Schiff komplett in "Editier-Modus" begradigt
- Wenn die Konturbahn genau auf Mittellinie des Behälters abgegrenzt, speichern, indem Sie auf das Symbol "Kurvenbahn", um die Datei zu exportieren
- Generieren 1 mm axialen Schichten senkrecht zur gekrümmten Bahn und speichern als DICOM-Dateien (Abbildung 3). Beachten Sie die die Kurvenbahn, richtete Gefäß und entsprechende axiale Bilder zur Quantifizierung DVT von MRV Bilder.
HINWEIS: Die in der 3D-Curved MPR Betrachter gerenderte Bilder müssen dann exportiert werden in DICOM-Datei und als eine neue Reihe von Bildern, die der Datenbank hinzugefügt.
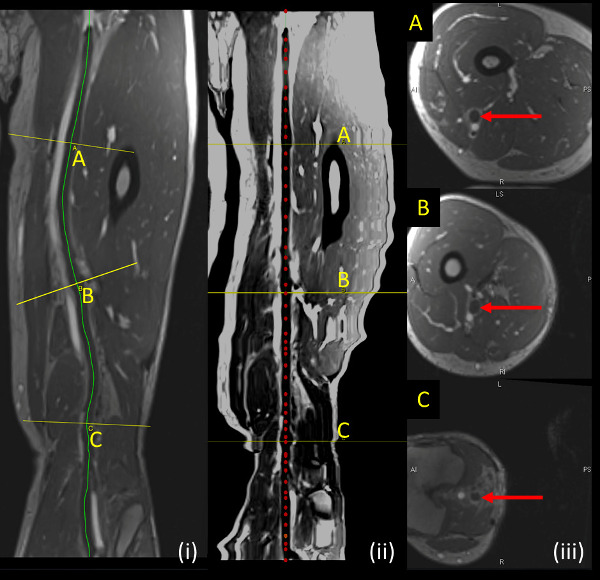
Abb. 3: auf MRV-Sequenz gezeigt Proben DVT (i, links) gekrümmten Bahn (gelbe Linie) zeigt die Kontur gefolgt von der Vene analysiert. (Ii, Mitte) Gestreckte Schiff entlang der Mittellinie des Schiffes, die analysiert wird (rot gestrichelte Linie) (iii, rechts) zeigt axialen Schichten senkrecht zur Ader an Stellen mit gelben Linien (A, B, C) auf Längsschnitten angegeben analysiert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Auf diesen axialen DICOM-Bilder, manuell Segment RegionenInteresse umfasst den Thrombus (siehe Abbildung 4), indem Sie die "Closed Polygon ROI Tool". Sparen Regionen Interessen, indem Sie die Schaltfläche "Speichern alle ROIs dieser Serie" in der "ROI" sich-Datei im Dropdown-Menü und speichern ROI Kennzahlen, indem Sie zum Menü "Plugins" und wählen Sie "ROI Tools" gefolgt von "Export ROIs ". Dies sollte in einer CSV-Format gespeichert werden.
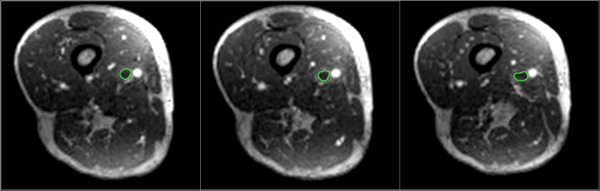
Abb. 4: manuell segmentierten interessierenden Bereiche (grün) sind umfasst den Thrombus auf axiale umformatiert DICOM-Bildern gezeigt Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Berechnen Thrombus Volumen durch Multiplizieren der ar ea auf jeden analysierten Scheibe von der Scheibendicke (1 mm) unter Verwendung eines speziell angefertigten Matlab-Skript. Berechnen Gesamt Thrombus Volumen in jedem Fach, indem Sie die Thrombus Volumina in jedem Gefäß.
- Für DTHi Analyse identifizieren frischen Thrombus als helle Bereiche auf Vor-Kontrast T1W 3D-Gradienten-Echo-Scans 13 innerhalb der DVT Regionen durch die MRV segmentiert.
- Am axialen Vor-Kontrast-Bilder, berechnen das Volumen des frischen Thrombus durch Ziehen Regionen von Interesse (ROI) von Hand, wie in Abbildung 5 dargestellt. In 6 sind Beispielbilder anzeigt DVT durch DTHi in Verbindung mit den MRV Bilder gemessen dargestellt.
- Öffnen Sie die Vor-Kontrast-und Post-Kontrast-Sequenzen nebeneinander. Wählen Sie Ansicht "axial" und abzugrenzen hellen Regionen entlang des Schiffes von Interesse unter Verwendung der "geschlossenen Polygons ROI Tool".
es / ftp_upload / 52761 / 52761fig5.jpg "/>
Abbildung 5: auf DTHi Bildgebungssequenz gezeigt Proben DVT (a) koronalen Bild, (b) axiale Bild, und (c) axial Bild, Region of Interest (grün) zurückverfolgt rund frischen Thrombus (blaue Pfeile) auf Pre-kontrastreiche Bilder.. Die DTHi Bilder vor der Injektion des Kontrastmittels erfasst und sich auf Met-Hämoglobingehalt von Thromben zu hellem Signal zu erzeugen.

Abb. 6: auf DTHi Bildgebungssequenz gezeigt Proben DVT Die linke Tafeln zeigen MRV Bilder mit Signal Hohlräume anzeigt Gesamt DVT (grüne Pfeile). Das rechte Bild zeigen entsprechende DTHi Bilder mit hellen Signal, das Vorhandensein von frischem Thrombus (blaue Pfeile). Bitte klicken Sie hier, um einen BlickGrößere Version der Figur.
4. Bewertung der Reproduzierbarkeit
- Auswerten eines Untergruppe von zehn Probanden für die Reproduzierbarkeit der Analyse.
- Führen Analyse, wie oben beschrieben, durch zwei separate Bildanalysten (primäre und sekundäre Leser), um inter-observer Variabilität zu beurteilen
- Stellen Sie sicher, dass die primäre Lesegerät führt auch eine zweite Bildanalyse von drei Monaten nach der ersten Analyse, um intra-observer Variabilität der Ergebnisse zu beurteilen.
- Berechne intra-class-Korrelationskoeffizienten (ICC) und führen Sie einen Bland-Altman-Analyse, um inter- und intra-observer Reproduzierbarkeit zu bewerten. Führen Sie eine eine Probe t-Test für Vorspannung an Bland-Altman-Analyse aussehen. ICC> 0,9 und keine Vorspannung auf Bland-Altman-Analyse werden als akzeptabel angesehen.
Ergebnisse
Für die Zwecke der Reproduzierbarkeit Assessments, der Baseline und Follow-up-Scans wurden gepoolt und als separate Fälle analysiert. Von den 10 zufällig ausgewählten Probanden (je 2 Besuche) gab es 59 Schiffe mit DVT identifiziert mit der MRV Ansatz und 29 Schiffe mit frischen Thrombus durch die DTHi identifiziert. In der Untergruppe dieser 10 zufällig ausgewählten Probanden für die Reproduzierbarkeit Metriken analysiert wurden keine Gefäße mit DVT als der un-analysierbare Qualität (als subjektive Scoring 0-2...
Diskussion
Diese Studie zeigte die Machbarkeit der Quantifizierung von tiefen Venenthrombosen auf MR Phlebographie mit Gadofosveset Trinatriumsalz als Kontrastmittel, mit ausgezeichneter Reproduzierbarkeit der Analyse zur Quantifizierung der Thrombus Volumen in einer multizentrischen Einstellung. Um insgesamt Thrombus Volumen zu berechnen, verwendet die primäre Methode der post-Kontrast MRV-Scan zu Thrombus Volumen zu messen. Der verwendete sekundäre Methode war die direkte Abbildung von Thromben Ansatz (DTHi), die das Vorhanden...
Offenlegungen
Venkatesh Mani has received research grants from Novartis. Nadia Alie, Sarayu Ramachandran, Cecilia Besa, Philip Robson and Bachir Taouli have nothing to disclose. Michele Mercuri and Michael Grosso are employees of Daiichi Sankyo. Greg Piazza has received research grants from Daiichi Sankyo, BMS, EKOS, and the Thrombosis Research Institute. Samuel Goldhaber has received grants from BMS, Daiichi Sankyo, EKOS, NHLBI and the Thrombosis Research Institute. He is a consultant for Ariad, Bayer, Boehringer Ingelheim, Bristol Myers Squibb, Daiichi Sankyo, Genentech, Janssen, Merck, Pfizer and Portola. Zahi Fayad has received research grants from Daiichi Sankyo, Roche, GlaxoSmithKline, Merck, VBL Therapeutics, Novartis, Bristol-Myers Squibb, and Via Pharmaceuticals.
Danksagungen
The authors have no acknowledgements.
Materialien
| Name | Company | Catalog Number | Comments |
| Ablavar (gadofosveset trisodium) | Lantheus | Contrast Agent | |
| 1.5 T or 3 T Scanners | GE, Siemens, or Phillips | GE (Horizon, Signa, Hdx, 750), Siemens (Symphony, Avanto, Sonata, Trio, Aera) or Philips (Intera, Achieva) |
Referenzen
- Goldhaber, S. Z. Venous thromboembolism: epidemiology and magnitude of the problem. Best Pract Res Clin Haematol. 25, 235-242 (2012).
- Huisman, M. V., Klok, F. A. Diagnostic management of acute deep vein thrombosis and pulmonary embolism. J Thromb Haemost. 11, 412-422 (2013).
- Ramzi, D. W., Leeper, K. V. DVT and pulmonary embolism. Part I. Diagnosis. Am Fam Physician. 69, 2829-2836 (2004).
- Wilbur, J., Shian, B. Diagnosis of deep venous thrombosis and pulmonary embolism. Am Fam Physician. 86, 913-919 (2012).
- Goodacre, S., Sampson, F., Thomas, S., van Beek, E., Sutton, A. Systematic review and meta-analysis of the diagnostic accuracy of ultrasonography for deep vein thrombosis. BMC Med Imaging. 5, 6 (2005).
- Elias, A., et al. A single complete ultrasound investigation of the venous network for the diagnostic management of patients with a clinically suspected first episode of deep venous thrombosis of the lower limbs. Thromb Haemost. 89, 221-227 (2003).
- Farahmand, S., Farnia, M., Shahriaran, S., Khashayar, P. The accuracy of limited B-mode compression technique in diagnosing deep venous thrombosis in lower extremities. Am J Emerg Med. 29, 687-690 (2011).
- Sampson, F. C., Goodacre, S. W., Thomas, S. M., van Beek, E. J. The accuracy of MRI in diagnosis of suspected deep vein thrombosis: systematic review and meta-analysis. Eur Radiol. 17, 175-181 (2007).
- Moody, A. R. Direct imaging of deep-vein thrombosis with magnetic resonance imaging. Lancet. 350, 1073 (1997).
- Phinikaridou, A., et al. In vivo magnetization transfer and diffusion-weighted magnetic resonance imaging detects thrombus composition in a mouse model of deep vein thrombosis. Circ Cardiovasc Imaging. 6, 433-440 (2013).
- Phinikaridou, A., Qiao, Y., Giordano, N., Hamilton, J. A. Detection of thrombus size and protein content by ex vivo magnetization transfer and diffusion weighted MRI. J Cardiovasc Magn Reson. 14, 45 (2012).
- Carpenter, J. P., et al. Magnetic resonance venography for the detection of deep venous thrombosis: comparison with contrast venography and duplex Doppler ultrasonography. J Vasc Surg. 18, 734-741 (1993).
- Westerbeek, R. E., et al. Magnetic resonance direct thrombus imaging of the evolution of acute deep vein thrombosis of the leg. J Thromb Haemost. 6, 1087-1092 (2008).
- Koizumi, J., et al. Magnetic resonance venography of the lower limb. Int Angiol. 26, 171-182 (2007).
- Goyen, M. Gadofosveset: the first intravascular contrast agent EU-approved for use with magnetic resonance angiography. Future Cardiol. 3, 19-26 (2007).
- Aime, S., Caravan, P. Biodistribution of gadolinium-based contrast agents, including gadolinium deposition. J Magn Reson Imaging. 30, 1259-1267 (2009).
- Shamsi, K., Yucel, E. K., Chamberlin, P. A summary of safety of gadofosveset (MS-325) at 0.03 mmol/kg body weight dose: Phase II and Phase III clinical trials data. Invest Radiol. 41, 822-830 (2006).
- Zhang, H. Trisodium-[(2-(R)-[(4,4-diphenylcyclohexyl)phosphono-oxymethyl]-diethylenetriamin epentaacetato)(aquo)gadolinium(III). Gadofosveset. , (2004).
- Pfeil, A., et al. Magnetic resonance VIBE venography using the blood pool contrast agent gadofosveset trisodium--an interrater reliability study. Eur J Radiol. 81, 547-552 (2012).
- Rosset, A., Spadola, L., Ratib, O. OsiriX: an open-source software for navigating in multidimensional DICOM images. J Digit Imaging. 17, 205-216 (2004).
- Ouriel, K., Greenberg, R. K., Green, R. M., Massullo, J. M., Goines, D. R. A volumetric index for the quantification of deep venous thrombosis. J Vasc Surg. 30, 1060-1066 (1999).
- Elias, A., et al. A single complete ultrasound investigation of the venous network for the diagnostic management of patients with a clinically suspected first episode of deep venous thrombosis of the lower limbs. Thromb Haemost. 89, 221-227 (2003).
- Farahmand, S., Farnia, M., Shahriaran, S., Khashayar, P. The accuracy of limited B-mode compression technique in diagnosing deep venous thrombosis in lower extremities. Am J Emerg Med. 29, 687-690 (2011).
- Thomas, S. M., Goodacre, S. W., Sampson, F. C., van Beek, E. J. Diagnostic value of CT for deep vein thrombosis: results of a systematic review and meta-analysis. Clin Radiol. 63, 299-304 (2008).
- Heverhagen, J. T., Krombach, G. A., Gizewski, E. Application of Extracellular Gadolinium-based MRI Contrast Agents and the Risk of Nephrogenic Systemic Fibrosis. Rofo. , (2014).
- Alhadad, A., et al. Safety aspects of gadofosveset in clinical practice - analysis of acute and long-term complications. Magn Reson Imaging. , (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten