Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Traitement de l'azote supercritique pour la purification de réactifs matériaux poreux
Dans cet article
Résumé
L'azote est un fluide supercritique efficace pour des procédés d'extraction ou de séchage en raison de sa petite taille moléculaire, à haute densité dans le régime quasi-liquide supercritique, et l'inertie chimique. Nous présentons un protocole de séchage supercritique d'azote pour le traitement de purification, de matériaux poreux réactifs.
Résumé
Supercritical fluid extraction and drying methods are well established in numerous applications for the synthesis and processing of porous materials. Herein, nitrogen is presented as a novel supercritical drying fluid for specialized applications such as in the processing of reactive porous materials, where carbon dioxide and other fluids are not appropriate due to their higher chemical reactivity. Nitrogen exhibits similar physical properties in the near-critical region of its phase diagram as compared to carbon dioxide: a widely tunable density up to ~1 g ml-1, modest critical pressure (3.4 MPa), and small molecular diameter of ~3.6 Å. The key to achieving a high solvation power of nitrogen is to apply a processing temperature in the range of 80-150 K, where the density of nitrogen is an order of magnitude higher than at similar pressures near ambient temperature. The detailed solvation properties of nitrogen, and especially its selectivity, across a wide range of common target species of extraction still require further investigation. Herein we describe a protocol for the supercritical nitrogen processing of porous magnesium borohydride.
Introduction
Extraction par fluide supercritique (SFE) et le séchage (SCD) méthodes sont bien établis dans une large gamme d'applications pratiques, en particulier dans les industries alimentaires et pétroliers, mais aussi dans la synthèse chimique, l'analyse et le traitement des matériaux. 1-6 L'utilisation du séchage ou les médias d'extraction dans les conditions ci-dessus leurs points critiques est souvent plus rapide, plus propre et plus efficace que les techniques traditionnelles (liquides), et a l'avantage supplémentaire d'être très accordables par rapport à la puissance de solvatation du fluide par un léger ajustement des conditions d'exploitation . 3,7 Une méthode simple consiste ScD de trois étapes de base. La première étape est d'exposer la matière solide (ou peut-être liquide) de départ qui contient le composé cible en impureté à un fluide ScD choisi de manière appropriée dans son liquide (ou quasi-liquide supercritique) de phase, où sa densité élevée correspond à un niveau élevé (et peut-être sélectif 7) pouvoir solvant par rapport aux espèces cibles. Til seconde étape est le chauffage et la compression du système ci-dessus point critique du fluide ScD choisi dans un récipient fermé de sorte que le fluide et ses espèces cibles dissous ne passent pas une limite de phase qui pourrait aboutir à la séparation. La dernière étape est de réduire lentement la pression du fluide ScD à vide à une température supérieure à la température critique, ce qui permet la solution fluide contenant l'espèce cible à fuir, encore une fois sans se heurter à une limite de phase ou des effets de tension de surface préjudiciables sur le chemin.
Le matériau de départ est laissée déchargée de l'espèce cible et peut être soumis à des traitements itérées si nécessaire. Dans le cas de l'extraction par fluide supercritique, l'espèce cible de soluté est le produit désiré, et on recueille à partir de solution pour une utilisation ultérieure. 8,9 Dans d'autres cas, la matière de départ séché ou purifié est le produit désiré, et les impuretés extraites sont mis au rebut. Ce dernier scénario, appelé icicomme l'approche ScD, a été découvert pour être une stratégie efficace pour le prétraitement de grande surface, matériaux microporeux tels que les cadres organo-métalliques (MOF), où les méthodes de traitement thermique traditionnels sous vide sont dans de nombreux cas ne suffit pas à nettoyer les pores de tous les invités indésirables, ou aboutir à pores effondrement. dioxyde 10 de carbone ScD (CSCd) le traitement est maintenant un processus de post-synthétique de routine pour les MOF, 11 conduisant à l'augmentation des surfaces azote accessible plus de matériaux non traités jusqu'à 1000% 12 et d'autres améliorations, telles que l'activité catalytique. 19- 13 Autres applications de fluides supercritiques sont notables comme un moyen largement accordable pour des réactions chimiques, 14-16 chromatographie en phase supercritique (SCFC) 6,17,18 et la synthèse des aérogels et des matériaux composites avancés. 22
Pour le séchage des applications, un fluide ScD est choisie en fonction de deux critères: a) la proximité de sespoint critique aux conditions ambiantes (pour plus de commodité et de réduire les coûts de l'énergie ou de la complexité du processus) et b) son pouvoir de solvatation à l'égard des espèces cibles. Le dioxyde de carbone (CO 2) a prouvé être un fluide ScD pratique dans de nombreuses applications, car il est non toxique, ininflammable, et pas cher, et peut être réglé pour présenter un fort pouvoir de solvatation vers un nombre d'espèces cibles organiques courants dans sa quasi-liquide Etat (à des pressions <10 MPa et à des températures de 273 à 323 K). 1-3,7-9 autres solvants supercritiques communes (ou co-solvants) comprennent l'eau (couvrant une gamme remarquable de propriétés de solvant entre son ambiance et l'état supercritique 23), l'acétone, l'éthylène, le méthanol, l'éthanol, et de l'éthane, couvrant le spectre de polaire (protique et aprotique) à non polaire, et ayant des points critiques relativement près aux conditions ambiantes.
Le dioxyde de carbone est de loin le plus commun ScD fluide utilisé. Dans les méthodes CSCd établies, la réactivitédu matériau de départ est pas un facteur inhibiteur depuis CO 2 est que très faiblement réactif à des températures proches de son point critique. Cependant, certaines classes de matériaux tels que les hydrures dits complexes (par exemple, alanates et borohydrures) présentent des défis uniques en matière de manutention en raison de leur forte réactivité en présence d'eau ou de CO 2 en plus de leur (peut-être intentionnellement adapté) l'instabilité chauffage 24-26. En outre, il est un grand intérêt international dans des matières telles que les composés à haute densité de stockage d'hydrogène, 27-30, et donc aussi dans nanostructuré et / ou variétés poreuses 31-33. Pour la purification efficace de ces réactifs, instables, et les matériaux nanostructurés, méthodes SCD sont une stratégie prometteuse. Fluide 34 A ScD doit être utilisé qui a un petit diamètre moléculaire appropriée pour la pénétration dans les cavités étroites et qui dispose également d'un fort pouvoir de solvatation vers le impuretés cibles, WHIle restant non réactif vers le matériau de départ lui-même. Ici, l'utilisation de l'azote supercritique (N 2) en tant que fluide efficace pour une telle extraction et en particulier les applications de séchage est présentée. Un séchage supercritique d'azote (NSCD) méthodologie spécifique est décrit ci-dessous pour la purification de borohydrure de magnésium en phase γ où l'espèce cible comprennent à la fois le diborane et d'un composé n-butylique (similaire à, mais pas spécifiquement identifiés comme étant des n-butane). Le protocole suivant peut être facilement modifié pour extension générale à d'autres procédés de séchage par de l'azote ou extraction supercritique.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Appareil
- Utilisez un séchage supercritique (ScD) Appareil de base composé de quatre éléments principaux reliés par des tubes de gaz à haute pression: l'alimentation en gaz, un système de vide, capteurs (température et pression), et de l'environnement de l'échantillon (qui peut être immergé dans un bain). Veiller à ce que la construction est de vannes de haute qualité en acier inoxydable, les raccords et tubes, la pression évalué à au moins 10 MPa dans la gamme de température entre 80-300 K.
Remarque: Un schéma est représenté sur la Figure 1. - Pour azote ScD (nscd) traitements, veiller à ce que l'alimentation en gaz est la pureté de recherche (> 99,999%) de l'azote gazeux équipé d'un régulateur de pression pour le contrôle de la pression de sortie entre 0-10 MPa. Attacher une bouteille de 50 L (20 MPa) à l'appareil, et purger le système avec de l'azote pur plusieurs fois avant utilisation.
- Assurez-vous que le système de vide est capable d'atteindre des pressions de vide jusqu'à <0,1 Pa et est connecté à l'appareil avec unbien-vanne de commande de l'aiguille. De préférence, utiliser une pompe primaire sans huile et une pompe turbo moléculaire glisser, placé en série.
- Utiliser au moins deux capteurs de pression pour la mesure précise de la pression au cours des traitements SCD: un capteur de pression pour la mesure de faible vide et un capteur de haute pression pour obtenir une plage de pression mesurable totale entre 0,1 à 10 7 Pa.
- Utilisez au moins deux capteurs de température de l'exactitude minimale nécessaire pour effectuer des traitements typiques SCD: un capteur en contact thermique avec l'échantillon et un capteur dans le primaire collecteur de dosage de gaz pour des mesures précises entre 77 à 300 K (par exemple, des thermocouples de type K) .
- Vérifiez que le porte-échantillon présente un volume interne appropriée pour contenir la quantité d'échantillon nécessaire pour le traitement, et est construit en acier inoxydable.
Note: allongées auxiliaires de conception cylindriques en contact thermique avec le bain. - Assurez-vous que le raccord qui ferme le récipient d'échantillon est approprIATE pour les hautes pressions et une utilisation répétée (par exemple, Swagelok VCR). Connecter le volume du récipient d'échantillon à une vanne d'isolement de l'environnement extérieur par l'intermédiaire d'une longueur appropriée d'un tube (le tube plongeur) pour l'immersion complète du porte-échantillon dans le bain.
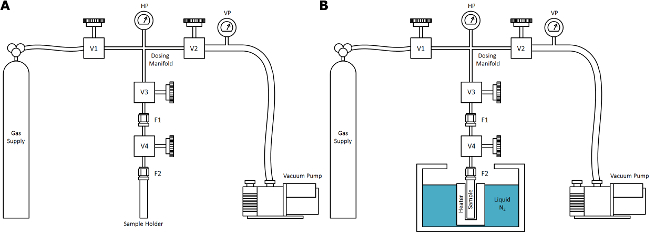
. Figure 1. Le séchage supercritique d'azote (NSCD) Dispositif Une représentation schématique de l'appareil NSCD simplifié pour l'utilisation dans le laboratoire typique: (A) à la température ambiante et (B) après immersion de l'échantillon dans le bain. L'alimentation en gaz pour le procédé décrit dans ce travail est de l'azote, mais cet appareil générale est généralisable à d'autres fluides SCD avec un point critique se situant dans une gamme pratique de température et de pression, tels que le CO 2. Les composants sont étiquetés pour la cohérence avec ee protocole décrit ici. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
2. Préparation
- Charge: 0,2 à 0,5 g d'échantillon (γ-Mg (BH 4) 2, sous forme de poudre, après la synthèse chimique par voie humide et des procédés de séchage classiques) dans le porte-échantillon dans des conditions appropriées, typiquement dans une atmosphère inerte telle qu'une boîte à gants de l'argon, à température ambiante ou au-dessous. Fermez le porte-échantillon (F2 raccord) avec un joint de filtre et puis fermer la vanne (vanne V4). Transférer le porte-échantillon à l'appareil et l'attacher (F1 raccord).
- Ouvrez le collecteur de dosage à vide par l'intermédiaire V2 et évacuer. Ouvrir V3 et évacuer. Purger l'appareil avec de l'azote par V1 et V2 via évacuer. Ouvrir V4 et évacuer l'échantillon à température ambiante pendant jusqu'à 24 heures, pour atteindre la pression minimale du système (<0,1 Pa).
- Installez le bain de l'échantillon (voir Figure 2) autour du support d'échantillon. Effectuer en levant le bain en position sur une table élévatrice à ciseaux, ou un mécanisme similaire.
- Réglez l'appareil de chauffage à l'avenir souhaité température du liquide (T l, voir l'étape 3.1) de 110 K, et de continuer à évacuer l'appareil jusqu'à ce que la température se équilibre.
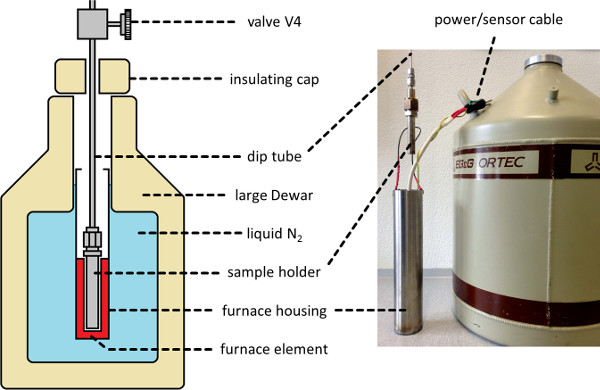
Figure 2. cryogénique Furnace bain de l'échantillon. Une représentation schématique (à gauche) et photo (à droite) d'un environnement cryostatée thermal appropriée pour contenir le support d'échantillon pendant le traitement Nscd, permettant la mesure et le contrôle de la température de l'échantillon entre 77 à 298 K. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
3. supercritique azote exposition
- Pour le traitement Nscd de γ-Mg (BH 4) 2, (l'objet de la démonstration dans ce protocole), sélectionnez une température de liquide (T l) de 110 K. Cela correspond à un liquide modérée densité du solvant (~ 0,6 g ml -1) ; Ajustez comme nécessaire pour l'application de ce protocole à d'autres procédés de traitement Nscd (voir la note ci-dessous).
- Fermez le système à vide en fermant V2. Étrangler ouverte V1 lentement, permettant à la pression d'augmenter dans la région liquide du diagramme de phase. Équilibrer le système à 2 MPa et T l.
- Faire tremper l'échantillon dans de l'azote liquide 2 pendant 4 heures.
- Réglez le chauffe à 150 K avec un min -1 rampe ≤2 K. Laisser la pression pour augmenter pas supérieure à la pression nominale maximale de l'appareil (ce P max devrait être ≥10 MPa); si nécessaire, évacuer soigneusement l'excès de pression à vide par l'intermédiaire V2. Equilibrer le système à P max et 150 K.
- Faire tremper l'échantillon dans supercritical 2 N pendant 1 heure.
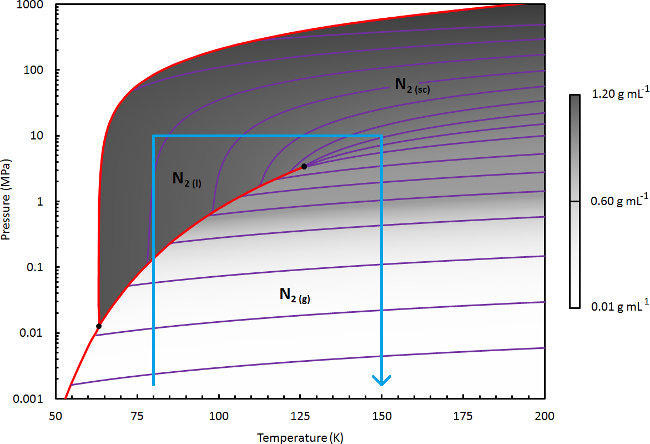
Figure 3. Diagramme de phase d'azote. Un diagramme de phase détaillée d'azote, où la densité du fluide (représenté en niveaux de gris linéaire) est calculé en utilisant REFPROP (une équation Webb-Benoît-Rubin d'état modifié). 41 Plusieurs lignes de densité constante sont présentés en violet. Les solides limites de phase et lignes de transition d'ébullition sont indiquées en rouge. Les lignes bleues indiquent la limite de la région du diagramme de phase qui est pertinent pour le séchage ou l'extraction de traitement utilisant N 2. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Remarque: Pour l'application du présent protocole à d'autres matériaux, d'établir un traitement approprié Nscd scheme en choisissant les conditions nécessaires pour la solvatation efficace de l'espèce cible. Consultez le diagramme de phase de N 2, montre la figure 3. Pour atteindre une densité de fluide haute en phase liquide (par exemple, 0,8-1 g ml -1), sélectionnez un T l de 80-90 K. Pour densité du liquide modérée (par exemple, 0,6-0,8 g ml -1), sélectionnez un T l de 90-115 K. Une approche d'essai et d'erreur peut être nécessaire.
4. supercritique libération de l'azote
- Fissurer attentivement le système de vide par étranglement V2, permettant à la pression pour diminuer le plus lentement possible. À plusieurs reprises fissurer le système des taux de dépression plus élevés que nécessaires pour atteindre un déclin graduel à un vide poussé (<0,1 Pa) dans le laps de temps approximatif de 12-24 h.
- Retirer le bain de l'échantillon et entièrement V2 ouverte pour évacuer complètement l'échantillon. Equilibrer à température ambiante et sous vide poussé (<0,1 Pa).
- Dégazer l'échantillon à température ambiante et <0,1 Pa pendant 1-24 h, comme desired.
5. Traitement Poster
- Fermer les vannes V3 et V4, et retirez le support de l'échantillon de l'appareil (montage F1).
- Transférer le porte-échantillon à un environnement inerte pour la manipulation, la boîte à gants, tel qu'un rempli d'argon. Retirer l'échantillon du porte-échantillon (montage F2) et conserver dans un récipient hermétique à température ambiante ou en dessous.
Access restricted. Please log in or start a trial to view this content.
Résultats
Borohydrures de métaux alcalins et alcalino-terreux sont des matériaux de stockage d'hydrogène potentiels, qui offrent une grande teneur en hydrogène gazeux lors de la décomposition. 27,29 Autres produits de décomposition tel que le diborane ont aussi parfois été détectée dans le gaz désorbé, mais leur origine est a priori pas clair ; il est possible qu'ils sont des produits de la décomposition en phase pure, mais peuvent également être des impuretés ou de produits de réactions d'...
Access restricted. Please log in or start a trial to view this content.
Discussion
Peut-être en raison de sa relativement faible température critique (126 K), N 2 a toujours été négligé en tant que solvant ScD efficace. Dans les rapports précédents, 3,17,42,43, il n'a été fait allusion dans le contexte du traitement de températures égales ou supérieures ambiante, où il présente seul pouvoir de solvatation modeste en raison de sa faible densité du fluide dans cette région de son diagramme de phase (sauf à des pressions extrêmement élevées 43). L...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ont rien à révéler.
Remerciements
Ce travail a été soutenu par les cellules à combustible et européennes entreprise commune Hydruogen sous BOR4STORE collaborative de projet (convention de subvention n ° 303428) et le programme d'infrastructure H2FC (Convention de subvention No. FP7-284522).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Compressed Nitrogen Gas | Messer Schweiz AG | 50 L bottle, purity > 99.999%, <3 ppmv H2O | |
| Liquid Nitrogen | Pan Gas AG | Bulk storage, on site | |
| Custom Supercritical Drying Apparatus | Empa | Swagelok (compression fitting and VCR) components | |
| Custom Cryogenic Furnace Bath | Empa | ||
| Custom Labview Interface | Empa |
Références
- McHugh, M. A., Krukonis, V. J. Supercritical Fluid Extraction. , 1st ed, Butterworth. Stoneham, MA. (1986).
- Schneider, G. M. Physicochemical Principles of Extraction with Supercritical Gases. Angew. Chem. lnt. Ed. 17, 716-727 (1978).
- Williams, D. F. Extraction with Supercritical Gases. Chem. Eng. Sci. 36 (11), 1769-1788 (1981).
- Eckert, C. A., Knutson, B. I., Debenedetti, P. G. Supercritical fluids as solvents for chemical and materials processing. Nature. 383, 313-318 (1996).
- Cooper, A. I. Polymer synthesis and processing using supercritical carbon dioxide. J. Mater. Chem. 10, 207-234 (2000).
- Klesper, E., Corwin, A. H., Turner, D. A. High pressure gas chromatography above critical temperatures. J. Org. Chem. 27, 700-701 (1962).
- Tucker, S. C. Solvent Density Inhomogeneities in Supercritical Fluids. Chem. Rev. 99 (2), 391-418 (1999).
- Hubert, P., Vitzthum, O. G. Fluid Extraction of Hops, Spices, and Tobacco with Supercritical Gases. Angew. Chem. Int. Ed. 17 (10), 710-715 (1978).
- Zosel, K. Separation with Supercritical Gases: Practical Applications. Angew. Chem. Int. Ed. 17 (10), 702-709 (1978).
- Nelson, A. P., Farha, O. K., Mulfort, K. L., Hupp, J. T. Supercritical Processing as a Route to High Internal Surface Areas and Permanent Microporosity in Metal−Organic Framework Materials. J. Am. Chem. Soc. 131, 458-460 (2009).
- Liu, B., Wong-Foy, A. G., Matzger, A. J. Rapid and enhanced activation of microporous coordination polymers by flowing supercritical CO2. Chem. Commun. 49, 1419-1421 (2013).
- Cooper, A. I., Rosseinsky, M. J. Metal–organic frameworks: improving pore performance. Nat. Chem. 1, 26-27 (2009).
- Totten, R. K., et al. Enhanced Catalytic Activity through the Tuning of Micropore Environment and Supercritical CO2 Processing: Al(Porphyrin)-Based Porous Organic Polymers for the Degradation of a Nerve Agent Simulant. J. Am. Chem. Soc. 135, 11720-11723 (2013).
- Savage, P. E., Gopalan, S., Mizan, T. I., Martino, C. J., Brock, E. E. Reactions at supercritical conditions: Applications and fundamentals. AIChE J. 41 (7), 1723-1778 (1995).
- Baiker, A. Supercritical Fluids in Heterogeneous Catalysis. Chem. Rev. 99 (2), 453-474 (1999).
- Jessop, P. G., Ikariya, T., Noyori, R. Homogeneous Catalysis in Supercritical Fluids. Chem. Rev. 99 (2), 475-494 (1999).
- Giddings, J. C., Myers, M. N., McLaren, L., Keller, R. A. High Pressure Gas Chromatography Of Nonvolatile Species. Science. 162 (3849), 67-73 (1968).
- Gere, D. R. Supercritical Fluid Chromatography. Science. 222, 253-259 (1983).
- Kistler, S. S. Coherent Expanded Aerogels and Jellies. Nature. 127, 741-741 (1931).
- Biener, J., et al. Advanced carbon aerogels for energy applications. Energy Environ. Sci. 4, 656-667 (2011).
- Morère, J., et al. Deposition of Pd into mesoporous silica SBA-15 using supercritical carbon dioxide. J. Supercrit. Fluids. 56 (2), 213-222 (2011).
- Sathish, M., Mitani, S., Tomai, T., Honma, I. Supercritical fluid assisted synthesis of N-doped graphene nanosheets and their capacitance behavior in ionic liquid and aqueous electrolytes. J. Mater. Chem. A. 2, 4731-4738 (2014).
- Toews, K. L., Shroll, R. M., Wai, C. M., Smart, N. G. pH-Defining Equilibrium between Water and Supercritical CO2. Influence on SFE of Organics and Metal Chelates. Anal. Chem. 67 (22), 4040-4043 (1995).
- Barbaras, G., Barbaras, G. D., Finholt, A. E., Schlesinger, H. I. Cause Of Explosions Occasionally Observed During Evaporation Of Solutions Of Aluminum Hydride And Related Compounds. J. Am. Chem. Soc. 70, 877(1948).
- Burr, J. G., Brown, W. G., Heller, H. E. The Reduction of Carbon Dioxide to Formic Acid. J. Am. Chem. Soc. 72 (6), 2560-2562 (1950).
- Hugelshofer, C. L., et al. Gas−Solid Reaction of Carbon Dioxide with Alanates. J. Phys. Chem. C. 118, 15940-15945 (2014).
- Orimo, S. I., Nakamori, Y., Eliseo, J. R., Züttel, A., Jensen, C. M. Complex Hydrides for Hydrogen Storage. Chem. Rev. 107 (10), 4111-4132 (2007).
- Gross, K. J., Thomas, G. J., Jensen, C. M. Catalyzed alanates for hydrogen storage. J. Alloys Compd. 330-332, 683-690 (2002).
- Li, H. W., Yan, Y., Orimo, S. I., Züttel, A., Jensen, C. M. Recent Progress in Metal Borohydrides for Hydrogen Storage. Energies. 4 (1), 185-214 (2011).
- Frankcombe, T. J. Proposed Mechanisms for the Catalytic Activity of Ti in NaAlH4. Chem. Rev. 112, 2164(2012).
- Vajo, J. J., Olson, G. L. Hydrogen storage in destabilized chemical systems. Scr. Mater. 56, 829(2007).
- Zhang, Y., et al. LiBH4 nanoparticles supported by disordered mesoporous carbon: Hydrogen storage performances and destabilization mechanisms. Int. J. Hyd. Energ. 32 (16), 3976-3980 (2007).
- Christian, M. L., Aguey-Zinsou, K. F. Core–Shell Strategy Leading to High Reversible Hydrogen Storage Capacity for NaBH4. ACS Nano. 6 (9), 7739-7751 (2012).
- Stadie, N. P., et al. Supercritical N2 Processing as a Route to the Clean Dehydrogenation of Porous Mg(BH4)2. J. Am. Chem. Soc. 136 (23), 8181-8184 (2014).
- Borgschulte, A., et al. Impurity Gas Analysis of the Decomposition of Complex Hydrides. J. Phys. Chem. C. 115, 17220-17226 (2011).
- Filinchuk, Y., et al. Porous and Dense Magnesium Borohydride Frameworks: Synthesis, Stability, and Reversible Absorption of Guest Species. Angew. Chem. Int. Ed. 50, 11162-11166 (2011).
- Li, H. W., et al. Dehydriding and rehydriding processes of well-crystallized Mg(BH4)2 accompanying with formation of intermediate compounds. Acta Mater. 56 (6), 1342-1347 (2008).
- Schüth, F., Bogdanovic, B., Felderhoff, M. Light metal hydrides and complex hydrides for hydrogen storage. Chem. Comm. , 2249-2258 (2004).
- Vitillo, J. G., Groppo, E., Bardají, E. G., Baricco, M., Bordiga, S. Fast carbon dioxide recycling by reaction with γ-Mg(BH4)2. Phys. Chem. Chem. Phys. 16, 22482-22486 (2014).
- Paskevicius, M., et al. In-Situ X-ray Diffraction Study of γ-Mg(BH4)2 Decomposition. J. Phys. Chem. C. 116, 15321-15240 (2012).
- Lemmon, E. W., Huber, M. L., McLinden, M. O. NIST standard reference database 23: reference fluid thermodynamic and transport properties. Standard Reference Data Program. , (2008).
- Moquin, P. H. L., Temelli, F. J. Kinetic modeling of hydrolysis of canola oil in supercritical media. J. Supercrit. Fluid. 45, 94-101 (2008).
- Myers, M. N., Giddings, J. C. Ultra-High-Pressure Gas Chromatography in Micro Columns to 2000 Atmospheres. Sep. Sci. 1 (6), 761-776 (1966).
- McLeary, E. E., Jansen, J. C., Kapteijn, F. Zeolite based films, membranes and membrane reactors: Progress and prospects. Microporous Mesoporous Mater. 90, 198-220 (2006).
- Richter, B., Ravnsbæk, D. B., Tumanov, N., Filinchuk, Y., Jensen, T. R. Manganese borohydride; synthesis and characterization. Dalton Trans. , (2015).
- Liang, S., Tilotta, D. C. Extraction of petroleum hydrocarbons from soil using supercritical argon. Anal. Chem. 70 (3), 616-622 (1998).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon