É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Processamento de nitrogênio supercrítico para a purificação de Reativos Porous Materials
Neste Artigo
Resumo
O azoto é um fluido supercrítico eficazes para os processos de extracção ou de secagem, devido ao seu pequeno tamanho molecular e de alta densidade em regime quase-líquido supercrítico, e inércia química. Nós apresentamos um protocolo de secagem azoto supercrítico para o tratamento de purificação, os materiais porosos reactivos.
Resumo
Supercritical fluid extraction and drying methods are well established in numerous applications for the synthesis and processing of porous materials. Herein, nitrogen is presented as a novel supercritical drying fluid for specialized applications such as in the processing of reactive porous materials, where carbon dioxide and other fluids are not appropriate due to their higher chemical reactivity. Nitrogen exhibits similar physical properties in the near-critical region of its phase diagram as compared to carbon dioxide: a widely tunable density up to ~1 g ml-1, modest critical pressure (3.4 MPa), and small molecular diameter of ~3.6 Å. The key to achieving a high solvation power of nitrogen is to apply a processing temperature in the range of 80-150 K, where the density of nitrogen is an order of magnitude higher than at similar pressures near ambient temperature. The detailed solvation properties of nitrogen, and especially its selectivity, across a wide range of common target species of extraction still require further investigation. Herein we describe a protocol for the supercritical nitrogen processing of porous magnesium borohydride.
Introdução
Extracção com fluido supercrítico (SFE) e secagem (SCD) métodos estão bem estabelecidos em uma ampla gama de aplicações práticas, especialmente nas indústrias alimentares e de petróleo, mas também 1-6 A utilização de secagem por síntese química, análise e processamento de materiais. ou meios de extracção em condições acima seus pontos críticos é muitas vezes mais rápido, mais limpo e mais eficiente do que (líquidos) as técnicas tradicionais, e tem a vantagem adicional de ser altamente ajustável com respeito ao poder de solvatação do fluido por ligeiro ajustamento das condições de operação . Um método 3,7 ScD simples consiste em três etapas básicas. O primeiro passo é a exposição do material sólido (ou talvez líquido) de partida que contém o composto alvo impureza a um fluido ScD apropriadamente escolhido no seu estado líquido (ou quase líquido supercrítico) de fase, onde a sua elevada densidade corresponde a uma alta (e talvez selectiva 7) poder solvente em relação à espécie alvo. Tele segundo passo é o aquecimento e a compressão do sistema acima do ponto crítico do fluido ScD escolhido num recipiente fechado, de modo que o fluido e as suas espécies alvo dissolvidos não transmitir um limite de fase, que pode resultar na separação. O passo final é a redução lentamente a pressão do fluido ScD a vácuo a uma temperatura acima da temperatura crítica, permitindo que a solução de fluido contendo as espécies alvo escapar, novamente sem a ocorrência de um limite de fase ou quaisquer efeitos prejudiciais de tensão superficial ao longo do caminho.
O material de partida é deixado empobrecido da espécie alvo e pode ser sujeito a tratamentos iterados se necessário. Em casos de extracção de fluido supercrítico, as espécies do soluto alvo é o produto desejado, e é recolhida a partir de solução para utilização posterior 8,9. Em outros casos, o material de partida seco ou purificada é o produto desejado, e as impurezas extraídas são descartados. Este último caso, aqui referidoscomo a abordagem ScD, foi descoberto para ser uma estratégia eficaz para o pré-tratamento de elevada área superficial, materiais microporosos, tais como estruturas metal-orgânicas (MOFs), onde os métodos tradicionais de tratamento térmico sob vácuo são, em muitos casos não é suficiente na limpeza dos poros de todos os hóspedes indesejados, ou resultar em colapso de poros. dióxido de carbono 10 ScD (CSCD) processamento é agora um processo de pós-sintética de rotina para MOFs, 11 levando a aumentos em áreas de superfície em nitrogênio acessível sobre os materiais não tratados de até 1.000% e 12 outras melhorias, tais como na actividade catalítica. 13 Outras aplicações de fluidos supercríticos são notáveis como um meio largamente sintonizável para reacções químicas, 14-16 cromatografia supercrítica de fluidos (SCFC) 6,17,18 e síntese dos aerogéis e materiais compósitos avançados. 19- 22
Para aplicações de secagem, um fluido ScD é escolhido com base em dois critérios: a) a proximidade da suaponto crítico em condições ambiente (por conveniência e para reduzir os custos de energia ou a complexidade do processo) e b) o seu poder de solvatação em relação à espécie alvo. O dióxido de carbono (CO 2) provou ser um fluido ScD conveniente em muitas aplicações, uma vez que não é tóxico, não inflamável, e mais barato, e pode ser ajustado para exibir um elevado poder de solvatação para um número de espécies orgânicas alvo comum na sua quase-líquida Estado (a pressões <10 MPa e temperaturas de 273-323 K). 1-3,7-9 outros solventes supercríticos comuns (ou co-solventes) incluem água (abrangendo uma gama notável de propriedades de solventes entre seu ambiente e estado supercrítico 23), acetona, etileno, metanol, etanol, e o etano, cobrindo o espectro de polar (prótico e aprótico) para não polar, e tendo pontos críticos relativamente próximo às condições ambientais.
O dióxido de carbono é, de longe, o fluido ScD mais comum utilizado. Em métodos cscd estabelecidos, a reactividadedo material de partida não é um factor inibidor desde CO 2 só é muito fracamente reactivo a temperaturas próximas do seu ponto crítico. No entanto, certas classes de materiais, tais como os chamados hidretos complexos (por exemplo, boro-hidretos e alanates) apresentam grandes desafios no manuseamento devido à sua forte reactividade na presença de água ou de CO 2 para além da sua (talvez intencionalmente concebidos) instabilidade sob aquecimento 24-26. Além disso, há um grande interesse internacional em materiais tais como compostos de armazenamento de hidrogénio de alta densidade, 27-30 e, portanto, também em nanoestruturada e / ou variedades porosas 31-33. Para a purificação eficaz de tais, instável e materiais nanoestruturados reactivos, os métodos são SCD uma estratégia promissora. Um fluido de 34 ScD deve ser utilizado, que tem um diâmetro molecular pequeno apropriado para a penetração nas cavidades estreitas e que também tem um elevado poder de solvatação para o impurezas alvo, while restante não reactiva para com o próprio material de partida. Aqui, a utilização de azoto supercrítico (N2) como um fluido efectivo para tal extracção e especialmente secagem de aplicações é apresentada. Uma metodologia específica supercrítico secagem azoto (NSCD) é descrito abaixo para a purificação de boro-hidreto de magnésio de fase γ onde a espécie alvo incluem tanto diborano e um composto de n-butilo (similar a, mas não especificamente identificadas como n-butano). O protocolo a seguir podem ser facilmente modificados para a extensão global para outros processos de secagem de azoto ou de extração supercrítica.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Aparelho
- Usar uma secagem super-critica (SCD) aparelho de base constituído por quatro componentes primários ligados por tubagem de gás de alta pressão: o fornecimento de gás, um sistema de vácuo, sensores (temperatura e pressão), e o ambiente de amostra (que pode ser submerso num banho). Certifique-se de que a construção é de válvulas de alta qualidade de aço inoxidável, conexões e tubos, pressão nominal de pelo menos 10 MPa na faixa de temperatura entre 80-300 K.
Nota: Um esquema é mostrado na Figura 1. - Para nitrogênio ScD (nscd) tratamentos, garantir que o fornecimento de gás é a pureza de pesquisa (> 99,999%) de azoto gasoso equipado com um regulador de pressão para controle de pressão de saída entre 0-10 MPa. Anexar uma garrafa de 50 L (20 MPa) para o aparelho, e purgar o sistema com nitrogênio puro várias vezes antes do uso.
- Certifique-se de que o sistema de vácuo é capaz de atingir pressões de vácuo até <0,1 Pa e está ligada ao aparelho com umválvula de agulha-controle fino. De preferência, use uma bomba de desbaste oil-free e uma bomba turbo molecular-arrasto, colocado em série.
- Use pelo menos dois sensores de pressão para medição precisa da pressão durante os tratamentos SCD: um sensor de baixa pressão para a medição de vácuo e um sensor de alta pressão para alcançar um intervalo de pressão mensurável total entre 0,1-10 7 Pa.
- Use pelo menos dois sensores de temperatura para a precisão mínimo necessário para realizar tratamentos típicos SCD: um sensor em contacto térmico com a amostra e um sensor dentro do colector de doseamento de gás primário para medições precisas entre 77-300 K (por exemplo, termopares tipo K) .
- Verificar que o suporte de amostra tem um volume interno apropriado para conter a quantidade de amostra necessária para o tratamento, e é construída de aço inoxidável.
Nota: A SIDA cilíndricos alongados em contacto térmico com o banho. - Certifique-se de que a montagem que fecha o recipiente da amostra é aproprIATE para altas pressões e uso repetido (por exemplo, Swagelok VCR). Ligue o volume do recipiente da amostra para uma válvula de isolamento a partir do ambiente exterior através de um comprimento adequado do tubo (o tubo de mergulho) para a completa imersão do suporte de amostras para o banho.
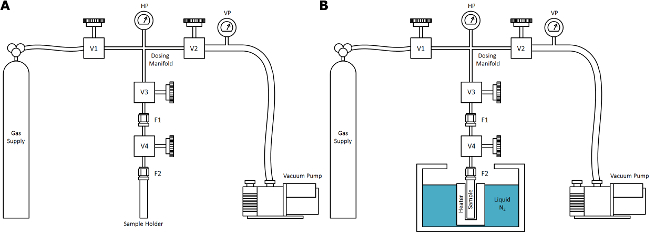
. Figura 1. supercrítico Azoto Secagem (NSCD) Aparelho Uma representação esquemática do aparelho NSCD simplificado para uso em laboratório típico: (A) à temperatura ambiente e (B), após imersão da amostra no banho. O fornecimento de gás para o processo descrito neste trabalho é azoto, mas em geral este aparelho é generalizáveis a outros fluidos SCD com um ponto crítico encontra-se dentro de uma gama prática de temperatura e pressão, tal como CO 2. Os componentes estão marcados para a coerência com the protocolo aqui descrito. Por favor clique aqui para ver uma versão maior desta figura.
2. Preparação
- Carga 0,2-0,5 g de amostra (γ-Mg (BH4) 2, na forma de pó, seguindo-síntese química húmida e métodos de secagem padrão) no suporte da amostra sob condições adequadas, normalmente, numa atmosfera inerte, tal como uma caixa de luvas de árgon, à temperatura ambiente ou abaixo. Feche o suporte da amostra (F2 montagem) com uma junta de filtro e, em seguida, fechar a válvula (V4 válvula). Transferir o porta-amostra para o aparelho e anexar (F1 encaixe).
- Abra o colector de dosagem para aspirar via V2 e evacuar. Abrir V3 e evacuar. Purgar o aparelho com nitrogênio via V1 e V2 evacuar via. Abrir V4 e evacuar a amostra à temperatura ambiente durante até 24 horas, para atingir a pressão mínima do sistema (<0,1 Pa).
- Instale o banho de amostra (ver Figura 2) em torno do suporte da amostra. Execute este levantando o banho em posição em um elevador de tesoura, ou mecanismo similar.
- Definir o aquecedor para o futuro desejada temperatura do líquido (t l, ver passo 3.1) de 110 K, e continuar a evacuar o aparelho até que a temperatura se equilibra.
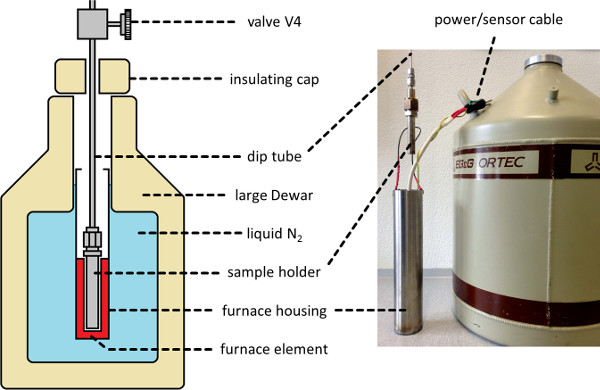
Figura 2. forno de banho criogénico da amostra. Uma ilustração esquemática (esquerda) e fotografia (direita) de um banho de ambiente térmico criostato apropriado para conter o suporte de amostras durante o processamento NSCD, permitindo a medição e controlo da temperatura da amostra entre 77-298 K. Por favor clique aqui para ver uma versão maior desta figura.
3. Supercritical Nitrogênio Exposição
- Para NSCD processamento de γ-Mg (BH4) 2, (o objecto de demonstração neste protocolo) seleccionar uma temperatura do líquido (t l) de 110 K. Isto corresponde a uma densidade de solvente líquido moderada (~ 0,6 g ml -1) ; Ajuste conforme necessário para a aplicação do presente protocolo a outros processos de tratamento NSCD (ver nota abaixo).
- Feche o sistema de vácuo, fechando V2. Borboleta aberta V1 lentamente, permitindo que a pressão aumente dentro da região de líquido da diagrama de fases. Equilibrar o sistema a 2 MPa e T l.
- Mergulhe a amostra em N2 líquido durante 4 h.
- Definir o aquecedor a 150 K com um min -1 rampa ≤2 K. Permitir que a pressão aumente não seja superior à pressão máxima do aparelho (esta P max deve ser ≥10 MPa); se necessário, ventilar cuidadosamente o excesso de pressão a vácuo através de V2. Equilibrar o sistema em P max e 150 K.
- Mergulhe a amostra em supercritical N2 durante 1 h.
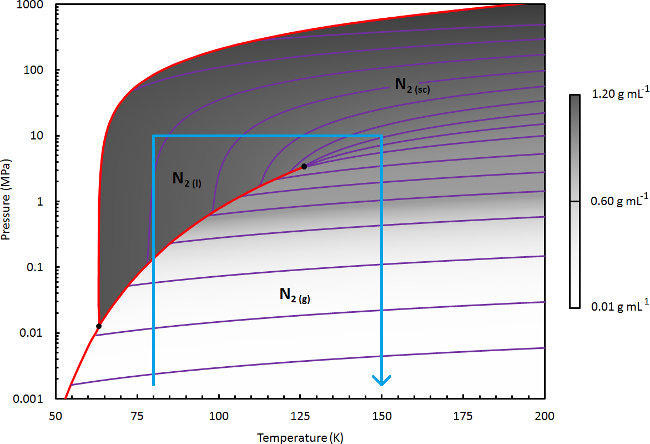
Figura 3. Diagrama de Fase de nitrogênio. Um diagrama de fases detalhada de azoto, em que a densidade do fluido (mostrado na escala de cinzentos linear) é calculada usando REFPROP (a equação Webb-Benedict-Rubin de estado modificado). 41 Várias linhas de densidade constante são mostrados no roxo. Os limites de fase sólida e linhas de transição de ebulição são mostrados em vermelho. As linhas azuis indicam o limite da região do diagrama de fases que é relevante para a secagem ou processamento de extração utilizando N 2. Por favor clique aqui para ver uma versão maior desta figura.
Nota: Para a aplicação do presente protocolo a outros materiais, estabelecer um schem tratamento adequado NSCDe escolhendo as condições necessárias para a solvatação eficaz da espécie-alvo. Consulte o diagrama de fase de N 2, mostrada na Figura 3. Para alcançar uma alta densidade do fluido na fase líquida (por exemplo, 0,8-1 g ml -1), seleccionar um t l de 80-90 K. Para densidade líquida moderada (por exemplo, 0,6-0,8 g ml -1), seleccionar um t l de 90-115 K. Uma abordagem de tentativa e erro poderá ser necessário.
4. Supercritical nitrogênio lançamento
- Rachar cuidadosamente o sistema de vácuo por estrangulamento V2, permitindo que a pressão para diminuir o mais lentamente possível. Repetidamente quebrar o sistema de vácuo para taxas mais elevadas, conforme necessário para alcançar um declínio gradual para alto vácuo (<0,1 Pa) no intervalo de tempo de aproximadamente 12-24 horas.
- Remover o banho de amostra e totalmente V2 aberta para evacuar completamente a amostra. Equilibre à TA e alto vácuo (<0,1 Pa).
- Desgaseificar a amostra à temperatura ambiente e <0,1 Pa para 1-24 horas, como desired.
5. Publicar Tratamento
- Feche as válvulas V3 e V4, e remover o suporte de amostras do aparelho (ajuste F1).
- Transferir o porta-amostra para um ambiente inerte para manuseamento, tal como uma caixa de luvas cheia de árgon. Retirar a amostra do suporte de amostras (montagem F2) e armazenar em um recipiente fechado à temperatura ambiente ou abaixo.
Access restricted. Please log in or start a trial to view this content.
Resultados
Boro-hidretos de metais alcalinos e alcalino-terrosos são materiais de armazenamento de hidrogénio potenciais, que proporcionam um elevado teor de hidrogénio gasoso após a decomposição. 27,29 Outros produtos de decomposição, tais como diborano, por vezes, têm também sido detectados no gás dessorvido, mas a sua origem não é, a priori, claro ; é possível que são produtos da decomposição da fase pura, mas também podem ser impurezas ou produtos de reacções de impurezas que tenham ficado de s?...
Access restricted. Please log in or start a trial to view this content.
Discussão
Talvez devido à sua relativamente baixa temperatura crítica (126 K), N 2 historicamente tem sido negligenciado como um solvente ScD eficaz. Em relatórios anteriores, 3,17,42,43 só foi aludido no contexto de processamento temperaturas iguais ou acima da temperatura ambiente, onde ele exibe apenas o poder de solvatação modesta devido à sua baixa densidade do fluido na região de seu diagrama de fases (excepto a altíssimas pressões 43). O passo chave na realização a utilidade pr?...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelos Pilhas de Combustível e europeus empresa comum Hydruogen sob BOR4STORE colaborativa de projetos (Acordo de Subvenção No. 303428) e um programa de infra-estrutura H2FC (Acordo de Subvenção No. FP7-284522).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Compressed Nitrogen Gas | Messer Schweiz AG | 50 L bottle, purity > 99.999%, <3 ppmv H2O | |
| Liquid Nitrogen | Pan Gas AG | Bulk storage, on site | |
| Custom Supercritical Drying Apparatus | Empa | Swagelok (compression fitting and VCR) components | |
| Custom Cryogenic Furnace Bath | Empa | ||
| Custom Labview Interface | Empa |
Referências
- McHugh, M. A., Krukonis, V. J. Supercritical Fluid Extraction. , 1st ed, Butterworth. Stoneham, MA. (1986).
- Schneider, G. M. Physicochemical Principles of Extraction with Supercritical Gases. Angew. Chem. lnt. Ed. 17, 716-727 (1978).
- Williams, D. F. Extraction with Supercritical Gases. Chem. Eng. Sci. 36 (11), 1769-1788 (1981).
- Eckert, C. A., Knutson, B. I., Debenedetti, P. G. Supercritical fluids as solvents for chemical and materials processing. Nature. 383, 313-318 (1996).
- Cooper, A. I. Polymer synthesis and processing using supercritical carbon dioxide. J. Mater. Chem. 10, 207-234 (2000).
- Klesper, E., Corwin, A. H., Turner, D. A. High pressure gas chromatography above critical temperatures. J. Org. Chem. 27, 700-701 (1962).
- Tucker, S. C. Solvent Density Inhomogeneities in Supercritical Fluids. Chem. Rev. 99 (2), 391-418 (1999).
- Hubert, P., Vitzthum, O. G. Fluid Extraction of Hops, Spices, and Tobacco with Supercritical Gases. Angew. Chem. Int. Ed. 17 (10), 710-715 (1978).
- Zosel, K. Separation with Supercritical Gases: Practical Applications. Angew. Chem. Int. Ed. 17 (10), 702-709 (1978).
- Nelson, A. P., Farha, O. K., Mulfort, K. L., Hupp, J. T. Supercritical Processing as a Route to High Internal Surface Areas and Permanent Microporosity in Metal−Organic Framework Materials. J. Am. Chem. Soc. 131, 458-460 (2009).
- Liu, B., Wong-Foy, A. G., Matzger, A. J. Rapid and enhanced activation of microporous coordination polymers by flowing supercritical CO2. Chem. Commun. 49, 1419-1421 (2013).
- Cooper, A. I., Rosseinsky, M. J. Metal–organic frameworks: improving pore performance. Nat. Chem. 1, 26-27 (2009).
- Totten, R. K., et al. Enhanced Catalytic Activity through the Tuning of Micropore Environment and Supercritical CO2 Processing: Al(Porphyrin)-Based Porous Organic Polymers for the Degradation of a Nerve Agent Simulant. J. Am. Chem. Soc. 135, 11720-11723 (2013).
- Savage, P. E., Gopalan, S., Mizan, T. I., Martino, C. J., Brock, E. E. Reactions at supercritical conditions: Applications and fundamentals. AIChE J. 41 (7), 1723-1778 (1995).
- Baiker, A. Supercritical Fluids in Heterogeneous Catalysis. Chem. Rev. 99 (2), 453-474 (1999).
- Jessop, P. G., Ikariya, T., Noyori, R. Homogeneous Catalysis in Supercritical Fluids. Chem. Rev. 99 (2), 475-494 (1999).
- Giddings, J. C., Myers, M. N., McLaren, L., Keller, R. A. High Pressure Gas Chromatography Of Nonvolatile Species. Science. 162 (3849), 67-73 (1968).
- Gere, D. R. Supercritical Fluid Chromatography. Science. 222, 253-259 (1983).
- Kistler, S. S. Coherent Expanded Aerogels and Jellies. Nature. 127, 741-741 (1931).
- Biener, J., et al. Advanced carbon aerogels for energy applications. Energy Environ. Sci. 4, 656-667 (2011).
- Morère, J., et al. Deposition of Pd into mesoporous silica SBA-15 using supercritical carbon dioxide. J. Supercrit. Fluids. 56 (2), 213-222 (2011).
- Sathish, M., Mitani, S., Tomai, T., Honma, I. Supercritical fluid assisted synthesis of N-doped graphene nanosheets and their capacitance behavior in ionic liquid and aqueous electrolytes. J. Mater. Chem. A. 2, 4731-4738 (2014).
- Toews, K. L., Shroll, R. M., Wai, C. M., Smart, N. G. pH-Defining Equilibrium between Water and Supercritical CO2. Influence on SFE of Organics and Metal Chelates. Anal. Chem. 67 (22), 4040-4043 (1995).
- Barbaras, G., Barbaras, G. D., Finholt, A. E., Schlesinger, H. I. Cause Of Explosions Occasionally Observed During Evaporation Of Solutions Of Aluminum Hydride And Related Compounds. J. Am. Chem. Soc. 70, 877(1948).
- Burr, J. G., Brown, W. G., Heller, H. E. The Reduction of Carbon Dioxide to Formic Acid. J. Am. Chem. Soc. 72 (6), 2560-2562 (1950).
- Hugelshofer, C. L., et al. Gas−Solid Reaction of Carbon Dioxide with Alanates. J. Phys. Chem. C. 118, 15940-15945 (2014).
- Orimo, S. I., Nakamori, Y., Eliseo, J. R., Züttel, A., Jensen, C. M. Complex Hydrides for Hydrogen Storage. Chem. Rev. 107 (10), 4111-4132 (2007).
- Gross, K. J., Thomas, G. J., Jensen, C. M. Catalyzed alanates for hydrogen storage. J. Alloys Compd. 330-332, 683-690 (2002).
- Li, H. W., Yan, Y., Orimo, S. I., Züttel, A., Jensen, C. M. Recent Progress in Metal Borohydrides for Hydrogen Storage. Energies. 4 (1), 185-214 (2011).
- Frankcombe, T. J. Proposed Mechanisms for the Catalytic Activity of Ti in NaAlH4. Chem. Rev. 112, 2164(2012).
- Vajo, J. J., Olson, G. L. Hydrogen storage in destabilized chemical systems. Scr. Mater. 56, 829(2007).
- Zhang, Y., et al. LiBH4 nanoparticles supported by disordered mesoporous carbon: Hydrogen storage performances and destabilization mechanisms. Int. J. Hyd. Energ. 32 (16), 3976-3980 (2007).
- Christian, M. L., Aguey-Zinsou, K. F. Core–Shell Strategy Leading to High Reversible Hydrogen Storage Capacity for NaBH4. ACS Nano. 6 (9), 7739-7751 (2012).
- Stadie, N. P., et al. Supercritical N2 Processing as a Route to the Clean Dehydrogenation of Porous Mg(BH4)2. J. Am. Chem. Soc. 136 (23), 8181-8184 (2014).
- Borgschulte, A., et al. Impurity Gas Analysis of the Decomposition of Complex Hydrides. J. Phys. Chem. C. 115, 17220-17226 (2011).
- Filinchuk, Y., et al. Porous and Dense Magnesium Borohydride Frameworks: Synthesis, Stability, and Reversible Absorption of Guest Species. Angew. Chem. Int. Ed. 50, 11162-11166 (2011).
- Li, H. W., et al. Dehydriding and rehydriding processes of well-crystallized Mg(BH4)2 accompanying with formation of intermediate compounds. Acta Mater. 56 (6), 1342-1347 (2008).
- Schüth, F., Bogdanovic, B., Felderhoff, M. Light metal hydrides and complex hydrides for hydrogen storage. Chem. Comm. , 2249-2258 (2004).
- Vitillo, J. G., Groppo, E., Bardají, E. G., Baricco, M., Bordiga, S. Fast carbon dioxide recycling by reaction with γ-Mg(BH4)2. Phys. Chem. Chem. Phys. 16, 22482-22486 (2014).
- Paskevicius, M., et al. In-Situ X-ray Diffraction Study of γ-Mg(BH4)2 Decomposition. J. Phys. Chem. C. 116, 15321-15240 (2012).
- Lemmon, E. W., Huber, M. L., McLinden, M. O. NIST standard reference database 23: reference fluid thermodynamic and transport properties. Standard Reference Data Program. , (2008).
- Moquin, P. H. L., Temelli, F. J. Kinetic modeling of hydrolysis of canola oil in supercritical media. J. Supercrit. Fluid. 45, 94-101 (2008).
- Myers, M. N., Giddings, J. C. Ultra-High-Pressure Gas Chromatography in Micro Columns to 2000 Atmospheres. Sep. Sci. 1 (6), 761-776 (1966).
- McLeary, E. E., Jansen, J. C., Kapteijn, F. Zeolite based films, membranes and membrane reactors: Progress and prospects. Microporous Mesoporous Mater. 90, 198-220 (2006).
- Richter, B., Ravnsbæk, D. B., Tumanov, N., Filinchuk, Y., Jensen, T. R. Manganese borohydride; synthesis and characterization. Dalton Trans. , (2015).
- Liang, S., Tilotta, D. C. Extraction of petroleum hydrocarbons from soil using supercritical argon. Anal. Chem. 70 (3), 616-622 (1998).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados