JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
반응성이 있음 다공성 물질의 정제를위한 초 임계 질소 처리
요약
질소 인해 작은 분자 크기, 거의 액체, 초 임계 영역에서 고 밀도 및 화학적 불활성으로 추출 또는 건조 공정을위한 유효 임계 유체이다. 우리는 반응성, 다공성 물질의 정제 처리를 위해 초 임계 건조 질소 프로토콜을 제시한다.
초록
Supercritical fluid extraction and drying methods are well established in numerous applications for the synthesis and processing of porous materials. Herein, nitrogen is presented as a novel supercritical drying fluid for specialized applications such as in the processing of reactive porous materials, where carbon dioxide and other fluids are not appropriate due to their higher chemical reactivity. Nitrogen exhibits similar physical properties in the near-critical region of its phase diagram as compared to carbon dioxide: a widely tunable density up to ~1 g ml-1, modest critical pressure (3.4 MPa), and small molecular diameter of ~3.6 Å. The key to achieving a high solvation power of nitrogen is to apply a processing temperature in the range of 80-150 K, where the density of nitrogen is an order of magnitude higher than at similar pressures near ambient temperature. The detailed solvation properties of nitrogen, and especially its selectivity, across a wide range of common target species of extraction still require further investigation. Herein we describe a protocol for the supercritical nitrogen processing of porous magnesium borohydride.
서문
건조 초 임계 유체 추출 (SFE) 및 (SCD) 방법이 아니라, 특히 식품 및 석유 산업에서, 실제 응용의 넓은 범위에서 설정뿐만 아니라, 화학 합성, 분석 및 재료 처리. 1-6 건조 사용되는 또는 임계점 위의 조건에서 추출 매체들은 더 빠르고, 깨끗하고 효율적인 전통 (액체) 기법에 비해, 높은 작동 조건의 약간의 조정에 의해 유체의 매화 전원에 대하여 동조되는 추가적인 장점을 갖는다 . 3,7 간단한 SCD 방법은 세 가지 기본 단계로 구성되어 있습니다. 첫 번째 단계는 액체에 적절하게 선택된 SCD 액에 대상 불순 화합물을 함유하는 출발 고체 (혹은 액체) 물질에 노출되어 높은 밀도가 높은 (어쩌면 선택성에 대응 (또는 거의 액체 초임)의 위상, 대상 종에 대한 7) 용매의 전원을 켭니다. 티그 두 번째 단계는 가열 유체와 용해 목표 종 분리를 초래할 수 위상 경계가 통과하지 않도록, 밀폐 용기에 선택된 SCD 유체의 임계점 위의 압축 시스템이다. 마지막 단계는 천천히 위상 경계 또는 도중에 어떠한 해로운 표면 장력 효과가 발생하지 않고, 다시 탈출 대상 종을 포함하는 액체 용액을 허용 임계 온도 이상의 온도에서 진공 SCD 유체의 압력을 감압한다.
출발 물질은 표적 종 고갈 채로 필요하다면 반복 치료를 실시 할 수있다. 초 임계 유체 추출의 경우, 대상 용질 종 목적 생성물이고, 다른 경우에는 더욱 사용하기위한 용액으로부터. -8,9- 수집, 건조 또는 정제 된 출발 물질이 목적 생성물이며, 추출 된 불순물은 폐기된다. 후자의 시나리오, 본 명세서SCD 접근으로서, 높은 표면적, 진공 하에서 기존의 열처리 방법은 많은 경우에 기공을 비운에 충분하지 않은 유기 금속 틀 (MOFs와) 같은 미세 다공성 물질의 전처리에 대한 효율적인 전략으로 밝혀졌다 모든 원치 않는 손님, 또는 기공 붕괴 초래한다. (10) 이산화탄소 SCD (CSCD) 처리는 지금까지 1,000 %에 치료 물질을 통해 질소가 접촉 할 수있는 표면 영역의 증가로 이어지는으로 MOFs, 11 일과 후 합성 과정 12 이러한 촉매 활성 등의 개선. (13) 다른 주목할만한 초 임계 유체 응용 화학 반응을위한 광범위하게 조정할 수있는 매체로하고, 14 ~ 16 초 임계 유체 크로마토 그래피 (SCFC) 6,17,18 및 에어로젤과 첨단 복합 재료의 합성. 19- (22)
애플리케이션을 건조, SCD 유체는 두 가지 기준을 기반으로 선택된다 : a) 동작의 근접성중요한 포인트는 (편의를 위해 에너지 비용이나 공정의 복잡성 감소시키는)을 주위 조건하는 표적 종에 대해서와 b)의 용 매화 전원. 이산화탄소 (CO 2)가, 비 독성, 불연성 및 저렴한 때문에 많은 응용에서 편리한 SCD 유체 입증하고 있으며, 그 근처에 액체 일반적인 유기 표적 종의 수를 향해 높은 용 매화 능력을 나타내도록 조정될 수있다 . 1-3,7-9 다른 일반적인 초 임계 용매 (또는 공용 매) (<10 MPa로 압력과 273-323 K의 온도에서) 상태는 물 (그 주위 온도 및 초 임계 상태 사이의 용매 특성의 놀라운 범위에 걸쳐 포함 극성 (양성 자성 및 비 양성 자성) 비극성에 및 주변 조건에 비교적 가까운 임계점을 갖는로부터 스펙트럼을 커버 (23)), 아세톤, 에틸렌, 메탄올, 에탄올, 및 에탄.
이산화탄소가 사용될까지 가장 흔한 SCD 유체가있다. CSCD 확립 방법에있어서, 반응성출발 물질이없는 방청 인자의 CO 2 임계점 부근의 온도에서 매우 약하게 반응성 때문이다. 그러나, 가열 하에서 그들의 (아마도 의도적 맞춤) 불안정성에 부가 물 또는 이산화탄소의 존재 하에서 강한 반응성 소위 복합 하이드 라이드 (예를 들어, 알라 네이트 및 보로 하이드 라이드) 처리에서 본 독특한 도전 재료로서 특정 부류 . 24-26은 또한 나노 구조 및 / 또는 다공성 31-33 품종에 따라서도 큰 국제 고밀도 수소 저장 화합물, 27-30 등의 재료에 대한 관심이있다. 반응성, 불안정 및 나노 물질의 효율적인 정제를 위해, SCD 방법은 좁은 공동으로 침투에 적합한 작은 분자 직경을 가지고 있으며, 또한 향해 높은 용 매화 능력을 갖는다. 34 SCD 유체가 사용되어야 유망한 전략 아르 타겟 불순물 WHI르는 출발 물질 자체 향해 반응성 나머지. 여기서, 예컨대 추출, 특히 건조 애플리케이션 효과적인 초 임계 유체로서 질소를 사용하는 (N 2)가 제공된다. 특정 초 임계 질소 건조 (NSCD) 방법론은 목표 종 디보 란 및 N 부틸 화합물 (비슷하지만 N 개의 뷰 테인 구체적으로 식별되지 않음)를 모두 포함 γ 상 마그네슘 보로 하이드 라이드의 정제에 대하여 설명한다. 다음 프로토콜은 쉽게 다른 초 임계 질소 건조 또는 추출 과정에 일반 연장을 수정할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 장치
- 가스 공급기, 진공 시스템, 센서 (온도 및 압력), 및 (욕에 침지 될 수있는) 샘플 환경 : 고압 가스 배관으로 연결된 네 개의 주요 구성 요소로 이루어진 기본 초 임계 건조 (SCD) 장치를 사용. 건축 고품질 스테인리스 밸브, 피팅, 및 튜브 인 것을 확인, 80-300 K. 사이의 온도 범위에서 적어도 10 MPa의 압력이 정격
참고 : 회로도는 그림 1에 표시됩니다. - 질소 SCD (NSCD) 트리트먼트, 가스 공급 연구 순도는 0-10 MPa의 출구 사이의 압력 제어를위한 압력 조절기를 장착 (> 99.999 %) 질소 가스가 있음을 보장한다. 장치 50 L 병 (20 MPa로)를 연결하고 사용 전에 순수한 질소를 여러 번으로 시스템을 퍼지.
- 진공 시스템은 0.1Pa로 <까지 진공 압력을 달성 할 수 있고, 장치에 연결되어 있는지 확인미세 제어 니들 밸브. 바람직하게는, 직렬로 배치 된 오일 프리 러핑 펌프와 분자 드래그 터보 펌프를 사용한다.
- SCD 치료 동안에 압력의 정확한 측정을위한 적어도 두 개의 압력 센서를 사용하여 측정 및 진공 고압 센서 저압 센서가 0.1 내지 7 파 사이 총 측정 압력 범위를 달성했다.
- 전형적인 SCD 치료를 수행하기 위해 필요한 최소한의 정확성을 위해 적어도 두 온도 센서를 사용하는 센서를 샘플 및 77-300 K 사이의 정확한 측정을위한 기본 가스 투약 폴드 내의 센서와 열 접촉 (예를 들면, K 형 열전대) .
- 샘플 홀더는 처리에 필요한 시료의 양을 포함하는 적당한 내부 체적을 가지며, 스테인리스 강으로 제작되어 있는지 확인한다.
참고 : 목욕과 열 접촉에 길게 원통형 디자인 에이즈. - 샘플 용기를 닫 피팅 appropr 있는지 확인높은 압력과 반복 사용 (예를 들어,은 Swagelok VCR)에 늦는. 욕조에 샘플 홀더의 완전한 몰입을위한 튜브의 적절한 길이 (딥 튜브)를 통해 외부 환경으로부터 격리를위한 밸브 샘플 용기 볼륨을 연결합니다.
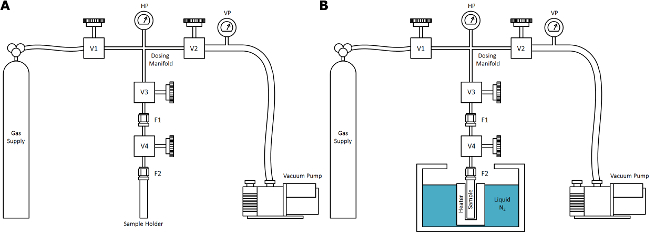
. 욕에서 시료의 침수 후 상온 (B)에서 (A) :도 1 초 임계 건조 질소 (NSCD) 장치 전형적인 실험실에서 사용하기위한 장치의 단순화 된 NSCD 개략도. 이 연구에서 기술 된 프로세스에 대한 가스 공급을 질소이지만, 이러한 일반적인 장치는 CO 2 등의 온도와 압력의 범위 내에서 실질적 누워 임계점 다른 SCD 유체로 일반화된다. 구성 요소는 제와 일관성을 위해 표시되어 있습니다프로토콜은 여기에 설명 된 전자. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 준비
- 샘플의 하중 0.2-0.5 g (γ-마그네슘 (BH 4) 2, 분말 형태의 습식 화학 합성 표준 건조 방법에 따라) 예컨대 아르곤 글로브 박스로서 전형적으로 불활성 분위기에서 적절한 조건하에 시료 홀더로, 아래 또는 주위 온도. 필터 가스켓 샘플 홀더 (피팅 F2)를 닫고 밸브 (밸브 V4)를 닫습니다. 장치에 샘플 홀더를 전송하고 (피팅 F1)를 연결합니다.
- (V2)를 통해 진공 청소기 대피 투여 매니 폴드를 엽니 다. 열기 V3 및 피난. (V1)을 통해 질소와 장치를 제거하고 (V2)를 통해 대피. 오픈 V4는 시스템 (<0.1 PA)의 최소 압력에 도달하기까지 24 시간 동안 RT에서 샘플을 피난.
- 샘플 목욕을 설치 (참조 샘플 홀더 주위에 그림 2). 가위 리프트, 또는 유사한 메커니즘에 위치로 목욕을 제기하여이 작업을 수행합니다.
- 110 K의 (단계 3.1 참조, T의 L) 원하는 미래 액체 온도로 히터를 설정하고 온도가 평형을 때까지 장치를 철수하는 것을 계속한다.
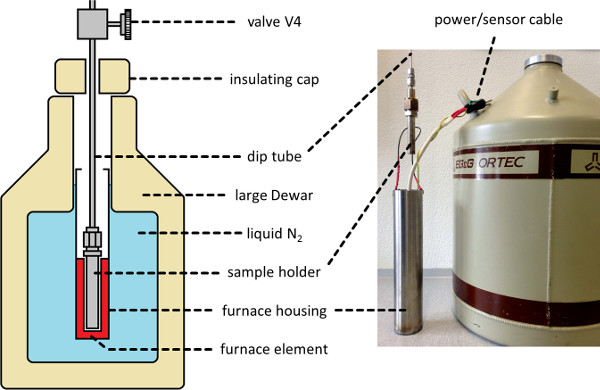
그림 2. 극저온 전기로 샘플 목욕. (왼쪽) 개략도 및 저온 유지 열 목욕 환경의 사진 (오른쪽), nscd를 처리하는 동안 샘플 홀더를 포함하는 측정 및 77-298 케이 사이의 시료 온도 제어를 허용하기위한 적절한 하세요 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 초 임계 질소 노출
- γ - 마그네슘 (BH 4) 2, (이 프로토콜에서 시연의 주제)의 NSCD 처리를 위해이 적당한 액체 용매 밀도에 해당하는 110 케이의 액체 온도 (T의 L)을 선택 (~ 0.6 g을 ml의 -1) ; 다른 nscd를 처리 공정에이 프로토콜의 응용 프로그램에 대한 필요에 따라 조정합니다 (아래 참고 참조).
- V2를 닫아 진공 시스템을 닫습니다. 압력이 상태도의 액체 영역으로 증가 할 수 있도록, 서서히 개방 V1을 스로틀 링. 2 MPa의와 T L에서 시스템을 평형.
- 4 시간 동안 액체 N 2의 샘플을 만끽 해보세요.
- 램프 ≤2 K 분 -1 150 (K)에 히터를 설정합니다. 압력 (이 P 최대가 MPa의 ≥10해야한다) 장치의 최대 정격 압력보다 더 이상 증가하지 않습니다 허용; 필요한 경우라면, V2를 통해 진공하는 초과 압력을 벤트. P 최대 150 K.에 시스템을 평형
- SUP의 샘플을 적시1 시간 동안 ercritical N 2.
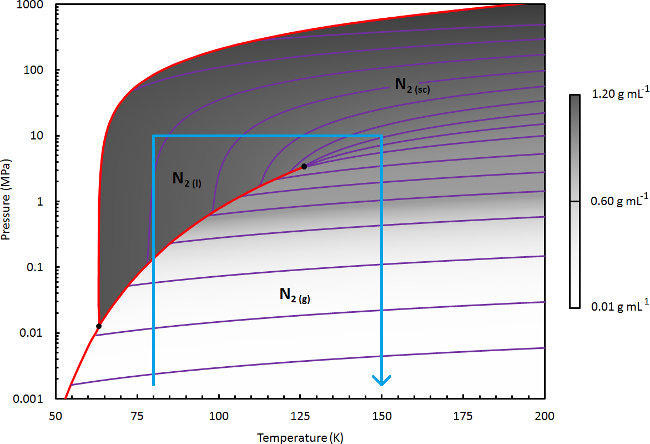
도 3 질소의 위상 다이어그램. 유체 밀도 (선형 스케일에 도시) 질소의 상세한 상태도 Refprop (상태의 개질 웹은-베네딕트 - 루빈 방정식)을 사용하여 계산된다. 일정한 밀도의 41 다양 라인 나타낸다 보라색. 고상 경계와 전이 비등 라인 빨간색으로 표시되어있다. 파란색 선은 N 2를 사용하여 건조 또는 추출 처리를 위해 관련 상태도의 영역의 경계를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
다른 물질이 프로토콜의 응용 프로그램에 대한 적절한 nscd를 처리 schem을 설정 참고 :표적 종의 효과적인 용 매화하기 위해 필요한 조건을 선택하여 E. 도 3에 도시 된 N (2)의 상태도를 참조. 액상 유체 높은 밀도를 달성하기 위해 (예를 들어, g는 0.8-1 ml의 -1), 적당한 액체 밀도 80-90 K.의 T의 L을 선택 (예를 들어, 0.6-0.8 G ml의 -1), 필요할 수 있습니다 90-115 케이 시행 착오 방식의 T는 L을 선택합니다.
4. 초 임계 질소 출시
- 조심스럽게 V2을 스로틀 압력은 가능한 한 느리게 감소시킴으로써 진공 시스템 균열. 반복적 12-24 hr의 대략적인 시간 범위에서 고 진공 (<0.1 PA)에 점진적 감소를 달성하기 위해 필요에 따라 더 높은 속도로 진공 시스템 균열.
- 완전히 샘플을 대피 샘플 목욕 및 완전 개방 (V2)를 제거합니다. RT 및 고진공 (<0.1 PA)에서 평형.
- D로, 1-24 시간 동안 RT와 <0.1 아빠의 샘플을 드가esired.
5. 사후 처리
- 닫기 밸브 V3 및 V4, 그리고 (F1 피팅) 장치로부터 샘플 홀더를 제거합니다.
- 예컨대 아르곤 충진 글로브 박스와 같은 처리를 위해 불활성 환경에 샘플 홀더를 이동. 아래의 주위 온도 또는 밀봉 된 용기에 시료 (F2 피팅) 홀더와 상점에서 샘플을 제거합니다.
Access restricted. Please log in or start a trial to view this content.
결과
알칼리 및 알칼리 토 금속 보로 하이드 라이드가 디보 란은 또한 때때로 탈리 가스에서 검출 된 같은 분해. 27, 29 다른 분해 생성물에 기체 수소의 큰 콘텐츠를 제공 가능한 수소 저장 물질이지만, 그 기원은 명확 선험적 아니다 ; 그들이 순수한 위상 분해 제품이지만, 또한 남은 화학 합성에서 불순물의 반응의 불순물 및 제품 일 수있다. (35), 마그네슘 보로 하이드 라이드 다공질 ?...
Access restricted. Please log in or start a trial to view this content.
토론
아마도 상대적으로 낮은 임계 온도 (126 K)로 인해, N (2)는 역사적으로 효과적인 SCD 용매로서 간과하고있다. 이전의보고에서, 3,17,42,43은 만 제외 (인해 상태도의이 영역에서의 낮은 유체 밀도 또는 단지 적당한 매화 전력을 나타내는 주변, 이상의 온도 처리의 맥락에서 언급 한 내용 매우 높은 압력 (43))에서. 초 임계 용매로서 N (2)의 실용성을 실현하는데 핵심 단계?...
Access restricted. Please log in or start a trial to view this content.
공개
저자가 공개하는 게 없다.
감사의 말
이 작품은 협업 프로젝트 BOR4STORE (부여 계약 번호 303428) 및 인프라 프로그램 H2FC (보조금 협정 제 FP7-284522)에서 유럽의 연료 전지 및 Hydruogen 공동 Undertaking에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Compressed Nitrogen Gas | Messer Schweiz AG | 50 L bottle, purity > 99.999%, <3 ppmv H2O | |
| Liquid Nitrogen | Pan Gas AG | Bulk storage, on site | |
| Custom Supercritical Drying Apparatus | Empa | Swagelok (compression fitting and VCR) components | |
| Custom Cryogenic Furnace Bath | Empa | ||
| Custom Labview Interface | Empa |
참고문헌
- McHugh, M. A., Krukonis, V. J. Supercritical Fluid Extraction. , 1st ed, Butterworth. Stoneham, MA. (1986).
- Schneider, G. M. Physicochemical Principles of Extraction with Supercritical Gases. Angew. Chem. lnt. Ed. 17, 716-727 (1978).
- Williams, D. F. Extraction with Supercritical Gases. Chem. Eng. Sci. 36 (11), 1769-1788 (1981).
- Eckert, C. A., Knutson, B. I., Debenedetti, P. G. Supercritical fluids as solvents for chemical and materials processing. Nature. 383, 313-318 (1996).
- Cooper, A. I. Polymer synthesis and processing using supercritical carbon dioxide. J. Mater. Chem. 10, 207-234 (2000).
- Klesper, E., Corwin, A. H., Turner, D. A. High pressure gas chromatography above critical temperatures. J. Org. Chem. 27, 700-701 (1962).
- Tucker, S. C. Solvent Density Inhomogeneities in Supercritical Fluids. Chem. Rev. 99 (2), 391-418 (1999).
- Hubert, P., Vitzthum, O. G. Fluid Extraction of Hops, Spices, and Tobacco with Supercritical Gases. Angew. Chem. Int. Ed. 17 (10), 710-715 (1978).
- Zosel, K. Separation with Supercritical Gases: Practical Applications. Angew. Chem. Int. Ed. 17 (10), 702-709 (1978).
- Nelson, A. P., Farha, O. K., Mulfort, K. L., Hupp, J. T. Supercritical Processing as a Route to High Internal Surface Areas and Permanent Microporosity in Metal−Organic Framework Materials. J. Am. Chem. Soc. 131, 458-460 (2009).
- Liu, B., Wong-Foy, A. G., Matzger, A. J. Rapid and enhanced activation of microporous coordination polymers by flowing supercritical CO2. Chem. Commun. 49, 1419-1421 (2013).
- Cooper, A. I., Rosseinsky, M. J. Metal–organic frameworks: improving pore performance. Nat. Chem. 1, 26-27 (2009).
- Totten, R. K., et al. Enhanced Catalytic Activity through the Tuning of Micropore Environment and Supercritical CO2 Processing: Al(Porphyrin)-Based Porous Organic Polymers for the Degradation of a Nerve Agent Simulant. J. Am. Chem. Soc. 135, 11720-11723 (2013).
- Savage, P. E., Gopalan, S., Mizan, T. I., Martino, C. J., Brock, E. E. Reactions at supercritical conditions: Applications and fundamentals. AIChE J. 41 (7), 1723-1778 (1995).
- Baiker, A. Supercritical Fluids in Heterogeneous Catalysis. Chem. Rev. 99 (2), 453-474 (1999).
- Jessop, P. G., Ikariya, T., Noyori, R. Homogeneous Catalysis in Supercritical Fluids. Chem. Rev. 99 (2), 475-494 (1999).
- Giddings, J. C., Myers, M. N., McLaren, L., Keller, R. A. High Pressure Gas Chromatography Of Nonvolatile Species. Science. 162 (3849), 67-73 (1968).
- Gere, D. R. Supercritical Fluid Chromatography. Science. 222, 253-259 (1983).
- Kistler, S. S. Coherent Expanded Aerogels and Jellies. Nature. 127, 741-741 (1931).
- Biener, J., et al. Advanced carbon aerogels for energy applications. Energy Environ. Sci. 4, 656-667 (2011).
- Morère, J., et al. Deposition of Pd into mesoporous silica SBA-15 using supercritical carbon dioxide. J. Supercrit. Fluids. 56 (2), 213-222 (2011).
- Sathish, M., Mitani, S., Tomai, T., Honma, I. Supercritical fluid assisted synthesis of N-doped graphene nanosheets and their capacitance behavior in ionic liquid and aqueous electrolytes. J. Mater. Chem. A. 2, 4731-4738 (2014).
- Toews, K. L., Shroll, R. M., Wai, C. M., Smart, N. G. pH-Defining Equilibrium between Water and Supercritical CO2. Influence on SFE of Organics and Metal Chelates. Anal. Chem. 67 (22), 4040-4043 (1995).
- Barbaras, G., Barbaras, G. D., Finholt, A. E., Schlesinger, H. I. Cause Of Explosions Occasionally Observed During Evaporation Of Solutions Of Aluminum Hydride And Related Compounds. J. Am. Chem. Soc. 70, 877(1948).
- Burr, J. G., Brown, W. G., Heller, H. E. The Reduction of Carbon Dioxide to Formic Acid. J. Am. Chem. Soc. 72 (6), 2560-2562 (1950).
- Hugelshofer, C. L., et al. Gas−Solid Reaction of Carbon Dioxide with Alanates. J. Phys. Chem. C. 118, 15940-15945 (2014).
- Orimo, S. I., Nakamori, Y., Eliseo, J. R., Züttel, A., Jensen, C. M. Complex Hydrides for Hydrogen Storage. Chem. Rev. 107 (10), 4111-4132 (2007).
- Gross, K. J., Thomas, G. J., Jensen, C. M. Catalyzed alanates for hydrogen storage. J. Alloys Compd. 330-332, 683-690 (2002).
- Li, H. W., Yan, Y., Orimo, S. I., Züttel, A., Jensen, C. M. Recent Progress in Metal Borohydrides for Hydrogen Storage. Energies. 4 (1), 185-214 (2011).
- Frankcombe, T. J. Proposed Mechanisms for the Catalytic Activity of Ti in NaAlH4. Chem. Rev. 112, 2164(2012).
- Vajo, J. J., Olson, G. L. Hydrogen storage in destabilized chemical systems. Scr. Mater. 56, 829(2007).
- Zhang, Y., et al. LiBH4 nanoparticles supported by disordered mesoporous carbon: Hydrogen storage performances and destabilization mechanisms. Int. J. Hyd. Energ. 32 (16), 3976-3980 (2007).
- Christian, M. L., Aguey-Zinsou, K. F. Core–Shell Strategy Leading to High Reversible Hydrogen Storage Capacity for NaBH4. ACS Nano. 6 (9), 7739-7751 (2012).
- Stadie, N. P., et al. Supercritical N2 Processing as a Route to the Clean Dehydrogenation of Porous Mg(BH4)2. J. Am. Chem. Soc. 136 (23), 8181-8184 (2014).
- Borgschulte, A., et al. Impurity Gas Analysis of the Decomposition of Complex Hydrides. J. Phys. Chem. C. 115, 17220-17226 (2011).
- Filinchuk, Y., et al. Porous and Dense Magnesium Borohydride Frameworks: Synthesis, Stability, and Reversible Absorption of Guest Species. Angew. Chem. Int. Ed. 50, 11162-11166 (2011).
- Li, H. W., et al. Dehydriding and rehydriding processes of well-crystallized Mg(BH4)2 accompanying with formation of intermediate compounds. Acta Mater. 56 (6), 1342-1347 (2008).
- Schüth, F., Bogdanovic, B., Felderhoff, M. Light metal hydrides and complex hydrides for hydrogen storage. Chem. Comm. , 2249-2258 (2004).
- Vitillo, J. G., Groppo, E., Bardají, E. G., Baricco, M., Bordiga, S. Fast carbon dioxide recycling by reaction with γ-Mg(BH4)2. Phys. Chem. Chem. Phys. 16, 22482-22486 (2014).
- Paskevicius, M., et al. In-Situ X-ray Diffraction Study of γ-Mg(BH4)2 Decomposition. J. Phys. Chem. C. 116, 15321-15240 (2012).
- Lemmon, E. W., Huber, M. L., McLinden, M. O. NIST standard reference database 23: reference fluid thermodynamic and transport properties. Standard Reference Data Program. , (2008).
- Moquin, P. H. L., Temelli, F. J. Kinetic modeling of hydrolysis of canola oil in supercritical media. J. Supercrit. Fluid. 45, 94-101 (2008).
- Myers, M. N., Giddings, J. C. Ultra-High-Pressure Gas Chromatography in Micro Columns to 2000 Atmospheres. Sep. Sci. 1 (6), 761-776 (1966).
- McLeary, E. E., Jansen, J. C., Kapteijn, F. Zeolite based films, membranes and membrane reactors: Progress and prospects. Microporous Mesoporous Mater. 90, 198-220 (2006).
- Richter, B., Ravnsbæk, D. B., Tumanov, N., Filinchuk, Y., Jensen, T. R. Manganese borohydride; synthesis and characterization. Dalton Trans. , (2015).
- Liang, S., Tilotta, D. C. Extraction of petroleum hydrocarbons from soil using supercritical argon. Anal. Chem. 70 (3), 616-622 (1998).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유