Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Procédure d'adaptation Laboratoire de l'évolution de Microorganismes Utilisation chémostat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons un protocole pour obtenir adaptatif évolution en laboratoire de micro-organismes dans des conditions à l'aide de la culture chemostat. En outre, l'analyse génomique de la souche évoluée est discutée.
Résumé
Natural evolution involves genetic diversity such as environmental change and a selection between small populations. Adaptive laboratory evolution (ALE) refers to the experimental situation in which evolution is observed using living organisms under controlled conditions and stressors; organisms are thereby artificially forced to make evolutionary changes. Microorganisms are subject to a variety of stressors in the environment and are capable of regulating certain stress-inducible proteins to increase their chances of survival. Naturally occurring spontaneous mutations bring about changes in a microorganism's genome that affect its chances of survival. Long-term exposure to chemostat culture provokes an accumulation of spontaneous mutations and renders the most adaptable strain dominant. Compared to the colony transfer and serial transfer methods, chemostat culture entails the highest number of cell divisions and, therefore, the highest number of diverse populations. Although chemostat culture for ALE requires more complicated culture devices, it is less labor intensive once the operation begins. Comparative genomic and transcriptome analyses of the adapted strain provide evolutionary clues as to how the stressors contribute to mutations that overcome the stress. The goal of the current paper is to bring about accelerated evolution of microorganisms under controlled laboratory conditions.
Introduction
Les microorganismes peuvent survivre et s'adapter à des environnements divers. En cas de stress sévère, l' adaptation peut se produire via l' acquisition de phénotypes bénéfiques par des mutations génomiques aléatoires et la sélection positive ultérieure 1-3. Par conséquent, les cellules microbiennes peuvent adapter en changeant métabolique ou les réseaux de régulation pour une croissance optimale, qui est appelé «l'évolution adaptative". tendances microbiennes importantes récentes, telles que les épidémies de superbactéries et l'apparition de souches microbiennes robustes, sont très étroitement liés à l'évolution adaptative dans des conditions stressantes. Dans des conditions de laboratoire définies, nous sommes en mesure d'étudier les mécanismes de l'évolution moléculaire et même de contrôler la direction de l'évolution microbienne pour diverses applications. Contrairement à des organismes multicellulaires, les organismes unicellulaires sont bien adaptés à l'évolution de laboratoire adaptatif (ALE) pour les raisons suivantes: ils régénèrent rapidement, ils maintiennent des populations importantes, et il est facile de créer et maintenir homenvironnements ogeneous. Combiné avec les récentes avancées dans les techniques de séquençage de l'ADN et des technologies à haut débit, ALE permet l'observation directe des changements génomiques qui conduisent à des changements réglementaires systémiques. la dynamique de mutation et la diversité de la population sont également observables. Stratégies de génie génétique peuvent être déterminées à partir de l'analyse des souches d'ale 4,5.
Culture Chemostat est une méthode utilisée pour obtenir des cellules à l' état stable et d' augmenter la productivité dans les processus de fermentation 6. Du milieu frais est ajouté et le bouillon de culture est récolté pendant le processus (celui-ci comprend en moyenne et la biomasse). Culture chemostat à long terme, cependant, modifie la productivité à l' état stable de la culture et provoque l'accumulation de mutations spontanées et la sélection lors de la culture (figure 1a). Sous diverses pressions de sélection (facteurs de stress), l'accumulation de mutations est améliorée. Une augmentation progressive de stress dans un long terme chémostat prévoit une sélection continue de mutations qui agissent contre les facteurs de stress donnés, tels que la température, le pH, la pression osmotique, des substances nutritives inanition, l' oxydation, des produits finaux toxiques, etc. , le transfert des colonies à partir d' un milieu solide et le transfert en série à partir d' un milieu liquide (répété culture discontinue) permettent également aux chercheurs d'obtenir des micro - organismes évolués (figure 1b et 1c). Bien que la culture chemostat nécessite des méthodes compliquées, la piscine de la diversité (nombre de répétitions et de la taille de la population) est supérieure à celle obtenue par transfert des colonies et des techniques de transfert de série. L'exposition au stress stable à des cellules individuelles et une diminution de la variation de l'état cellulaire pendant la culture chemostat (état stable) sont les autres avantages de l'ALE par rapport aux techniques basées sur la culture par lots. ALE Le stress induit par des Escherichia coli soumis à des conditions succinate élevées est introduit dans cet article.
iles / ftp_upload / 54446 / 54446fig1.jpg "/>
Figure 1: Méthodes d'évolution de laboratoire adaptatif (A) Chemostat;. (B) transfert en série; (C) transfert des colonies. Les chiffres supérieurs illustrent le concept des méthodes pour ALE, et les chiffres inférieurs illustrent le nombre de cellules qui se sont développées au cours ALE. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Protocole
1. Équipement Préparation
- Obtenir un récipient chimiostatique (150-250 ml) ou d'un Erlenmeyer (250 ml) contenant un orifice d'entrée et un orifice de sortie. Connectez les ports avec des tubes de silicium permettant des taux de 10-100 ml / h de débit. En option, utiliser un évent, un orifice de sortie d'air et des orifices d'entrée et sortie d'eau à température contrôlée.
- Obtenir un dispositif approprié pour le pot de chemostat qui fournit pour l'agitation et de la température (ou utiliser un incubateur agitateur rotatif).
- Obtenir deux pompes péristaltiques afin d'offrir un milieu frais et de percevoir la culture.
- Obtenir un pot de réservoir (10 à 20 L) contenant un orifice de sortie de fluide et un orifice d'entrée d'air.
- Obtenir un tube de silicium pour le taux de dilution (c. -à- ID 0,8 mm, plage de débit de 0,06 à 36 ml / min; L / S 13 tubes).
2. Moyen Préparation et stérilisation
- Medium initial
- Dissoudre 0,3 g de glucose, 0,08 g de NH 4Cl, 0,05 g de NaCl, 0,75 g de Na 2 HPO 4 .2H 2 O, et 0,3 g de KH 2 PO 4 dans 90 ml d' eau distillée (DW) dans un récipient chimiostatique.
- Sceller le bocal en chemostat avec le tuyau à l'aide des pinces. Ne pas sceller l'évent.
- Stériliser le pot de chemostat dans un autoclave à 121 ° C pendant 15 min. Après stérilisation, stocker le pot de chemostat à la température ambiante.
- Dissoudre 0,02 g de MgSO 4 · 7H 2 O, 0,01 g de CaCl 2, et 0,1 mg de thiamine dans 10 ml DW (solution A).
- Une solution de filtration à l'aide d'une seringue et d'un filtre à seringue pré-stérilisé (un filtre de 0,45 um de pores).
- Ajouter la solution A filtrats dans le pot de chemostat.
- stress Medium
- Dissoudre 30 g de glucose, 8 g de NH 4 Cl, 5 g de NaCl, 75 g de Na 2 HPO 4 .2H 2 O, 30 g de KH 2 PO 4 et 300 g de succinate disodique hexahydraté (Na 2 · succinate .6H 2 O; le facteur de stress utilisé dans cette expérience) dans 9,9 L DW dans un pot de réservoir.
- Sceller le pot de réservoir avec le tuyau à l'aide des pinces. Ne pas sceller l'évent.
- Stériliser le pot de réservoir dans un autoclave à 121 ° C pendant 15 min. Après stérilisation, stocker le pot à la température ambiante.
- Dissoudre 2 g MgSO 4 · 7H 2 O, 1 g de CaCl 2, et 10 mg de thiamine dans 100 ml DW (solution A).
- Une solution de filtre avec une seringue et d'un filtre à seringue pré-stérilisé (un filtre à pores de 0,45 um).
- Ajouter la solution A filtrats dans le pot de réservoir.
- Aseptique connecter le tube de silicium stérilisé pour le pot de réservoir et fixer les pompes péristaltiques.
- Haut-stress moyen
- Préparer le milieu comme dans la section 2.2, mais avec une plus grande concentration de stresseur (ie, 3-5 g / L plus élevé dans l'adaptation succinate).
Remarque: Ce protocole est pour l'adaptation à une contrainte eà peut être livré via le support. Dans le cas des facteurs de stress physiques tels que la température, l'agitation ou l'illumination, la culture doit être conçu en conséquence.
- Préparer le milieu comme dans la section 2.2, mais avec une plus grande concentration de stresseur (ie, 3-5 g / L plus élevé dans l'adaptation succinate).
3. Culture initiale
- Inoculer une seule colonie de type sauvage E. coli dans un tube à essai de 15 ml contenant 4 ml de milieu initial.
- Incuber le tube à essai dans un incubateur à agitation par secousses pendant 12 heures à 37 ° C et à 220 tours par minute.
- transfert aseptique 1 ml de préculture au pot chemostat.
- Incuber le pot de chemostat, prévoyant l'aération (air 50 ml / min) et l'agitation (200 rpm), à 37 ° C pendant 6 heures.
4. Stress Adaptation
- Aseptique connecter l'extrémité du tube de silicium à partir des pompes à la jarre de chemostat.
- Démarrer la pompe de sortie (10 ml / h ou plus) et recueillir la culture.
Remarque: La culture doit être en phase exponentielle, généralement 4-8 heures après la culture initiale. - ChEck la densité optique (600 nm) de la culture de la tubulure de sortie.
- Démarrer la pompe d'entrée (10 ml / h, ce qui correspond à un taux de dilution de 0,1 h -1).
- Vérifier la densité optique de la culture à 600 nm à partir de la tubulure de sortie toutes les 24 heures.
- Faire fonctionner le chemostat pendant 96 heures (chiffre d'affaires de 9,6 fois) ou plus. Si la densité optique est stable, échanger le réservoir contenant le milieu de stress élevé. Si la densité optique est inférieure à 0,2, arrêter la pompe d'entrée d'alimentation pendant 6 heures. Redémarrez la pompe d'entrée et vérifier que la densité optique est supérieure à 0,2.
- Augmenter graduellement la concentration du facteur de stress en changeant à un réservoir contenant une concentration plus élevée de facteur de stress.
- Prélever des échantillons de la culture adaptée chaque fois qu'il atteint une étape importante (par exemple, une souche adaptée à 100 g / L stress succinate), et un magasin pour une analyse génomique.
- Pour le stockage de l'échantillon, mélanger l'échantillon de culture (0,5 ml) avec un stérilisée 80% de glycérol solutisur (0,5 ml) et le stocker à -80 ° C.
Remarque: si le micro-organisme acquiert une capacité de dégrader le facteur de stress au cours du procédé ALE, la concentration du facteur de force dans le récipient de fermentation ne sont pas les mêmes que dans le réservoir frais.
5. unique colonie d'isolement de la souche adaptée au stress
- Préparer le milieu de plaque de gélose (1,6% de gélose) contenant le même facteur de stress et à la même concentration du milieu.
- La culture de la plaque de sortie (0,1 ml) à partir du chemostat, et incuber à 37 ° C pendant 16 heures.
- Prélever des colonies uniques à partir de la plaque à l'aide d'un cure-dent stérile et inoculer 15 ml dans les tubes à essai contenant le même facteur de stress et à la même concentration que dans le milieu chémostat, et laisser incuber pendant 6 heures.
- Transférer 1 ml de bouillon de culture dans un erlenmeyer de 250 ml contenant 50 ml de milieu. Récolte 0,5 ml du bouillon de culture, toutes les 1 h, et de mesurer la DO à 600 nm. Comparer le taux de l'strai adapté de croissancen à celle de la souche de type sauvage étant donné le stresseur.
Résultats
Pour haute succinate adaptation au stress, le type sauvage E. coli W3110 a été cultivé dans un chemostat à D = 0,1 h -1 pendant 270 jours (Figure 2).
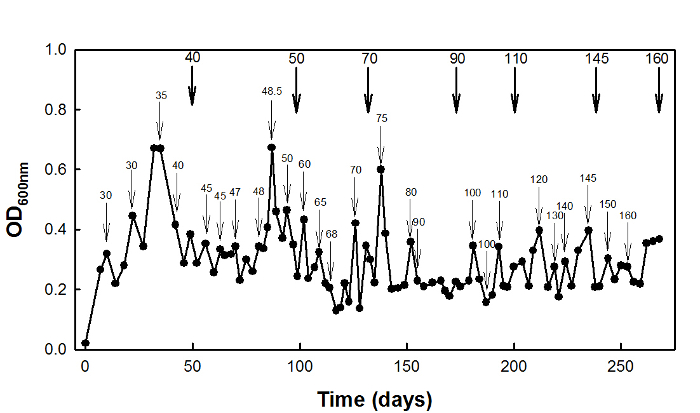
Figure 2: High-succinate adaptation au stress de E. coli W3110 en utilisant la culture chemostat. flèches minces indiquent...
Discussion
Les microorganismes sont capables d'adapter à presque tous les environnements en raison de leur taux de croissance rapide et de la diversité génétique. évolution de laboratoire Adaptive permet des micro-organismes à évoluer dans des conditions conçues, ce qui fournit un moyen de sélectionner les organismes individuels hébergeant des mutations spontanées qui sont bénéfiques dans les conditions données.
La technique de chemostat est plus robuste pour réaliser l'évolutio...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This study was financially supported by the Korean Ministry of Science, ICT and Future Planning (Intelligent Synthetic Biology Center program 2012M3A6A8054887). P. Kim was supported by a fellowship from the Catholic University of Korea (2015).
matériels
| Name | Company | Catalog Number | Comments |
| Mini-chemostat fermentor | Biotron Inc. | - | manufactured by special order |
| silicon tubing | Cole-Parmer | Masterflex L/S 13 | tubing size can be varied depending on the dilution rate and the size of fermentor jar. |
| reservoir jar | Bellco | Media storage bottle | 20 L |
| chemicals | Sigma-Aldrich | - | reagent grade |
| glucose | Sigma-Aldrich | G5767 | ACS reagent |
| NH4Cl | Sigma-Aldrich | A9434 | for molecular biology, suitable for cell culture, ≥99.5% |
| NaCl | Sigma-Aldrich | 746398 | ACS reagent, ≥99% |
| Na2HPO4·2H2O | Sigma-Aldrich | 4272 | 98.5-101% |
| KH2PO4 | Sigma-Aldrich | 795488 | ACS reagent, ≥99% |
| MgSO4·7H2O | Sigma-Aldrich | 230391 | ACS reagent, ≥98% |
| CaCl2 | Sigma-Aldrich | 793639 | ACS reagent, ≥96% |
| thiamine·HCl | Sigma-Aldrich | T4625 | reagent grade, ≥99% |
| Na2·succinate·6H2O | Sigma-Aldrich | S2378 | ReagentPlus, ≥99% |
Références
- Rando, O. J., Verstrepen, K. J. Timescales of genetic and epigenetic inheritance. Cell. 128, 655-668 (2007).
- Kim, H. J., et al. Short-term differential adaptation to anaerobic stress via genomic mutations by Escherichia coli strains K-12 and B lacking alcohol dehydrogenase. Front Microbiol. 5, 476 (2014).
- Mendizabal, I., Keller, T. E., Zeng, J., Yi, S. V. Epigenetics and evolution. Integr Comp Biol. 54, 31-42 (2014).
- Lee, J. Y., Seo, J., Kim, E. S., Lee, H. S., Kim, P. Adaptive evolution of Corynebacterium glutamicum resistant to oxidative stress and its global gene expression profiling. Biotechnol Lett. 35, 709-717 (2013).
- Lee, J. Y., et al. Artificial oxidative stress-tolerant Corynebacterium glutamicum. AMB Express. 4, 15 (2014).
- Narang, A. The steady states of microbial growth on mixtures of substitutable substrates in a chemostat. J Theor Biol. 190, 241-261 (1998).
- Kwon, Y. D., Kim, S., Lee, S. Y., Kim, P. Long-term continuous adaptation of Escherichia coli to high succinate stress and transcriptome analysis of the tolerant strain. J Biosci Bioeng. 111, 26-30 (2011).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nat Rev Genet. 14, 827-839 (2013).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25, 2078-2079 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- Deatherage, D. E., Barrick, J. E. Identification of mutations in laboratory-evolved microbes from next-generation sequencing data using breseq. Methods Mol Biol. 1151, 165-188 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon