Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Kemostat kullanarak Mikroorganizmaların Adaptif Laboratuvarı Evolution Prosedürü
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, biz kemostat kültür kullanarak koşullar altında mikroorganizmaların adaptif laboratuvar evrimini elde etmek için bir protokol mevcut. Ayrıca, gelişmiş soyunun genomik analiz tartışılmıştır.
Özet
Natural evolution involves genetic diversity such as environmental change and a selection between small populations. Adaptive laboratory evolution (ALE) refers to the experimental situation in which evolution is observed using living organisms under controlled conditions and stressors; organisms are thereby artificially forced to make evolutionary changes. Microorganisms are subject to a variety of stressors in the environment and are capable of regulating certain stress-inducible proteins to increase their chances of survival. Naturally occurring spontaneous mutations bring about changes in a microorganism's genome that affect its chances of survival. Long-term exposure to chemostat culture provokes an accumulation of spontaneous mutations and renders the most adaptable strain dominant. Compared to the colony transfer and serial transfer methods, chemostat culture entails the highest number of cell divisions and, therefore, the highest number of diverse populations. Although chemostat culture for ALE requires more complicated culture devices, it is less labor intensive once the operation begins. Comparative genomic and transcriptome analyses of the adapted strain provide evolutionary clues as to how the stressors contribute to mutations that overcome the stress. The goal of the current paper is to bring about accelerated evolution of microorganisms under controlled laboratory conditions.
Giriş
Mikroorganizmalar hayatta ve çeşitli ortamlara uyum sağlayabilir. Ağır stres altında, adaptasyon rastgele genomik mutasyonların ve sonraki pozitif seleksiyon 1-3 yararlı fenotip kazanması ile ortaya çıkabilir. Bu nedenle, mikrobiyal hücreler "adaptif evrim" olarak adlandırılır optimum büyüme için metabolik veya düzenleyici ağları değiştirerek uyum sağlayabilir. Bu tür süpermikroplar salgınları ve sağlam mikrobiyal suşların ortaya çıkması gibi yeni önemli mikrobiyal eğilimler, çok yakından stresli koşullar altında evrimi uyarlamalı ilişkilidir. tanımlanan laboratuvar koşullarında, moleküler evrim mekanizmaları incelemek ve hatta çeşitli uygulamalar için mikrobik evrimin yönünü kontrol edebiliyoruz. onlar büyük nüfusları korumak, hızlı bir şekilde yeniden ve oluşturmak ve Hom bakımı kolaydır: Çok hücreli organizmalardan farklı, tek hücreli canlılar aşağıdaki nedenlerden ötürü adaptif laboratuvar evrim (ALE) için uygundurogeneous ortamlar. DNA dizileme teknikleri ve yüksek verimli teknolojilerindeki son gelişmeler ile birlikte, ALE sistemik düzenleyici değişikliklere yol genomik değişikliklerin doğrudan gözlem sağlar. Mutasyon dinamikleri ve nüfus çeşitliliği de gözlemlenebilir. Genetik mühendisliği yöntemi ALE suşlarının 4,5 analizinden belirlenebilir.
Kemostat kültür kararlı durum hücreleri elde etmek ve fermantasyon süreçleri 6 verimliliği artırmak için kullanılan bir yöntemdir. Taze ortam ilave edilir ve kültür sıvısı işlemi (ikinci orta ve biyokütle içerir) içinde toplanır. Uzun vadeli kemostat kültürü Bununla birlikte, kültürün kararlı durum verimliliği değiştirir ve kültür (Şekil 1a) sırasında spontan mutasyon ve seleksiyon birikimi getiriyor. Çeşitli seçim basınçlarında (stres) altında, mutasyonların birikimi artar. Uzun vadede stres kademeli bir artış kemostat tekrarlanan sıvı bir ortamda bir katı ortam ve seri transferi (arasında, sıcaklık, pH, ozmotik basıncı, besin açlık, oksidasyon, toksik son ürün, vb Koloni transferi verilen stres karşı çalışma mutasyonlar, sürekli bir seçim sağlar küme kültür), araştırmacılara gelişti mikroorganizmaları (Şekil 1B ve 1C) elde edilmesine olanak sağlamaktadır. kemostat kültür karmaşık yöntemler gerektirmesine rağmen, çeşitlilik havuzu (tekrarlamalı ve nüfus büyüklüğü sayısı) koloni transfer ve seri transfer teknikleri ile elde edilenden daha yüksektir. tek tek hücrelerin kararlı stres maruziyeti ve kemostat kültürü (sabit durum) toplu kültür temelli tekniklerle karşılaştırıldığında ALE diğer faydaları şunlardır sırasında hücresel devlet varyasyon azalmıştır. Yüksek süksinat koşullara tabi Escherichia coli strese bağlı ALE Bu makalede tanıtıldı.
iles / ftp_upload / 54446 / 54446fig1.jpg "/>
Şekil 1: adaptif laboratuvar evrim Yöntemleri (A) Kemostat;. (B) Seri transferi; (C) koloni transferi. Üst rakamlar ALE yöntemleri kavramını göstermek ve alt rakamlar ALE sırasında büyüyen hücrelerin sayısını göstermektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Protokol
1. Ekipman Hazırlığı
- Bir kemostat küp (150-250 mi) ya da bir giriş noktası ihtiva eden bir bir Erlenmeyer şişesi (250 mi) ve bir çıkış portuna elde edin. silikon boru 10-100 ml / saat akış hızları için izin ile bağlantı noktalarını bağlayın. İsteğe bağlı olarak, bir hava deliği, bir hava çıkış ağzı, ve sıcaklık kontrollü su giriş ve çıkış bağlantı noktaları kullanımı.
- ajitasyon ve ısı kontrolü sağlayan kemostat kavanoz için uygun olan bir cihaz elde edilir (veya bir döner çalkalama inkübatöründe kullanın).
- kültür taze orta teslim ve toplamak için iki peristaltik pompa edinin.
- orta çıkış deliği ve bir hava giriş ağzı ihtiva eden bir hazne kavanoz (10-20 L) elde edilir.
- (L / S 13 boru Yani, ID, 0.8 mm, akış aralığı 0,06-36 ml / dak) seyrelme oranı için uygun silikon boru elde edilir.
2. Orta Hazırlama ve Sterilizasyon
- ilk Orta
- 0.3 gr glikoz, 0.08 g NH4 çözülürCI, 0.05 g NaCl, 0.75 g Na 2 HPO 4 · 2H 2, O, ve 0.3 g KH 2 PO 4 90 ml damıtılmış su, kemostat kavanoza (DW).
- kelepçeler kullanılarak boru ile birlikte kemostat kavanoz mühür. havalandırma deliğini mühür yok.
- 15 dakika boyunca 121 ° C'de bir otoklav içinde kemostat kavanoz sterilize edin. Sterilizasyon sonrasında, oda sıcaklığında kemostat kavanoz saklayın.
- Çözülür 0.02 gr MgSO 4 · 7H 2, O, 0.01 g CaCl2 ve 10 mi DW (A çözeltisi) içinde 0.1 mg tiamin.
- bir şırınga ve bir önceden sterilize edilmiş şırınga filtresi (0.45 mikron gözenek filtresi) ile filtre solüsyonu için uygun değildir.
- Bir kemostat kavanoza süzüntüler çözüm ekleyin.
- stres Orta
- 30 g glukoz, 8 g NH4CI, 5 g NaCl, 75 g 2 Na HPO 4 · çözülür 2H 2, O, 30 g KH 2 PO 4 ve 300 g disodyum süksinat heksahidrat (Na2 · süksinat · 6H 2 O; Bir rezervuar kavanoza 9.9 L DW bu deneyde kullanılan stres).
- kelepçeler kullanılarak boru ile birlikte rezervuar kavanoz mühür. havalandırma deliğini mühür yok.
- 15 dakika boyunca 121 ° C'de bir otoklav içinde, rezervuar kavanoz sterilize edin. Sterilizasyon sonrasında, oda sıcaklığında kavanoz saklayın.
- 2 g MgSO 4 · 7H 2, O, 1 g CaCl2, ve 100 ml DW (A çözeltisi) içinde 10 mg tiamin çözülür.
- bir şırınga ve bir ön-sterilize edilmiş şırınga filtresinden (0.45 mikron gözenek filtresi) ile filtre solüsyonu için uygun değildir.
- Bir rezervuar kavanoza süzüntüler solüsyonu ekleyin.
- Aseptik rezervuar kavanoza sterilize silikon tüp bağlamak ve peristaltik pompalar takın.
- Yüksek stres Orta
- Bölüm 2.2 gibi orta hazırlayın, ama stresörün büyük bir konsantrasyon ile (yani, süksinat adaptasyon 3-5 g / L daha yüksek).
Not: Bu protokol bir stres inci adaptasyon içinde orta yoluyla teslim edilebilir. sıcaklık, ajitasyon ya da aydınlatma gibi fiziksel stres durumunda, kültür buna göre tasarlanmış olmalıdır.
- Bölüm 2.2 gibi orta hazırlayın, ama stresörün büyük bir konsantrasyon ile (yani, süksinat adaptasyon 3-5 g / L daha yüksek).
3. İlk Yetiştirme
- Yabani tip E. tek bir koloni İnokülasyon Başlangıç ortamı 4 ml içeren 15 ml'lik deney tüpünde coli.
- 37 ° C'de 12 saat ve 220 rpm'de sallanan bir kuluçka makinesinde test tüpünü inkübe edin.
- Aseptik olarak transferi kemostat kavanoza ön kültür 1 ml.
- 6 saat boyunca 37 ° C 'de, havalandırma (hava 50 ml / dakika) ve karıştırılarak (200 rpm) sağlayan, kemostat kavanoz inkübe edin.
4. Stres Adaptasyon
- Aseptik kemostat kavanoza pompalardan silikon hortumun ucunu.
- çıkış pompası (10 ml / saat veya daha yüksek) başlatın ve kültür toplamak.
Not: Kültür tipik olarak 4-8 saat, ilk yetiştirme sonrasında, üslü fazda olması gerekir. - Chçıkış borusundan kültürün optik yoğunluğu (600 nm) eck.
- Giriş pompası (0.1 saat -1 sulandırma bir orana karşı gelen 10 ml / sa,) başlatın.
- her 24 saatte tüp çıkışından 600 nm'de kültür optik yoğunluk kontrol edin.
- 96 saat (9.6 kat ciro) ya da daha fazla kemostat çalıştırın. optik yoğunluk stabil ise, yüksek stres ortamı içeren rezervuar alışverişi. Optik yoğunluk 0.2 düşükse, 6 saat boyunca besleme giriş pompayı durdurun. giriş pompasını yeniden başlatın ve optik yoğunluk 0.2 üzerinde olup olmadığını kontrol edin.
- Yavaş yavaş daha yüksek stres konsantrasyonunu ihtiva eden bir rezervuara değiştirerek stres konsantrasyonunu artırır.
- O bir dönüm noktası ulaştığında adapte kültür örnekleri almak (örneğin, 100 g / L süksinat strese adapte suş) ileri genomik analiz için, ve mağaza.
- Örnek depolama için, steril bir% 80 gliserol soluti kültür numunesi (0.5 mL) karışımıilgili (0.5 mi) ve -80 ° C'de saklayın.
Not: Mikroorganizma ALE sürecinde stres aşağılamak için bir yeteneği edinirse, fermantasyon kavanoz stres konsantrasyonu taze haznesinde aynı değildir.
Stres adapte Uzama 5. Tek koloni izolasyonu
- Agar plaka orta (% 1.6 ağar) aynı stres içeren ve ortamın aynı konsantrasyonda hazırlayın.
- kemostat gelen çıkış kültür (0.1 mi) plaka ve 16 saat 37 ° C'de inkübe edin.
- Steril kürdan ile plaka, tek koloniler aynı stres ihtiva eden 15 ml'lik deney tüpleri ve kemostat aynı ortam konsantrasyonunda bunları inoküle ve 6 saat inkübe edilir.
- Transfer ortamı 50 ml içeren 250 ml'lik bir Erlenmeyer şişesi içinde bulundukları kültür çorbasından 1 mi. Hasat kültür sıvısının 0.5 ml her 1 saat ve 600 nm'de OD'yi ölçün. adapte strai büyüme hızını karşılaştırmakstres verilen yabani tip suşu edilene n.
Sonuçlar
Yüksek süksinat stres adaptasyonu için, vahşi tip E. coli W3110 suşu D bir kemostat kültürlenmiştir = 0.1 saat -1 270 gün (Şekil 2).
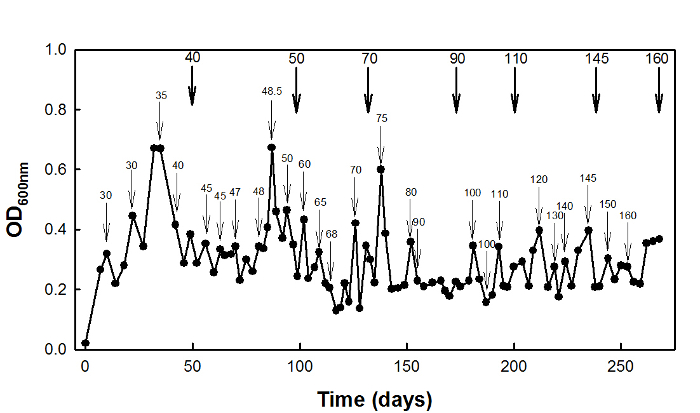
Şekil 2: E. Yüksek süksinat stres adaptasyonu E. coli kemostat kültür kullanarak W3110. İnce oklar stresörün konsantrasyonu artmış edildiği kez gösterir ve kalın o...
Tartışmalar
Mikroorganizmalar nedeniyle hızlı büyüme oranı ve genetik çeşitliliğin hemen hemen tüm ortamlarda uyum yeteneğine sahiptirler. Adaptif laboratuvar evrim verilen koşullar altında yararlıdır spontan mutasyon barındıran bireysel organizmaların seçerek bir yol sağlar tasarlanmış koşullar altında gelişmeye mikroorganizmaları sağlar.
kemostat tekniği aşağıdaki nedenlerle transfer teknikleri daha yapay tahrik evrimi elde etmek için daha sağlamdır, (a) sürekli bir o...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This study was financially supported by the Korean Ministry of Science, ICT and Future Planning (Intelligent Synthetic Biology Center program 2012M3A6A8054887). P. Kim was supported by a fellowship from the Catholic University of Korea (2015).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Mini-chemostat fermentor | Biotron Inc. | - | manufactured by special order |
| silicon tubing | Cole-Parmer | Masterflex L/S 13 | tubing size can be varied depending on the dilution rate and the size of fermentor jar. |
| reservoir jar | Bellco | Media storage bottle | 20 L |
| chemicals | Sigma-Aldrich | - | reagent grade |
| glucose | Sigma-Aldrich | G5767 | ACS reagent |
| NH4Cl | Sigma-Aldrich | A9434 | for molecular biology, suitable for cell culture, ≥99.5% |
| NaCl | Sigma-Aldrich | 746398 | ACS reagent, ≥99% |
| Na2HPO4·2H2O | Sigma-Aldrich | 4272 | 98.5-101% |
| KH2PO4 | Sigma-Aldrich | 795488 | ACS reagent, ≥99% |
| MgSO4·7H2O | Sigma-Aldrich | 230391 | ACS reagent, ≥98% |
| CaCl2 | Sigma-Aldrich | 793639 | ACS reagent, ≥96% |
| thiamine·HCl | Sigma-Aldrich | T4625 | reagent grade, ≥99% |
| Na2·succinate·6H2O | Sigma-Aldrich | S2378 | ReagentPlus, ≥99% |
Referanslar
- Rando, O. J., Verstrepen, K. J. Timescales of genetic and epigenetic inheritance. Cell. 128, 655-668 (2007).
- Kim, H. J., et al. Short-term differential adaptation to anaerobic stress via genomic mutations by Escherichia coli strains K-12 and B lacking alcohol dehydrogenase. Front Microbiol. 5, 476 (2014).
- Mendizabal, I., Keller, T. E., Zeng, J., Yi, S. V. Epigenetics and evolution. Integr Comp Biol. 54, 31-42 (2014).
- Lee, J. Y., Seo, J., Kim, E. S., Lee, H. S., Kim, P. Adaptive evolution of Corynebacterium glutamicum resistant to oxidative stress and its global gene expression profiling. Biotechnol Lett. 35, 709-717 (2013).
- Lee, J. Y., et al. Artificial oxidative stress-tolerant Corynebacterium glutamicum. AMB Express. 4, 15 (2014).
- Narang, A. The steady states of microbial growth on mixtures of substitutable substrates in a chemostat. J Theor Biol. 190, 241-261 (1998).
- Kwon, Y. D., Kim, S., Lee, S. Y., Kim, P. Long-term continuous adaptation of Escherichia coli to high succinate stress and transcriptome analysis of the tolerant strain. J Biosci Bioeng. 111, 26-30 (2011).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nat Rev Genet. 14, 827-839 (2013).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25, 2078-2079 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- Deatherage, D. E., Barrick, J. E. Identification of mutations in laboratory-evolved microbes from next-generation sequencing data using breseq. Methods Mol Biol. 1151, 165-188 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır