Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Методика адаптивной лабораторной эволюции микроорганизмов с использованием хемостатическую
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы приводим протокол для получения адаптивной лабораторной эволюции микроорганизмов в условиях с использованием хемостате культуры. Кроме того, геномный анализ выделившегося штамма обсуждается.
Аннотация
Natural evolution involves genetic diversity such as environmental change and a selection between small populations. Adaptive laboratory evolution (ALE) refers to the experimental situation in which evolution is observed using living organisms under controlled conditions and stressors; organisms are thereby artificially forced to make evolutionary changes. Microorganisms are subject to a variety of stressors in the environment and are capable of regulating certain stress-inducible proteins to increase their chances of survival. Naturally occurring spontaneous mutations bring about changes in a microorganism's genome that affect its chances of survival. Long-term exposure to chemostat culture provokes an accumulation of spontaneous mutations and renders the most adaptable strain dominant. Compared to the colony transfer and serial transfer methods, chemostat culture entails the highest number of cell divisions and, therefore, the highest number of diverse populations. Although chemostat culture for ALE requires more complicated culture devices, it is less labor intensive once the operation begins. Comparative genomic and transcriptome analyses of the adapted strain provide evolutionary clues as to how the stressors contribute to mutations that overcome the stress. The goal of the current paper is to bring about accelerated evolution of microorganisms under controlled laboratory conditions.
Введение
Микроорганизмы могут выжить и адаптироваться к различных средах. Под сильным стрессом, адаптация может происходить путем приобретения полезных фенотипов случайными геномных мутаций и последующего положительного отбора 1-3. Таким образом, микробные клетки могут адаптироваться путем изменения метаболических или регуляторных сетей для оптимального роста, которая называется "адаптивная эволюция". Последние важные микробные тенденции, такие как вспышки суперошибок и появления устойчивых штаммов микроорганизмов, которые очень тесно связаны с адаптивной эволюции в стрессовых условиях. В соответствии с определенными в лабораторных условиях, мы можем изучить механизмы молекулярной эволюции и даже контролировать направление эволюции микробов для различных областей применения. В отличие от многоклеточных организмов, одноклеточные организмы хорошо подходят для адаптивной лабораторной эволюции (ALE) по следующим причинам: они быстро регенерируют, они поддерживают большие группы населения, а также легко создавать и поддерживать Homogeneous среды. В сочетании с последними достижениями в области методов секвенирования ДНК и высокопроизводительных технологий, ALE позволяет непосредственное наблюдение за геномных изменений, которые приводят к системным регуляторных изменений. Мутационные динамика и разнообразие населения также наблюдается. Генная инженерия стратегии могут быть определены из анализа ALE штаммов 4,5.
Хемостатическую культура представляет собой метод , используемый для получения устойчивого состояния клеток и увеличение производительности в бродильных процессов 6. добавляют свежую среду и культуральный бульон собирают во время процесса (последняя включает в себя среду и биомассы). Долгосрочный хемостатическую культура, однако, изменяет стационарную продуктивности культуры и приводит к накоплению спонтанных мутаций и отбора в процессе культивирования (рис 1а). При различных давлениях отбора (стрессоров), накопление мутаций усиливается. Постепенное увеличение стресса в долгосрочной перспективе хемостатическую предусматривает непрерывный отбор мутаций , которые работают против заданных факторов стресса, таких как температура, рН, осмотическое давление, питательного голодания, окисления, токсичных конечных продуктов и т.д. передачи колонии от твердой среды и последовательной передачи из жидкой среды ( с повтором партия культуры) также позволяют исследователям получить эволюционировали микроорганизмы (рис 1б и 1в). Хотя хемостатическую культура требует сложных методов, пул разнообразия (количество репликаций и численности населения) выше, чем полученная путем переноса колоний и последовательные методы переноса. Стабильная воздействие стресса на отдельные клетки и снижение изменения в клеточном состоянии во время хемостатной культуры (устойчивое состояние) и другие преимущества эля по сравнению с методами культивирования на основе партий. Стресс-индуцированной ALE кишечной палочки , подвергнутой воздействию высоких янтарной условий вводится в этой статье.
Iles / ftp_upload / 54446 / 54446fig1.jpg "/>
Рисунок 1: Методы лабораторной эволюции адаптивной (А) хемостатическую;. (B) последовательный перевод; (C) перенос колонии. Верхние цифры иллюстрируют концепцию методов ALE, а нижние рисунки иллюстрируют количество клеток, выросших во время ALE. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
протокол
1. Подготовка оборудования
- Получить хемостате банку (150-250 мл) или колбы Эрленмейера (250 мл), содержащей входное отверстие и выходное отверстие. Соедините порты с кремнием трубки позволяет скорости потока 10-100 мл / ч. Необязательно использовать вентиляционное отверстие, выпускное отверстие воздуха и регулируемой температурой воды на входе и выходе портов.
- Получить устройство, подходящее для хемостатной банку, который обеспечивает перемешивания и температуры управления (или использовать ротационным качанием инкубатор).
- Получают два перистальтических насосов для того, чтобы доставить свежую среду и собирать культуру.
- Получить резервуар банку (10-20 л), содержащий средний выходной порт и порт для впуска воздуха.
- Получение силиконовых труб , подходящий для скорости разбавления (т.е., ID 0,8 мм, диапазон расхода 0.06-36 мл / мин; L / S 13 насосно - компрессорных труб).
2. Средняя Подготовка и Стерилизация
- Начальный средний
- Растворить 0,3 г глюкозы, 0,08 г NH 4Cl, 0,05 г NaCl, 0,75 г Na 2 HPO 4 · 2H 2 O и 0,3 г KH 2 PO 4 в 90 мл дистиллированной воды (DW) в хемостатной банке.
- Уплотнение хемостате банку вместе с трубкой при помощи зажимов. Не запечатать вентиляционное отверстие.
- Стерилизация Хемостат банку в автоклаве при температуре 121 ° С в течение 15 мин. После стерилизации хранить Хемостат банку при комнатной температуре.
- Растворить 0,02 г MgSO 4 · 7H 2 O, 0,01 г CaCl 2, и 0,1 мг тиамина в 10 мл DW (раствор А).
- Решение Фильтр A с помощью шприца и предварительно стерилизованного шприца фильтр (0,45 мкм поры фильтра а).
- Добавьте -ный раствор фильтратов в хемостатной банку.
- Стресс Средняя
- Растворить 30 г глюкозы, 8 г NH 4 Cl, 5 г NaCl, 75 г Na 2 HPO 4 · 2H 2 O, 30 г KH 2 PO 4 и 300 г динатрий сукцинат гексагидрат (Na 2 · сукцинат · 6H <к югу> 2 O; стрессор, используемый в этом эксперименте) в 9,9 л DW в резервуаре баночке.
- Уплотнение резервуара банку вместе с трубкой при помощи зажимов. Не запечатать вентиляционное отверстие.
- Стерилизацию резервуар банку в автоклаве при температуре 121 ° С в течение 15 мин. После стерилизации хранить банку при комнатной температуре.
- Растворить 2 г MgSO 4 · 7H 2 O, 1 г CaCl 2, и 10 мг тиамина в 100 мл DW (раствор А).
- Фильтр раствор А с помощью шприца и предварительно стерилизованные шприцевой фильтр (0,45 мкм пор фильтра а).
- Добавьте -ный раствор фильтратов в резервуар банку.
- Консерванта подключить стерилизованного кремния трубки к резервуару банку и прикрепите перистальтических насосов.
- Высокого напряжения среднего
- Подготовка среды, описанной в разделе 2.2, но с более высокой концентрацией стрессора (то есть, 3-5 г / л выше , в приспособлении сукцинат).
Примечание: Этот протокол предназначен для адаптации к стрессу йпри могут быть доставлены через среду. В случае физических факторов стресса, таких как температура, перемешивание, или освещения, культивирование следует проектировать соответствующим образом.
- Подготовка среды, описанной в разделе 2.2, но с более высокой концентрацией стрессора (то есть, 3-5 г / л выше , в приспособлении сукцинат).
3. Начальное Культивирование
- Инокулируйте одну колонию дикого типа E. палочки в пробирку объемом 15 мл , содержащую 4 мл исходной среды.
- Инкубируйте пробирку в качалке инкубаторе в течение 12 ч при температуре 37 ° С и 220 оборотов в минуту.
- Консерванта передача 1 мл предкультурой к хемостатной банку.
- Выдержите Хемостат банку, обеспечивая для аэрации (воздуха 50 мл / мин) и перемешивании (200 оборотов в минуту), при 37 ° С в течение 6 часов.
4. Стресс Адаптация
- Консерванта соединить конец трубки кремния от насосов до Хемостат банку.
- Запуск выходе из насоса (10 мл / ч или выше) и собирать культуру.
Примечание: Культура должна быть в экспоненциальной фазе, как правило, 4-8 ч после первоначального культивирования. - ChEck оптической плотности (600 нм) культуры из выпускного отверстия трубки.
- Запуск на входе в насос (10 мл / ч, что соответствует скорости разбавления 0,1 ч - 1).
- Проверьте оптическую плотность культуры при 600 нм из выпускного отверстия НКТ каждые 24 ч.
- Эксплуатация хемостата в течение 96 ч (оборот 9,6 раза) или более. Если оптическая плотность стабильна, обменивать резервуар, содержащий высокого напряжения среды. Если оптическая плотность ниже, чем 0,2, остановка подачи пищи на входе насоса в течение 6 ч. Перезапуск на входе в насос и проверьте, что оптическая плотность составляет более 0,2.
- Постепенно увеличивают концентрацию стрессора путем изменения в резервуар, содержащий более высокую концентрацию стрессора.
- Отбирают образцы адаптированной культуры всякий раз , когда он достигает рубежа (например, штамм , адаптированный к 100 г / л сукцината стресса), и сохранять для дальнейшего геномного анализа.
- Для хранения проб, смешайте образец культуры (0,5 мл) с стерилизованный 80% глицерина Solutiна (0,5 мл) и хранить его при температуре -80 ° С.
Примечание: Если микроорганизм приобретает способность ухудшать стрессора в процессе ALE, концентрация стрессора в ферментационной банку не то же самое, что и в свежем резервуаре.
5. Single-колония Выделение стресс-адаптированный штамм
- Приготовьте чашки с агаром среду (1,6% агар), содержащий ту же стрессора и при той же концентрации среды.
- Пластина культуры выпускное отверстие (0,1 мл) с хемостате, и инкубируют при температуре 37 ° С в течение 16 часов.
- Выбор отдельных колоний от пластины с помощью стерильной зубочисткой и прививают их в 15 мл пробирки, содержащие один и тот же стрессора и в то же средней концентрации, что и в хемостате, и инкубируют в течение 6 часов.
- Передача 1 мл культурального бульона в колбу 250 мл Эрленмейера, содержащую 50 мл среды. Урожай 0,5 мл культуральной жидкости каждые 1 ч, и измеряют оптическую плотность при 600 нм. Сравните темпы роста адаптированного ес'ип тому из штамма дикого типа данного стрессор.
Результаты
Для адаптации напряжения высокой сукцинат, дикого типа E. палочка W3110 штамм культивировали в хемостате при D = 0,1 ч -1 в течение 270 дней (Рисунок 2).
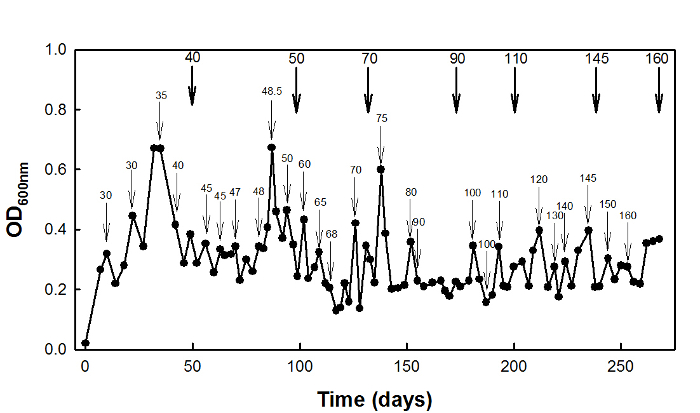
Рисунок 2: High-сукцинат адаптация напряжения ...
Обсуждение
Микроорганизмы способны адаптироваться к практически во всех средах из-за их быстрого темпа роста и генетического разнообразия. Эволюция Адаптивная лаборатория позволяет микроорганизмы развиваться при условиях, разработанных, что обеспечивает способ выбора отдельных организмов, у?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This study was financially supported by the Korean Ministry of Science, ICT and Future Planning (Intelligent Synthetic Biology Center program 2012M3A6A8054887). P. Kim was supported by a fellowship from the Catholic University of Korea (2015).
Материалы
| Name | Company | Catalog Number | Comments |
| Mini-chemostat fermentor | Biotron Inc. | - | manufactured by special order |
| silicon tubing | Cole-Parmer | Masterflex L/S 13 | tubing size can be varied depending on the dilution rate and the size of fermentor jar. |
| reservoir jar | Bellco | Media storage bottle | 20 L |
| chemicals | Sigma-Aldrich | - | reagent grade |
| glucose | Sigma-Aldrich | G5767 | ACS reagent |
| NH4Cl | Sigma-Aldrich | A9434 | for molecular biology, suitable for cell culture, ≥99.5% |
| NaCl | Sigma-Aldrich | 746398 | ACS reagent, ≥99% |
| Na2HPO4·2H2O | Sigma-Aldrich | 4272 | 98.5-101% |
| KH2PO4 | Sigma-Aldrich | 795488 | ACS reagent, ≥99% |
| MgSO4·7H2O | Sigma-Aldrich | 230391 | ACS reagent, ≥98% |
| CaCl2 | Sigma-Aldrich | 793639 | ACS reagent, ≥96% |
| thiamine·HCl | Sigma-Aldrich | T4625 | reagent grade, ≥99% |
| Na2·succinate·6H2O | Sigma-Aldrich | S2378 | ReagentPlus, ≥99% |
Ссылки
- Rando, O. J., Verstrepen, K. J. Timescales of genetic and epigenetic inheritance. Cell. 128, 655-668 (2007).
- Kim, H. J., et al. Short-term differential adaptation to anaerobic stress via genomic mutations by Escherichia coli strains K-12 and B lacking alcohol dehydrogenase. Front Microbiol. 5, 476 (2014).
- Mendizabal, I., Keller, T. E., Zeng, J., Yi, S. V. Epigenetics and evolution. Integr Comp Biol. 54, 31-42 (2014).
- Lee, J. Y., Seo, J., Kim, E. S., Lee, H. S., Kim, P. Adaptive evolution of Corynebacterium glutamicum resistant to oxidative stress and its global gene expression profiling. Biotechnol Lett. 35, 709-717 (2013).
- Lee, J. Y., et al. Artificial oxidative stress-tolerant Corynebacterium glutamicum. AMB Express. 4, 15 (2014).
- Narang, A. The steady states of microbial growth on mixtures of substitutable substrates in a chemostat. J Theor Biol. 190, 241-261 (1998).
- Kwon, Y. D., Kim, S., Lee, S. Y., Kim, P. Long-term continuous adaptation of Escherichia coli to high succinate stress and transcriptome analysis of the tolerant strain. J Biosci Bioeng. 111, 26-30 (2011).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nat Rev Genet. 14, 827-839 (2013).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25, 2078-2079 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- Deatherage, D. E., Barrick, J. E. Identification of mutations in laboratory-evolved microbes from next-generation sequencing data using breseq. Methods Mol Biol. 1151, 165-188 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены