JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Chemostat를 사용하여 미생물의 적응 연구소 발전을위한 절차
요약
여기서는 chemostat 문화 사용 조건 하에서 미생물 적응 진화 실험을 얻을 프로토콜을 제시한다. 또한, 진화 된 균주의 게놈 분석은 설명한다.
초록
Natural evolution involves genetic diversity such as environmental change and a selection between small populations. Adaptive laboratory evolution (ALE) refers to the experimental situation in which evolution is observed using living organisms under controlled conditions and stressors; organisms are thereby artificially forced to make evolutionary changes. Microorganisms are subject to a variety of stressors in the environment and are capable of regulating certain stress-inducible proteins to increase their chances of survival. Naturally occurring spontaneous mutations bring about changes in a microorganism's genome that affect its chances of survival. Long-term exposure to chemostat culture provokes an accumulation of spontaneous mutations and renders the most adaptable strain dominant. Compared to the colony transfer and serial transfer methods, chemostat culture entails the highest number of cell divisions and, therefore, the highest number of diverse populations. Although chemostat culture for ALE requires more complicated culture devices, it is less labor intensive once the operation begins. Comparative genomic and transcriptome analyses of the adapted strain provide evolutionary clues as to how the stressors contribute to mutations that overcome the stress. The goal of the current paper is to bring about accelerated evolution of microorganisms under controlled laboratory conditions.
서문
미생물이 생존하고 다양한 환경에 적응할 수 있습니다. 심한 스트레스, 적응은 임의의 게놈 변이 이후 긍정적 인 선택 1-3으로 도움이 표현형의 인수를 통해 발생할 수 있습니다. 따라서, 균체는 "적응 진화"이라한다 최적 성장을 위해 대사 또는 규제 네트워크를 변경하여 적용 할 수있다. 이러한 슈퍼 박테리아의 발생 및 강력한 미생물 균주의 발생으로 최근 중요한 미생물 경향은 매우 밀접하게 스트레스 조건에서 진화를 적응 적 관련이 있습니다. 정의 실험실 조건에서, 우리는 분자 진화의 메커니즘을 연구에도 다양한 용도 미생물 진화의 방향을 제어 할 수있다. 그들은 큰 개체군을 유지 빠르게 재생하고, 생성 및 혼을 유지하기 쉽다 : 다세포 유기체 달리 단세포 유기체 이유는 다음 실험실 적응 진화 (ALE)에 적합ogeneous 환경. DNA 시퀀싱 기술과 높은 처리량 기술의 최근 발전과 결합, ALE는 전신 규제 변화로 이어질 게놈의 변화를 직접 관찰 할 수 있습니다. 돌연변이 역학 및 인구의 다양성도 관찰 할 수 있습니다. 유전 공학 전략 ALE 균주 4,5의 분석으로부터 결정될 수있다.
Chemostat 배양 정상 세포를 얻는 발효 공정 6의 생산성을 향상하기 위해 사용하는 방법이다. 신선한 배지를 첨가하고, 배양액의 처리 (후자는 중간 및 바이오 매스를 포함한다) 중에 수확된다. 장기 배양 chemostat 그러나 배양 정상 생산성을 변경하여 배양 (도 1a) 중 자발적인 돌연변이 및 선택의 축적을 초래한다. 다양한 선택 압력 (스트레스)에서 돌연변이의 축적이 향상된다. 장기 응력 점진적 증가 chemostat는 반복 액체 매질에서 고체 배지 및 시리얼 전송 (에서 온도, pH, 삼투압, 영양 결핍, 산화, 독성 최종 제품 등 식민지 전송으로 지정된 스트레스에 반대 돌연변이의 연속 선택을 제공합니다 배치 배양)도 연구 진화 미생물 (도 1B 및 1C)을 수득 할 수있다. chemostat 배양 복잡한 방법이 필요하지만, 다이버 시티 풀 (복제 인구 크기의 수) 콜로니 전송과 시리얼 전송 기술에 의해 얻어진 것보다 높다. 각각의 세포에 안정 스트레스 노출과는 chemostat 문화 (정상 상태) 일괄 문화 기반 기술에 비해 ALE의 다른 혜택입니다 동안 세포 상태의 변화를 감소. 높은 숙시 네이트 조건에 적용 대장균의 스트레스 유발 ALE는이 문서에서 소개된다.
세틸 / ftp_upload / 54446 / 54446fig1.jpg "/>
그림 1 : 적응 형 실험실 진화의 방법 (A) Chemostat;. (B) 시리얼 전송하는 단계; (C) 식민지 전송. 상단 그림은 ALE에 대한 방법의 개념을 설명하고, 아래 그림은 ALE 동안 성장 세포의 수를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 장비 준비
- chemostat 항아리 (150-250 ml)로 또는 유입구를 함유하는 삼각 플라스크 (250 mL) 및 출구 포트를 얻었다. 실리콘 튜브는 10 ~ 100 ㎖ / hr의 유량을 허용하여 포트를 연결합니다. 선택적으로 통기, 공기 출구, 및 온도 조절 물 입구 및 출구 포트를 사용한다.
- 교반 및 온도 제어를 제공하는 chemostat 항아리에 적합한 장치를 취득 (또는 회전 진탕 배양기를 사용).
- 문화를 새로운 배지를 전달하고 수집하기 위해 두 개의 연동 펌프를 얻습니다.
- 매체 출구 포트 및 공기 입구 포트를 포함하는 저장 용기 (10 ~ 20 L)을 얻었다.
- (; L / S (13) 튜브 즉, ID 0.8 mm, 유량 범위 0.06-36 ml / 분) 희석 비율에 적합한 실리콘 튜브를 얻습니다.
2. 중간 준비 및 살균
- 초기 중간
- 0.3 g 포도당, 0.08 g NH 4를 녹여CL, 0.05 g의 NaCl, 0.75 g 나 2 HPO 4 · 2H 2 O, 0.3 g의 KH 2 PO 4 90 ml의 증류수 chemostat 항아리 (DW).
- 클램프를 사용하여 튜브와 함께 chemostat 항아리를 밀봉합니다. 통풍구를 밀봉하지 마십시오.
- 15 분 동안 121 ℃에서 오토 클레이브에서 chemostat 항아리 소독. 살균 한 후, 실온에서 chemostat 항아리를 저장합니다.
- 녹인 0.02 g 황산 · 7H 2 O, 0.01 g의 CaCl2를, 10 ml의 DW (용액 A) 0.1 mg의 티아민.
- 주사기 및 미리 멸균 주사기 필터 (0.45 ㎛의 세공 필터)를 사용하여 용액 A 필터.
- A는 chemostat 항아리에 여과하는 솔루션을 추가합니다.
- 스트레스 중간
- 30g 글루코스 8g NH 4 CL, 5g의 NaCl, 75g이 나 HPO 4 · 용해 2H 2 O, 30g의 KH 2 PO 4, 300g 나트륨 숙시 네이트 수화물 (NA 2 · 숙신산 · 6H <서브> 2 O; 저수지 항아리에 9.9 L DW에서이 실험에 사용 된 스트레스).
- 클램프를 사용하여 튜브와 함께 저장 항아리를 밀봉합니다. 통풍구를 밀봉하지 마십시오.
- 15 분 동안 121 ℃에서 오토 클레이브 저류 용기 살균. 멸균 후, 실온에서 보관 용기.
- 2g 황산 4 · 7H 2 O, 1g의 염화칼슘 2, 100 ㎖ DW (용액 A) 10 mg을 티아민을 녹인다.
- 주사기 및 미리 멸균 주사기 필터 (0.45 ㎛의 세공 필터)와 필터 A 액.
- A는 저장 항아리에 여과하는 솔루션을 추가합니다.
- 무균는 저장 항아리에 살균 실리콘 튜브를 연결하고 연동 펌프를 연결합니다.
- 스트레스가 높은 중간
- 2.2 절에서와 같이 매체를 준비하지만, 스트레스의 큰 농도 (즉, 숙시 네이트 적응에 3~5g / L 이상).
참고 :이 프로토콜은 스트레스 일에 적응입니다AT는 매체를 통해 전달 될 수있다. 온도, 교반이나 조명과 같은 물리적 스트레스의 경우, 배양이 적절하게 설계되어야한다.
- 2.2 절에서와 같이 매체를 준비하지만, 스트레스의 큰 농도 (즉, 숙시 네이트 적응에 3~5g / L 이상).
3. 초기 재배
- 야생형 E.의 단일 식민지의 예방 초기 배지 4 mL를 함유하는 15 ㎖의 시험관에 대장균.
- 37 ° C에서 12 시간, 220 rpm으로의 진탕 배양기에서 테스트 튜브를 품어.
- 무균 전송 chemostat 항아리에 예비 배양 1 ㎖.
- 6 시간 동안 37 ° C에서, 폭기 (공기 50 ml / 분)와 교반 (200 rpm으로)에 대해 제공하는 chemostat 항아리를 품어.
4. 스트레스 적응
- 무균는 chemostat 항아리에 펌프 실리콘 튜브의 끝을 연결합니다.
- 배출 펌프 (10 ㎖ / 시간 이상)을 시작하고 문화를 수집합니다.
참고 : 문화는 일반적으로 4-8 시간 초기 배양 한 후, 지수 상에 있어야합니다. - 장출구 관에서 문화의 광학 밀도 (600 nm의) 에크.
- 입구 펌프 (0.1 시간-1의 희석 비율에 해당하는 10 ㎖ / 시간 등)를 시작합니다.
- 매 24 시간을 튜브 콘센트에서 600 nm에서 문화의 광학 밀도를 확인합니다.
- 96 시간 (9.6 배 매출) 이상에 대한 chemostat을 운영하고 있습니다. 광학 농도가 안정되면, 높은 스트레스 매체를 함유하는 저장 용기를 교환한다. 광학 밀도가 0.2보다 낮 으면, 6 시간에 대한 공급 흡입 펌프를 멈춘다. 입구 펌프를 다시 시작하고 광학 밀도가 0.2 이상인지 확인합니다.
- 점차 높은 스트레스 농도를 함유하는 저장조로 변경하여 스트레스의 농도를 증가시킨다.
- 이 이정표에 도달 할 때마다 적응 문화의 샘플을 채취 (예를 들어, 100g / L 숙시 네이트 스트레스에 적응 주) 더 게놈 분석 및 저장.
- 샘플 수납하는 멸균 80 % 글리세롤 soluti 함께 배양 시료 (0.5 ml)에 혼합상 (0.5 ml)에 용해시키고 -80 ℃에서 보관.
주 : 상기 미생물은 ALE 과정에서 스트레스를 저하시키는 능력을 취득하는 경우, 발효 용기에서 스트레스 농도는 신선한 저장조와 동일하지 않다.
스트레스 적응 변형 5. 단일 콜로니 분리
- 한천 평판 배지 (1.6 % 한천) 같은 스트레스를 함유 매체의 동일한 농도를 준비합니다.
- chemostat에서 출구 배양 (0.1 ㎖) 플레이트, 16 시간 동안 37 ℃에서 배양한다.
- 멸균 된 이쑤시개를 이용하여 플레이트로부터 단일 콜로니를 선택하고, 동일한 스트레스를 함유하는 15 ㎖의 시험관에 상기 chemostat와 동일한 중간 농도 그들을 접종하고, 6 시간 동안 배양한다.
- 전사 배지 50 ㎖를 포함하는 250 ㎖의 삼각 플라스크에 배양액 1 ㎖. 수확 배양액 0.5ml를 각 1 시간, 600 nm에서의 OD를 측정한다. 적응 strai의 성장 속도를 비교하여스트레스 요인 특정 야생형 균주의 것과 N.
결과
높은 숙시 응력 적응 야생형 E. 대장균 W3110 균주는 D에서 chemostat에서 배양 = 0.1 시간 -1 270일에 대한 (그림 2).
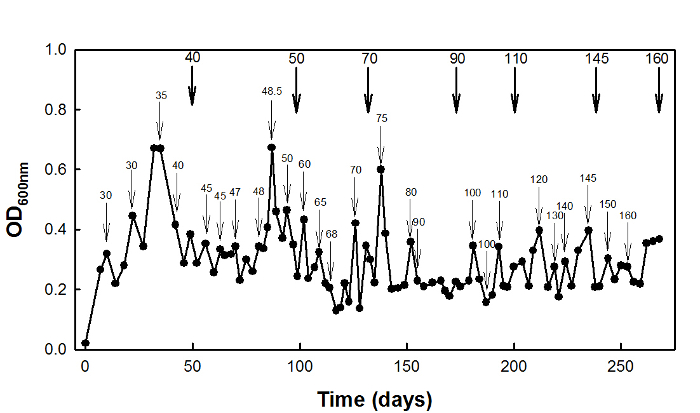
그림 2 : E.의 높은 숙시 네이트 스트레스 적응 대장균을 이용하여 배양 chemostat W3110. 얇은 화살표는 스트레스의 농도가 증가하는 시간...
토론
미생물 때문에 빠른 성장 속도와 유전 적 다양성의 거의 모든 환경에 적응시킬 수있다. 적응 진화 실험은 주어진 조건 하에서 유용 자연 돌연변이를 보유하는 개개의 유기체를 선택하는 방법을 제공하는 설계 조건 하에서 미생물 발전을 가능하게한다.
chemostat 기술은 다음과 같은 이유로 이전 기법보다 인위적 구동 발전을 달성하기위한 더 강력 : (a) 정상 환경 - 전송 기술들?...
공개
The authors have nothing to disclose.
감사의 말
This study was financially supported by the Korean Ministry of Science, ICT and Future Planning (Intelligent Synthetic Biology Center program 2012M3A6A8054887). P. Kim was supported by a fellowship from the Catholic University of Korea (2015).
자료
| Name | Company | Catalog Number | Comments |
| Mini-chemostat fermentor | Biotron Inc. | - | manufactured by special order |
| silicon tubing | Cole-Parmer | Masterflex L/S 13 | tubing size can be varied depending on the dilution rate and the size of fermentor jar. |
| reservoir jar | Bellco | Media storage bottle | 20 L |
| chemicals | Sigma-Aldrich | - | reagent grade |
| glucose | Sigma-Aldrich | G5767 | ACS reagent |
| NH4Cl | Sigma-Aldrich | A9434 | for molecular biology, suitable for cell culture, ≥99.5% |
| NaCl | Sigma-Aldrich | 746398 | ACS reagent, ≥99% |
| Na2HPO4·2H2O | Sigma-Aldrich | 4272 | 98.5-101% |
| KH2PO4 | Sigma-Aldrich | 795488 | ACS reagent, ≥99% |
| MgSO4·7H2O | Sigma-Aldrich | 230391 | ACS reagent, ≥98% |
| CaCl2 | Sigma-Aldrich | 793639 | ACS reagent, ≥96% |
| thiamine·HCl | Sigma-Aldrich | T4625 | reagent grade, ≥99% |
| Na2·succinate·6H2O | Sigma-Aldrich | S2378 | ReagentPlus, ≥99% |
참고문헌
- Rando, O. J., Verstrepen, K. J. Timescales of genetic and epigenetic inheritance. Cell. 128, 655-668 (2007).
- Kim, H. J., et al. Short-term differential adaptation to anaerobic stress via genomic mutations by Escherichia coli strains K-12 and B lacking alcohol dehydrogenase. Front Microbiol. 5, 476 (2014).
- Mendizabal, I., Keller, T. E., Zeng, J., Yi, S. V. Epigenetics and evolution. Integr Comp Biol. 54, 31-42 (2014).
- Lee, J. Y., Seo, J., Kim, E. S., Lee, H. S., Kim, P. Adaptive evolution of Corynebacterium glutamicum resistant to oxidative stress and its global gene expression profiling. Biotechnol Lett. 35, 709-717 (2013).
- Lee, J. Y., et al. Artificial oxidative stress-tolerant Corynebacterium glutamicum. AMB Express. 4, 15 (2014).
- Narang, A. The steady states of microbial growth on mixtures of substitutable substrates in a chemostat. J Theor Biol. 190, 241-261 (1998).
- Kwon, Y. D., Kim, S., Lee, S. Y., Kim, P. Long-term continuous adaptation of Escherichia coli to high succinate stress and transcriptome analysis of the tolerant strain. J Biosci Bioeng. 111, 26-30 (2011).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nat Rev Genet. 14, 827-839 (2013).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25, 2078-2079 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- Deatherage, D. E., Barrick, J. E. Identification of mutations in laboratory-evolved microbes from next-generation sequencing data using breseq. Methods Mol Biol. 1151, 165-188 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유