Method Article
Combiné la microscopie intravitale et échographie de contraste accentué des membres postérieurs souris pour étudier la vasodilatation induite par l’insuline et la Perfusion du Muscle
Dans cet article
Résumé
Vasodilatation induite par l’insuline régule la perfusion musculaire et augmente la microvasculaire surface habitable (recrutement microvasculaire) disponible pour échange soluté entre interstitium de sang et de tissus. La microscopie intravitale combinée et échographie de contraste accentué est présenté Evaluer simultanément l’action de l’insuline à des gros vaisseaux et la microcirculation in vivo.
Résumé
Il a été démontré que les actions vasculaires de l’insuline contribuent à régulation de sensibilité à l’insuline. Effets de l’insuline sur la perfusion du muscle réglementent postprandiale livraison des hormones et des nutriments aux tissus sensibles à l’insuline. Nous décrivons ici une technique permettant de combiner la microscopie intravitale (IVM) et l’échographie de contraste accentué (UFC) du compartiment de l’adducteur de la souris du membre postérieur de visualiser simultanément les artères de résistance musculaire et de la perfusion de la microcirculation in vivo. En même temps évaluer les effets de l’insuline à de multiples niveaux de l’arbre vasculaire est important pour étudier les relations entre les multiples effets vasoactifs de l’insuline et la perfusion du muscle. Expériences dans cette étude ont été effectuées chez la souris. Tout d’abord, la canule de veine de queue est insérée pour l’infusion d’anesthésie, composés vasoactifs et agent de contraste ultrasonore (microbulles encapsulé lipidique). Deuxièmement, une petite incision est pratiquée dans la région de l’aine pour exposer l’arbre artériel du compartiment muscle adducteur. La sonde est ensuite positionnée sur le postérieur supérieur controlatéral pour visualiser les muscles en coupe transversale. Pour évaluer les paramètres de ligne de base, le diamètre artériel est évalué et microbulles sont infusés par la suite à un rythme constant pour estimer le débit sanguin musculaire et volume sanguin microvasculaire (MBV). Lorsqu’il est appliqué avant et Pendant un clamp euglycémique hyperinsulinique, combiné IVM et UFC permettre l’évaluation de changements induite par l’insuline du diamètre artériel, perfusion musculaire microvasculaire et sensibilité à l’insuline de l’organisme entier. En outre, la relation temporelle entre les réponses de la microcirculation et les artères de résistance à l’insuline peut être quantifiée. Il est également possible de suivi la souris longitudinalement dans le temps, ce qui en fait un outil précieux pour étudier les changements dans la sensibilité à l’insuline vasculaire et confiné.
Introduction
En réponse à une augmentation de la glycémie, le pancréas sécrète de l’insuline dans le sang où il est rapidement distribué à ses tissus cibles tels que les muscles squelettiques, via les artères de résistance et les capillaires. Le muscle squelettique est responsable d’environ 80 % de l’absorption de glucose postprandial1. L’injection d’insuline à l’interstitium de muscle squelettique s’est avérée être un taux limitant l’étape pour les actions métaboliques d’insuline qui favorisent l’élimination de glucose pour2,3,4. Moins de 10-15 min, l’insuline augmente le volume de sang capillaire (microvasculaire recrutement), un effet qui se produit avant que le débit sanguin total augmente de5,6. Microvasculaire recrutement élargit la surface endothéliale disponible pour échange de nutriments (et insuline)7,8. Induite par l’insuline microvasculaire recrutement précède et est indépendamment associée à des changements dans le muscle squelettique glucose uptake8,9. L’effet de l’insuline sur le système vasculaire a été appelé « sensibilité à l’insuline vasculaire ».
Il a été démontré que le recrutement microvasculaire induite par l’insuline et la vasodilatation induite par l’insuline sont altérées chez les obèses Zucker rats10,11. En outre, des souris maigres avec diminution de la densité capillaire affichent muscle insulino résistance12. Dans leur ouvrage influent, Kubota et coll. ont montré que l’insuline avec facultés affaiblies, la signalisation dans les cellules endothéliales entraîné une baisse recrutement microvasculaire induite par l’insuline, ce qui réduit l’absorption du glucose dans le muscle squelettique par environ 40 %13. Ces anomalies microvasculaires fonction ne seulement produisent pas dans le muscle, mais aussi dans plusieurs autres tissus et les organes comme le cœur, rétine et rein14,15,16. Ces exemples et autres études17,18,19,20 suggèrent que les effets vasculaires de l’insuline constituent un mécanisme important dans la physiologie (patho) de résistance à l’insuline et ses complications.
Bien qu’il y a des preuves substantielles que l’insuline augmente le volume sanguin microvasculaire (MBV) dans le muscle squelettique5,6, les mécanismes par lesquels ce qui se passe ne sont pas totalement comprise9. Vasodilatation endothélium-dépendante est essentielle dans de nombreux aspects de l’insuline vasculaire sensibilité21,22,23 à différents niveaux du système vasculaire. Sensibilité à l’insuline vasculaire peut se manifester par une relaxation induite par l’insuline des artères de résistance et de relaxation des artérioles pré capillaires pour augmenter l’échange microvasculaire perfusé superficie7,24, 25.
La microscopie intravitale (IVM) a été utilisée dans une variété de préparations de tissus, y compris les chambres du pli cutané de la face dorsale de souris26, mésentère de la souris et le rat27, modèles d’ischémie des membres dans la souris28 ainsi que la pochette de joues de hamster 29. échographie de contraste accentué (UFC) est une autre technique d’imagerie qui permet l’évaluation de la microcirculation dans cardiaque30 ainsi que le muscle squelettique,31. Il utilise les microbulles remplis de gaz inerte qui se comportent rhéologiquement comme les globules rouges et de rester entièrement dans la lumière vasculaire. Ces microbulles sont perfusion intraveineuse à débit constant pour atteindre un état stable. Une vague d’échographie de haute énergie, alors, peut être utilisée pour détruire les microbulles. Vitesse de réapprovisionnement des microbulles dans la région d’intérêt (ROI) représente la vitesse d’écoulement (MFV). L’intensité du signal total de l’image contraste représente le MBV. CEUS peuvent être effectuées à plusieurs reprises (aussi chez les humains) et il a fait progresser la compréhension de la dysfonction vasculaire qui se rencontre aux insulino-résistant (discuté dans Barrett et al. ( 32).
Dans la présente étude, les auteurs décrivent une nouvelle technique pour étudier le règlement de la perfusion du muscle, grâce à l’utilisation simultanée de IVM et UFC. Ici, nous nous concentrons sur les actions vasculaires de l’insuline dans le compartiment des adducteurs de la souris du membre postérieur. Ce compartiment est l’un des plus grands groupes de muscle squelettique chez la souris, ce qui permet des études d’absorption du glucose local dans un muscle représentatif. Ce compartiment est idéal pour IVM car la préparation et la visualisation des artères sont facilement accessibles par une intervention chirurgicale standardisée28. En outre, notre propre groupe et autres ont montré que l’UFC peut être utilisé dans ce compartiment33,34.
Un avantage de la technique combinée de IVM et UFC est la possibilité d’évaluer l’effet de l’insuline au niveau des plus grande et artérioles (aliments pour animaux ou la résistance des artères) et la microcirculation (lits capillaires) dans le même groupe musculaire. En outre, l’application simultanée des deux méthodes donne un aperçu de l’action temporelle de l’insuline au niveau des artères de résistance et microcirculation. Ceci combiné IVM et CEUS technique peut également être mis en œuvre dans d’autres domaines de la biologie vasculaire. Par exemple, le rôle de diverses protéines et certaines conditions physiopathologiques affectant l’endothélium peut être étudié à l’aide de modèles knock-out. En outre, les deux techniques peuvent servir dans une souris à plusieurs moments réduisant le temps et le coût de la recherche.
Protocole
Toutes les expériences animales ont été approuvés par le Comité d’éthique et de soin des animaux locaux. L’ensemble du protocole d’induction de l’anesthésie chez la souris jusqu'à la fin de la clamp euglycémique hyperinsulinique dure environ 2 heures.
1. préparation microchirurgicale
- Induire l’anesthésie et l’analgésie chez une souris mâle pesant 20-25 g après un 14 h ou une nuit de jeûne avec une injection intrapéritonéale de Fentanyl (0,31 mg/kg), Midazolam (6,25 mg/kg) et Acepromazine (6,25 mg/kg) (anesthésie FMA) et placez-le sur un coussin de chauffage homéothermes rectale-température contrôlée qui maintient la température corporelle à 37 ° C.
- Désinfecter la table d’opération et de l’équipement plusieurs fois en utilisant une solution à base d’alcool.
- Poser une aiguille de 27 G dans un tube de polyéthylène longue de 10 cm (PE-20) et fixer le tube à un connecteur à 4 voies. Insérer l’aiguille dans la veine caudale et fixer à l’aide de gel adhésif tissu. Cette canule sera utilisé pour la perfusion des microbulles, insuline, glucose et anesthésie.
Remarque : L’ajout d’héparine (5 U/mL) dans du sérum physiologique stérile pendant la canulation processus afin d’éliminer la veine caudale (environ 10 µL) réduit la possibilité des canules bouchés. - Dans toutes les interventions chirurgicales et des protocoles expérimentaux, maintenir l’anesthésie par une perfusion intraveineuse continue d’anesthésie FMA via la canule de veine de queue au taux de 33,75 µL/kg/min.
- Placer la souris avec la face ventrale vers le haut et fixer les pieds à l’aide d’un ruban thermostable pour exposer la zone supérieure de la cuisse. Utilisez une exorotation léger de l’articulation de la hanche (pattes postérieur vers le haut) et un angle de 40-60° à l’articulation du genou pour standardiser l’étirement du muscle dans le compartiment des adducteurs de la cuisse.
- Enlever les poils à l’aine et les zones de haut de la cuisse sur le plan bilatéral à l’aide d’une crème dépilatoire. Recueillir tous les cheveux coupés avec un coton-tige humide.
- Placez votre souris sous un stéréomicroscope et effectuez les opérations chirurgicales suivantes à l’aide de 10 X à 16 X.
- Faire une incision de 2 cm à l’aide de ciseaux de peau parallèle au ligament inguinal, juste latéral à la courbure abdominale (Figure 1). S’applique à traction sur la partie distale de l’incision distale à l’aide d’une pince bulldog (Figure 1). Cela aidera à ajuster la fenêtre selon les besoins et de maintenir l’huile de paraffine (décrit en 1.12).
- Disséquer le tissu adipeux de la paroi abdominale. Pour éviter tout saignement, séparer les doucement les coussinets adipeux du mur au lieu de dissection directement par le biais de la touche. Une traction douce à la grosse garniture en direction distale facilitera le processus (Figure 1).
- Identifier l’artère fémorale et suivez-la jusqu'à les premières branches principales (l’artère épigastrique et l’artère gracilis) (Figure 2). L’artère gracilis est le premier volet majeur de l’artère fémorale en cours d’exécution sur le magnus adducteur et exécute ensuite profondément au muscle gracilis. L’artère gracilis sera utilisé pour IVM.
- Identifier le fascia profond transparent couvrant les muscles et les vaisseaux. Avec une pincette pointus, tirez vers le haut, le fascia et coupez-le à l’aide d’un microscissor.
- Couvrir le muscle exposé avec une goutte d’eau (200 µL) de paraffine liquide médicinale (la température ambiante, ou préalablement chauffé à 37 ° C) pour empêcher les tissus préparés ne se dessèchent pas. Assurez-vous que la goutte de pétrole ne fuit pas loin. Ajuster les plis de la peau de l’incision à l’aide de la pince bulldog pour créer une petite cavité pour contenir de l’huile de paraffine qui baigne les vaisseaux.
- Placez votre souris au microscope (grossissement optique de 16 X) préalablement calibré de telle manière que l’artère gracilis est verticale sur l’écran de l’ordinateur. Fixez le microscope à une caméra et un ordinateur basé système d’analyse qui peut extraire le diamètre des navires de l’ensemble de données d’images. Le diamètre est la distance entre les deux parties luminales du navire. Surveillance continue et mesure du diamètre de l’artère est souhaitable.
- Placer la source lumineuse à une distance suffisante (minimum de 20 cm) des membres postérieurs pour réduire la tête conduction de la lumière.
- Appliquer le gel de transduction échographie préchauffée au supérieur postérieur controlatéral. Placez la sonde perpendiculaire à l’axe longitudinal de l’os du fémur.
- Ajustez soigneusement l’angle et la direction de la sonde d’échographie pour obtenir une vue transversale du groupe de muscle adducteur. Prenez soin de garder la position de la sonde par rapport à la souris stable pour garder le même plan d’imagerie pour les mesures de base et hyperinsulinémique.
- Laissez la souris stabiliser pendant 30 min. Le diamètre de l’artère gracilis doit être stable pendant 10 min avant de documenter le diamètre de la base.
2. données initiales et mesures hyperinsulinique
- S’assurer que le diamètre de l’artère base gracilis est enregistré par le programme informatique utilisé pour IVM.
- Préparer les microbulles d’avance comme décrit35 et comte avec Coulter compteur à une concentration de 2,5 x 109 bulles/mL juste avant l’expérience.
-
Comme les microbulles peuvent être affichées uniquement en mode de contraste de l’échographe, contrôler les paramètres qui affectent l’image et contraste données collectées (décrit en 2.3.1) et utiliser systématiquement lors de l’acquisition.
- Utilisez les paramètres suivants sur la machine d’échographie : gain de contraste à 35 décibels ; le temps gain compensation OFF ; Densité de lignes à haute ; Nombre de Zones focales à l’échelle ; Transmettre la puissance aux 4 % ; Transmettre la largeur du faisceau standard ; Porte de SV à 4 ; Sensibilité à 1 ; Persistance sur OFF. Niveau de l’emplacement des Zones de convergence vers le centre de la région d’intérêt.
- Enregistrez un court (5 s) clip. Cela servira à calculer le signal de fond.
- Agiter le flacon contenant les microbulles à la main pour avoir une suspension uniforme. Commencer à insuffler les microbulles à l’aide de la canule de veine de queue à un taux de 5 µL/min. Placer le tube de perfusion sur un vortex vibratoire (200 x / min) afin de maintenir une suspension uniforme de microbulles.
- Laisser 5 min de perfusion continue de microbulles afin qu’un niveau d’équilibre est atteint. Aller de l’avant d’avoir obtenu les courbes temps-intensité des bulles à l’aide de la fonction de destruction de microbulles (MBD) sur la machine d’échographie à 5 min et 10 min après le début de la perfusion de microbulles (Figure 3 a). Prendre le signal moyen de ces deux mesures pour obtenir les données de perfusion de base.
-
Après avoir obtenu les données de référence, démarrez le clamp euglycémique hyperinsulinique décrit34. La canule de queue (placée au point 1.3) permet d’administrer de l’insuline et de glucose (et anesthésie).
- En bref, induire un état de hyperinsulinémique en introduisant un bolus d’insuline 200 mU/kg suivi d’une perfusion continue d’insuline (7,5 mU/kg/min) pour 60 min. utiliser une perfusion variable de 20 % D-glucose à maintenir l’euglycémie.
- Évaluer la glycémie de la veine caudale toutes les 5 min avec un dispositif de contrôle de la glycémie et maintenir à 5 mM en ajustant la vitesse de perfusion de glucose variable. Déterminer la sensibilité d’insuline en faisant la moyenne de la vitesse de perfusion de glucose moyenne au cours des 30 dernières minutes.
- S’assurer que le diamètre de l’artère gracilis est documenté dans les délais souhaités (par exemple à 10, 30 et 60 min) du début de la clamp euglycémique hyperinsulinique avec le programme informatique.
- Après 25 min ou 55 min de l’étau de l’insuline, commencez la seconde mesure (hyperinsulinémique) UFC pour documenter le MBV à 30 ou 60 min, respectivement. Suivez les mêmes étapes décrites en 2.4 et 2.5. Détacher et utiliser le port d’anesthésie du connecteur 4 broches pour infuser les microbulles. Fixez à nouveau le tube de l’anesthésie après la fin de la perfusion de microbulles.
- À l’issue de l’IVM et les mesures de CEUS 60 min après le début de la perfusion d’insuline, prélever du sang de la souris par une procédure de ponction cardiaque pour une analyse ultérieure. Cela sera aussi euthanasier la souris. Soigneusement disséquer le gracilis et les artères fémorales et de les stocker pour des expériences plus désirées (pour par exemple, transfert Western, immunohistochimie, ex vivo pression myographie expériences36,37, 38).
3. hors ligne analyse
Remarque : Les analyses de l’IVM et UFC mesures devraient être effectuées hors connexion par un détective aveugle. CEUS offre la possibilité de distinguer la microcirculation de grands navires en détruisant temporairement les microbulles par ondes ultrasonores de haute intensité à l’aide de la fonction MBD. Le signal (mesuré en unités arbitraires (Abdel)) dans les plus gros navires rétabli plus vite que celles de la microcirculation en raison de la vitesse de microbulles dans les vaisseaux correspondants.
- Utiliser un poste de travail en mode hors connexion ou le logiciel sur la machine d’échographie à faire les analyses.
- Dessiner une région d’intérêt (ROI) d’inscrire la microcirculation. Dessiner un ROI distinct afin d’inclure des gros vaisseaux fémoraux (Figure 3 a).
- Dupliquer du microcirculation et des navires plus grands ROIs pour les mesures de fond, base et hyperinsulinémique en utilisant la fonction de copie ROI construite dans le logiciel.
- Soustraire le signal de l’intensité de la mesure de l’arrière-plan de la ligne de base et les mesures de hyperinsulinémique.
- Diviser le signal de l’intensité de la microcirculation par le signal de l’intensité des vaisseaux fémoraux. MBVs base et hyperinsulinémique peuvent maintenant être comparées.
Résultats
Débit de perfusion de glucose pendant le clamp euglycémique hyperinsulinique (sensibilité à l’insuline) a été 180.21 ± 19.81 µmol/kg/min. application locale d’huile de paraffine sur le compartiment de muscle adducteur pour stabiliser le navire n’a pas changé le diamètre moyen de base des artères (73.6 µm ± 29,0 vs 68.8 ± 17,9 µm ; p = 0,58) mais a contribué à réduire la variation des animaux testés (Figure 4 a). L’insuline augmente régulièrement le diamètre de l’artère gracilis (de 14,58 ± 6,2 % après 60 min ; N = 9) qui était significativement différente (p < 0,0001) de la variation de diamètre causés par perfusion de solution saline (-6,3 ± 4,9 % ; N = 6). La vasodilatation induite par l’insuline a été appréciable après 10 min (10,09 ± 5,1 % ; p = 0,002) et atteint environ 95 % de sa capacité maximale de dilatoire après 30 min.
L’insuline à l’aide d’UFC, constamment augmenté muscle MBV (Figure 5 a) de 33,5 % (± 31.04 %, N = 7 ; p = 0,0009) par rapport à la perfusion de solution saline (-10.63 ± 27,87 %, N = 6) (Figure 5 b). Les données présentées sont les intensités du signal du muscle MBV divisé par que dans les vaisseaux fémoraux. Cela réduit la variation expérimentale entre les différentes mesures et entre différentes souris (données non présentées). L’intensité du signal dans les vaisseaux fémoraux correspond de façon linéaire avec la concentration de microbulles dans la circulation (Figure 3). Correction de signal des vaisseaux fémoraux théoriquement corrige les différences de concentrations de microbulles utilisée (Figure 3D). Données sont présentées dans cette section en moyenne ± écart-type.

Figure 1 : Exposition chirurgicale du compartiment adducteurs des membres postérieurs. (A) une incision est faite à l’aine, parallèle à la direction de l’arcade crurale. (B) une traction douce à la grosse garniture dans les directions distales (flèches noires) présentera le tissu conjonctif (*) entre la garniture et la paroi abdominale. (C), la peau des plis de l’incision peuvent être ajustées à l’aide de la pince bulldog pour créer une petite cavité pour contenir de l’huile de paraffine qui baigne les vaisseaux. (D), l’échographie sonde est positionné sur le postérieur supérieur controlatéral après que l’artère préparés gracilis est visionnée à l’aide d’un microscope calibré. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
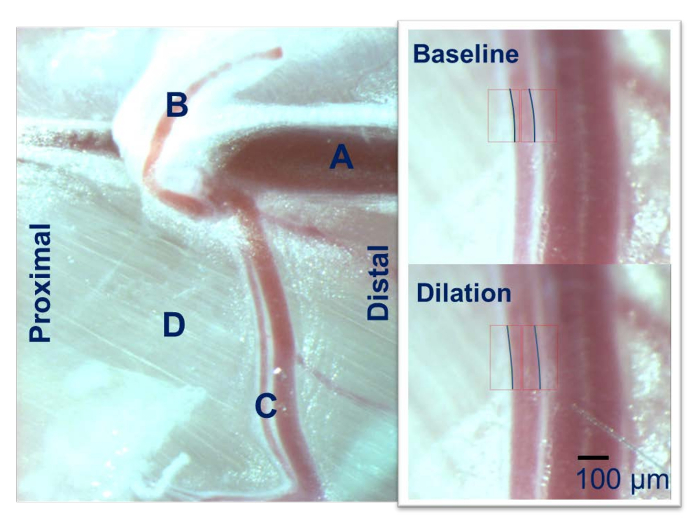
Figure 2 : Des membres postérieurs souris la microscopie intravitale. L’artère fémorale (A) donne naissance à l’artère épigastrique (B) et l’artère de gracilis (C) qui s’exécute sur le groupe de muscles adducteurs (D). L’artère gracilis est utilisé pour l’IVM à l’aide d’un microscope calibré. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
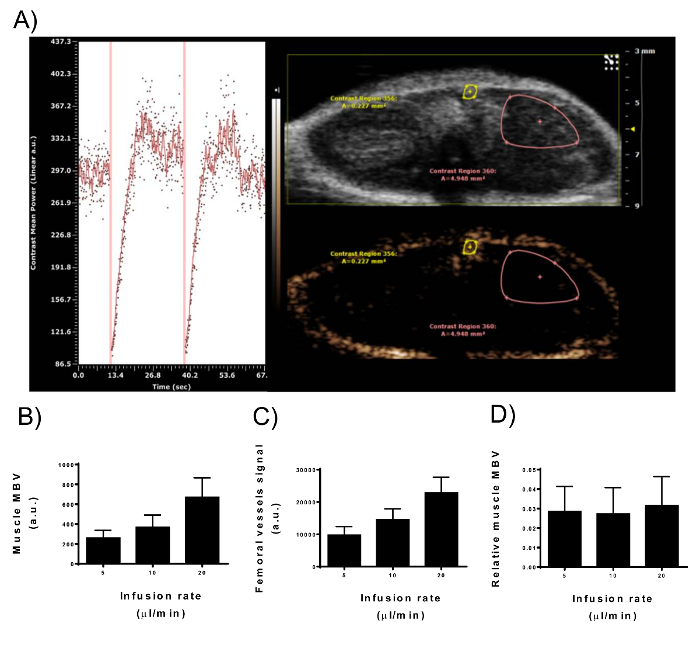
Figure 3 : Signal d’intensité de l’échographie de contraste accentué dans le Muscle du Volume sanguin microvasculaire et vaisseaux fémoraux. (A) vue du contraste non linéaire d’imagerie mode de la plate-forme d’imagerie numérique durant la perfusion constante de microbulles dans un membre supérieur chez les souris mâles. Panneau de droite : deux ROIs sont dessinés pour représenter le muscle MBV et les vaisseaux fémoraux. Seule la partie superficielle du compartiment muscle adducteur est incluse dans le retour sur investissement que le signal intensité diminue avec la profondeur. Panneau de gauche : courbe de temps-intensité du muscle MBV ROI. Lignes verticales représentent la destruction de la microbulles (MBD) avec des vagues de haute énergie. Immédiatement après le MBD, sans agent de contraste est présent dans le plan d’imagerie qui commence à se remplir avec les microbulles progressivement. Après 10-15 s, le pic de l’amélioration du contraste a été trouvé. (B-D) Après un signal stationnaire est atteint, la vitesse de perfusion de 2,5 x 109 bulles/mL a été doublée (5, 10, 20 µL/min). Intensité du signal de MBV (B) des muscles et vaisseaux fémoraux (C) en parallèle du doublement de la concentration de microbulles dans la circulation. (D) correction musculaire MBV pour le signal de vaisseaux fémoraux supprime la variabilité dans l’intensité du signal causée par des microbulles de différentes concentrations (N = 9 ;-barres d’erreur représentent déviation standard). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
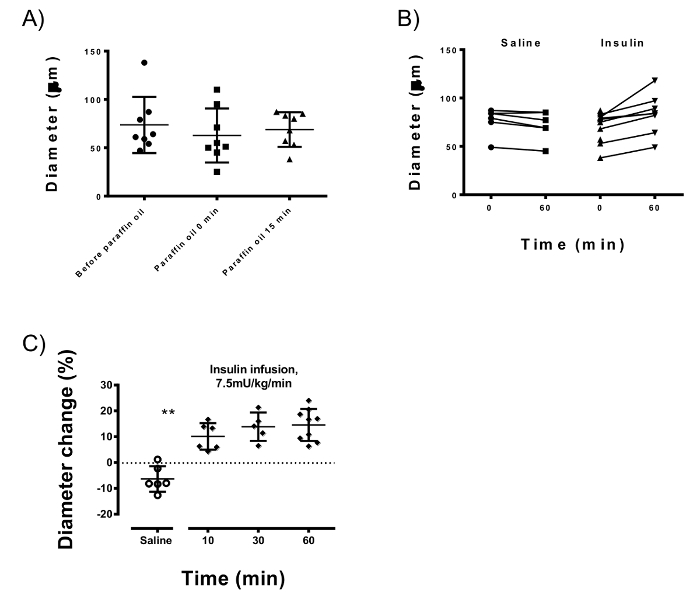
Figure 4 : Mesures de microscopie intravitale de l’artère Gracilis. (A) huile de paraffine réduit la variation des artères gracilis de différents animaux (c'est-à-dire après avoir appliqué l’huile 29,0 µm sans paraffine vs 17,9 µm) tout en gardant le diamètre moyen de référence stable (73.6 µm contre 68,8 µm ; p = 0,58). (B) diamètre artériel au début et après 60 min de perfusion d’insuline ou de sérum physiologique. L’insuline après 60 min de perfusion dilatées constamment l’artère gracilis (p < 0,0001) par rapport à la perfusion de solution saline. (C) la vasodilatation induite par l’insuline se produit à 10 min après le début de la perfusion (p = 0,002) et atteint 95 % de la valeur maximale à 30 min. barres d’erreur représentent l’écart-type ; test T de Student non apparié est utilisé pour les statistiques. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
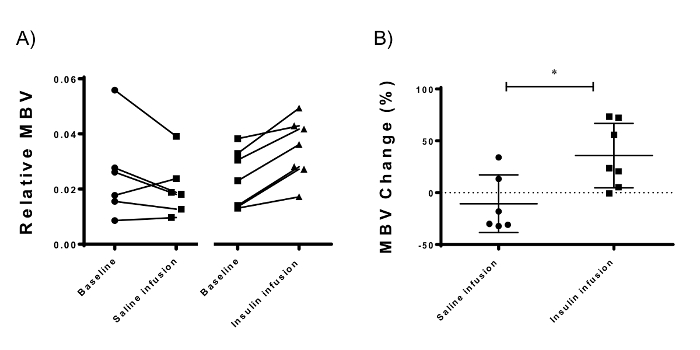
Figure 5 : Mesures de Volume sanguin microvasculaire utilisant l’échographie de contraste accentué du compartiment Muscle adducteur de la souris du membre postérieur. (A) l’insuline a entraîné une augmentation constante MBV 30 min après le début de la perfusion d’insuline. (B) la différence entre les hyperinsulinémiques et les mesures de base (changement MBV) est désigné comme le recrutement microvasculaire induite par l’insuline. Insuline induit une 33,5 % (± 31.04 %, p = 0,016 ; N = 7) recrutement microvasculaire par rapport à la perfusion de solution saline (-10.63 ± 27,87 %, N = 6). Barres d’erreur représentent déviation standard ; test T de Student non apparié est utilisé pour les statistiques. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Nous avons développé une technique pour estimer simultanément des actions vasculaires de l’insuline sur les artères plus grandes (à l’aide de IVM) et la microcirculation du muscle squelettique (à l’aide d’UFC). Les étapes essentielles pour les mesures performantes et fiables sont : 1) exposer correctement l’artère gracilis sans saignement ; 2) empêchant la fuite de l’huile de paraffine se baignant l’artère ; 3) ayant un accès veineux brevet (canule de veine de queue) pour la perfusion de composés vasoactifs (insuline) et agent de contraste (microbulles).
L’étude de la dysfonction microvasculaire dans le muscle a gagné l’attention dans le contexte de l’obésité et l’insuline résistance14,25,39,40. L’impact négatif de l’obésité et la résistance à l’insuline sur la fonction vasculaire se manifeste à différents niveaux de l’arbre vasculaire. Désormais, différentes approches sont nécessaires pour évaluer ces changements. L’utilisation combinée de l’IVM et UFC techniques chez la souris même fournit un outil puissant pour quantifier les effets de l’insuline à différents niveaux du système vasculaire. IVM permet une visualisation directe et l’analyse quantitative de l’artère de résistance et CEUS permet pour l’évaluation des changements perfusion musculaire induite par l’insuline.
Étudier le compartiment de muscle adducteur présente plusieurs avantages. Les artères sont facilement accessibles et le caractère superficiel de l’incision permet de refermer l’incision de la peau avec un 5,0 résorbable stérile une fois l’expérience terminée. Les animaux ont été injectées par voie sous-cutanée avec la buprénorphine, après les expériences comme analgésique à une dose de 0,1 mg/kg et a permis de récupérer dans un environnement chaleureux. Les souris toléré la procédure très bien et nous avons vécu sans perte d’animaux ni d’infections des membres postérieurs chez les plus de 35 animaux étudiés. Cela rend possible pour le suivi ou étudier les animaux de manière longitudinale. Les animaux utilisés dans ces expériences, cependant, ont été anesthésiés à l’aide de 1,8 % par inhalation isoflurane équilibré avec l’oxygène coulant à 0,4 L/min dans un masque d’anesthésie. Contrairement à l’isoflurane anesthésie41,42, anesthésie FMA ne perturbe pas la sensibilité à l’insuline périphérique. Un plan d’avenir est d’étudier comment bien les souris récupérer de l’anesthésie de la FMA.
Le compartiment de muscle adducteur est également utile depuis divers composés vasoactifs médiation locale et effets vasculaires en aval peuvent être évaluées. Par exemple, l’application topique de ces composés dans le tissu cible est réalisable à l’aide de techniques superfusion28 ou manipulation chirurgicale et implantation des poignets à élution de médicament qui entoure les vaisseaux43. En outre, l’artère gracilis peut être isolé et étudié dans la myographe pression. Notre groupe et autres sont sont réunis des preuves substantielles expérimentale utilisant le myographe pression à documenter les effets de l’insuline et d’autres composés vasoactifs sur cette artère ex vivo36,37,38.
Une limitation inhérente à l’utilisation de la technique IVM est l’exposition chirurgicale du muscle et l’application de l’huile de paraffine pour stabiliser les vaisseaux. On ne sait ne pas si ces actions influent sur l’environnement natif de l’artère. Cependant, la Figure 3 a montre que le diamètre de la base de l’artère gracilis baignée dans l’huile de paraffine ne change pas considérablement. Il a été également démontré que l’huile minérale inhibe avec succès la diffusion de l’oxygène, protéger les tissus contre hyperoxique conditions44. En outre, l’huile contribue à réduire la variation du diamètre de la base des artères. C’est pourquoi nous préconisons d’utiliser de l’huile de paraffine et laissez reposer la préparation pendant au moins 30 min. À noter, l’utilisation d’une solution saline tamponnée au lieu d’huile – ou pas entraîné du tout – diamètres très variables et constriction du navire (données non présentées). En outre, à la fin des expériences, nous isolé les artères gracilis - baignées dans l’huile de paraffine - et testé leur réactivité dans le myographe pression ex vivo. Les artères baignée dans l’huile de paraffine ont réagi de la même façon pour contrôler les artères lorsque stimulée par l’insuline et l’acétylcholine (un vasodilatateur) (données non présentées). La vasodilatation induite par l’insuline cohérente montre clairement que le protocole IVM décrit dans la présente étude produit des résultats fiables.
L’avantage de l’application de ces deux techniques chez la souris même surmonte certaines des limitations intrinsèques d’une technique par l’autre : CEUS estime MBV dans le muscle intacts in vivo, mais les navires individuels ne peuvent être vus ; IVM permet de voir les navires individuels, bien qu’il ne peut pas estimer MBV. Un futur plan consiste à utiliser la microscopie IVM du muscle crémaster en combinaison avec CEUS du muscle adducteur du côté controlatéral. Cette modification peut fournir une estimation de la MBV (à l’aide d’UFC) et un accès direct et optique pour les capillaires (à l’aide de vecteurs). Le protocole peut être modifié ; le connecteur 4 broches utilisé pour la canule de la queue peut être commuté sur un connecteur 5 broches. Par la présente, nous pouvons éviter de détacher le tube de l’anesthésie lors de l’exécution de la deuxième mesure CEUS (décrite au point 2.9). Dans notre expérience, les souris toléré le protocole actuel. Une autre modification qui peut être faite au présent protocole est le taux d’insuline pince utilisé. Nous avons utilisé 7,5 taux mU/kg/min pince qui est considérée comme supra-physiologique. Selon l’étude, un taux inférieur de pince l’insuline (par exemple 3 mU/kg/min) peut être utilisé.
Alors que nous avons trouvé le protocole décrit fiables, il y a des limitations spécifiques qui ont besoin d’attention. Il existe des situations où la mesure du diamètre artériel n’est pas optimale. Exécuter les étapes de préparation nécessite une expérience avec le modèle. Il est crucial que l’huile de paraffine ne fuit pas dans l’environnement de navire en complétant avec de l’huile nouvelle va déranger le navire et changer le diamètre, rendant nécessaire de laisser le reste de l’artère pendant 30 min. En outre, la réflexion de la lumière (décrite à l’étape 1.14 du protocole) sur la surface de l’huile de paraffine était parfois trop lumineuse, rendant difficile visualiser l’artère. Cela peut être contrecarrée en ordonnant à la source de lumière afin que la lumière tombe sous un angle à l’huile de paraffine, surface et parallèle à l’artère.
En conclusion, la combinaison de l’IVM et UFC techniques décrites dans cette étude permet de quantifier les différents effets de l’insuline à différents niveaux du système vasculaire. IVM de l’artère gracilis donne un aperçu des changements vasculaires en amont contribuant à perfusion microvasculaire en aval, mesurée à l’aide d’UFC. Nous plaidons pour la combinaison de plusieurs techniques expérimentales chez la souris même afin de mieux évaluer la fonction vasculaire.
Déclarations de divulgation
Visual Sonics Inc. a couvert les frais d’accès libre, tandis que la structure et le contenu de l’article demeurent l’entière responsabilité des auteurs.
Remerciements
Nous remercions Ing. Duncan van Groen pour la programmation de logiciel d’analyse de l’image (ImageGrabber) utilisé dans cette étude. Le financement de cette recherche a bénéficié d’une subvention VIDI de l’Organisation néerlandaise pour la recherche scientifique (fief 016.136.372).
matériels
| Name | Company | Catalog Number | Comments |
| C57BL/6 Mice | Charles river | Mice used were bred in-house | |
| Vevo 2100 high-resolution ultrasound system | VisualSonics inc. | ||
| MS250 non-linear transducer | VisualSonics inc. | ||
| Vevo 2100 software | VisualSonics inc. | ||
| Ultrasound gel (Aquasonic 100, colourless) | CSP Medical | 133-1009 | Ultrasound gel used to transmit the ultrasound waves |
| Vortex | VWR international | 58815-234 | |
| Heating pad | Pantlab | ||
| Freestyle Precision Xceed | Abbott | To measure blood glucose level during the hyperinsulinemic-euglycemic clamp | |
| Insulin Novorapid | Novo Nordisk | ||
| Glucose monohydrate | Merck Millipore | 1083421000 | |
| Buffered saline solution | B. Braun | 152118062 | |
| PE-20 medical tubing | Becton, Dickinson and Company | 427405 | |
| Needle, 27 Gauge | Becton-Dickinson & Co | 305109 | |
| Medical tape | 3M | ||
| Ultrasound probe holder | Built In-house | ||
| Cotton swabs | Multiple Equivalent | ||
| Creme depilator | Multiple Equivalent | ||
| Gel tissue adhesive | Derma+flex | GA30005-2222 | |
| Infusion pump | Harvard Apparatus | Harvard Apparatus PHD 2000 | |
| Small fine straight scissors | Fine Science Tools (FST) | 14090-09 | |
| Needle holder | Fine Science Tools (FST) | 12500-12 | |
| Straight forceps with fine tip | Fine Science Tools (FST) | 11251-20 | |
| Stereomicroscope | Olympus | SZX12 | |
| Camera | Basler | scA1390-17gc | |
| Image Grabber program | Built in-house | Image acquisition system | |
| Timer | VWR | 33501-418 | |
| Syringes, 1 mL | Fisher | 14-817-25 | |
| Light source, fiber-optic | Schott | KL1500 | Ideally has adjustable arms |
| Paraffin oil | Multiple Equivalent | ||
| Name | Company | Catalog Number | Comments |
| Microbubbles | |||
| 1,2-Distearoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850365C | |
| polyoxyethylene stearate | Sigma | p3440 | |
| perfluorobutane gas | F2 Chemicals | C4F10(g) | |
| Decon FS200 ultrasonic bath | Decon Ultrasonics Ltd | ||
| Vialmix | Lantheus Medical Imaging | 515370-0810 | |
| Multisizer Coulter Counter | Beckman Coulter Inc |
Références
- DeFronzo, R. A., Tobin, J. D., Rowe, J. W., Andres, R. Glucose intolerance in uremia. Quantification of pancreatic beta cell sensitivity to glucose and tissue sensitivity to insulin. The J Clin Invest. 62, 425-435 (1978).
- Chiu, J. D., et al. Direct administration of insulin into skeletal muscle reveals that the transport of insulin across the capillary endothelium limits the time course of insulin to activate glucose disposal. Diabetes. 57, 828-835 (2008).
- Herkner, H., et al. Transcapillary insulin transfer in human skeletal muscle. Eur J Clin Invest. 33, 141-146 (2003).
- Yang, Y. J., Hope, I. D., Ader, M., Bergman, R. N. Insulin transport across capillaries is rate limiting for insulin action in dogs. J Clin Invest. 84, 1620-1628 (1989).
- Clerk, L. H., et al. The vasodilatory actions of insulin on resistance and terminal arterioles and their impact on muscle glucose uptake. Diabetes Metab Res Rev. 20, 3-12 (2004).
- Vincent, M. A., et al. Microvascular recruitment is an early insulin effect that regulates skeletal muscle glucose uptake in vivo. Diabetes. 53, 1418-1423 (2004).
- Barrett, E. J., et al. The vascular actions of insulin control its delivery to muscle and regulate the rate-limiting step in skeletal muscle insulin action. Diabetologia. 52, 752-764 (2009).
- Vincent, M. A., Clerk, L. H., Rattigan, S., Clark, M. G., Barrett, E. J. Active role for the vasculature in the delivery of insulin to skeletal muscle. Clin Exp Pharmacol Physiol. 32, 302-307 (2005).
- Clark, M. G., Rattigan, S., Barrett, E. J., Vincent, M. A. Point: There is capillary recruitment in active skeletal muscle during exercise. J Appl Physiol (1985). 104, 889-891 (2008).
- Wallis, M. G., et al. Insulin-mediated hemodynamic changes are impaired in muscle of Zucker obese rats. Diabetes. 51, 3492-3498 (2002).
- Eringa, E. C., Stehouwer, C. D., Roos, M. H., Westerhof, N., Sipkema, P. Selective resistance to vasoactive effects of insulin in muscle resistance arteries of obese Zucker (fa/fa) rats. Am J Physiol Endocrinol Metab. 293, 1134-1139 (2007).
- Bonner, J. S., et al. Muscle-specific vascular endothelial growth factor deletion induces muscle capillary rarefaction creating muscle insulin resistance. Diabetes. 62, 572-580 (2013).
- Kubota, T., et al. Impaired insulin signaling in endothelial cells reduces insulin-induced glucose uptake by skeletal muscle. Cell Metab. 13, 294-307 (2011).
- Levy, B. I., et al. Impaired tissue perfusion: a pathology common to hypertension, obesity, and diabetes mellitus. Circulation. 118, 968-976 (2008).
- Schelbert, H. R. Coronary circulatory function abnormalities in insulin resistance: insights from positron emission tomography. J Am Coll Cardiol. 53, 3-8 (2009).
- Wong, T. Y., et al. Associations between the metabolic syndrome and retinal microvascular signs: the Atherosclerosis Risk In Communities study. Invest Ophthalmol Vis Sci. 45, 2949-2954 (2004).
- Bonadonna, R. C., et al. Role of tissue-specific blood flow and tissue recruitment in insulin-mediated glucose uptake of human skeletal muscle. Circulation. 98, 234-241 (1998).
- Ellmerer, M., et al. Reduced access to insulin-sensitive tissues in dogs with obesity secondary to increased fat intake. Diabetes. 55, 1769-1775 (2006).
- Ellmerer, M., et al. Physiological hyperinsulinemia in dogs augments access of macromolecules to insulin-sensitive tissues. Diabetes. 53, 2741-2747 (2004).
- Vincent, M. A., et al. Mixed meal and light exercise each recruit muscle capillaries in healthy humans. Am J Physiol Endocrinol Metab. 290, 1191-1197 (2006).
- de Jongh, R. T., Serne, E. H., RG, I. J., de Vries, G., Stehouwer, C. D. Impaired microvascular function in obesity: implications for obesity-associated microangiopathy, hypertension, and insulin resistance. Circulation. 190, 2529-2535 (2004).
- Ketel, I. J., et al. Obese but not normal-weight women with polycystic ovary syndrome are characterized by metabolic and microvascular insulin resistance. J Clin Endocrinol Metab. 93, 3365-3372 (2008).
- Khan, F., et al. Impaired microvascular function in normal children: effects of adiposity and poor glucose handling. J Physiol. 551, 705-711 (2003).
- Clark, M. G. Impaired microvascular perfusion: a consequence of vascular dysfunction and a potential cause of insulin resistance in muscle. Am J Physiol Endocrinol Metab. 295, 732-750 (2008).
- Serne, E. H., et al. Impaired skin capillary recruitment in essential hypertension is caused by both functional and structural capillary rarefaction. Hypertension. 38, 238-242 (2001).
- Sriramarao, P., Anderson, W., Wolitzky, B. A., Broide, D. H. Mouse bone marrow-derived mast cells roll on P-selectin under conditions of flow in vivo. Lab Invest. 74, 634-643 (1996).
- Leister, I., et al. A peritoneal cavity chamber for intravital microscopy of the liver under conditions of pneumoperitoneum. Surg Endosc. 17, 939-942 (2003).
- Cardinal, T. R., et al. Chronic hindlimb ischemia impairs functional vasodilation and vascular reactivity in mouse feed arteries. Front Physiol. 2, 91 (2011).
- Duling, B. R. The preparation and use of the hamster cheek pouch for studies of the microcirculation. Microvasc Res. 5, 423-429 (1973).
- Wei, K., et al. Quantification of myocardial blood flow with ultrasound-induced destruction of microbubbles administered as a constant venous infusion. Circulation. 97, 473-483 (1998).
- Clerk, L. H., Rattigan, S., Clark, M. G. Lipid infusion impairs physiologic insulin-mediated capillary recruitment and muscle glucose uptake in vivo. Diabetes. 51, 1138-1145 (2002).
- Barrett, E. J., Keske, M. A., Rattigan, S., Eringa, E. C. CrossTalk proposal: De novo capillary recruitment in healthy muscle is necessary. J Physiol. 592, 5129-5131 (2014).
- Aman, J., et al. Effective treatment of edema and endothelial barrier dysfunction with imatinib. Circulation. 126, 2728-2738 (2012).
- Boer, M. P., et al. Globular adiponectin controls insulin-mediated vasoreactivity in muscle through AMPKalpha2. Vascul Pharmacol. 78, 24-35 (2016).
- van den Brom, C. E., et al. Myocardial Perfusion and Function Are Distinctly Altered by Sevoflurane Anesthesia in Diet-Induced Prediabetic Rats. J Diabetes Res. 2016, 5205631 (2016).
- Meijer, R. I., et al. Perivascular adipose tissue control of insulin-induced vasoreactivity in muscle is impaired in db/db mice. Diabetes. 62, 590-598 (2013).
- Meijer, R. I., et al. Insulin-induced changes in skeletal muscle microvascular perfusion are dependent upon perivascular adipose tissue in women. Diabetologia. 58, 1907-1915 (2015).
- Sun, D., Kaley, G., Koller, A. Characteristics and origin of myogenic response in isolated gracilis muscle arterioles. Am J Physiol. 266, 1177-1183 (1994).
- Jonk, A. M., et al. Microvascular dysfunction in obesity: a potential mechanism in the pathogenesis of obesity-associated insulin resistance and hypertension. Physiology (Bethesda). 22, 252-260 (2007).
- Wiernsperger, N., Nivoit, P., De Aguiar, L. G., Bouskela, E. Microcirculation and the metabolic syndrome. Microcirculation. 14, 403-438 (2007).
- Horber, F. F., et al. Isoflurane and whole body leucine, glucose, and fatty acid metabolism in dogs. Anesthesiology. 73, 82-92 (1990).
- Sui, H., et al. Quantifying insulin sensitivity and entero-insular responsiveness to hyper- and hypoglycemia in ferrets. PLoS One. 9, 90519 (2014).
- Pires, N. M., et al. Local perivascular delivery of anti-restenotic agents from a drug-eluting poly(epsilon-caprolactone) stent cuff. Biomaterials. 26, 5386-5394 (2005).
- Young, D. A., Chi, M. M., Lowry, O. H. Energy metabolism of skeletal muscle biopsies stimulated anaerobically without load in vitro. Am J Physiol. 250, 813-820 (1986).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon