Method Article
Combinado de microscopia Intravital e ultra-sonografia contraste aprimorado do membro posterior Mouse para estudar a vasodilatação induzida por insulina e perfusão muscular
Neste Artigo
Resumo
Vasodilatação induzida por insulina regula a perfusão muscular e aumenta o microvascular superfície (recrutamento microvascular) disponível para troca de soluto entre sangue e tecido do interstício. Combinado de microscopia intravital e ultra-sonografia contraste aprimorado é apresentado para avaliar simultaneamente a ação da insulina em vasos maiores e a microcirculação in vivo.
Resumo
Foi demonstrado que ações vasculares da insulina contribuem para a regulação da sensibilidade à insulina. Efeitos da insulina na perfusão muscular regulam pós-prandial entrega de nutrientes e hormônios para os tecidos sensíveis à insulina. Aqui descrevemos uma técnica de combinação de microscopia intravital (IVM) e ultra-sonografia (CEUS) do compartimento adutor do membro posterior do mouse simultaneamente Visualizar artérias de resistência muscular e perfusão de contraste aprimorado a microcirculação in vivo. Ao mesmo tempo avaliar o efeito da insulina em vários níveis da árvore vascular é importante estudar as relações entre vários efeitos vasoativas da insulina e da perfusão muscular. Foram realizados experimentos neste estudo em ratos. Primeiro, a cânula de veia da cauda é inserida para a infusão de anestesia, compostos vasoativas e agente de contraste de ultra-som (lipid-encapsulado microbolhas). Em segundo lugar, uma pequena incisão é feita na região da virilha para expor a árvore arterial do compartimento de músculo adutor. A sonda de ultra-som é então posicionada no membro superior contralateral, posterior para visualizar os músculos em secção transversal. Para avaliar os parâmetros de linha de base, considera-se o diâmetro arterial e microbolhas são posteriormente infundidas em uma taxa constante para estimar o fluxo sanguíneo muscular e volume sanguíneo microvascular (MBV). Quando aplicados antes e durante uma pinça hiperinsulinêmica-euglicêmico, combinada IVM e CEUS permitem apreciar induzida por insulina alterações do diâmetro arterial, perfusão microvascular muscular e sensibilidade à insulina do corpo inteiro. Além disso, a relação temporal entre as respostas da microcirculação e as artérias de resistência à insulina pode ser quantificada. Também é possível para acompanhar o tempo longitudinalmente em ratos, tornando-se uma ferramenta valiosa para estudar alterações na sensibilidade à insulina vascular e todo o organismo.
Introdução
Em resposta a um aumento no nível de glicose no sangue, o pâncreas segrega insulina para a corrente sanguínea onde é rapidamente distribuído para seus tecidos-alvo como o músculo esquelético, através de resistência das artérias e capilares. Músculo esquelético é responsável por ~ 80% de absorção de glicose pós-prandial1. A entrega de insulina para o interstício do músculo esquelético tem demonstrada ser uma passo para as ações metabólicas da insulina que promovem a eliminação de glicose a2,3,4de limitação de taxa. Dentro de 10-15 min, a insulina aumenta o volume de sangue capilar (recrutamento microvascular), um efeito que ocorre antes que o fluxo total de sangue aumenta5,6. Recrutamento microvascular expande a área de superfície endotelial disponível para troca de nutrientes (e insulina)7,8. Recrutamento microvascular mediada por insulina precede e está independentemente associado com alterações no músculo esquelético absorção de glicose8,9. O efeito da insulina na vasculatura foi denominado 'a sensibilidade à insulina vascular'.
Tem sido demonstrado que mediada por insulina recrutamento microvascular e vasodilatação induzida por insulina são prejudicadas em obeso Zucker ratos10,11. Além disso, magros ratos com reduzida densidade capilar exibem muscular insulina resistência12. Em seu trabalho influente, Kubota et al mostrou que a insulina deficiente sinalização em células endoteliais provocou redução no recrutamento microvascular induzida pela insulina, que reduziu a absorção de glicose no músculo esquelético por aproximadamente 40%13. Essas anormalidades na função microvascular não só ocorrem no músculo, mas também em vários outros tecidos e órgãos como o coração, retina e rins14,15,16. Esses exemplos e outros estudos17,18,19,20 sugerem que efeitos vasculares de insulina são um importante mecanismo na fisiologia (patho) de resistência à insulina e sua complicações.
Enquanto não há evidências substanciais de que a insulina aumenta volemia microvascular (MBV) em músculo esquelético5,6, os mecanismos pelos quais isso acontece não são completamente compreendidos,9. A vasodilatação endotélio-dependente é essencial em muitos aspectos da sensibilidade vascular insulina21,22,23 níveis diferentes da vasculatura. A sensibilidade à insulina vascular pode manifestar-se pelo relaxamento induzido por insulina das artérias de resistência e pelo relaxamento das arteríolas pré-capilares para aumentar o intercâmbio microvascular perfundidos superfície7,24, 25.
A microscopia intravital (IVM) tem sido utilizada em uma variedade de preparações de tecido, incluindo câmaras de dobras cutâneas do rato dorso26, mesentério do camundongo e rato de27modelos de isquemia do membro no rato28 e o malote de bochecha de hamster 29. contraste aprimorado ultra-sonografia (CEUS) é outra técnica de imagem que permite a avaliação da microcirculação em cardíaca30 , bem como o músculo esquelético31. Ele utiliza microbolhas cheio de gás inerte, que se comportam reologicamente como glóbulos vermelhos e permanecem inteiramente dentro do lúmen vascular. Estas microbolhas são infundidas por via intravenosa a uma taxa constante para atingir um estado estável. Uma onda de ultra-som de alta energia, em seguida, pode ser usada para destruir as microbolhas. Velocidade de reposição das microbolhas na região de interesse (ROI) representa a velocidade de fluxo (MFV). A intensidade de sinal total da imagem contraste representa o MBV. CEUS podem ser executadas repetidamente (também em seres humanos) e avançou a compreensão da disfunção vascular que ocorre em Estados de resistência à insulina (discutidos em Barrett et al 32).
No estudo atual, descrevemos uma técnica nova para estudar o Regulamento de perfusão muscular, através do uso simultâneo do IVM e CEUS. Aqui focamos em ações de vascular do insulin no compartimento adutor do membro posterior do mouse. Este compartimento é um dos maiores grupos musculares no mouse, permitindo estudos de absorção de glicose local em um músculo representativa. Este compartimento é ideal para IVM como preparação e visualização das artérias estão prontamente acessíveis por um procedimento cirúrgico padronizado28. Além disso, nosso grupo e outros têm mostrado que os CEUS pode ser usada neste compartimento33,34.
Uma vantagem para a técnica combinada de IVM e CEUS é a possibilidade de avaliar o efeito da insulina a nível dos maiores arteríolas (artérias feed ou resistência) e a microcirculação (leitos capilares) no mesmo grupo muscular. Além disso, a aplicação simultânea dos dois métodos fornece insights sobre a ação temporal da insulina a nível das artérias de resistência e microcirculação. Isto combinado IVM e técnica CEUS também pode ser implementada em outros campos da biologia vascular. Por exemplo, o papel de várias proteínas e certas condições fisiopatológicas que afectam o endotélio pode ser estudado usando modelos de nocaute. Além disso, ambas as técnicas podem ser usadas em um mouse em vários pontos de tempo, reduzindo o tempo e o custo da investigação.
Protocolo
Todos os experimentos com animais foram aprovados pelo Comitê de ética e cuidados de animais locais. O protocolo inteiro da indução da anestesia no mouse até o fim da mordaça hiperinsulinêmica-euglicêmico leva aproximadamente 2 h.
1. preparação microcirúrgica
- Induzir anestesia junto com analgesia em um rato macho pesando 20-25 g após um 14 h ou durante a noite de jejum com uma injeção intraperitoneal de fentanil (0,31 mg/kg), Midazolam (6,25 mg/kg) e acepromazina (6,25 mg/kg) (anestesia FMA) e coloque-o sobre uma almofada de aquecimento homeotérmicos retal-temperatura controlada que mantém a temperatura do corpo em 37 ° C.
- Desinfecte o equipamento várias vezes usando uma solução baseada em álcool e a mesa de operação.
- Anexar uma agulha 27G para um tubo de polietileno longa de 10 cm (PE-20) e anexar o tubo a um conector de 4 vias. Introduza a agulha na veia de cauda e fixá-lo usando gel adesivo de tecido. Esta cânula será usada para a infusão de microbolhas, insulina, glicose e anestesia.
Nota: Adição de heparina (5 U/mL) em soro fisiológico estéril durante a canulação processo para lavar a veia da cauda (cerca de 10 µ l) reduz a possibilidade de cânulas entupidas. - Durante os procedimentos cirúrgicos e protocolos experimentais, manter a anestesia por infusão intravenosa contínua de anestesia FMA através da cânula de veia de cauda a taxa de 33.75 µ l/kg/min.
- Coloque o mouse com o ventral lado e corrigir os pés, usando uma fita thermostable para expor a área da parte superior da coxa. Use um ligeiro exorotation da articulação do quadril (membro posterior de patas para cima) e um ângulo de 40-60° na articulação do joelho para padronizar o estiramento do músculo no compartimento de adutores da coxa.
- Remova o cabelo na virilha e áreas de parte superior da coxa, bilateralmente, usando um creme depilatório. Recolha todo o cabelo solto com um cotonete úmido.
- Coloque o mouse sob um estereomicroscópio e execute o seguinte procedimento cirúrgico usando 10 X para ampliação de X 16.
- Faça uma incisão de 2 cm com uma tesoura de pele paralela ao ligamento inguinal, apenas lateral para a curvatura abdominal (Figura 1). Aplica tração no lado distal da incisão distalmente, usando uma pinça buldogue (Figura 1). Isso ajudará a ajustar a janela, conforme necessário e ajudar a manter o óleo de parafina (descrito em 1,12).
- Disse o tecido adiposo longe da parede abdominal. Para evitar sangramento, separe delicadamente a almofada de gordura da parede em vez de diretamente através do pad de dissecação. Tração suave ao bloco gordo na direção distal facilitará o processo (Figura 1).
- Identificar a artéria femoral e segui-lo até os primeiros maiores ramos (a artéria epigástrica e o gracilis) (Figura 2). A artéria gracilis é o primeiro ramo importante da artéria femoral, executando no músculo adutor Magno e executa profundo para o músculo grácil. A artéria gracilis será usada para IVM.
- Identifica a fáscia profunda transparente cobrindo os músculos e os vasos. Usando Pinças afiadas, puxe para cima a fáscia e cortá-la usando um microscissor.
- Cobrir o músculo exposto com uma gota (200 µ l) de parafina líquida medicinal (temperatura de quarto, ou pré aquecido a 37 ° C) para evitar que o tecido preparado de secar. Certifique-se que a gota de óleo não vaza daqui. Ajuste as dobras de pele da incisão utilizando a pinça bulldog para criar uma pequena cavidade para armazenar o óleo de parafina que banha os vasos.
- Coloque o mouse sob um microscópio previamente calibrado (zoom óptico X 16) de forma a que a artéria gracilis é vertical na tela do computador. Anexar o microscópio para uma câmera e um computador com base em sistema de análise que pode extrair o diâmetro dos vasos do conjunto de dados de imagem. O diâmetro é a distância entre os dois lados luminal do vaso. Contínuo monitoramento e medição do diâmetro da artéria é desejável.
- Coloque a fonte de luz a uma distância suficiente (mínimo 20 cm) do membro posterior para reduzir a cabeça da condução da luz.
- Aplica o gel de transdução escaldadas ultra-som para o superior membro posterior contralateral. Coloque a sonda de ultra-som perpendicular ao eixo longo do osso fêmur.
- Com cuidado ajuste o ângulo e a direção da sonda de ultra-som para obter uma visão transversal do grupo de músculos adutores. Tome cuidado para manter a posição da sonda de ultra-som em relação ao mouse estável para manter o mesmo plano de imagem para medições de base e hiperinsulinêmica.
- Deixe o mouse estabilizar por 30 min. O diâmetro da artéria gracilis deve ser estável por 10 min antes de documentar o diâmetro da linha de base.
2. linha de base e medições hiperinsulinêmica
- Certifique-se que o diâmetro de artéria de base gracilis é salvo pelo programa de computador usado para o IVM.
- Prepare as microbolhas antecipadamente como descrito35 e contagem com Coulter contador a uma concentração de 2,5 x 109 bolhas/mL antes do experimento.
-
Como as microbolhas só podem ser exibidas no modo de contraste da máquina do ultra-som, controlar os parâmetros que afetam a imagem e o contraste os dados coletados (descrito em 2.3.1) e uso consistentemente durante a aquisição.
- Use as seguintes configurações na máquina do ultra-som: ganho de contraste em 35 decibéis; o tempo ganho de compensação para OFF; Densidade de linha para alta; Número de zonas focais de largo; Transmita o poder para 4%; Transmitir a largura de feixe de padrão; Portão SV para 4; Sensibilidade a 1; Persistência para fora. Nível da localização das zonas focais para o centro da região de interesse.
- Salvar um curto (5 s) clipe. Isto será usado para calcular o sinal de fundo.
- Agite o frasco contendo as microbolhas à mão para ter uma suspensão uniforme. Começa a infusão de microbolhas usando a cânula da veia de cauda em uma taxa de 5 µ l/min. Coloque o tubo de infusão em um vórtice de vibração (200 x / min) para manter uma suspensão uniforme de microbolhas.
- Permita a 5 min de infusão contínua de microbolhas para que um nível de estado estacionário é atingido. Prosseguir com a obtenção das curvas de tempo-intensidade das bolhas usando a função de destruição de microbolhas (MBD) na máquina de ultra-som em 5 min e em 10 min após o início da infusão de microbolhas (Figura 3A). Leve o sinal médio dessas duas medições para obter os dados de perfusão de linha de base.
-
Depois de obter os dados de linha de base, inicie a braçadeira hiperinsulinêmica-euglicêmico como descrito34. Use a cânula de cauda (colocada em 1.3) para administrar a insulina e glicose (e anestesia).
- Em suma, induzir um estado de hiperinsulinêmica introduzindo um bolus de insulina de 200 mU/kg seguido de infusão contínua de insulina (7,5 mU/kg/min) 60 min. de uso de uma infusão variável de 20% para manter a euglycemia da D-glicose.
- Avaliar a glicose no sangue da veia da cauda cada 5min com um dispositivo de monitoramento de glicose e manter-se a 5 mM, ajustando a taxa de infusão de glicose variável. Determine a sensibilidade do insulin, calculando a taxa de infusão de glicose média durante o último 30 min.
- Certifique-se que o diâmetro da artéria gracilis é documentado para os períodos de tempo desejado (por exemplo às 10, 30 e 60 min) do início da mordaça hiperinsulinêmica-euglicêmico com o programa de computador.
- Depois de 25 min e/ou 55 min da mordaça insulina, inicie a segunda medição (hiperinsulinémico) CEUS para documentar o MBV em 30 ou 60 min, respectivamente. Siga os mesmos passos descritos no 2.4 e 2.5. Retire e use a porta de anestesia do conector de 4 vias para infundir as microbolhas. Recolocar o tubo da anestesia após o término da infusão de microbolhas.
- Após a conclusão do IVM e as medições de CEUS 60 min após o início da infusão de insulina, Retire sangue do mouse por um procedimento de punção de coração para análise posterior. Isto também irá eutanásia o mouse. Cuidadosamente, dissecar o grácil e artérias femoral e armazená-los para novas experiências desejadas (para , por exemplo, borrões ocidentais, imuno-histoquímica, ex vivo pressão miografia experimentos36,37,, 38).
3. análise off-line
Nota: As análises de IVM e CEUS medições devem ser realizadas off-line por um investigador cego. CEUS oferece a possibilidade de distinguir a microcirculação de navios maiores por temporariamente as microbolhas pelas ondas de ultra-som de alta intensidade usando a função MBD-destruição. O sinal (medido em unidades arbitrárias (Afonso)), em vasos maiores é restaurado mais rapidamente do que aqueles na microcirculação por causa da velocidade de microbolhas nos vasos correspondentes.
- Use uma estação de trabalho off-line ou o software na máquina do ultra-som para fazer as análises.
- Desenhe uma região de interesse (ROI) para incluir a microcirculação. Desenhe um ROI separado para incluir os maiores vasos femorais (Figura 3A).
- Duplica ROIs do microcirculação e dos maiores navios para os fundo, a linha de base e hiperinsulinêmica medições usando a função de cópia ROI construída no software.
- Subtrai o sinal de intensidade da medição de plano de fundo da linha de base e as medições hiperinsulinêmica.
- Distribuir o sinal de intensidade da microcirculação pelo sinal de intensidade dos vasos femorais. Linha de base e hiperinsulinêmica MBVs agora podem ser comparados.
Resultados
A taxa de infusão de glicose durante a braçadeira hiperinsulinêmica-euglicêmico (a sensibilidade à insulina) foi 180.21 ± 19.81 µmol/kg/min. aplicação Local de óleo de parafina no compartimento do músculo adutor para estabilizar o navio não alterou o diâmetro médio da linha de base das artérias (73.6 µm ± 29.0 vs 68,8 ± 17,9 µm; p = 0,58), mas ajudou a reduzir a variação dos animais testaram (Figura 4A). Insulina consistentemente aumentou o diâmetro da artéria gracilis (14,58 ± 6.2% em 60 min; N = 9) que foi significativamente diferente (p < 0,0001) desde a mudança de diâmetro causada pela infusão de salina (-6.3 ± 4,9%; N = 6). Vasodilatação induzida por insulina foi apreciável após 10min (10,09 ± 5,1%; p = 0,002) e atingiu cerca de 95% de sua capacidade máxima dilatória após 30 min.
Usando o CEUS, insulina consistentemente aumentou músculo MBV (Figura 5A) 33,5% (± 31.04%, N = 7; p = 0.0009) quando comparado com infusão de solução salina (-10.63 ± 27.87%, N = 6) (Figura 5B). Os dados apresentados são as intensidades de sinal do músculo MBV dividido por isso nos vasos femorais. Isso reduz a variação experimental entre diferentes medições e entre diferentes ratos (dados não mostrados). A intensidade de sinal nos vasos femorais corresponde linearmente com a concentração de microbolhas na circulação (Figura 3). Corrigindo o sinal dos vasos femorais teoricamente corrige diferenças de concentrações de microbolhas usadas (Figura 3D). Dados são apresentados nesta seção como média ± desvio padrão.

Figura 1: Exposição cirúrgica do compartimento adutor do membro posterior. (A) uma incisão é feita na virilha, paralela à direção do ligamento inguinal. (B) a tração suave ao bloco gordo nas direções distais (setas pretas) apresentará o tecido conjuntivo (*) entre a almofada de gordura e a parede abdominal. (C) a pele dobras da incisão podem ser ajustadas usando a braçadeira de buldogue para criar uma pequena cavidade para armazenar o óleo de parafina que banha os vasos. (D), o ultra-som sonda é posicionada sobre o contralateral membro posterior superior após a artéria preparado gracilis é vista usando um microscópio calibrado. Clique aqui para ver uma versão maior desta figura.
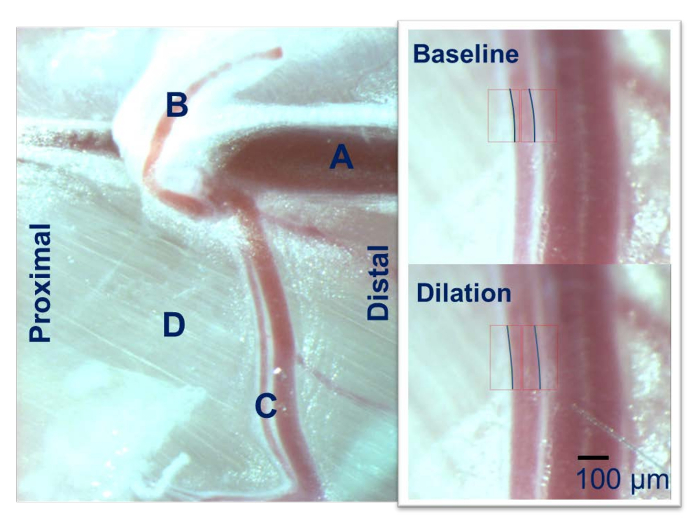
Figura 2: Microscopia intravital do membro posterior Mouse. A artéria femoral (A) dá origem à artéria epigástrica (B) e a artéria gracilis (C) que é executado sobre o grupo do músculo adutor (D). A artéria gracilis é usada para o IVM usando um microscópio calibrado. Clique aqui para ver uma versão maior desta figura.
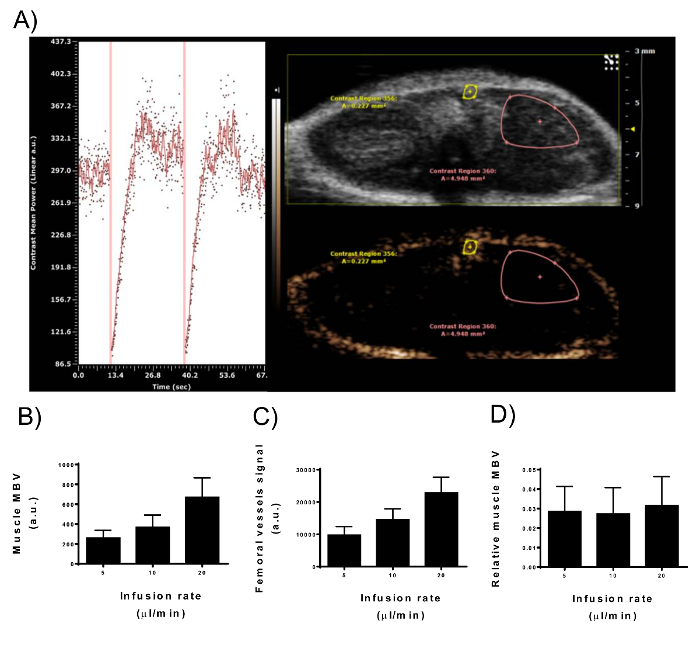
Figura 3: Sinal de intensidade da ultra-sonografia contraste aprimorado no Volume de sangue Microvascular do músculo e vasos femorais. (A) vista do contraste não-linear de imagem modo da plataforma digital de imagem durante a infusão constante de microbolhas em um membro superior posterior rato masculino. Painel direito: dois ROIs são desenhadas para representar o músculo MBV e os vasos femorais. Apenas a parte superficial do compartimento do músculo adutor é incluída no ROI como o sinal de intensidade diminui com a profundidade. Painel esquerdo: curva de tempo-intensidade do músculo MBV ROI. Linhas verticais representam a destruição das microbolhas (MBD) com ondas de alta energia. Imediatamente após o MBD, nenhum agente de contraste está presente no plano da imagem latente que começa a encher com microbolhas gradualmente. Após 10-15 s, atingiu o pico de realce de contraste. (B-D) Depois chegou-se um sinal de estado estacionário, a taxa de infusão de 2,5 x 109 bolhas/mL foi duplicada (5, 10, 20 µ l/min). Intensidade de sinal do músculo MBV (B) e os vasos femorais (C) em paralelo a duplicação da concentração de microbolhas na circulação. (D) corrigindo muscular MBV para o sinal de vasos femorais remove a variabilidade na intensidade de sinal causada por microbolhas diferentes concentrações (N = 9; barras de erro representam o desvio padrão). Clique aqui para ver uma versão maior desta figura.
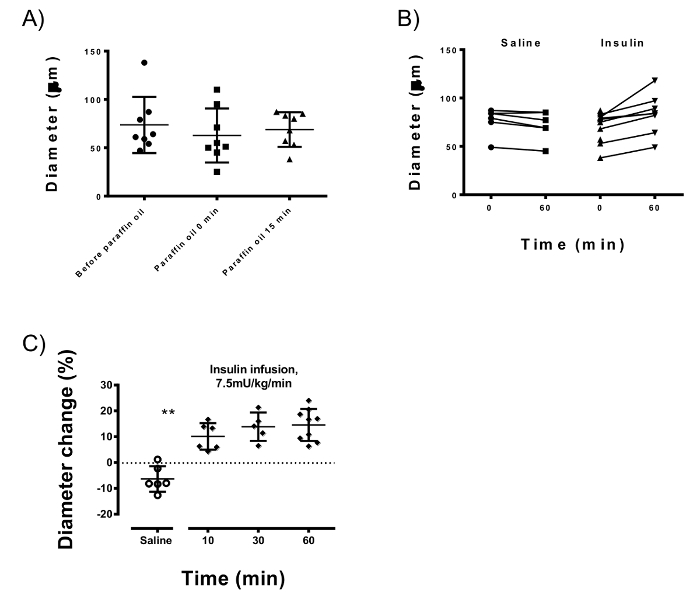
Figura 4: Microscopia intravital medições da artéria Gracilis. (A) óleo de parafina reduz a variação das artérias de diferentes animais gracilis (que é µm 29,0 sem parafina vs 17,9 µm depois de aplicar o óleo), mantendo o diâmetro médio da linha de base estável (73.6 µm vs 68,8 µm; p = 0,58). (B) diâmetros Arterial no início do estudo e após 60 min de infusões de insulina ou soro fisiológico. Insulina após 60 min infusão dilatadas consistentemente a artéria gracilis (p < 0,0001) quando comparado com infusão de solução salina. (C) induzida por insulina vasodilatação ocorre em 10 min após o início da infusão (p = 0,002) e chega a 95% do máximo em 30 min. barras de erro representam desvio-padrão; Teste-T de Student não pareado é usado para as estatísticas. Clique aqui para ver uma versão maior desta figura.
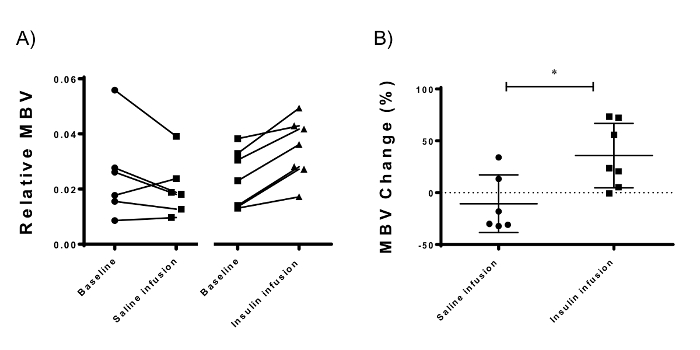
Figura 5: Microvascular medições de Volume de sangue usando contraste aprimorado ultra-sonografia do compartimento músculo adutor do membro posterior Mouse. (A) insulina resultou em um aumento consistente em MBV 30 min após o início da infusão de insulina. (B) a diferença entre o hiperinsulinémico e as medições de linha de base (mudança MBV) é denotado como o recrutamento microvascular mediada por insulina. Insulina induzida uma 33,5% (± 31.04%, p = 0.016; N = 7) recrutamento microvascular em comparação com infusão de solução salina (-10.63 ± 27.87%, N = 6). Barras de erro representam o desvio padrão; Teste-T de Student não pareado é usado para as estatísticas. Clique aqui para ver uma versão maior desta figura.
Discussão
Nós desenvolvemos uma técnica para estimar simultaneamente a ações de vascular da insulina sobre as artérias maiores (usando o IVM) e a microcirculação de músculo esquelético (usando CEUS). Os passos críticos para medições fiáveis e bem sucedidas são: 1) corretamente, expondo a artéria gracilis sem sangramento; 2) impedem fugas de óleo parafina banhando a artéria; 3) tendo um patente para o acesso venoso (cânula de veia de cauda) para infusão de compostos vasoativas (insulina) e agente de contraste (microbolhas).
O estudo da disfunção microvascular no músculo vem ganhando destaque no contexto da obesidade e insulina resistência14,25,39,40. O impacto negativo da obesidade e resistência à insulina na função vascular manifesta-se em diferentes níveis da árvore vascular. De agora em diante, abordagens diferentes são necessárias para avaliar essas alterações. O uso combinado das técnicas IVM e CEUS no mouse mesmo fornece uma poderosa ferramenta para quantificar os efeitos da insulina em níveis diferentes da vasculatura. IVM permite visualização directa e análise quantitativa da artéria resistência e CEUS permite a avaliação da insulina induzida por alterações na perfusão muscular.
Estudar o compartimento de músculo adutor tem várias vantagens. As artérias são facilmente acessíveis e a natureza superficial da incisão torna possível fechar a incisão na pele com uma sutura 5.0 de estéril após o experimento é terminado. Os animais foram injetados por via subcutânea com buprenorfina após as experiências como um analgésico na dose de 0,1 mg/kg e permitiu a recuperação em um ambiente quente. Os ratos tolerado o procedimento muito bem e nós experimentamos sem perda dos animais nem infecções do membro posterior em mais de 35 animais estudados. Isto torna possível para acompanhamento ou estudar os animais de uma forma longitudinal. Animais utilizados nesses experimentos, no entanto, foram anestesiados com isoflurano 1,8% inalado equilibrado com oxigênio fluindo a 0,4 L/min, porém, uma máscara de anestesia. Em contraste com isoflurano anestesia41,42, anestesia FMA não perturba a sensibilidade periférica à insulina. Um plano futuro é estudar bem como os ratos se recuperar da anestesia FMA.
O compartimento de músculo adutor também é útil desde vários compostos vasoativas mediando o local e a jusante efeitos vasculares podem ser avaliados. Por exemplo, a aplicação tópica destes compostos para o tecido-alvo é viável usando técnicas superfusion28 ou manipulação cirúrgica e implantação de algemas farmacológico em torno das embarcações43. Além disso, a artéria gracilis pode ser isolada e estudou em myograph a pressão. O nosso grupo e outros reuniram-se substancial evidência experimental usando o myograph de pressão para documentar os efeitos da insulina e outros compostos vasoativas sobre esta artéria ex vivo36,37,38.
Uma limitação inerente ao uso da técnica IVM é a exposição cirúrgica do músculo e a aplicação de óleo de parafina para estabilizar os vasos. Não está claro se essas ações de impacto no ambiente nativo da artéria. No entanto, a Figura 3A mostra que o diâmetro da linha de base da artéria gracilis banhado em óleo de parafina não altera consideravelmente. Também mostrou que o óleo mineral com êxito inibe a difusão de oxigênio, protegendo o tecido de hyperoxic condições44. Além disso, o óleo ajuda a reduzir a variação no diâmetro de base das artérias. É por isso que defendemos a usar óleo de parafina e deixe o resto de preparação pelo menos 30 min. De nota, o uso de solução salina tamponada, em vez de óleo – ou sem óleo – resultou em diâmetros altamente variáveis e constrição do vaso (dados não mostrados). Além disso, no final dos experimentos, nós isolado das artérias gracilis - banhadas em óleo de parafina - e testado sua reatividade no myograph de pressão ex vivo. As artérias de óleo-banho de parafina reagiram da mesma forma para controlar as artérias quando estimulado com insulina e acetilcolina (vasodilatador) (dados não mostrados). A vasodilatação induzida por insulina consistente mostra claramente que o protocolo IVM descrito neste estudo produz resultados confiáveis.
A vantagem de aplicar as duas técnicas no mouse mesmo supera algumas das limitações intrínsecas de uma técnica pelo outro: CEUS estima MBV no músculo imperturbável in vivo, mas navios individuais não podem ser vistos; IVM torna possível ver navios individuais, embora isso não posso estimar MBV. Um plano futuro é utilizar microscopia IVM do músculo cremaster em combinação com CEUS do músculo adutor do lado contralateral. Esta modificação pode fornecer uma estimativa do MBV (usando CEUS) e acesso directo aos capilares (usando o IVM) óptico. O protocolo pode ser mais modificado; o conector de 4 vias, utilizado para a cânula de cauda pode ser ligado a um conector de 5 vias. Por isso, podemos evitar retirar o tubo de anestesia ao executar a segunda medição de CEUS (descrita no ponto 2.9). Em nossa experiência, os ratos tolerado o atual protocolo bem. Outra modificação que pode ser feita a este protocolo é a taxa de braçadeira de insulina utilizada. Usámos 7.5 taxa de braçadeira de mU/kg/min que é considerado supra fisiológicos. Dependendo do estudo, uma menor taxa de braçadeira de insulina (por exemplo 3 mU/kg/min) pode ser usada.
Enquanto encontramos o protocolo descrito confiável, existem limitações específicas que precisam de atenção. Existem situações em que a medição do diâmetro arterial não é o ideal. Executar as etapas de preparação requer alguma experiência com o modelo. É fundamental que o óleo de parafina não vaze o ambiente do navio como complementando-o com óleo novo irá perturbar o navio e mudar o diâmetro, tornando-se necessário deixar a artéria descansar por mais 30 minutos. Além disso, o reflexo da luz (descrito na etapa 1.14 do protocolo) na superfície do óleo parafina às vezes era muito brilhante, tornando difícil visualizar a artéria. Isto pode ser contrabalançado por dirigir a fonte de luz para que a luz cai em um ângulo para o óleo de parafina, superfície e paralelo à artéria.
Em conclusão, a combinação de IVM e CEUS técnicas descritas neste estudo torna possível quantificar os diferentes efeitos da insulina em níveis diferentes da vasculatura. IVM da artéria gracilis fornece insights sobre as alterações vasculares montante contribuindo para jusante da perfusão microvascular medida usando CEUS. Defendemos que a combinação de várias técnicas experimentais no mouse mesmo para melhor avaliar a função vascular.
Divulgações
Visual Sonics Inc coberta das taxas de acesso aberto, Considerando que a estrutura e o conteúdo do artigo permaneceram toda a responsabilidade dos autores.
Agradecimentos
Agradecemos a Ing. Duncan van Groen para programar o software de análise de imagem (ImageGrabber) usado neste estudo. Financiamento para esta pesquisa foi fornecida por uma concessão VIDI da organização neerlandesa para a investigação científica (grant 016.136.372).
Materiais
| Name | Company | Catalog Number | Comments |
| C57BL/6 Mice | Charles river | Mice used were bred in-house | |
| Vevo 2100 high-resolution ultrasound system | VisualSonics inc. | ||
| MS250 non-linear transducer | VisualSonics inc. | ||
| Vevo 2100 software | VisualSonics inc. | ||
| Ultrasound gel (Aquasonic 100, colourless) | CSP Medical | 133-1009 | Ultrasound gel used to transmit the ultrasound waves |
| Vortex | VWR international | 58815-234 | |
| Heating pad | Pantlab | ||
| Freestyle Precision Xceed | Abbott | To measure blood glucose level during the hyperinsulinemic-euglycemic clamp | |
| Insulin Novorapid | Novo Nordisk | ||
| Glucose monohydrate | Merck Millipore | 1083421000 | |
| Buffered saline solution | B. Braun | 152118062 | |
| PE-20 medical tubing | Becton, Dickinson and Company | 427405 | |
| Needle, 27 Gauge | Becton-Dickinson & Co | 305109 | |
| Medical tape | 3M | ||
| Ultrasound probe holder | Built In-house | ||
| Cotton swabs | Multiple Equivalent | ||
| Creme depilator | Multiple Equivalent | ||
| Gel tissue adhesive | Derma+flex | GA30005-2222 | |
| Infusion pump | Harvard Apparatus | Harvard Apparatus PHD 2000 | |
| Small fine straight scissors | Fine Science Tools (FST) | 14090-09 | |
| Needle holder | Fine Science Tools (FST) | 12500-12 | |
| Straight forceps with fine tip | Fine Science Tools (FST) | 11251-20 | |
| Stereomicroscope | Olympus | SZX12 | |
| Camera | Basler | scA1390-17gc | |
| Image Grabber program | Built in-house | Image acquisition system | |
| Timer | VWR | 33501-418 | |
| Syringes, 1 mL | Fisher | 14-817-25 | |
| Light source, fiber-optic | Schott | KL1500 | Ideally has adjustable arms |
| Paraffin oil | Multiple Equivalent | ||
| Name | Company | Catalog Number | Comments |
| Microbubbles | |||
| 1,2-Distearoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850365C | |
| polyoxyethylene stearate | Sigma | p3440 | |
| perfluorobutane gas | F2 Chemicals | C4F10(g) | |
| Decon FS200 ultrasonic bath | Decon Ultrasonics Ltd | ||
| Vialmix | Lantheus Medical Imaging | 515370-0810 | |
| Multisizer Coulter Counter | Beckman Coulter Inc |
Referências
- DeFronzo, R. A., Tobin, J. D., Rowe, J. W., Andres, R. Glucose intolerance in uremia. Quantification of pancreatic beta cell sensitivity to glucose and tissue sensitivity to insulin. The J Clin Invest. 62, 425-435 (1978).
- Chiu, J. D., et al. Direct administration of insulin into skeletal muscle reveals that the transport of insulin across the capillary endothelium limits the time course of insulin to activate glucose disposal. Diabetes. 57, 828-835 (2008).
- Herkner, H., et al. Transcapillary insulin transfer in human skeletal muscle. Eur J Clin Invest. 33, 141-146 (2003).
- Yang, Y. J., Hope, I. D., Ader, M., Bergman, R. N. Insulin transport across capillaries is rate limiting for insulin action in dogs. J Clin Invest. 84, 1620-1628 (1989).
- Clerk, L. H., et al. The vasodilatory actions of insulin on resistance and terminal arterioles and their impact on muscle glucose uptake. Diabetes Metab Res Rev. 20, 3-12 (2004).
- Vincent, M. A., et al. Microvascular recruitment is an early insulin effect that regulates skeletal muscle glucose uptake in vivo. Diabetes. 53, 1418-1423 (2004).
- Barrett, E. J., et al. The vascular actions of insulin control its delivery to muscle and regulate the rate-limiting step in skeletal muscle insulin action. Diabetologia. 52, 752-764 (2009).
- Vincent, M. A., Clerk, L. H., Rattigan, S., Clark, M. G., Barrett, E. J. Active role for the vasculature in the delivery of insulin to skeletal muscle. Clin Exp Pharmacol Physiol. 32, 302-307 (2005).
- Clark, M. G., Rattigan, S., Barrett, E. J., Vincent, M. A. Point: There is capillary recruitment in active skeletal muscle during exercise. J Appl Physiol (1985). 104, 889-891 (2008).
- Wallis, M. G., et al. Insulin-mediated hemodynamic changes are impaired in muscle of Zucker obese rats. Diabetes. 51, 3492-3498 (2002).
- Eringa, E. C., Stehouwer, C. D., Roos, M. H., Westerhof, N., Sipkema, P. Selective resistance to vasoactive effects of insulin in muscle resistance arteries of obese Zucker (fa/fa) rats. Am J Physiol Endocrinol Metab. 293, 1134-1139 (2007).
- Bonner, J. S., et al. Muscle-specific vascular endothelial growth factor deletion induces muscle capillary rarefaction creating muscle insulin resistance. Diabetes. 62, 572-580 (2013).
- Kubota, T., et al. Impaired insulin signaling in endothelial cells reduces insulin-induced glucose uptake by skeletal muscle. Cell Metab. 13, 294-307 (2011).
- Levy, B. I., et al. Impaired tissue perfusion: a pathology common to hypertension, obesity, and diabetes mellitus. Circulation. 118, 968-976 (2008).
- Schelbert, H. R. Coronary circulatory function abnormalities in insulin resistance: insights from positron emission tomography. J Am Coll Cardiol. 53, 3-8 (2009).
- Wong, T. Y., et al. Associations between the metabolic syndrome and retinal microvascular signs: the Atherosclerosis Risk In Communities study. Invest Ophthalmol Vis Sci. 45, 2949-2954 (2004).
- Bonadonna, R. C., et al. Role of tissue-specific blood flow and tissue recruitment in insulin-mediated glucose uptake of human skeletal muscle. Circulation. 98, 234-241 (1998).
- Ellmerer, M., et al. Reduced access to insulin-sensitive tissues in dogs with obesity secondary to increased fat intake. Diabetes. 55, 1769-1775 (2006).
- Ellmerer, M., et al. Physiological hyperinsulinemia in dogs augments access of macromolecules to insulin-sensitive tissues. Diabetes. 53, 2741-2747 (2004).
- Vincent, M. A., et al. Mixed meal and light exercise each recruit muscle capillaries in healthy humans. Am J Physiol Endocrinol Metab. 290, 1191-1197 (2006).
- de Jongh, R. T., Serne, E. H., RG, I. J., de Vries, G., Stehouwer, C. D. Impaired microvascular function in obesity: implications for obesity-associated microangiopathy, hypertension, and insulin resistance. Circulation. 190, 2529-2535 (2004).
- Ketel, I. J., et al. Obese but not normal-weight women with polycystic ovary syndrome are characterized by metabolic and microvascular insulin resistance. J Clin Endocrinol Metab. 93, 3365-3372 (2008).
- Khan, F., et al. Impaired microvascular function in normal children: effects of adiposity and poor glucose handling. J Physiol. 551, 705-711 (2003).
- Clark, M. G. Impaired microvascular perfusion: a consequence of vascular dysfunction and a potential cause of insulin resistance in muscle. Am J Physiol Endocrinol Metab. 295, 732-750 (2008).
- Serne, E. H., et al. Impaired skin capillary recruitment in essential hypertension is caused by both functional and structural capillary rarefaction. Hypertension. 38, 238-242 (2001).
- Sriramarao, P., Anderson, W., Wolitzky, B. A., Broide, D. H. Mouse bone marrow-derived mast cells roll on P-selectin under conditions of flow in vivo. Lab Invest. 74, 634-643 (1996).
- Leister, I., et al. A peritoneal cavity chamber for intravital microscopy of the liver under conditions of pneumoperitoneum. Surg Endosc. 17, 939-942 (2003).
- Cardinal, T. R., et al. Chronic hindlimb ischemia impairs functional vasodilation and vascular reactivity in mouse feed arteries. Front Physiol. 2, 91 (2011).
- Duling, B. R. The preparation and use of the hamster cheek pouch for studies of the microcirculation. Microvasc Res. 5, 423-429 (1973).
- Wei, K., et al. Quantification of myocardial blood flow with ultrasound-induced destruction of microbubbles administered as a constant venous infusion. Circulation. 97, 473-483 (1998).
- Clerk, L. H., Rattigan, S., Clark, M. G. Lipid infusion impairs physiologic insulin-mediated capillary recruitment and muscle glucose uptake in vivo. Diabetes. 51, 1138-1145 (2002).
- Barrett, E. J., Keske, M. A., Rattigan, S., Eringa, E. C. CrossTalk proposal: De novo capillary recruitment in healthy muscle is necessary. J Physiol. 592, 5129-5131 (2014).
- Aman, J., et al. Effective treatment of edema and endothelial barrier dysfunction with imatinib. Circulation. 126, 2728-2738 (2012).
- Boer, M. P., et al. Globular adiponectin controls insulin-mediated vasoreactivity in muscle through AMPKalpha2. Vascul Pharmacol. 78, 24-35 (2016).
- van den Brom, C. E., et al. Myocardial Perfusion and Function Are Distinctly Altered by Sevoflurane Anesthesia in Diet-Induced Prediabetic Rats. J Diabetes Res. 2016, 5205631 (2016).
- Meijer, R. I., et al. Perivascular adipose tissue control of insulin-induced vasoreactivity in muscle is impaired in db/db mice. Diabetes. 62, 590-598 (2013).
- Meijer, R. I., et al. Insulin-induced changes in skeletal muscle microvascular perfusion are dependent upon perivascular adipose tissue in women. Diabetologia. 58, 1907-1915 (2015).
- Sun, D., Kaley, G., Koller, A. Characteristics and origin of myogenic response in isolated gracilis muscle arterioles. Am J Physiol. 266, 1177-1183 (1994).
- Jonk, A. M., et al. Microvascular dysfunction in obesity: a potential mechanism in the pathogenesis of obesity-associated insulin resistance and hypertension. Physiology (Bethesda). 22, 252-260 (2007).
- Wiernsperger, N., Nivoit, P., De Aguiar, L. G., Bouskela, E. Microcirculation and the metabolic syndrome. Microcirculation. 14, 403-438 (2007).
- Horber, F. F., et al. Isoflurane and whole body leucine, glucose, and fatty acid metabolism in dogs. Anesthesiology. 73, 82-92 (1990).
- Sui, H., et al. Quantifying insulin sensitivity and entero-insular responsiveness to hyper- and hypoglycemia in ferrets. PLoS One. 9, 90519 (2014).
- Pires, N. M., et al. Local perivascular delivery of anti-restenotic agents from a drug-eluting poly(epsilon-caprolactone) stent cuff. Biomaterials. 26, 5386-5394 (2005).
- Young, D. A., Chi, M. M., Lowry, O. H. Energy metabolism of skeletal muscle biopsies stimulated anaerobically without load in vitro. Am J Physiol. 250, 813-820 (1986).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados