Method Article
Mesure et l’interprétation des taux de consommation d’oxygène en tout volent tête Segments
Dans cet article
Résumé
Mesure des altérations des taux métaboliques est central pour comprendre la progression de diverses maladies et le vieillissement. Ici, nous présentons une nouvelle technique permettant de mesurer la consommation d’oxygène tout chef qui plus étroitement ressemble à l’état physiologique et peut aider à révéler de nouveaux médicaments qui modifient l’activité mitochondriale.
Résumé
Activité métabolique réglementée est essentielle pour le fonctionnement normal des cellules vivantes. En effet, activité métabolique modifiée est causalement liée à la progression du cancer, le diabète, neurodégénérescence et vieillissement pour n’en nommer que quelques-uns. Par exemple, les changements dans l’activité mitochondriale, powerhouse métabolique de la cellule, ont été caractérisés dans beaucoup de ces maladies. En général, les taux de consommation d’oxygène des mitochondries ont été considérés comme une indication fiable de l’activité mitochondriale et mesures dans certaines de ces études étaient fondées sur des mitochondries isolées ou cellules. Toutefois, ces conditions ne peuvent représenter la complexité d’un tissu entier. Récemment, nous avons développé une nouvelle méthode qui permet la mesure dynamique des taux de consommation d’oxygène de têtes volent ensemble isolé. En utilisant cette méthode, nous avons enregistré le plus faibles taux de consommation d’oxygène du segment ensemble tête chez les jeunes et âgés de mouches. Deuxièmement, nous avons découvert que les inhibiteurs de désacétylases lysine modifient rapidement la consommation d’oxygène dans toute la tête. Notre nouvelle technique peut donc aider en découvrant de nouvelles propriétés de divers médicaments, qui peuvent avoir une incidence taux métabolique. De plus, notre méthode peut donner une meilleure compréhension du comportement métabolique dans un dispositif expérimental qui ressemble plus étroitement à des États physiologiques.
Introduction
Activité métabolique réglementée est essentielle pour la survie des cellules et le bon fonctionnement d’un tissu. Déréglementé activité métabolique a été largement démontrée lié à l’apparition et la progression de diverses maladies1. Par exemple, l’activité métabolique inférieure a déjà été décrite dans les maladies neurodégénératives telles qu’Alzheimer et mémoire associées à âge atteinte2,3. En outre, dysfonctionnement mitochondrial est censé être causalement impliqués dans le processus de vieillissement4,5. En revanche, mitochondries et métaboliques plus élevés ont été décrits dans le cancer cellules6, où l’utilisation d’inhibiteurs mitochondries réduit tumorigenèse7.
Une indication de l’activité métabolique est le taux de consommation d’oxygène (OCR) des mitochondries. Fait intéressant, ce type de lecture est principalement obtenu à partir des mitochondries isolées ou des cellules, donc la majorité de ce qui est décrit dans la littérature est principalement basée sur une lecture qui ne ressemble pas à l’état physiologique. Cependant, il y a plusieurs inconvénients à cette technique. Tout d’abord, le protocole d’isolement mitochondriale peut potentiellement endommager son intégrité8, qui peut être un artefact pertinent lorsqu’on compare les mitochondries isolées du jeune par rapport aux anciens tissus9. En outre, le processus d’isolement est long et peut entraîner la perte des modifications post-traductionnelles des protéines qui régulent la fonction mitochondriale9,10,11. En outre, il a été démontré que les mitochondries isolées ne représentent pas systématiquement tout tissu métabolismes12,13. Une telle complexité biologique cellulaire pourrait être considérée comme, « le tout est supérieur à la somme de ses parties », c'est-à-dire mitochondries peuvent afficher différents taux métaboliques à l’intérieur d’une cellule complexe par rapport à leur taux métabolique lorsque isolé.
Alors que les cellules peuvent offrir une meilleure lecture OCR que mitochondries isolées, cellule à cellule communication dans le contexte d’un tissus entiers peut-être être perdue. Par exemple, dans le cerveau, l’activité métabolique des neurones est fortement tributaire de l’activité métabolique des voisins des cellules gliales14. Par conséquent, établissant de nouvelles techniques pour étudier l’OCR en tissus entiers ou des organismes entiers peut s’avérer plus perspicace pour le déclenchement et la progression de diverses affections.
Nouvelles techniques ont vu le jour récemment, pour répondre à ces questions et permettre la mesure de l’OCR de segment, tissus entiers ou des organismes vivants. Par exemple, un travail récent rapporté la mesure de l’oxygène d’un muscle de vol beetle en utilisant une approche de fibre perméabilisées avec un respiromètre15. Nouvelles machines pour micro-respirométrie permettent la mesure de l’OCR des îlots pancréatiques16,17. En conséquence, il a été signalé que cette technologie permet la mesure de l’OCR de toute les vers18 et danios19. Toutefois, la présence de la barrière digestive peut poser un défi pour l’essai de diverses drogues dans le contexte des altérations de l’OCR. Fait intéressant, les rapports récents de Neville et ses collègues ont montré une nouvelle technique de mesure de cerveau de larve de drosophile unique avec la plaque bien20,21.
Dans cette étude, nous avons utilisé une configuration similaire pour permettre la mesure de l’OCR entière de vivre ensemble et non mobiles Drosophila22. Cette technique offre également un avantage secondaire dans la mesure de l’impact de diverses drogues sur l’activité métabolique dans un segment entier, sans avoir à passer par le système digestif barrière13,22. Par exemple, il a été démontré précédemment qui injection directe des inhibiteurs de désacétylases lysine (KDACi), un médicament croit altérer le mécanisme épigénétique dans le cerveau, a entraîné une amélioration souvenirs formation23. Cependant, grâce à notre nouvelle technique, nous avons découvert que l’inhibition KDAC a entraîné une augmentation rapide de l’OCR, qui peut être un facteur en soi dans l’activité neuronale. Notre protocole fournit une méthode simple et originale pour évaluer l’impact de diverses drogues, manipulation génétique ou les États physiologiques (maladie, vieillissement) sur OCR dans le contexte d’une tête entière.
Protocole
1. préparation de l’instrument
Remarque : Pour cette expérience, nous avons utilisé un dispositif de Seahorse XF24 avec des plaques « îlot ». L’exploitation de la technique utilise des différents cycles de mélange, d’attente et mesures ainsi que la possibilité d’ajouter des substances dans le compartiment de mesure.
- Allumez la machine bien avant le début de l’expérience alors qu’il y ait suffisamment de temps pour atteindre la température souhaitée et restent stables.
- Dans la configuration du logiciel (mode d’administration), choisissez la longueur de l’étalonnage de la cartouche (ici, 20 min a été choisi) et la température souhaitée.
Remarque : Alors que les mitochondries ou les mesures de tissus de mammifères sont généralement transportés out à 37 ° C,, tête volée de la température ambiante est de 25 ° C mais sont publiés les résultats des mesures effectuées à 31 ° C. Nous avons utilisé 31 ° C, puisque c’est le réglage de température le plus bas de l’appareil à la température ambiante. Pour atteindre une température de 25 ° C ou moins, placer l’appareil dans une pièce froide ou à 11 ° C, comme récemment publié21. - Dans le logiciel, utilisez le protocole suivant : 3 min – 2 min d’attente – 2 min mesure de mélange. Selon le protocole expérimental, ajoutez des étapes de l’injection des ports A-D après une étape de mesure choisie.
- Pour le contrôle de la qualité et la détermination des OCR basale, attendez au moins trois cycles de mesure avant d’injecter le médicament première via port A. Pour une chronologie détaillée du protocole, s’il vous plaît voir référence Becker et al. 13 .
2. cartouche préparation
- Avant de calibrer la cartouche un jour (ou au moins 4 heures) avant d’essais. Ajouter 1,0 mL de degré (pH 7,4) dans chaque puits et placez la cartouche de capteur sur le dessus de la plaque et le magasin à 37 ° C sans CO2 pendant la nuit ou jusqu'à 72 h. éviter l’évaporation de la cartouche avec parafilm si c’est être hydraté pendant plus de 24 h.
- S’assurer que les médicaments expérimentaux sont bien dissous dans le milieu (milieu frais + 2.5 % de glucose) avant le début de l’expérience.
- Mesurer et ajuster le pH de la solution médicamenteuse au pH du véhicule à la température désirée afin d’éviter toute différence de pH pendant l’injection de drogues.
- Pipette de la solution de la drogue à son port injection allouée. Par exemple, utilisez 77 μL d’entrée A pour atteindre une 01:10 dilution dans une solution de 770 μL et par la suite 85 μL pour le port B.
- Charger la cartouche dans la machine et commencer la calibration.
3. plaque préparation
Remarque : Il est fortement recommandé que les deux personnes préparent la plaque en même temps. La durée de préparation d’un plat pour deux personnes peut exiger ~ 45-60 minutes.
- Ajuster le fraîchement préparée media + 2.5 % de glucose au pH désiré avec 1 N HCl. s’assurer que le pH n’est pas affecté par changements de température.
- Préparer une glacière et placer une plaque de métal sur la glace.
- Ouvrir le sachet de plaque (la plaque 24 puits) d’îlot, plonger les filets dans un plat de pétri (92 x 16 mm) avec les médias.
- Recueillir une moustiquaire avec l’outil d’insertion (un petit instrument qui met le net fermement dans le puits) et ont l’introducteur debout à côté de la loupe. Ajouter une petite goutte de médias au filet attaché à l’outil d’insertion.
- Anesthésier les mouches (une semaine ou 4 semaines vieux mâles de canton ont été utilisés ici) en plaçant les mouches sur la plaque de métal glacée.
- À l’aide de pinces, saisir l’abdomen d’une mouche et plongez-le dans les médias dans une boîte de pétri sous le microscope.
- Avec une deuxième paire de pinces, délicatement enlever la tête de la mouche. Placez-le au milieu du filet attaché à l’introducteur et vérifiez que la tête est immergée dans les médias.
- Centre de la tête quand il y a 16 d'entre eux sur le net. Éliminer le liquide superflu avant de centrer la tête pour éviter toute perte de têtes en les plaçant dans le puits.
Remarque : 16 mouches chefs furent utilisés comme ce nombre a donné des données suffisantes et stables dans un délai raisonnable de préparation de la plaque lors de l’établissement de la méthode. - À l’aide de l’outil d’insertion, placer le filet dans le puits. Veiller à ce que les têtes sont pris au piège sous le filet. Ajouter lentement 700 μL de médias + 2.5 % de glucose (Figure 1). Répétez l’opération pour chacun des puits.
Remarque : 20 puits de volent des échantillons tête et 4 puits vides pour l’étalonnage du fond par plaque est recommandé. S’assurer que le puits vides contiennent aussi un filet avec 700 μl de tampon + 2.5 % de glucose. - Vérifier les puits pour les bulles d’air sous les filets par le microscope. Pipette doucement haut et en bas de l’aide d’une pipette de 1 mL pour enlever les bulles. Garder la tête centrée pour un OCR fiable de lecture.
- Ajouter la plaque de la machine et démarrer la mesure.
4. analyse des mesures OCR
- À la fin du protocole, retirez la cartouche.
- Contrôle qualité, observer des restes visibles dans les garnitures de port. Jeter la cartouche et la plaque (Option 1) si les têtes ne doivent ne pas être utilisés pour l’extraction de protéines, par exemple, (voir Option 2).
- Extrayez les fichiers de feuille de calcul et de contrôle qualité chacun bien pour des niveaux d’oxygène et du pH. Assurez-vous que les puits de fond ne montrent aucune OCR et que les niveaux d’oxygène sont stables.
- Utiliser un algorithme d’analyse des données, dont certaines peuvent être choisis dans le logiciel respectif. Utiliser l’algorithme AKOS pour OCR valeurs2 si la plage d’oxygène niveaux pendant la mesure entière, entre la première et la dernière tique (= mesure secondaire) sont similaires entre les deux échantillons biologiques et les niveaux d’oxygène des tiques derniers ne sont pas inférieures à 95) mmHg) (OCR des chefs est nettement inférieur à ce niveau d’oxygène), (Figure 2).
- Certaines conditions provoquent l’échantillon afin d’avoir un OCR rapide et peuvent afficher des niveaux inférieurs de l’oxygène au cours de la tiquest 1 et/ou dans le dernier battement (anoxie) (Figure 3 a). Dans un tel scénario, utilisez une méthode de mesure alternative tel que l’algorithme fixe. Durant l’anoxie, l’OCR est grandement réduite en raison de faibles niveaux d’oxygène dans la solution. Par conséquent, l’algorithme AKOS donne lectures trompeuses.
Remarque : La machine plus récente n’a pas l’algorithme fixe. Par conséquent, il est préférable d’extraire les niveaux d’oxygène total et tracer le taux par heure pour le premier 3-5 tiques (Figure 3).
5. (option 2) une analyse biochimique du Segment tête
- Pour mesurer la biochimiques (métabolites, protéome, etc.) les propriétés d’un segment de tête, ajuster le moment de l’exécution de l’obligation ; Toutefois, il est possible d’abandonner le protocole à tout moment et enlever la plaque.
- Une fois que la plaque est supprimée, utilisez pince non aiguisées pour faire un trou dans le filet et l’enlever libérant ainsi les têtes de flotter.
- À l’aide d’une pipette de 1 mL avec une coupe bout et transférer les têtes dans un flacon.
- Rapidement jeter le tampon et clin d’oeil-gel les chefs dans l’azote liquide. Stocker les têtes à-80 ° C pour des analyses.
Résultats
La possibilité d’enregistrer en haute qualité mesure OCR s’appuie sur le centrage de la tête au milieu du filet (Figure 1). C’est important pour la machine XF24, qui dispose d’un capteur d’oxygène plutôt petite tache par rapport à la machine plus récente de XFe24 où le capteur est plus grand. Comme précédemment indiqué, centrage les têtes affichent un OCR stable au moins 20 mesures consécutives dans les jeunes mouches13.
Un aspect critique de l’utilisation des machines est d’appliquer l’analyse correcte. Il est recommandé de vérifier les niveaux d’oxygène au cours des expériences. Chaque mesure 2 min est subdivisée en 10 mesures secondaires (tiques). Un puits avec 16 têtes saines affiche généralement une pression partielle de l’oxygène (pO2) de 140-170 (mmHg) pour le premier battement. Dans le premier exemple, nous avons comparé les jeunes vs midlife chefs mouche (Figure 2 a et 2 b). Bien que le taux d’oxygène baisse plus rapidement dans les têtes d’âge moyen, la différence observée est petite (Figure 2 a). En outre, la gamme des niveaux d’oxygène est similaire entre les conditions, avec 165 au cours de la première tique à 120 pendant le dernier battement. Dans un tel cas, il est préférable d’utiliser l’algorithme AKOS pour générer automatiquement l’OCR (pmol/min)2, qui reflète avec fiabilité la baisse de niveau d’oxygène entre les jeunes contre les chefs midlife (Figure 2 b). À noter, le programme d’analyse de la machine choisit automatiquement l’algorithme AKOS.
Toutefois, selon nos observations, automatiquement à l’aide de l’algorithme AKOS peut donner induire en erreur, sinon contraire résulte pour l’OCR correct. Ces objets peuvent être générées dans des conditions d’un échantillon très consommatrice qui atteint anoxie13,22. Par exemple, l’ajout du butyrate de sodium (SB), un inhibiteur de la KDAC, change transitoirement la dynamique des teneurs en oxygène (Figure 3 a). Tandis que les commandes du véhicule affichent un taux stable d’oxygène pendant le premiers et le derniers des tiques, SB addition provoque une baisse considérable et transitoire des niveaux d’oxygène dans ces tiques (Figure 3 a). SB en elle-même ne modifie pas le taux d’oxygène dans les puits de fond, où aucune tête n’est ajoutés (données non présentées). Les données appuient l’idée que SB augmente la consommation d’oxygène. Comme la collection de première tique est retardée (12 secondes jusqu'à ce que la tique première est inscrit dans la phase de mesure) le premier point de données est déjà plus faible dans les puits de SB traité. Par conséquent, il est difficile de capturer les premiers changements dans la consommation d’oxygène après l’ajout de cet inhibiteur d’HDAC. En outre, les niveaux d’oxygène dans les échantillons de SB traité sont réduits à déjà faibles (anoxie) comme en témoigne la collection des derniers tiques. À l’anoxie, les têtes de ralentissent leur consommation d’oxygène dans les derniers tiques (Figure 3 a). Parce que le calcul de AKOS prend en compte toutes les tiques et ignore un état anoxique, il génère un OCR trompeuse. En effet, le AKOS non-normalisé basé spectacle niveaux OCR peu de changement lors de l’injection (ligne pointillée) du port (véh/SB) (Figure 3 b).
Normaliser les niveaux de l’OCR à la mesure de l’injection préalable fondée sur la AKOS révèle des niveaux très similaires d’OCR, avant et après l’injection de port A, qui ne prend pas en charge les changements de niveau d’oxygène (Figure 3 a). Dans ces circonstances, l’algorithme fixe, qui ressemble plus à des modèles/les changements de niveau OCR et l’oxygène est recommandé (Figure 3). Par conséquent, l’algorithme fixe basé normalisé révèle mesure un OCR accrue après traitement SB (Figure 3).
Un inconvénient avec la nouvelle machine est l’absence de l’algorithme fixe. Par conséquent, dans les expériences où consommer très/traitement de l’échantillon est utilisé, il est recommandé de calculer les mensurations de l’OCR manuellement, et calculer la diminution de l’oxygène niveau par heure pour le premier tiques 3-5 dans chaque mesure.

Figure 1 . Un exemple d’un puits contenant 16 têtes âgés d’un semaine de mouches mâles. Les têtes sont centrés sous un filet et flottant dans les médias. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
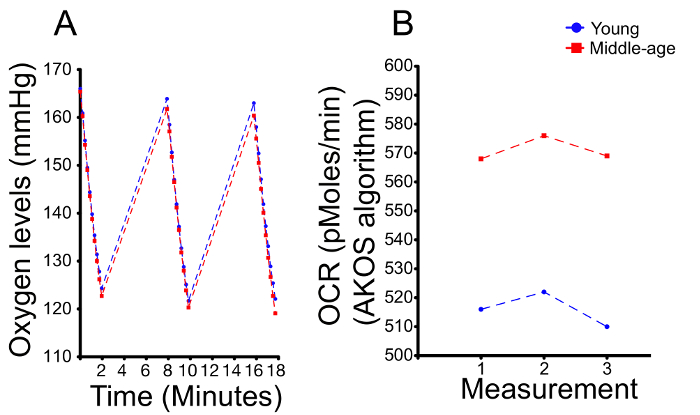
Figure 2 . Un exemple représentatif de comparaison mesure OCR entre chefs mouche âgé d’un semaine (jeune) et quatre - semaine vieux chefs mouche (moyen-âge). (A) les niveaux d’oxygène sont indiquées pour les trois mesures distinctes ; chaque mesure 2 min est subdivisée en dix mesures secondaires (tiques). (B) une quantification de (A). Les niveaux des premières et la dernières tiques sont similaires, bien que les niveaux de l’échantillon du moyen-âge sont légèrement inférieurs. Une quantification de la pente de la diminution des teneurs en oxygène est utilisée pour générer les niveaux d’OCR. Comme décrit précédemment22, l’OCR de mouches âgés moyens est 10-15 % plus élevé que les jeunes mouches. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
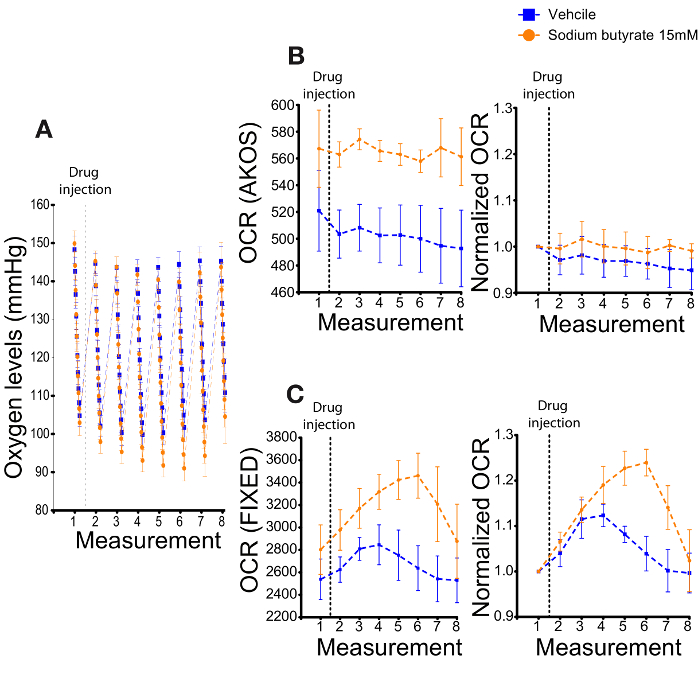
Figure 3 . Un exemple de l’altération de l’OCR de butyrate de sodium (SB) dans les jeunes mouches chefs. (A) oxygène niveaux enregistrés de sept mesures suite à l’ajout de 15 mM SB. La ligne pointillée marque l’injection de la drogue (ou véhicule) du port A. À noter, alors que les niveaux d’oxygène de graduations 1 et 10 demeurent stables dans le groupe témoin (bleu), les niveaux d’oxygène au cours de ces tiques sont transitoirement (six mesures après l’injection) réduit dans les échantillons de SB traité (orange). En outre, la diminution des teneurs en oxygène est fortement réduite au cours des dernières tiques d’échantillons SB traité. N = 3 par groupe (B) [gauche] OCR Non normalisé niveaux calculés à partir de l’algorithme AKOS. Le calcul affiche incorrectement des niveaux similaires de OCR, avant et après l’injection de SB par port a. normalisation [droit] de l’OCR à la mesure avant l’injection du port A. (C) [à gauche] « Fixe » algorithme calcul de (A) montrant l’OCR non normalisé . Ici, l’OCR représente fidèlement l’augmentation transitoire dans l’utilisation de l’oxygène des têtes de traitement par SB ; [Droit] Normalisation de l’OCR à la mesure avant l’injection du port A. erreur barres indiquent la S.E.M. dans tous les graphes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Notre nouvelle technique offre une nouvelle approche pour l’étude des changements métaboliques dans le vieillissement et la maladie dans le contexte de l’ensemble mouche segments tête22. La méthode peut également être adaptée pour étudier l’impact du butyrate de sodium KDAC sur la consommation d’oxygène. Comme nous l’avons démontré, inhibiteurs de deacetlyase de lysine (HDACs/KDACs) provoquer des changements de l’OCR. Essentiellement, que les cibles de ces inhibiteurs ne sont normalement pas localisées dans les mitochondries (ces inhibiteurs n’ont aucune incidence sur la classe III déacétylases, les sirtuines)24, ces médicaments ne pourraient seulement être testés sur au moins niveau tissulaire. En effet, divers médicaments sont injectés directement dans le cerveau, contournant ainsi la possible transformation/modification/inactivation par le système digestif. À ce titre, notre technique offre un roman aperçu de comment ces médicaments directement impact le segment de la tête.
Il y a plusieurs étapes cruciales. Tout d’abord, comme indiqué dans le protocole, nous recommandons fortement prépare une assiette moins d’une heure, avec deux paires de mains, préparation de la plaque. D’après notre expérience, la qualité et la stabilité des mesures OCR sont meilleures lorsque préparés en temps opportun. Si vous prenez trop de temps, la présence de puits de votre bas de OCR augmente, ainsi que de plus courte durée d’OCR stable. Deuxièmement, il est important de procéder à un contrôle de qualité et s’assurer que les conditions expérimentales entre divers échantillons sont similaire (pH, teneur en oxygène). Enfin, une étape cruciale sera de choisir l’algorithme exact pour analyser les échantillons. Comme nous l’avons démontré, l’algorithme AKOS par défaut a donné un calcul trompeur et parfois opposé dans les échantillons qui consomme l’oxygène à des taux élevés de13. Nous insistons donc sur l’importance de vérifier les données brutes pour les teneurs en oxygène et en comparant l’OCR qui en résulte.
Actuellement, il y a plusieurs limites à cette technique. À température ambiante, la machine chauffe jusqu'à 31 ° C (c’est la température minimale de mesure lorsque la machine est à température ambiante), qui peut représenter un état de stress pour l' mouches chefs25. Cela peut toutefois être surmonté en plaçant l’appareil dans une pièce froide, ce qui permettra aux mesures faites à 25 ° C et donc sans un stress de chaleur possible jusqu’aux têtes de mouches. Récent rapport a démontré en plaçant la machine à 11 ° C, permettant ainsi l’enregistrement OCR de mouches à 25 ° C,21. Néanmoins, la séparation de tête mouche doit être effectuée à la température ambiante. Par ailleurs, les fluctuations de température rendent difficile aux changements de pH control et c’est pourquoi il est fortement recommandé de tester l’impact des conditions physiologiques/médicaments sur OCR en utilisant des configurations expérimentales similaires. En outre, la contribution de la consommation d’oxygène par des mécanismes non-mitochondriale-indépendants n’a pas encore été établi26. À l’aide de divers inhibiteurs respiratoires qui sont efficaces dans les têtes volent, il serait possible d’établir de tels taux de consommation d’oxygène non-mitochondriale.
Il convient de noter que les diverses maladies chez les mammifères sont caractérisés par des altérations dans le métabolisme énergétique. Parmi eux sont les maladies qui sont caractérisent par soit réduction métabolique comme la maladie d’Alzheimer ou métaboliques recâblage comme le cancer. Fait intéressant, inhibiteurs de la KDAC sont utilisés pour la maladie d’Alzheimer et le cancer traitement27. Alors que les mécanismes précis par lequel KDAC inhibiteurs atteignent l’aspect thérapeutique restent floues, les données de notre technique prend en charge la notion de roman que ces inhibiteurs pourraient moduler le métabolisme.
En résumé, cette méthode est utile pour mesurer la consommation d’oxygène totale des tarifs de vivo et plus affiche avec précision les effets des médicaments sur le métabolisme général, qui peut être négligée dans les mitochondries isolées protocoles12. Par exemple, résultats obtenus par cette méthode, plutôt que les techniques précédentes, ont mis en cause nouveaux aperçus d’inflexibilité métabolique associées à l’âge par traitement de KDAC. Tandis que le travail supplémentaire est nécessaire pour optimiser les conditions expérimentales pour volent des têtes, la combinaison de notre technique et l’analyse appropriée peut conduire à autre élucidation de l’activité mitochondriale dans le contexte des tissus vivants ensemble.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt financier concurrentes.
Remerciements
Nous remercions Andreas Ladurner, Carla Margulis et leurs équipes pour une vaste prise en charge expérimentale. Nous remercions Caitlin Ondracek pour ses commentaires sur le manuscrit. Nous tenons à remercier Sofia Vikstrom pour nous aider à établir les premières phases de cette technique. Nous remercions aussi peut Sanderhoff pour son aide technique. LB est financé par le ministère fédéral allemand de l’éducation et la recherche (01KX1012 de concession de Infrafrontier). SP a été financée par une bourse postdoctorale du Fonds AXA pour la recherche et la FNSC (numéro de licence 81870900). AVV est financé par le QBM.
matériels
| Name | Company | Catalog Number | Comments |
| Glucose | Sigma-Aldrich | G8644 | D-(+)-Glucose solution 100 g/L in H2O, sterile-filtered |
| XF assay Medium | Agilent | 103575-100 | Seahorse XF DMEM Medium, pH 7.4 |
| Sodium butyrate | Merck | 817500 | Dissolved in XF assay buffer |
| Seahorse XF24/e24 analyzer | Agilent | ||
| XF24/e24 Extracellular Assay Kit | Agilent | 100850-001 | Cartridge |
| XF24/e24 Islet Capture Microplates | Agilent | 101122-100 | Plate |
| Seahorse Capture Screen Insert Tool | Agilent | 101135-10 | Insertor |
| Petri dish | Sarstedt | 821,472 | Petri dish 92 x 16 mm |
Références
- Wallace, D. C. . Mitochondrial diseases in man and mouse. 283 (5407), 1482-1488 (1999).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical chemistry. 81 (16), 6868-6878 (2009).
- Cunnane, S., et al. Brain fuel metabolism, aging, and Alzheimer's disease. Nutrition. 27 (1), 3-20 (2011).
- Wang, Y., Hekimi, S. . Mitochondrial dysfunction and longevity in animals: Untangling the knot. 350 (6265), 1204-1207 (2015).
- Wallace, D. C., Fan, W., Procaccio, V. Mitochondrial energetics and therapeutics. Annual review of pathology. 5, 297-348 (2010).
- Zhang, X., et al. Induction of mitochondrial dysfunction as a strategy for targeting tumour cells in metabolically compromised microenvironments. Nature communications. 5, 3295 (2014).
- Wheaton, W. W., et al. Metformin inhibits mitochondrial complex I of cancer cells to reduce tumorigenesis. eLife. 3, e02242 (2014).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS one. 6 (3), e18317 (2011).
- Baker, D. J., Peleg, S. Biphasic Modeling of Mitochondrial Metabolism Dysregulation during Aging. Trends in biochemical sciences. 42 (9), 702-711 (2017).
- Zhao, S., et al. . Regulation of cellular metabolism by protein lysine acetylation. 327 (5968), 1000-1004 (2010).
- Baeza, J., Smallegan, M. J., Denu, J. M. Mechanisms and Dynamics of Protein Acetylation in Mitochondria. Trends in biochemical sciences. 41 (3), 231-244 (2016).
- Picard, M., et al. Mitochondrial functional impairment with aging is exaggerated in isolated mitochondria compared to permeabilized myofibers. Aging cell. 9 (6), 1032-1046 (2010).
- Becker, L., Nogueira, M. S., Klima, C., de Angelis, M. H., Peleg, S. Rapid and transient oxygen consumption increase following acute HDAC/KDAC inhibition in Drosophila tissue. Scientific reports. 8 (1), 4199 (2018).
- Volkenhoff, A., et al. Glial Glycolysis Is Essential for Neuronal Survival in Drosophila. Cell metabolism. 22 (3), 437-447 (2015).
- Newell, C. . Physiological Entomology. 41, 96-102 (2016).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PloS one. 6 (7), e21746 (2011).
- Wikstrom, J. D., et al. A novel high-throughput assay for islet respiration reveals uncoupling of rodent and human islets. PloS one. 7 (5), e33023 (2012).
- Koopman, M., et al. A screening-based platform for the assessment of cellular respiration in Caenorhabditis elegans. Nature. 11 (10), 1798-1816 (2016).
- Kumar, M. G., et al. Altered Glycolysis and Mitochondrial Respiration in a Zebrafish Model of Dravet Syndrome. eNeuro. 3 (2), (2016).
- Neville, K. E., et al. A novel ex vivo method for measuring whole brain metabolism in model systems. Journal of neuroscience. 296, 32-43 (2018).
- Neville, K. E., et al. Metabolic Analysis of Drosophila melanogaster Larval and Adult Brains. Journal of visualized experiments: JoVE. (138), (2018).
- Peleg, S., et al. Life span extension by targeting a link between metabolism and histone acetylation in Drosophila. EMBO reports. 17 (3), 455-469 (2016).
- Peleg, S., et al. . Altered histone acetylation is associated with age-dependent memory impairment in mice. 328 (5979), 753-756 (2010).
- Drazic, A., Myklebust, L. M., Ree, R., Arnesen, T. The world of protein acetylation. Biochimica et biophysica acta. 1864 (10), 1372-1401 (2016).
- Miquel, J., Lundgren, P. R., Bensch, K. G., Atlan, H. Effects of temperature on the life span, vitality and fine structure of Drosophila melanogaster. Mechanisms of ageing and development. 5 (5), 347-370 (1976).
- Banh, R. S., et al. PTP1B controls non-mitochondrial oxygen consumption by regulating RNF213 to promote tumour survival during hypoxia. Nature cell biology. 18 (7), 803-813 (2016).
- Falkenberg, K. J., Johnstone, R. W. Histone deacetylases and their inhibitors in cancer, neurological diseases and immune disorders. Nature reviews. Drug discovery. 13 (9), 673-691 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon