Method Article
Implantation d’ECG télémétrique et de transmetteurs de pression artérielle combinés pour déterminer la sensibilité spontanée aux baroréflexes chez des souris conscientes
Dans cet article
Résumé
Le baroréflexe est un mécanisme de régulation de la fréquence cardiaque par le système nerveux autonome en réponse aux changements de pression artérielle. Nous décrivons une technique chirurgicale pour implanter des transmetteurs de télémétrie pour la mesure continue et simultanée de l’électrocardiogramme et de la pression artérielle chez la souris. Cela peut déterminer la sensibilité spontanée aux baroréflexes, un marqueur pronostique important des maladies cardiovasculaires.
Résumé
La pression artérielle (PA) et la fréquence cardiaque (FC) sont toutes deux contrôlées par le système nerveux autonome (SNA) et sont étroitement liées en raison de mécanismes réflexes. Le baroréflexe est un mécanisme homéostatique clé pour contrer les changements aigus à court terme de la PA artérielle et pour maintenir la PA dans une plage physiologique relativement étroite. La PA est détectée par des barorécepteurs situés dans l’arc aortique et le sinus carotidien. Lorsque la PA change, les signaux sont transmis au système nerveux central et sont ensuite communiqués aux branches parasympathique et sympathique du système nerveux autonome pour ajuster la FC. Une augmentation de la PA provoque une diminution réflexe de la FC, une baisse de la PA provoque une augmentation réflexe de la FC.
La sensibilité baroréflexe (BRS) est la relation quantitative entre les changements dans la PA artérielle et les changements correspondants dans la HR. Les maladies cardiovasculaires sont souvent associées à une altération de la fonction baroréflexe. Dans diverses études, une réduction du BRS a été rapportée, par exemple, dans une insuffisance cardiaque, un infarctus du myocarde ou une maladie coronarienne.
La détermination du BRS nécessite des informations provenant à la fois de BP et de HR, qui peuvent être enregistrées simultanément à l’aide de dispositifs télémétriques. L’intervention chirurgicale est décrite en commençant par l’insertion du capteur de pression dans l’artère carotide gauche et le positionnement de son extrémité dans l’arc aortique pour surveiller la pression artérielle, suivie de la mise en place sous-cutanée de l’émetteur et des électrodes ECG. Nous décrivons également les soins intensifs postopératoires et la prise en charge analgésique. Après une période de récupération post-chirurgicale de deux semaines, des enregistrements ECG et BP à long terme sont effectués chez des souris conscientes et non retenues. Enfin, nous incluons des exemples d’enregistrements de haute qualité et l’analyse de la sensibilité spontanée des barorécepteurs à l’aide de la méthode de séquence.
Introduction
Le réflexe barorécepteur artériel est le principal système de contrôle par rétroaction chez l’homme qui fournit un contrôle à court terme - et peut-être aussi à plus long terme 1,2 - de la pression artérielle artérielle (ABP). Ce réflexe amortit les perturbations de la PA qui se produisent en réponse à des déclencheurs physiologiques ou environnementaux. Il fournit des changements réflexes rapides dans la fréquence cardiaque, le volume de l’AVC et la résistance artérielle périphérique totale. Le réflexe provient des terminaisons nerveuses sensorielles de l’arc aortique et des sinus carotidiens. Ces terminaisons nerveuses constituent les barorécepteurs artériels. Les somata des terminaisons nerveuses de l’arc aortique sont situées dans le ganglion nodose tandis que celles des terminaisons nerveuses du sinus carotidien sont situées dans le ganglion pétrosal. Le réflexe est déclenché par une augmentation de la pression artérielle, qui étire et active les terminaisons nerveuses barorécepteurs (Figure 1A). L’activation entraîne des volées potentielles d’action qui sont transmises centralement via le dépresseur aortique afférent et les nerfs du sinus carotidien aux noyaux cardiovasculaires du tronc cérébral tels que le noyau tractus solitarii et le noyau dorsal du nerf vagal. Les changements dans l’activité nerveuse afférente modulent à leur tour l’activité efférente autonome. L’activité accrue des nerfs barorécepteurs diminue l’activité sympathique et augmente l’activité nerveuse parasympathique. Ainsi, les conséquences de l’activation des barorécepteurs sont une réduction de la fréquence cardiaque, du débit cardiaque et de la résistance vasculaire qui, ensemble, contrecarrent et amortissent l’augmentation de la pression artérielle3. En revanche, la diminution de l’activité des nerfs barorécepteurs augmente l’activité sympathique et diminue l’activité nerveuse parasympathique, ce qui augmente la fréquence cardiaque, le débit cardiaque et la résistance vasculaire et contrecarre ainsi la diminution de la pression artérielle.
De nombreuses études chez l’homme et l’animal ont démontré que le réflexe barorécepteur peut être ajusté dans des conditions physiologiques telles que l’exercice4, le sommeil5, le stress thermique6 ou la grossesse7. En outre, il existe des preuves que le baroréflexe est chroniquement altéré dans les maladies cardiovasculaires, telles que l’hypertension, l’insuffisance cardiaque, l’infarctus du myocarde et les accidents vasculaires cérébraux. En fait, le dysfonctionnement baroréflexe est également utilisé comme marqueur pronostique dans plusieurs maladies cardiovasculaires 8,9,10. De plus, un dysfonctionnement du baroréflexe est également présent dans les troubles du SNA. Compte tenu de l’importance du réflexe barorécepteur pour la santé et les états pathogènes, l’estimation in vivo de ce réflexe est une composante importante de la recherche autonome et cardiovasculaire avec certaines implications cliniques graves.
Les lignées génétiques de souris sont des outils essentiels dans la recherche cardiovasculaire. Les études in vivo de ces lignées de souris fournissent des informations précieuses sur la physiologie et la physiopathologie cardiovasculaires et, dans de nombreux cas, servent de systèmes de modèles précliniques pour les maladies cardiovasculaires. Nous fournissons ici un protocole pour l’enregistrement télémétrique in vivo de l’ECG et de la PA chez des souris conscientes, non retenues et se déplaçant librement et décrivons comment la sensibilité baroréflexe peut être déterminée à partir de ces enregistrements à l’aide de la méthode de séquence (Figure 1B). La méthode appliquée est appelée méthode de séquence, car les séries battement à battement des intervalles systolique BP (SBP) et RR sont criblées pour de courtes séquences de trois battements ou plus lors de l’augmentation ou de la diminution spontanée de la PAS avec adaptation réflexe de la FC. Cette méthode est l’étalon-or pour la détermination de la sensibilité baroréflexe puisque seuls les mécanismes réflexes spontanés sont étudiés. La technique est supérieure aux techniques plus anciennes qui impliquaient des procédures invasives telles que l’injection de médicaments vasoactifs pour induire des changements de PA.
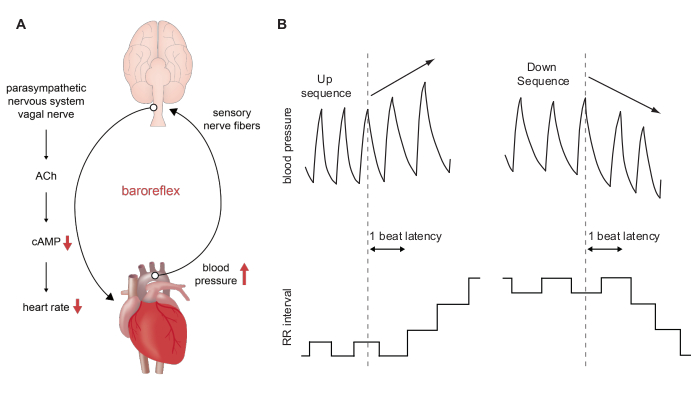
Figure 1 : Représentation schématique de l’évaluation du baroréflexe et de la sensibilité baroréflexe à l’aide de la méthode de séquence. (A) Évolution du baroréflexe lors d’une augmentation aiguë de la pression artérielle. Une augmentation à court terme de l’ABP est détectée par les barorécepteurs situés dans l’arc aortique et le sinus carotidien. Cette information est transmise au système nerveux central et induit une diminution de l’activité du nerf sympathique parallèlement à une augmentation de l’activité parasympathique. La libération d’acétylcholine par les terminaisons nerveuses situées dans la région du nœud sino-auriculaire induit une diminution de l’AMPc du second messager dans les cellules du stimulateur cardiaque du ganglion sino-auriculaire et donc une réduction de la fréquence cardiaque. Une diminution à court terme de la pression artérielle a l’effet inverse. (B) Traces BP schématiques au cours d’une séquence ascendante (panneau supérieur gauche) et descendante (panneau supérieur droit) de trois battements consécutifs. Une séquence ascendante est associée à une augmentation parallèle des intervalles RR (panneau inférieur gauche) qui équivaut à une diminution de la FC. Une séquence descendante est associée à une diminution parallèle des intervalles RR (panneau inférieur droit) qui équivaut à une augmentation de la FC. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Effectuer toutes les études sur les animaux conformément aux directives institutionnelles locales et aux lois nationales sur l’expérimentation animale. Pour cette expérience, les études ont été approuvées par la Regierung von Oberbayern et étaient conformes aux lois allemandes sur l’expérimentation animale. Animaux WT (fond C57BL/6J) et animaux d’un modèle murin malade du syndrome du sinus présentant une sensibilité accrue au BRS (Hcn4tm3(Y527F; R669E; T670A)Biel)11 (fond mixte C57BL/6N et 129/SvJ) ont été utilisés pour cette étude.
1. Configuration de l’équipement
- Retirez un émetteur télémétrique de son emballage stérile et raccourcissez les fils ECG à la longueur appropriée à la taille de la souris. Pour un mâle mâle de 12 semaines six souris noires (C57BL/6J), pesant ~30 g, raccourcir la sonde positive (rouge) à une longueur de ~45 mm et la sonde négative (incolore) à une longueur de ~40 mm à l’aide de ciseaux.
NOTE: Ces valeurs sont données comme orientation et doivent être adaptées si nécessaire (Figure 2). - Retirez environ 6 mm du tube en silicone de la sonde ECG à l’aide d’un scalpel pour exposer le fil. Couvrez les extrémités du fil avec un tube excessif en laissant une partie de ~ 2 mm du fil ECG découverte pour enregistrer les signaux électriques. Fixez le tube en silicone avec un matériau de suture en soie 5-0 non résorbable (Figure 2A).
- Notez le numéro de série de l’émetteur dans le protocole d’opération (fichier supplémentaire 1).
- Hydrater le transmetteur dans une solution chaude et stérile de NaCl à 0,9 %.
- Pesez la souris et notez son poids.
- Autoclave tous les instruments chirurgicaux avant la chirurgie. Stérilisez-les pendant la chirurgie et entre les opérations de différents animaux à la chaleur sèche à l’aide d’un stérilisateur de billes de verre chaudes.
REMARQUE: Les instruments chirurgicaux doivent refroidir à température ambiante avant utilisation pour prévenir les brûlures cutanées. - Désinfecter l’établi pour assurer des conditions aseptiques.
2. Implantation chirurgicale d’émetteurs télémétriques pour des mesures combinées d’ECG et de pression artérielle
- Dissection de l’artère carotide commune gauche.
- Anesthésier une souris par injection intrapéritonéale de mélange anesthésique (100 mg/kg de kétamine ; 15 mg/kg de xylazine ; 1 mg/kg d’acépromazine). Effectuez un test de pincement des orteils pour vous assurer que la souris est complètement anesthésiée avant de commencer la chirurgie.
- Utilisez une tondeuse pour raser la zone chirurgicale du dessous du menton vers les muscles pectoraux transversaux.
- Placez la souris en décubitus dorsal sur une plaque chirurgicale à température contrôlée réglée à 37 °C. Fixez les membres avec du ruban chirurgical et surveillez en permanence la température corporelle à l’aide d’un thermomètre rectal (figure 2C). Si la température corporelle descend en dessous de 37 °C, couvrir le corps de l’animal avec de la gaze de coton stérile pendant la chirurgie.
- Appliquez une pommade pour les yeux pour protéger les yeux de l’animal pendant l’anesthésie.
- Appliquez de la crème dépilatoire sur la zone chirurgicale préalablement rasée. Enlevez les cheveux et la crème dépilatoire à l’aide d’un coton et de l’eau tiède après 3-4 min. Assurez-vous que la peau est propre et exempte de tout poil résiduel et de toute crème dépilatoire, afin que la plaie ne soit pas contaminée pendant l’opération.
- Désinfectez la peau avec plusieurs cycles alternés de gommage à la povidone iodée ou à la chlorhexidine suivis d’alcool.
- Placez l’animal sous un microscope à dissection et placez un champ stérile autour de la zone chirurgicale.
- Faites une incision médiane de 1 à 1,5 cm à travers la peau du cou, en commençant immédiatement sous le menton. Faites des efforts pour rendre l’incision aussi droite que possible. (Figure 2D).
NOTE: Au cours des étapes suivantes, la zone chirurgicale doit être maintenue humide par application régulière de NaCl stérile, chaud (37 °C) 0,9%. - Créez un espace sous-cutané des deux côtés de l’incision en séparant la peau du tissu conjonctif sous-jacent à l’aide de ciseaux à dissection contondante. Veillez à ne pas pincer la peau trop fortement avec les forceps, car cela peut provoquer une nécrose et entraîner une altération de la cicatrisation des plaies après la chirurgie.
- Séparez les glandes parotide et sous-maxillaire à l’aide d’applicateurs à pointe de coton pour exposer la musculature recouvrant la trachée.
- Rétracter la glande salivaire gauche à l’aide d’une pince à dissection incurvée pour identifier l’artère carotide gauche située latéralement à la trachée (figure 2E).
- Disséquez soigneusement l’artère carotide du tissu adjacent à l’aide d’une pince incurvée. Faites très attention à ne pas blesser le nerf vagal qui court le long du vaisseau. Poursuivre le curage contondant pour exposer l’artère carotide gauche à environ 10 mm de longueur et la séparer complètement du fascia vasculaire et du nerf vague (figure 2F).
- Passez une suture de soie non résorbable 5-0 sous la partie isolée de l’artère carotide tout en soulevant légèrement le vaisseau sanguin avec une pince incurvée pour réduire la friction entre la suture et l’artère carotide, car cela pourrait facilement endommager la paroi vasculaire.
- Placez la suture crâniennement, juste à proximité de la bifurcation de l’artère carotide, formez un nœud et attachez-la pour ligaturer définitivement le vaisseau (Figure 2G). Fixez les deux extrémités de la suture d’occlusion crânienne à la table d’opération avec du ruban chirurgical.
- Passez une deuxième suture d’occlusion sous l’artère carotide et placez-la caudale à ~5 mm de distance de la suture crânienne (Figure 2H). Il est nécessaire pour l’occlusion temporaire du flux sanguin lors de la canulation de l’artère. Par conséquent, nouez un nœud lâche et fixez les deux extrémités de suture avec du ruban chirurgical.
- Positionnez une troisième suture (suture sécurisée) entre la suture d’occlusion crânienne et caudale et faites un nœud lâche (Figure 2I). Cette suture est nécessaire pour maintenir le cathéter en place tout en canulant l’artère. Collez une extrémité de la suture à la table d’opération.
- Canulation de l’artère carotide commune gauche.
REMARQUE : La zone du capteur du cathéter de pression artérielle est située à 4 mm de l’extrémité distale et se compose d’un tube contenant un liquide non compressible et un gel biocompatible (Figure 2B). Comme cette zone est très sensible, assurez-vous qu’elle est exempte de bulles d’air et ne la touchez à aucun moment pendant la procédure.- Pliez la pointe d’une aiguille de 24 G à un angle de ~100° pour l’utiliser comme introducteur de cathéter.
- Tirez doucement sur la suture d’occlusion caudale et fixez-la avec tension pour arrêter temporairement le flux sanguin et soulever légèrement l’artère.
- Pénétrez délicatement l’artère proximale à la suture d’occlusion crânienne à l’aide de l’aiguille pliée (figure 2J). Saisissez le cathéter avec une pince à canulation vasculaire, introduisez-le dans la petite perforation et laissez-le glisser lentement dans le vaisseau. Retirez doucement l’aiguille pliée simultanément (Figure 2K).
- Lorsque le cathéter atteint la suture d’occlusion caudale, serrez légèrement la suture sécurisée pour maintenir le cathéter en place (Figure 2L).
- Desserrez la suture d’occlusion caudale afin que le cathéter puisse être déplacé davantage jusqu’à ce que son extrémité soit positionnée dans l’arc aortique.
REMARQUE: Assurez-vous de déterminer la longueur d’insertion correcte du cathéter, car cela dépend de la taille de la souris. Pour les souris mâles ayant un fond C57BL / 6J à l’âge de 12 semaines et ~ 30 g de poids corporel, nous recommandons d’insérer le cathéter jusqu’à ce que l’encoche intégrée atteigne la suture d’occlusion crânienne. La profondeur d’insertion et l’emplacement corrects du cathéter pour la lignée de souris spécifique peuvent être vérifiés après l’euthanasie de l’animal. - Une fois positionné correctement, fixez le cathéter avec les trois sutures et coupez les extrémités aussi courtes que possible. Ne tirez pas les nœuds trop serrés car cela pourrait endommager le fragile cathéter de pression artérielle.
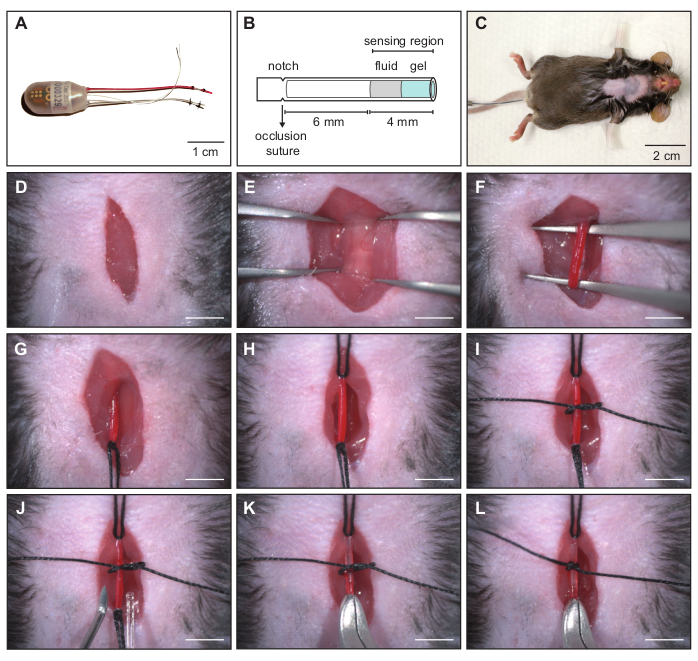
Figure 2 : Implantation d’un ECG combiné et d’un transmetteur de pression artérielle - canulation de l’artère carotide gauche. (A) Le transmetteur de télémétrie est composé d’un cathéter de pression, de deux électrodes de biopotentiel et du corps du dispositif. (B) Représentation schématique du cathéter de pression. La zone du capteur est constituée d’un fluide non compressible et d’un gel biocompatible. Le cathéter doit être inséré dans l’artère carotide jusqu’à ce que l’encoche soit au niveau de la suture d’occlusion crânienne pour assurer une position correcte dans le vaisseau sanguin. (C) Souris C57BL/6J anesthésiée préparée pour l’implantation d’un transmetteur chirurgical. (D-L) Séquence d’images montrant une intervention chirurgicale pour la canulation de l’artère carotide gauche. (D) Incision cutanée cervicale. E) Trachée exposée pour identifier l’artère carotide gauche située latéralement à la trachée. (F) Dissection contondante pour isoler l’artère du tissu adjacent et du nerf vague. (G) Ligature permanente de l’artère carotide gauche avec suture d’occlusion crânienne. (H) Tension appliquée à la suture d’occlusion caudale pour arrêter temporairement le flux sanguin. (I) Suture sécurisée pour maintenir le cathéter en place pendant la canulation. J) Canule à embout incurvé pour l’insertion du cathéter dans le vaisseau sanguin. (K) Le cathéter de pression est inséré dans l’artère carotide. (L) L’extrémité du cathéter est positionnée dans l’arc aortique et le cathéter est fixé avec la suture médiane. La barre d’échelle en D - L montre 4 mm. Réimprimé à partir de16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Placement du corps du dispositif de télémétrie dans une poche sous-cutanée sur le flanc gauche de la souris (Figure 3).
- Former un tunnel sous-cutané à partir du cou dirigé vers le flanc gauche de l’animal et former une petite poche à l’aide de petits ciseaux à dissection émoussés (figure 3B).
- Irriguer le tunnel avec une seringue de 1 mL remplie d’une solution chaude et stérile de NaCl à 0,9 % et introduire ~300 μL de la solution dans la poche (Figure 3C).
- Soulevez délicatement la peau à l’aide d’une pince émoussée et introduisez le corps de l’émetteur dans la poche (Figure 3D). Au cours de cette étape, veillez à ne pas retirer le cathéter de pression artérielle de l’artère carotide.
- Placement des fils ECG dans la configuration Einthoven II.
- Formez un mince tunnel vers le muscle pectoral droit avec des ciseaux à dissection émoussés et placez le plomb négatif (incolore) dans le tunnel à l’aide d’une pince émoussée. Fixez l’extrémité terminale de la sonde avec un point au muscle pectoral à l’aide d’un matériau de suture résorbable 6-0 (Figure 3E).
- Former une boucle dans la sonde positive (rouge), positionner son extrémité dans la région de la côte caudale gauche et sécuriser sa position avec une suture en utilisant un matériau de suture résorbable 6-0.
REMARQUE : Il est important que les deux sondes soient à plat contre le corps sur toute leur longueur pour éviter l’irritation des tissus (Figure 3F). - Fermer la peau avec des nœuds simples à l’aide d’un matériau de suture non résorbable 5-0 (Figure 3H). De plus, appliquez une petite quantité d’adhésif tissulaire sur chaque nœud pour empêcher l’animal de mordre la suture et prévenir la déhiscence.
- Appliquez de l’hydrogel povidone-iode à 10% sur la plaie pour prévenir l’infection de la plaie pendant la phase de récupération.
- Pour soulager préventivement la douleur, injecter 5 mg/kg de carprofène dans du NaCl à 0,9 % par voie sous-cutanée pendant que la souris est encore sous anesthésie.
- Réglez une plate-forme chauffante à 39 ± 1 °C et placez la souris dans une cage de boîtier séparée. Placez la moitié de la cage sur la plate-forme pendant 12 heures après la chirurgie et transférez la souris dans la zone chaude. Lorsque l’animal se réveille de l’anesthésie, il a la possibilité de rester dans la zone chaude ou de se déplacer vers la partie la plus froide de la cage.
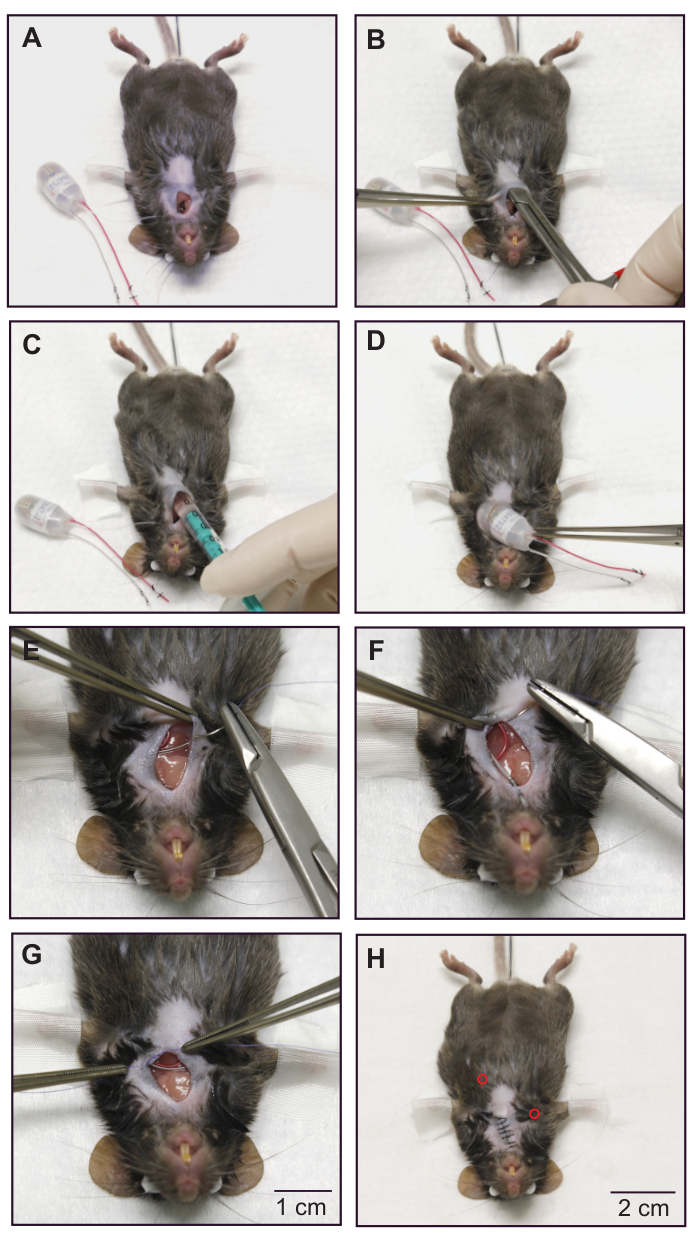
Figure 3 : Implantation d’un ECG et d’un transmetteur de pression artérielle combinés - mise en place sous-cutanée des électrodes ECG et du corps du dispositif. (A) Souris après insertion du cathéter de pression artérielle. La position du cathéter est assurée par les sutures d’occlusion. (B) Former une poche sous-cutanée sur le flanc gauche de l’animal avec des ciseaux émoussés. (C) La poche est irriguée avec ~300 μL de solution saline chaude et stérile. (D) Le corps de l’appareil est placé dans la poche sous-cutanée. (E) L’extrémité terminale de l’électrode négative (incolore) est fixée au muscle pectoral droit avec un matériau de suture résorbable. (F) Fixation de l’électrode positive (rouge) aux muscles intercostaux gauches. (G) Mise en place d’une suture permanente sur le muscle thoracique pour sécuriser la position des électrodes ECG. (H) Souris après fermeture de la peau. Les positions sous-cutanées des extrémités des électrodes ECG sont indiquées par des cercles rouges. À des fins de démonstration, un animal mort a été utilisé pour prendre ces images. Veuillez suivre des pratiques stériles lors de l’utilisation d’un animal vivant. Réimprimé à partir de16. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Soins postopératoires
- Pour soulager la douleur postopératoire, injecter 5 mg/kg de carprofène dans du NaCl à 0,9 % par voie sous-cutanée toutes les 12 heures pendant 3 à 5 jours jusqu’à ce que la plaie soit guérie.
- Injecter 10 μL/g de solution chaude de ringer-lactate par voie intrapéritonéale pour protéger l’animal de la déshydratation.
- Laissez la souris récupérer pendant 2-3 semaines avant d’exécuter les premières mesures télémétriques. Surveillez attentivement les conditions générales de santé, la cicatrisation des plaies, le poids corporel et la consommation de nourriture et d’eau pendant la période de récupération.
- À la fin de l’expérience, euthanasier la souris par inhalation de dioxyde de carbone (CO2).
REMARQUE: La luxation ou la décapitation cervicale n’est pas recommandée comme méthode d’euthanasie, car cela pourrait endommager certaines parties de l’ECG et du dispositif émetteur de PA.
- Acquisition de données.
- Prendre des mesures pour éviter le bruit acoustique et électronique pendant l’enregistrement des données. De plus, limitez l’accès du personnel pendant l’enregistrement des données et effectuez toutes les procédures d’élevage avant l’expérience.
- Placez la cage de l’animal sur la plaque du récepteur de télémétrie et allumez l’émetteur télémétrique en approchant un aimant de l’animal.
- Obtenez des enregistrements continus d’ECG, de pression artérielle et d’activité sur 72 heures (cycle obscurité/lumière de 12 heures) avec un logiciel d’acquisition de données (Figure 4).
- Analyse du rythme circadien de la fréquence cardiaque, de la pression artérielle et de l’activité.
- Vérifier la présence d’un rythme circadien régulier de FC, de PA et d’activité à l’aide d’un logiciel d’acquisition de données12 (Figure 5).
- Analyse des données, y compris la détermination de la sensibilité des barorécepteurs à l’aide de la méthode de séquence avec un logiciel d’analyse ECG et BP.
- Exportez les données BP et HR du logiciel d’acquisition de données vers les logiciels d’analyse ECG et BP (fichier supplémentaire 2). Utilisez la séquence de commandes suivante : Ouvrez le logiciel d’analyse ECG et BP > Fichier > Données brutes du convertisseur > Convertir des données brutes non-IOX. Dans la nouvelle fenêtre, cliquez sur Fichier > Charger les données ART4 de Dataquest. Encore une fois, une nouvelle fenêtre s’ouvrira, sélectionnez le fichier de données pour l’exportation > Nouvelle fenêtre s’ouvre, sélectionnez animal dans la liste « sujets » et sélectionnez ECG et BP dans « liste des formes d’onde » et appuyez sur OK. Choisissez les animaux à partir desquels les données doivent être converties en cliquant sur Convertir les données > Créer un fichier de site binaire IOX.
- Ouvrez le fichier de site binaire IOX dans le logiciel d’analyse ECG et BP à l’aide de la séquence de commandes suivante: Fichier > Charger les données IOX > Sélectionnez la trace BP et ECG > appuyez sur la coche verte.
REMARQUE: Les paramètres de traitement des données suivants sont optimisés pour les données acquises à partir de souris de type sauvage et devraient en principe s’adapter à tous les modèles murins utilisés dans le domaine préclinique. Cependant, l’adaptation de ces paramètres peut être nécessaire lorsque l’on travaille avec des modèles expérimentaux spécifiques, par exemple, des souris avec des valeurs de HR et/ou de PA extrêmement élevées ou faibles, ou différentes espèces de rongeurs. Dans tous les cas, les paramètres de traitement des données doivent être soigneusement examinés pour s’assurer qu’ils correspondent au modèle spécifique à l’étude. - Pour les paramètres de l’analyse ECG, BP et BRS, voir le dossier supplémentaire 3,4. Pour l’analyse BRS chez la souris, ajuster les paramètres BRS pour détecter uniquement les séquences de trois battements (ou plus) présentant un délai entre SBP et RR d’un battement, et régler le seuil de changement SBP et RR à 0,5 mmHg et 2 ms. S’assurer que le coefficient de corrélation de la pente de la droite de régression des diagrammes RR/SBP est supérieur à 0,75 et analyser uniquement les sections présentant un rythme sinusal stable. Définissez les paramètres pour l’analyse ECG, BP et BRS en conséquence à l’aide de la séquence de commandes suivante : Réglez les paramètres d’analyse > > nouvelle fenêtre s’ouvre
- Paramètres ECG (clic droit dans la fenêtre « Mode ECG et filtrage du signal » (Fichier supplémentaire 3)). Définissez les paramètres comme indiqué ici. Mode: ECG, RR uniquement, Mode de filtre: auto, selon le réglage HR, Fréquence cardiaque prévue: bpm > 300, Largeur du filtre d’élimination de ligne de base (ms): 100.00, Largeur du filtre antibruit: 1.00 ms, Filtre Notch: 50.0 Hz, Filtre d’élimination des pics: désactivé, Mode de détection de chute: désactivé, Longueurs maximales RR (ms): 900,00, RR à partir des pics R ajustés: désactivé, mode de réglage RR_only: Xsmall: souris, R largeur de crête (ms): 10.00, PR largeur (ms): 20.00, RT largeur (ms): 50.00, Max inter beat artefact (%): 50.00, R à un autre rapport d’amplitude: 3.00, R signe de crête: positif, et Calcul paramètre supplémentaire: désactivé
- Pour les paramètres de pression artérielle (PA, paramètres de pression), cliquez avec le bouton droit de la souris dans la fenêtre « Analyseur de pression artérielle » (fichier supplémentaire 4). Définissez les paramètres comme indiqué ici. Largeur du filtre antibruit (ms): 10.00, Largeur du filtre dérivé (ms): 6.00, Filtre Notch: 50.0 Hz, Filtre d’élimination des pointes: désactivé, Seuil de validation (unité cal.): 12.00, Seuil de rejet (unité cal.): 8.00, Dérivée au début de la course ascendante (cal U/s): 10.00, Limites de rejet: off, Retard par rapport à la référence ecg: fenêtre définie par l’utilisateur, Délai min de l’ecg Rpeak (ms): 10.00, Délai maximal de l’ecg Rpeak (ms): 250.00, Conduct_time_1 à partir de la marque: non calculé, Conduct_time_2 à partir de la marque: non calculé, BR (fréquence respiratoire): désactivé, BRS (sensibilité baroréflexe): on, Nombre de battement consécutif minimum: 3, Nombre de temps de latence: 1, Valeur de pression: SBP, Marquer pour calculer l’intervalle d’impulsion: R, Variation minimale de pression (caUI): 0,50, Variation minimale de l’intervalle (ms): 2,00, Corrélation minimale: 0,75
- Filtrez le signal d’activité pour une séquence de 3 heures avec une faible activité. Effectuez l’analyse BRS dans cette fenêtre temporelle car une activité élevée des animaux interfère avec la corrélation BP et RR.
- Effectuez une analyse BP et RR pendant cette fenêtre de temps de 3 heures tout en subdivisant l’analyse de 3 heures en étapes de 10 minutes.
- Effectuez une analyse BRS à l’aide de la séquence de commandes suivante : Ouvrir la fenêtre d’analyse BRS > Afficher > analyse BRS. Le panneau d’analyse BRS s’ouvre. Inspectez manuellement chaque séquence affichée dans le panneau d’analyse BRS et excluez les battements ectopiques, les pauses sinusales, les événements arythmiques ou les données bruyantes. Assurez-vous d’invalider chaque battement de ces séquences pour les exclure avec succès de l’analyse.
- Exportez les résultats de l’analyse BRS dans un fichier de feuille de calcul (fichier de résultats). Modifiez les paramètres exportés vers le fichier de feuille de calcul à l’aide de la séquence de commandes suivante (fichiers supplémentaires 5 à 7) :
- Réglez > Paramètres dans les sections de liste/pour déposer > > txt (fichier supplémentaire 5). Sélectionnez la section « beats » et toute autre section contenant des informations d’intérêt à l’exception de la section beats invalidée.
- Réglez > Paramètres dans la liste/pour déposer > étapes > txt (fichier supplémentaire 6). Choisissez les valeurs d’étape à exporter.
- Réglez > Paramètres dans list/to file > batts -> txt (fichier supplémentaire 7).
- Assurez-vous que la section beats du fichier contient au moins les données suivantes pour chaque battement. ECG_RR, ECG_HR, BP_SBP, BP_BRS_deltaP, BP_BRS_# (= intervalles de temps consécutifs de la séquence), BP_BRS_slope, BP_BRS_correl, BP_BRS_shiftl (=RR du temps suivant)
- Cliquez ensuite sur Fichier > Enregistrer le fichier de résultats.
- Triez les données exportées pour les séquences haut et bas à l’aide de la fonction de filtre d’Excel (fichier supplémentaire 8). Calculer séparément le nombre de séquences, la pente moyenne du BRS, l’écart type et l’erreur-type de la pente BRS pour les séquences ascendantes et descendantes. Calculez également le nombre total de séquences pour 1000 battements.
REMARQUE : Un modèle de feuille de calcul (TemplateBRS) pour le tri et l’analyse automatisés des séquences ascendantes et descendantes est fourni dans le Supplément (Fichier supplémentaire 8) et facilite l’analyse. En ajustant la fonction de filtre, vous pouvez trier les séquences en fonction de différents nombres de temps (par exemple, des séquences à trois ou quatre temps). Pour plus de détails, voir les dossiers supplémentaires 9 à 13.- Ouvrez le fichier de résultats et le fichier Excel TemplateBRS (fichier supplémentaire 8). Copiez les données des colonnes suivantes à partir du fichier de résultats : (Pression)_BRS_deltaP, (Pression)_BRS_# et (Pression)_BRS_slope (Fichier supplémentaire 9). Collez les données dans les colonnes respectives des feuilles de calcul « Séquences hautes » et « Séquences bas » dans le fichier TemplateBRS (fichier supplémentaire 10). En outre, copiez les données de la colonne (pression_BRS_SBP à partir du fichier de résultats (fichier supplémentaire 11) et collez-les dans la feuille de calcul « Toutes les séquences » du fichier TemplateBRS (fichier supplémentaire 12).
Remarque : Le nombre dans la colonne (Pressure)_BRS_# est répertorié uniquement au dernier temps d’une séquence et représente la longueur de la séquence. Les séquences de haut en bas peuvent être distinguées par le signe de la valeur (Pression)_deltaP. Les valeurs négatives pour les deuxième et troisième temps d’une séquence à trois temps indiquent une séquence vers le bas. Les valeurs positives indiquent respectivement une séquence ascendante. - Filtrez les données copiées avec les paramètres de filtre par défaut. Cliquez sur l’icône de filtre de la colonne (Pressure)_BRS_# et appuyez sur « ok » (Fichier supplémentaire 13). Appliquez cette étape aux feuilles de calcul « Séquences hautes » et « Séquences bas ».
Remarque : La feuille de calcul filtre pour les séquences à trois temps. Si d’autres longueurs de séquence sont demandées, le paramètre de cette colonne doit être modifié dans le menu déroulant. Les calculs du nombre de séquences, de la pente moyenne du BRS, de l’écart-type et de l’erreur-type de la pente BRS sont affichés dans les encadrés verts des feuilles de calcul « Séquences vers le haut » et « Séquences vers le bas ». Les calculs pour le nombre total de séquences pour 1000 battements apparaissent dans la case verte de la feuille de calcul « Toutes les séquences ».
- Ouvrez le fichier de résultats et le fichier Excel TemplateBRS (fichier supplémentaire 8). Copiez les données des colonnes suivantes à partir du fichier de résultats : (Pression)_BRS_deltaP, (Pression)_BRS_# et (Pression)_BRS_slope (Fichier supplémentaire 9). Collez les données dans les colonnes respectives des feuilles de calcul « Séquences hautes » et « Séquences bas » dans le fichier TemplateBRS (fichier supplémentaire 10). En outre, copiez les données de la colonne (pression_BRS_SBP à partir du fichier de résultats (fichier supplémentaire 11) et collez-les dans la feuille de calcul « Toutes les séquences » du fichier TemplateBRS (fichier supplémentaire 12).
Résultats
Résultats positifs pour les données brutes ECG et BP
Grâce à ce protocole, des données ECG et PA de haute qualité peuvent être acquises (Figure 4 et Fichier supplémentaire 14), permettant non seulement une analyse précise du BRS, mais également l’analyse d’un large éventail de paramètres ECG ou dérivés de la PA, par exemple les intervalles ECG (Figure 4B, panneau supérieur), les paramètres de pression artérielle (Figure 4B, panneau inférieur), la fréquence cardiaque et la variabilité de la pression artérielle, Détection d’arythmie etc12,13,14,15.
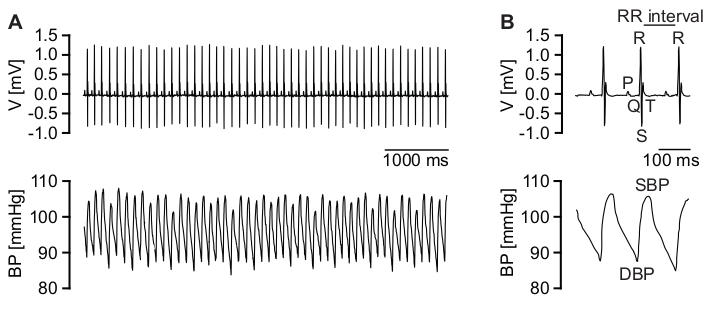
Figure 4: Enregistrements ECG télémétriques et PA. (A) Trace ECG représentative et de haute qualité (panneau supérieur) et enregistrements de PA bruts de haute qualité correspondants (panneau inférieur). (B) Grossissement des traces ECG (panneau supérieur). L’onde P, le complexe QRS, l’onde T et l’intervalle RR sont indiqués. Grossissement des données de PA correspondantes (panneau inférieur). La PA diastolique (PAD) et la PA systolique (PAS) sont indiquées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats positifs pour le rythme circadien
Une souris en bonne santé qui s’est suffisamment remise de la chirurgie montre une augmentation physiologique de l’activité, de la FC et de la PA pendant la phase d’activité (sombre) (Figure 5). De nombreux facteurs différents peuvent perturber ce rythme circadien régulier. Il s’agit notamment du stress psychologique, du bruit acoustique ou électrique et de la douleur. Par exemple, une douleur aiguë immédiatement après la chirurgie entraînerait une augmentation de la fréquence cardiaque avec une diminution simultanée de l’activité. Par conséquent, le rythme circadien est un indicateur important pour la santé et le bien-être des animaux et doit être systématiquement vérifié avant l’analyse BRS.
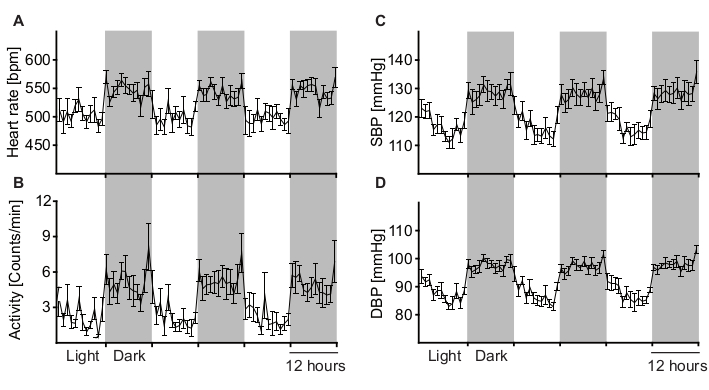
Figure 5 : Analyse des mesures de télémétrie à long terme pour déterminer les variations du rythme circadien. Le rythme circadien de la fréquence cardiaque (A), de l’activité (B), de la pression artérielle systolique (C) et de la pression artérielle diastolique (D) a été calculé en moyenne à partir de 9 souris mâles de type sauvage C57BL / 6J pendant 12 heures de cycles lumineux et sombres. Les zones grises représentent la phase d’activité (sombre) et les zones blanches représentent la phase de repos (lumière) des animaux. Tous les paramètres sont physiologiquement élevés pendant la phase d’activité (sombre) de l’animal. Les données sont représentées sous forme de moyenne +/- SEM. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats positifs pour l’analyse BRS
Après avoir effectué l’analyse décrite dans la section 2.8 du protocole, le logiciel détectera respectivement les séquences ascendantes et descendantes. La méthode utilisée est appelée méthode de séquence, car les changements dans les intervalles de TAS et de RR sont examinés sur une base battement à battement au cours de courtes séquences de trois battements ou plus avec une montée ou une baisse spontanée de la PAS (figure 6). Une élévation continue de la PAS sur trois battements cardiaques provoque une augmentation réflexe de l’activité parasympathique et, par conséquent, ralentit la FC, ce qui équivaut à des intervalles RR plus longs. La latence pour l’adaptation HR réflexe est d’un battement. Une telle séquence est représentée à la figure 6A et est définie comme une séquence ascendante. En revanche, une diminution continue de la PAS sur trois battements avec une augmentation parallèle de la FC (diminution de l’intervalle RR) est définie comme une séquence descendante (Figure 6B). Pour évaluer la corrélation entre RR et SBP, les deux paramètres sont tracés l’un par rapport à l’autre et la pente (ms/mmHg) de la droite de régression linéaire est calculée pour chaque séquence (figure 6A, B, panneaux inférieurs). Après tri par séquences ascendantes et descendantes, le nombre moyen de séquences pour 1000 battements (Figure 6C) et le gain moyen de BRS spontanés peuvent être calculés pour les séquences ascendantes et descendantes, respectivement (Figure 6D,E). Le gain de BRS spontané est reflété par la pente de la droite de régression linéaire calculée à partir de la relation RR/SBP. L’écart par rapport aux valeurs BRS normales peut avoir diverses causes. Il s’agit notamment de changements dans l’entrée de SNA ou de changements dans la réactivité du nœud sino-auriculaire à l’entrée du système nerveux autonome. Dans la figure 6, l’augmentation du BRS dans un modèle murin pour le syndrome du sinus malade (SSS) avec une réponse exagérée du nœud sino-auriculaire à l’entrée vagale est montrée11.
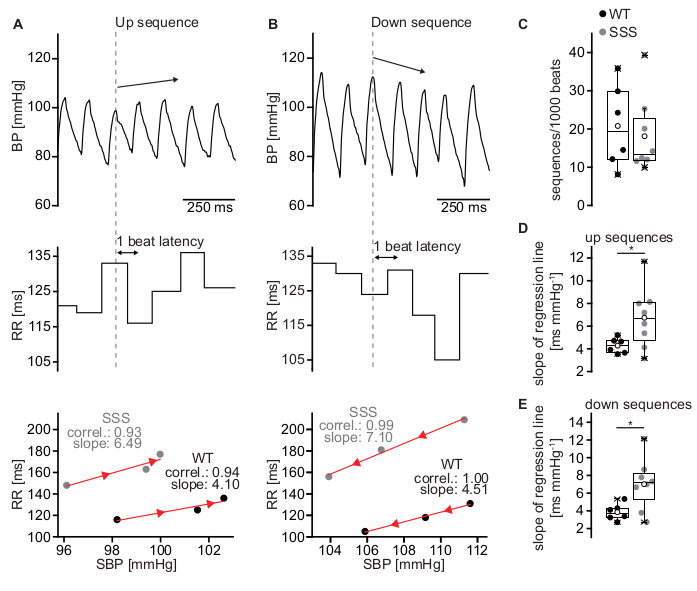
Figure 6 : Estimation des BRS à l’aide de la méthode séquentielle. (A) Trace représentative de la PA d’une souris C57BL/6J de type sauvage au cours d’une séquence ascendante de trois battements consécutifs (panneau supérieur) associée à une augmentation parallèle de l’intervalle RR (panneau central) qui équivaut à une diminution de la FC. Les intervalles RR ont été tracés par rapport au SBP (panneau inférieur). La pente de la droite de régression (ligne rouge) pour la séquence supérieure représentée dans les panneaux supérieur et central (WT, cercles noirs) était de 4,10 ms/mmHg. Une relation RR/SBP représentative du modèle murin du syndrome du sinus malade a donné une pente accrue de 6,49 ms/mmHg indiquant un BRS élevé (SSS, cercles gris). (B) Séquence descendante représentative d’une souris de type sauvage avec une baisse de la SBP (panneau supérieur) et une diminution subséquente de l’intervalle RR (panneau du milieu) qui donne une pente BRS de 4,51 ms/mmHg (panneau inférieur; WT, cercles noirs). Une relation RR/SBP représentative du modèle murin du syndrome du sinus malade (SSS, cercles gris) avec une pente de 7,10 ms/mmHg. L’orientation des pointes de flèches rouges indique la direction des séquences (séquence haut ou bas). (C) Nombre total de séquences pour 1000 battements pour les souris WT et SSS. (D) Pente moyenne de la relation RR/SBP pour les séquences up pour les souris WT et SSS. (E) Pente moyenne de la relation RR/SBP pour les séquences descendantes pour les souris WT et SSS. Des statistiques en (C-E) ont été réalisées à partir des résultats de six animaux WT mâles et de huit animaux mâles du modèle murin malade du syndrome du sinus. Les boxplots montrent la ligne médiane, perc 25/75 et la valeur min/max; Les symboles ouverts représentent la valeur moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultat négatif pour la qualité des données brutes
En particulier pendant les phases d’activité plus élevée, la qualité du signal peut diminuer (Figure 7 et fichiers supplémentaires 15,16). Cela peut être causé par un déplacement temporaire ou une position incorrecte du cathéter de PA ou des dérivations ECG ou des deux en raison du mouvement de l’animal. En outre, l’activité des muscles squelettiques peut être détectée à partir des dérivations ECG et induire du bruit (Figure 7B, panneau supérieur). Avec les paramètres logiciels décrits ci-dessus, ces battements de faible qualité ne sont pas détectés et sont donc exclus de l’analyse. Néanmoins, l’inspection manuelle des données brutes analysées est obligatoire.
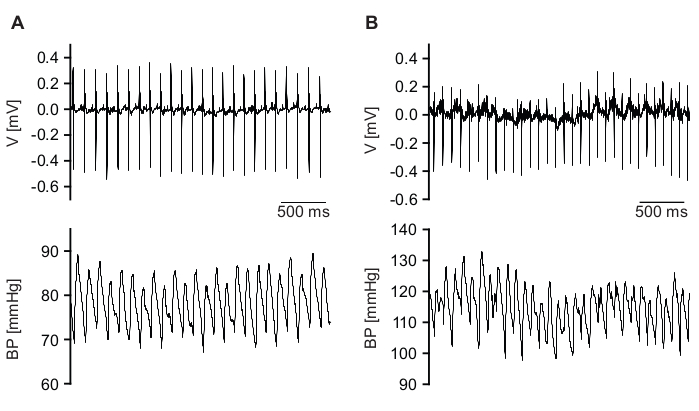
Figure 7 : Exemples de signaux bruts de mauvaise qualité. (A) Le signal ECG (panneau supérieur) est détecté avec une bonne qualité, mais la qualité du signal BP (panneau inférieur) est faible. (B) Les qualités du signal ECG (panneau supérieur) et BP (panneau inférieur) ne sont pas suffisantes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats négatifs pour l’analyse BRS
Les paramètres d’analyse BRS répertoriés dans la section 2.8.3 du protocole sont en général essentiels pour une détection rapide et correcte des séquences ascendantes et descendantes. Le coefficient de corrélation minimal pour la droite de régression est fixé à 0,75. La fixation de valeurs trop basses pour le coefficient de corrélation minimal entraîne de fausses détections de séquences qui ne reflètent pas l’activité baroréflexe mais résultent plutôt de battements arythmiques (Figure 8). Pour l’analyse BRS, seuls les épisodes avec un rythme sinusal stable doivent être analysés. Les battements ectopiques ou d’autres événements arythmiques, par exemple les pauses sinusales, peuvent être trouvés avec l’option VRC du logiciel d’analyse ECG et BP et doivent être invalidés.
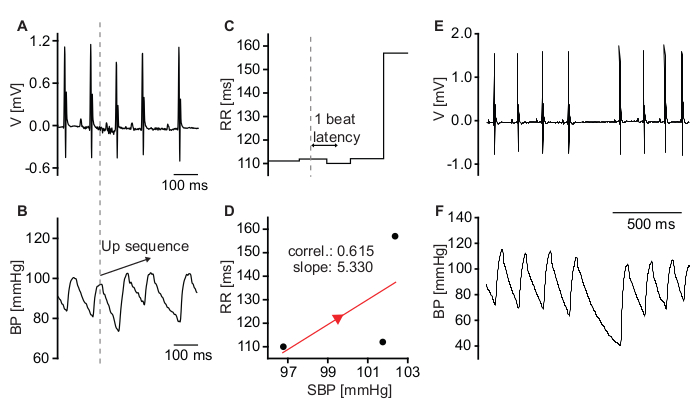
Figure 8 : Séquences ne reflétant pas l’activité baroréflexe. (A) Trace ECG d’une souris présentant une dysrythmie sinusale légère. (B) Enregistrement BP montrant une augmentation spontanée de la SBP. (C) Les intervalles RR correspondants indiquent une diminution de HR lors de l’augmentation de la PA. (D) Graphique de la SBP et intervalles RR correspondants. Le faible coefficient de corrélation de la droite de régression indique que la réduction de la HR n’a pas été causée par l’activité du baroréflexe mais plutôt par la dysrythmie sinusale. (E) Trace ECG brute représentant une pause sinusale. (F) Signal BP brut correspondant. La pause sinusale provoque une baisse de la pression artérielle diastolique. La pression artérielle systolique du battement suivant n’est presque pas affectée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dossier supplémentaire 1 : Protocole chirurgical. Modèle pour la documentation de l’intervention chirurgicale et des soins postopératoires. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 2 : Conversion des données Dataquest A.R.T en données IOX pour analyse dans le logiciel ecgAUTO. Sélectionnez les animaux dans la liste des sujets (à gauche) et Pression et ECG dans la liste des formes d’onde (à droite). Appuyez sur OK pour convertir les données. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 3 : paramètres ECG pour l’analyse BRS. Définissez les paramètres comme indiqué, appuyez sur OK et appliquez la configuration. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 4 : Paramètres de PA pour l’analyse BRS. Définissez les paramètres comme indiqué, appuyez sur OK et appliquez la configuration. Enregistrez la configuration en tant que fichier de configuration pour pouvoir charger facilement les paramètres. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 5 : Paramètres dans la fenêtre liste/vers le fichier pour les « sections ». Choisissez les sections à exporter sous les sections > en-tête txt (sélectionné) et appuyez sur Appliquer!. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 6 : Paramètres dans la fenêtre liste/vers le fichier pour les « étapes ». Choisissez les données d’étape à exporter sous les étapes > en-tête txt (sélectionné) et appuyez sur Appliquer!. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 7: Paramètres dans la fenêtre liste/vers le fichier pour « beats ». Choisissez les valeurs à exporter sous l’en-tête beats > txt (sélectionné) et appuyez sur Apply!. Pour l’analyse BRS, les paramètres cochés sont nécessaires. Notez l’ordre de sélection indiqué par les chiffres. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 8 : fichier de feuille de calcul TemplateBRS. Modèle de feuille de calcul pour le tri et l’analyse automatisés des séquences ascendantes et descendantes. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 9 : Copie des données pertinentes du fichier de résultats I. Copiez les colonnes (Pression)_BRS_deltaP, (Pression)_BRS_# et (Pression)_BRS_slope à partir du fichier de résultats. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 10 : Fichier modèle de feuille de calcul (TemplateBRS) pour le tri et l’analyse des données I. Collez les données copiées dans les colonnes respectives de la feuille de calcul « Séquences haut » et « Séquences vers le bas » dans le fichier de feuille de calcul TemplateBRS. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 11 : Copie des données pertinentes du fichier de résultats II. Copiez la colonne (Pression) _BRS_SBP à partir du fichier de résultats. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 12 : Un fichier modèle de feuille de calcul (TemplateBRS) pour le tri et l’analyse des données II. Collez les données SBP copiées dans la feuille de calcul « Toutes les séquences » du fichier de feuille de calcul TemplateBRS pour calculer le nombre total de séquences. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 13 : Filtrage et analyse des séquences. Dans la feuille de calcul « Hautes séquences » du fichier de feuille de calcul TemplateBRS, ouvrez le menu déroulant du filtre de colonne (Pressure)_BRS_# et appuyez sur OK sans modifier les paramètres. Cela triera automatiquement les données et mettra à jour les calculs pour les séquences à 3 temps. Répétez cette opération pour la feuille de calcul « Séquences vers le bas ». Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 14 : Capture d’écran d’un enregistrement de haute qualité détecté avec un logiciel d’analyse ECG et BP. La trace supérieure (ECG) montre la détection de chaque pic R et la trace inférieure (BP) montre la détection de chaque pic de pression diastolique (DP) et de pression systolique (SP). Les zones sous les pics détectés avec succès sont marquées en rouge. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 15 : Capture d’écran d’un enregistrement de PA de mauvaise qualité où les paramètres de PA ne sont que partiellement détectés. La trace supérieure (ECG) montre la détection de chaque pic R, mais la trace inférieure (BP) montre les écarts entre les pics de PA détectés. Les pics détectés de pression diastolique (DP) et de pression systolique (SP) sont marqués de zones rouges. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 16 : Capture d’écran d’un enregistrement ECG et BP de mauvaise qualité où les paramètres ECG et BP n’ont pas pu être détectés. La trace supérieure (ECG) montre une région (fond violet) où les paramètres ECG n’ont pas pu être détectés. La détection de la PA (trace inférieure) a également échoué en raison de la faible qualité du signal. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Importance de la méthode par rapport aux méthodes alternatives
Dans le présent travail, nous présentons un protocole détaillé pour quantifier les BRS spontanés en utilisant la méthode de séquence. Cette approche utilise des changements spontanés de PA et de HR réflexes mesurés par ECG et télémétrie BP. L’avantage de cette méthode est que les deux paramètres peuvent être enregistrés chez des animaux conscients, se déplaçant librement et sans retenue sans déranger les animaux en entrant dans la pièce où les mesures sont effectuées ou même par l’interaction physique requise pour l’injection de drogues. Ce point est très important car il a été clairement démontré que de telles perturbations interfèrent gravement avec les enregistrements HR et BP. Par exemple, l’injection de médicaments nécessite une fixation des souris, ce qui provoque une réponse maximale au stress qui augmente la FC jusqu’à 650-700 bpm. Pour contourner ces réponses au stress, BRS a déjà été déterminé chez des souris anesthésiées. Cependant, les anesthésiques standard utilisés en médecine vétérinaire tels que la kétamine/xylazine ou l’isoflurane induisent une bradycardie et influencent les réponses réflexes autonomes, limitant la validité de ces approches et l’interprétation des résultats. Pour surmonter partiellement ces limitations, des dispositifs implantables d’administration de médicaments, c’est-à-dire des pompes osmotiques, qui peuvent libérer des médicaments dans la cavité péritonéale, ont été utilisés. Cependant, avec les pompes osmotiques, il n’est pas possible d’appliquer un bolus d’une dose définie de médicament limitant l’application de tels dispositifs. Alternativement, cathéters de perfusion complexes17 peut être implanté chez la souris afin d’administrer des médicaments. Cependant, ces cathéters sont difficiles à manipuler et nécessitent des compétences chirurgicales comparables à celles requises pour l’implantation de dispositifs télémétriques, tout en produisant moins de résultats scientifiques que les mesures de BRS spontanées. Outre les problèmes techniques associés à la mesure du SRB à l’aide de l’injection de drogues, il existe certaines limites liées à l’action du médicament en soi. Les approches traditionnelles pour déterminer le BRS comprennent des injections en bolus de médicaments vasoactifs. Cependant, l’injection en bolus de vasoconstricteurs (par exemple, phényléphrine) ou de vasodilatateurs (par exemple, nitroprussiate de sodium) a été considérée comme un stimulus excessif et non physiologique pour l’adaptation réflexe HR aux changements de PA18. L’activité spontanée du réflexe barorécepteur peut également être quantifiée à l’aide de méthodes spectrales. L’une de ces méthodes évalue le BRS dans le domaine des fréquences en calculant le rapport entre les changements de HR et les changements de pression artérielle dans une bande de fréquences spécifique18,19. D’autres méthodes spectrales impliquent la détermination de la fonction de transfert de BP et HR ou la quantification de la cohérence entre BP et HR20,21. Ces méthodes nécessitent également l’acquisition télémétrique de paramètres spontanés de BP et HR et, bien qu’elles soient appropriées pour la détermination des BRS spontanés, elles nécessitent des outils de calcul intensifs et sont difficiles à appliquer. En outre, toutes les méthodes spectrales souffrent de la limitation que les signaux non stationnaires empêchent l’application de méthodes spectrales. En particulier, les pics spectraux induits par les rythmes respiratoires peuvent être réduits chez les patients humains en demandant au patient d’arrêter de respirer, ce qui n’est évidemment pas possible chez la souris. Par conséquent, le rapport signal sur bruit est souvent assez faible chez la souris. Compte tenu des limites des méthodes discutées ci-dessus, nous privilégions la méthode de séquence pour déterminer BRS chez la souris. Un avantage considérable de cette méthode est le fait qu’il s’agit d’une technique non invasive qui fournit des données sur le SRB spontané dans des conditions réelles.22. Un autre point important est que la durée des séquences analysées à l’aide de la méthode de séquence est assez courte, impliquant 3 à 5 battements. La régulation réflexe de la FC par le nerf vagal est très rapide et bien dans le délai de ces séquences. Par conséquent, la méthode de séquence est bien adaptée pour évaluer la contribution du nerf vagal au BRS. En revanche, la régulation par le système nerveux sympathique est beaucoup plus lente. En fait, au cours de ces courtes séquences, on peut supposer que l’activité du système nerveux sympathique est presque constante. Par conséquent, la méthode est personnalisée pour détecter sélectivement les changements réflexes de la FC entraînés par l’activité du nerf vague.
Interprétation des données BRS
Pour l’interprétation du dysfonctionnement BRS ou des données BRS en soi, il est important de considérer les niveaux fonctionnels individuels qui sont impliqués dans le réflexe barorécepteur. Au niveau neuronal, les composantes afférentes, centrales ou efférentes du réflexe peuvent être affectées23. Sur le plan cardiovasculaire, une réactivité réduite ou exagérée du nœud sino-auriculaire à l’entrée SNA pourrait être présente11,24. Un changement à chaque niveau pourrait entraîner des changements dans le SRB. Afin de disséquer si les mécanismes neuronaux et / ou cardiaques sont responsables des changements observés dans le BRS, la suppression de gènes cardiaques ou spécifiques aux neurones, des approches knock down ou d’édition de gènes pourraient être utilisées.
Étapes critiques du protocole
L’étape la plus sophistiquée et la plus critique de ce protocole est la préparation et la canulation de l’artère carotide gauche (étape 2.3). La tension de la suture d’occlusion caudale doit être suffisamment élevée pour arrêter complètement le flux sanguin avant la canulation. Sinon, même une petite fuite de sang pendant la canulation peut restreindre considérablement la visibilité ou même faire saigner la souris. La canulation devrait réussir dès la première tentative. Cependant, en cas d’échec de la première tentative, il est toujours possible de réessayer prudemment la canulation.
L’incision médiane et le tunnel sous-cutané du cou au flanc gauche (étape 2.3) doivent être suffisamment grands pour introduire facilement l’émetteur sans force, mais doivent également être aussi petits que possible pour maintenir l’émetteur en place. Sinon, il faudra le verrouiller en position avec un matériau de suture ou un adhésif tissulaire. Étant donné que les souris ont une peau très délicate, une nécrose de la peau peut survenir si le tunnel de l’émetteur est trop petit.
Si les électrodes ECG sont trop longues pour s’insérer dans le tunnel sous-cutané (étape 2.4), il est nécessaire de former une nouvelle pointe en raccourcissant l’électrode à une longueur appropriée. L’électrode doit reposer à plat contre le corps sur toute la longueur de la sonde. Des électrodes trop longues dérangeront les animaux et ils essaieront d’ouvrir la plaie pour enlever l’émetteur, ce qui entraînera un risque d’irritation des tissus et de déhiscence de la plaie. Les fils trop courts ne peuvent bien sûr pas être étendus et il se peut que, dans ce cas, les électrodes ne puissent pas être positionnées de manière à correspondre à la configuration Einthoven II. Nous recommandons donc de déterminer la longueur optimale des dérivations ECG sur une souris morte du même sexe, du même poids et du même bagage génétique.
Les souris doivent bénéficier d’un temps de récupération plus long après l’implantation de l’émetteur si elles n’ont pas un rythme circadien normal et que ce n’est pas le phénotype de la lignée de souris étudiée (étape 2.7). Une autre raison de la perturbation des rythmes circadiens pourrait être l’isolation acoustique inadéquate de l’animalerie ou du personnel entrant dans la salle pendant la mesure.
L’analyse des données ECG, BP et BRS est simple (étape 2.8). L’étape la plus critique consiste à exclure de l’analyse des données les battements ectopiques, les pauses sinusales, les épisodes arythmiques ou les sections avec des signaux de faible qualité.
Déclarations de divulgation
Aucun
Remerciements
Ce travail a été soutenu par la Fondation allemande pour la recherche [FE 1929/1-1 et WA 2597/3-1]. Nous remercions Sandra Dirschl pour son excellente assistance technique et Julia Rilling pour ses conseils vétérinaires.
matériels
| Name | Company | Catalog Number | Comments |
| Acepromazine maleate (Tranquisol KH) Solution Injectable 0.5 mg/mL | CP-Pharma, Germany | 1229 | anesthesia |
| B.Braun Injekt-F 1 mL syringe | Wolfram Droh GmbH, Germany | 9166017V | |
| Bepanthen eye and nose ointment | Bayer AG, Germany | ||
| Blunt dissecting scissors | Fine Science Tools GmbH, Germany | 14078-10 | |
| Carprofen (Carprosol) 50 mg/mL | CP-Pharma, Germany | 115 | preemptive and post-operative pain relief |
| Cutasept F skin desinfectant | BODE Chemie GmbH, Germany | 9803650 | |
| Cotton Tipped Applicator sterile | Paul Boettger GmbH & Co. KG, Germany | 09-119-9100 | |
| Forceps - Micro-Blunted Tips | Fine Science Tools GmbH, Germany | 11253-25 | |
| Forceps - straight | Fine Science Tools GmbH, Germany | 11008-13 | |
| Gauze swabs with cut edges, 7.5x7.5 cm, cotton | Paul Hartmann AG. Germany | 401723 | |
| HD?X11, Combined telemetric ECG and BP transmitters | Data Sciences International, United States | ||
| Homothermic blanket system with flexible probe | Harvard Apparatus, United States | ||
| Hot bead sterilizer | Fine Science Tools GmbH, Germany | 18000-45 | |
| Ketamine 10% | Ecuphar GmbH, Germany | 799-760 | anesthesia |
| Magnet | Data Sciences International, United States | transmitter turn on/off | |
| Needle holder, Olsen-Hegar with suture cutter | Fine Science Tools GmbH, Germany | 12502-12 | |
| Needle single use No. 17, 0.55 x 25 mm | Henke-Sass Wolf GmbH, Germany | 4710005525 | 24 G needle |
| Needle single use No. 20, 0.40 x 20 mm | Henke-Sass Wolf GmbH, Germany | 4710004020 | 27 G needle |
| Needle-suture combination, sterile, absorbable (6-0 USP, metric 0.7, braided) | Resorba Medical, Germany | PA10273 | lead fixation |
| Needle-suture combination, sterile, silk (5-0 USP, metric 1.5, braided) | Resorba Medical, Germany | 4023 | skin closure |
| OPMI 1FR pro, Dissecting microscope | Zeiss, Germany | ||
| Pilca depilatory mousse | Werner Schmidt Pharma GmbH, Germany | 6943151 | |
| PVP-Iodine hydrogel 10% | Ratiopharm, Germany | ||
| Ringer's lactate solution | B. Braun Melsungen AG, Germany | 401-951 | |
| Sensitive plasters, Leukosilk | BSN medical GmbH, Germany | 102100 | surgical tape |
| Sodium chloride solution 0.9% sterile Miniplasco Connect 5 ml | B. Braun Melsungen AG, Germany | ||
| Surgibond tissue adhesive | SMI, Belgium | ZG2 | |
| Suture, sterile, silk, non-needled (5-0 USP, metric 1 braided) | Resorba Medical, Germany | G2105 | lead preparation, ligation sutures |
| Trimmer, Wella Contura type 3HSG1 | Procter & Gamble | ||
| Vessel Cannulation Forceps | Fine Science Tools GmbH, Germany | 18403-11 | |
| Xylazine (Xylariem) 2% | Ecuphar GmbH, Germany | 797469 | anesthesia |
| Data acquisition and analysis | Source | ||
| DSI Data Exchange Matrix | Data Sciences International, United States | ||
| DSI Dataquest ART 4.33 | Data Sciences International, United States | data aquisition software | |
| DSI Ponemah | Data Sciences International, United States | data aquisition software | |
| DSI PhysioTel HDX-11 for mice | Data Sciences International, United States | ||
| DSI PhysioTel receivers RPC1 | Data Sciences International, United States | ||
| ecgAUTO v3.3.5.11 | EMKA Technologies | ECG and BP analysis software | |
| Microsoft Excel | Microsoft Corporation, United States |
Références
- Landgren, S. On the excitation mechanism of the carotid baroceptors. Acta Physiologica Scandinavica. 26 (1), 1-34 (1952).
- Heyman, C., Neil, E. Reflexogenic areas of the cardiovascular system. British Journal of Surgery. 46 (195), 92 (1958).
- Lu, Y., et al. The ion channel ASIC2 is required for baroreceptor and autonomic control of the circulation. Neuron. 64 (6), 885-897 (2009).
- Fadel, P. J., Raven, P. B. Human investigations into the arterial and cardiopulmonary baroreflexes during exercise. Experimental Physiology. 97 (1), 39-50 (2012).
- Nagura, S., Sakagami, T., Kakiichi, A., Yoshimoto, M., Miki, K. Acute shifts in baroreflex control of renal sympathetic nerve activity induced by REM sleep and grooming in rats. The Journal of Physiology. 558, 975-983 (2004).
- Crandall, C. G., Cui, J., Wilson, T. E. Effects of heat stress on baroreflex function in humans. Acta Physiologica Scandinavica. 177 (3), 321-328 (2003).
- Crandall, M. E., Heesch, C. M. Baroreflex control of sympathetic outflow in pregnant rats: effects of captopril. The American Journal of Physiology. 258 (6), 1417-1423 (1990).
- Mortara, A., et al. Arterial baroreflex modulation of heart rate in chronic heart failure: clinical and hemodynamic correlates and prognostic implications. Circulation. 96 (10), 3450-3458 (1997).
- La Rovere, M. T., Bigger, J. T., Marcus, F. I., Mortara, A., Schwartz, P. J. Baroreflex sensitivity and heart-rate variability in prediction of total cardiac mortality after myocardial infarction. ATRAMI (Autonomic Tone and Reflexes After Myocardial Infarction) Investigators. Lancet. 351 (9101), 478-484 (1998).
- Robinson, T. G., Dawson, S. L., Eames, P. J., Panerai, R. B., Potter, J. F. Cardiac baroreceptor sensitivity predicts long-term outcome after acute ischemic stroke. Stroke. 34 (3), 705-712 (2003).
- Fenske, S., et al. cAMP-dependent regulation of HCN4 controls the tonic entrainment process in sinoatrial node pacemaker cells. Nature Communications. 11 (1), 5555 (2020).
- Fenske, S., et al. Comprehensive multilevel in vivo and in vitro analysis of heart rate fluctuations in mice by ECG telemetry and electrophysiology. Nature Protocols. 11 (1), 61-86 (2016).
- Thireau, J., Zhang, B. L., Poisson, D., Babuty, D. Heart rate variability in mice: a theoretical and practical guide. Experimental Physiology. 93 (1), 83-94 (2008).
- Cesarovic, N., Jirkof, P., Rettich, A., Arras, M. Implantation of radiotelemetry transmitters yielding data on ECG, heart rate, core body temperature and activity in free-moving laboratory Mice. Journal of Visualized Experiments. (57), e3260 (2011).
- Alam, M. A., Parks, C., Mancarella, S. long-term blood pressure measurement in freely moving mice using telemetry. Journal of Visualized Experiments. (111), e53991 (2016).
- Optical and electrophysiological approaches to examine the role of cAMP-dependent regulation of the sinoatrial pacemaker channel HCN4. Dissertation, LMU Munich Available from: https://edoc.ub.uni-muenchen.de/24431/1/Brox_Verena.pdf (2019)
- Just, A., Faulhaber, J., Ehmke, H. Autonomic cardiovascular control in conscious mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 279 (6), 2214-2221 (2000).
- Parati, G., Di Rienzo, M., Mancia, G. How to measure baroreflex sensitivity: from the cardiovascular laboratory to daily life. Journal of Hypertension. 18 (1), 7-19 (2000).
- Robbe, H. W., et al. Assessment of baroreceptor reflex sensitivity by means of spectral analysis. Hypertension. 10 (5), 538-543 (1987).
- Pinna, G. D., Maestri, R., Raczak, G., La Rovere, M. T. Measuring baroreflex sensitivity from the gain function between arterial pressure and heart period. Clinical Science. 103 (1), 81-88 (2002).
- Pinna, G. D., Maestri, R. New criteria for estimating baroreflex sensitivity using the transfer function method. Medical and Biological Engineering and Computing. 40 (1), 79-84 (2002).
- Laude, D., Baudrie, V., Elghozi, J. L. Applicability of recent methods used to estimate spontaneous baroreflex sensitivity to resting mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 294 (1), 142-150 (2008).
- Ma, X., Abboud, F. M., Chapleau, M. W. Analysis of afferent, central, and efferent components of the baroreceptor reflex in mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 283 (5), 1033-1040 (2002).
- Fleming, S., et al. Impaired Baroreflex Function in Mice Overexpressing Alpha-Synuclein. Frontiers in Neurology. 4 (103), (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon