Method Article
Impianto combinato di ECG telemetrico e trasmettitori di pressione sanguigna per determinare la sensibilità baroriflessa spontanea in topi coscienti
In questo articolo
Riepilogo
Il baroriflesso è un meccanismo di regolazione della frequenza cardiaca da parte del sistema nervoso autonomo in risposta ai cambiamenti della pressione sanguigna. Descriviamo una tecnica chirurgica per impiantare trasmettitori di telemetria per la misurazione continua e simultanea dell'elettrocardiogramma e della pressione sanguigna nei topi. Questo può determinare la sensibilità baroriflessa spontanea, un importante marker prognostico per le malattie cardiovascolari.
Abstract
La pressione sanguigna (BP) e la frequenza cardiaca (HR) sono entrambe controllate dal sistema nervoso autonomo (ANS) e sono strettamente intrecciate a causa di meccanismi riflessi. Il baroriflesso è un meccanismo omeostatico chiave per contrastare i cambiamenti acuti a breve termine nella pressione arteriosa e per mantenere la pressione arteriosa in un intervallo fisiologico relativamente ristretto. La BP è rilevata dai barocettori situati nell'arco aortico e nel seno carotideo. Quando la pressione sanguigna cambia, i segnali vengono trasmessi al sistema nervoso centrale e vengono quindi comunicati ai rami parasimpatico e simpatico del sistema nervoso autonomo per regolare la FC. Un aumento della pressione arteriosa provoca una diminuzione riflessa della FC, una diminuzione della pressione arteriosa provoca un aumento riflesso della FC.
La sensibilità baroriflessa (BRS) è la relazione quantitativa tra i cambiamenti nella pressione arteriosa e i corrispondenti cambiamenti nella FC. Le malattie cardiovascolari sono spesso associate a una compromissione della funzione baroriflessa. In vari studi è stata riportata una riduzione della BRS, ad esempio in insufficienza cardiaca, infarto miocardico o malattia coronarica.
La determinazione della BRS richiede informazioni sia da BP che da HR, che possono essere registrate simultaneamente utilizzando dispositivi telemetrici. La procedura chirurgica è descritta a partire dall'inserimento del sensore di pressione nell'arteria carotide sinistra e dal posizionamento della sua punta nell'arco aortico per monitorare la pressione arteriosa seguita dal posizionamento sottocutaneo del trasmettitore e degli elettrodi ECG. Descriviamo anche la terapia intensiva postoperatoria e la gestione degli analgesici. Dopo un periodo di due settimane di recupero post-operatorio, le registrazioni ECG e BP a lungo termine vengono eseguite in topi coscienti e senza freni. Infine, includiamo esempi di registrazioni di alta qualità e l'analisi della sensibilità spontanea dei barocettori utilizzando il metodo della sequenza.
Introduzione
Il riflesso barocettore arterioso è il principale sistema di controllo del feedback nell'uomo che fornisce un controllo a breve termine - e forse anche a lungo termine 1,2 - della pressione arteriosa (ABP). Questo riflesso tampona le perturbazioni nella BP che si verificano in risposta a trigger fisiologici o ambientali. Fornisce rapidi cambiamenti riflessi nella frequenza cardiaca, nel volume dell'ictus e nella resistenza arteriosa periferica totale. Il riflesso ha origine nelle terminazioni nervose sensoriali nell'arco aortico e nei seni carotidei. Questi terminali nervosi costituiscono i barocettori arteriosi. I somati delle terminazioni nervose nell'arco aortico si trovano nel ganglio nodoso mentre quelli dei terminali nervosi nel seno carotideo si trovano nel ganglio petrosale. Il riflesso è innescato da un aumento della pressione sanguigna, che allunga e attiva i terminali nervosi barocettori (Figura 1A). L'attivazione provoca potenziali volée d'azione che vengono trasmesse centralmente attraverso il depressore aortico afferente e i nervi del seno carotideo ai nuclei del tronco cerebrale cardiovascolare come il nucleo del tratto solitario e il nucleo dorsale del nervo vagale. I cambiamenti nell'attività del nervo afferente a loro volta modulano l'attività efferente autonomica. L'aumento dell'attività dei nervi barocettori diminuisce simpatico e aumenta l'attività nervosa parasimpatica. Pertanto, le conseguenze dell'attivazione dei barocettori sono una riduzione della frequenza cardiaca, della gittata cardiaca e della resistenza vascolare che insieme contrastano e tamponano l'aumento della pressione sanguigna3. Al contrario, la diminuzione dell'attività dei nervi barocettori aumenta il simpatico e diminuisce l'attività del nervo parasimpatico, che aumenta la frequenza cardiaca, la gittata cardiaca e la resistenza vascolare e quindi contrasta la diminuzione della pressione sanguigna.
Numerosi studi su esseri umani e animali hanno dimostrato che il riflesso del barocettore può essere regolato in condizioni fisiologiche come l'esercizio4, il sonno5, lo stress da calore6 o la gravidanza7. Inoltre, ci sono prove che il baroriflesso è cronicamente compromesso nelle malattie cardiovascolari, come ipertensione, insufficienza cardiaca, infarto del miocardio e ictus. Infatti, la disfunzione baroriflessa è utilizzata anche come marcatore prognostico in diverse malattie cardiovascolari 8,9,10. Inoltre, la disfunzione del baroriflesso è presente anche nei disturbi dell'ANS. Data l'importanza del riflesso del barocettore per gli stati di salute e malattia, la stima in vivo di questo riflesso è una componente importante della ricerca autonomica e cardiovascolare con alcune gravi implicazioni cliniche.
Le linee genetiche di topo sono strumenti essenziali nella ricerca cardiovascolare. Gli studi in vivo di tali linee di topi forniscono preziose informazioni sulla fisiologia cardiovascolare e sulla fisiopatologia e in molti casi fungono da sistemi modello preclinici per le malattie cardiovascolari. Qui forniamo un protocollo per la registrazione telemetrica in vivo ECG e BP in topi coscienti, senza restrizioni e in movimento libero e descriviamo come la sensibilità baroriflessa può essere determinata da queste registrazioni utilizzando il metodo della sequenza (Figura 1B). Il metodo applicato è chiamato metodo di sequenza, perché la serie beat-to-beat degli intervalli di BP sistolica (SBP) e RR viene sottoposta a screening per brevi sequenze di tre o più battiti durante l'aumento o la diminuzione spontanea della SBP con adattamento riflesso dell'HR. Questo metodo è il gold standard per la determinazione della sensibilità baroriflessa poiché vengono studiati solo i meccanismi riflessi spontanei. La tecnica è superiore alle tecniche precedenti che prevedevano procedure invasive come l'iniezione di farmaci vasoattivi per indurre cambiamenti della BP.
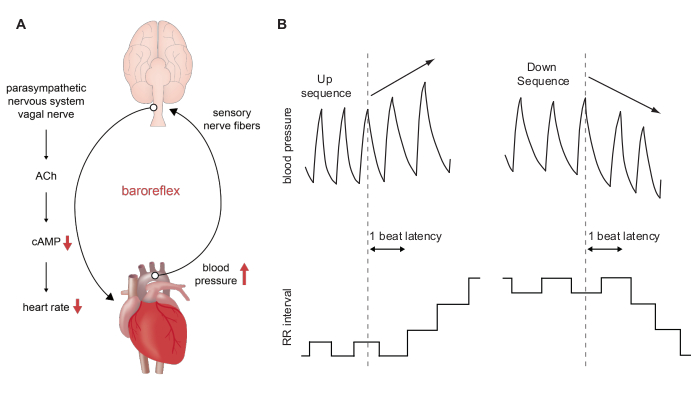
Figura 1: Rappresentazione schematica del baroriflesso e della valutazione della sensibilità baroriflessa utilizzando il metodo della sequenza . (A) Decorso del baroriflesso durante un aumento acuto della pressione sanguigna. Un aumento a breve termine dell'ABP è rilevato dai barocettori situati nell'arco aortico e nel seno carotideo. Questa informazione viene trasmessa al sistema nervoso centrale e induce una diminuzione dell'attività del nervo simpatico in parallelo con un aumento dell'attività parasimpatica. Il rilascio di acetilcolina dalle terminazioni nervose situate nella regione del nodo senoatriale induce una diminuzione del secondo messaggero cAMP nelle cellule pacemaker del nodo senoatriale e quindi una riduzione della frequenza cardiaca. Una diminuzione a breve termine della pressione sanguigna ha l'effetto opposto. (B) Tracce BP schematiche durante una sequenza su (pannello in alto a sinistra) e sequenza giù (pannello in alto a destra) di tre battiti consecutivi. Una sequenza up è associata a un aumento parallelo degli intervalli RR (pannello in basso a sinistra) che equivale a una diminuzione della FC. Una sequenza di down è associata a una diminuzione parallela degli intervalli RR (pannello in basso a destra) che equivale ad un aumento della FC. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
Eseguire tutti gli studi sugli animali in conformità con le linee guida istituzionali locali e le leggi nazionali sulla sperimentazione animale. Per questo esperimento, gli studi sono stati approvati dalla Regierung von Oberbayern ed erano conformi alle leggi tedesche sulla sperimentazione animale. Animali WT (sfondo C57BL/6J) e animali di un modello murino con sindrome del seno malato che mostrano una maggiore sensibilità BRS (Hcn4tm3 (Y527F; R669E; Per questo studio sono stati utilizzati T670A)Biel)11 (sfondo misto C57BL/6N e 129/SvJ).
1. Configurazione dell'attrezzatura
- Rimuovere un trasmettitore telemetrico dalla sua confezione sterile e accorciare i cavi ECG alla lunghezza appropriata per le dimensioni del mouse. Per un topo nero maschio di 12 settimane (C57BL / 6J), del peso di ~ 30 g, accorciare il piombo positivo (rosso) a una lunghezza di ~ 45 mm e il piombo negativo (incolore) a una lunghezza di ~ 40 mm usando le forbici.
NOTA: Questi valori sono indicati come orientamento e devono essere adattati secondo necessità (Figura 2). - Rimuovere circa 6 mm del tubo di silicone dell'elettrocatetere ECG utilizzando un bisturi per esporre il filo. Coprire le punte del filo con tubi eccessivi lasciando scoperta una porzione ~ 2 mm di filo ECG per registrare i segnali elettrici. Fissare il tubo in silicone con materiale di sutura di seta 5-0 non assorbibile (Figura 2A).
- Annotare il numero di serie del trasmettitore nel protocollo operativo (file supplementare 1).
- Idratare il trasmettitore in una soluzione calda e sterile di NaCl allo 0,9 %.
- Pesare il mouse e registrarne il peso.
- Autoclavare tutti gli strumenti chirurgici prima dell'intervento. Sterilizzarli durante l'intervento chirurgico e tra l'operazione di diversi animali a fuoco secco utilizzando uno sterilizzatore di perline di vetro caldo.
NOTA: Gli strumenti chirurgici devono raffreddarsi a temperatura ambiente prima dell'uso per prevenire ustioni cutanee. - Disinfettare il banco di lavoro per garantire condizioni asettiche.
2. Impianto chirurgico di trasmettitori telemetrici per misurazioni combinate di ECG e pressione arteriosa
- Dissezione dell'arteria carotide comune sinistra.
- Anestetizzare un topo mediante iniezione intraperitoneale di miscela di anestesia (100 mg/kg di ketamina; 15 mg/kg di xilazina; 1 mg/kg di acepromazina). Eseguire un test di pizzicamento del piede per assicurarsi che il topo sia completamente anestetizzato prima di iniziare l'intervento chirurgico.
- Utilizzare un trimmer per radere l'area chirurgica da sotto il mento verso i muscoli pettorali trasversali.
- Posizionare il mouse in posizione supina su una piastra chirurgica a temperatura controllata impostata a 37 °C. Fissare gli arti con nastro chirurgico e monitorare continuamente la temperatura corporea con un termometro rettale (Figura 2C). Se la temperatura corporea scende al di sotto di 37 °C, coprire il corpo dell'animale con una garza sterile di cotone durante l'intervento chirurgico.
- Applicare un unguento per gli occhi per proteggere gli occhi dell'animale durante l'anestesia.
- Applicare la crema depilatoria sull'area chirurgica precedentemente rasata. Rimuovere i capelli e la crema depilatoria con un batuffolo di cotone e acqua tiepida dopo 3-4 minuti. Assicurarsi che la pelle sia pulita e priva di peli residui e crema depilatoria, in modo che la ferita non venga contaminata durante l'operazione.
- Disinfettare la pelle con diversi cicli alternati di scrub povidone-iodio o clorexidina seguiti da alcool.
- Posizionare l'animale sotto un microscopio da dissezione e posizionare un drappo sterile intorno all'area chirurgica.
- Fare un'incisione della linea mediana di 1-1,5 cm attraverso la pelle del collo, iniziando immediatamente sotto il mento. Sforzati di rendere l'incisione il più dritta possibile. (Figura 2D).
NOTA: Durante le fasi successive, l'area chirurgica deve essere mantenuta umida mediante l'applicazione regolare di NaCl sterile, caldo (37 °C) allo 0,9 %. - Creare uno spazio sottocutaneo su entrambi i lati dell'incisione separando la pelle dal tessuto connettivo sottostante con forbici per dissezione smussata. Fare attenzione a non pizzicare la pelle troppo forte con la pinza, in quanto ciò può causare necrosi e portare a una compromissione della guarigione delle ferite dopo l'intervento chirurgico.
- Separare le ghiandole parotide e sottomandibolare utilizzando applicatori di punta di cotone per esporre la muscolatura sovrastante la trachea.
- Ritrarre la ghiandola salivare sinistra con una pinza da dissezione curva per identificare l'arteria carotide sinistra situata lateralmente alla trachea (Figura 2E).
- Sezionare attentamente l'arteria carotide dal tessuto adiacente usando una pinza curva. Fai molta attenzione a non ferire il nervo vagale che corre lungo la nave. Continuare la dissezione smussata per esporre l'arteria carotide sinistra a circa 10 mm di lunghezza e separarla completamente dalla fascia vascolare e dal nervo vago (Figura 2F).
- Passare una sutura di seta 5-0 non assorbibile sotto la porzione isolata dell'arteria carotide mentre si solleva leggermente il vaso sanguigno con una pinza curva per ridurre l'attrito tra la sutura e l'arteria carotide, poiché ciò potrebbe facilmente danneggiare la parete vascolare.
- Posizionare la sutura cranialmente, appena prossimalmente alla biforcazione dell'arteria carotide, formare un nodo e legarlo per legare permanentemente il vaso (Figura 2G). Fissare entrambe le estremità della sutura di occlusione cranica al tavolo operatorio con nastro chirurgico.
- Passare una seconda sutura di occlusione sotto l'arteria carotide e posizionarla caudalmente a ~ 5 mm di distanza dalla sutura cranica (Figura 2H). È necessario per l'occlusione temporanea del flusso sanguigno durante l'incannulamento dell'arteria. Pertanto, legare un nodo sciolto e fissare entrambe le estremità di sutura con nastro chirurgico.
- Posizionare una terza sutura (sutura sicura) tra la sutura di occlusione cranica e caudale e fare un nodo sciolto (Figura 2I). Questa sutura è necessaria per mantenere il catetere in posizione durante l'incannulamento dell'arteria. Fissare un'estremità della sutura sul tavolo operatorio.
- Incannulamento dell'arteria carotide comune sinistra.
NOTA: L'area del sensore del catetere per la pressione sanguigna si trova a 4 mm dall'estremità distale ed è costituita da un tubo contenente un fluido non comprimibile e un gel biocompatibile (Figura 2B). Poiché quest'area è molto sensibile, assicurarsi che sia priva di bolle d'aria e non toccarla in qualsiasi momento durante la procedura.- Piegare la punta di un ago da 24 G con un angolo di ~100° per utilizzarlo come introduttore del catetere.
- Tirare delicatamente la sutura di occlusione caudale e fissarla con tensione per interrompere temporaneamente il flusso sanguigno e sollevare leggermente l'arteria.
- Penetrare con attenzione l'arteria prossimale alla sutura di occlusione cranica con l'ago piegato (Figura 2J). Afferrare il catetere con una pinza per l'incannulamento dei vasi, introdurlo nella piccola puntura e lasciarlo scivolare lentamente nel vaso. Tirare delicatamente indietro l'ago piegato contemporaneamente (Figura 2K).
- Quando il catetere raggiunge l'occlusione caudale, stringere leggermente la sutura sicura per mantenere il catetere in posizione (Figura 2L).
- Allentare la sutura di occlusione caudale in modo che il catetere possa essere ulteriormente spostato fino a quando la sua punta non è posizionata nell'arco aortico.
NOTA: assicurarsi di determinare la lunghezza di inserimento corretta del catetere, poiché dipende dalle dimensioni del mouse. Per i topi maschi con un background C57BL / 6J a 12 settimane di età e ~ 30 g di peso corporeo, si consiglia di inserire il catetere fino a quando la tacca integrata raggiunge la sutura di occlusione cranica. La corretta profondità di inserimento e il posizionamento del catetere per la linea di topo specifica possono essere verificati dopo l'eutanasia dell'animale. - Una volta posizionato correttamente, fissare il catetere con tutte e tre le suture e tagliare le estremità il più corte possibile. Non tirare i nodi troppo stretti in quanto ciò potrebbe danneggiare il fragile catetere per la pressione sanguigna.
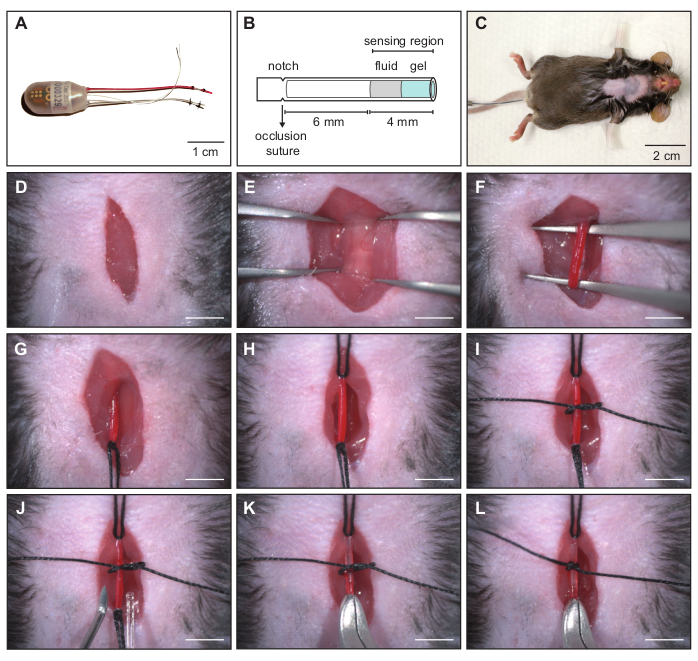
Figura 2: Impianto di un trasmettitore combinato di ECG e pressione sanguigna - incannulamento dell'arteria carotide sinistra . (A) Il trasmettitore di telemetria è composto da un catetere a pressione, due elettrodi biopotenziali e il corpo del dispositivo. (B) Rappresentazione schematica del catetere a pressione. L'area del sensore è costituita da un fluido non comprimibile e da un gel biocompatibile. Il catetere deve essere inserito nell'arteria carotide fino a quando la tacca è a livello della sutura di occlusione cranica per garantire la corretta posizione nel vaso sanguigno. (C) Topo C57BL/6J anestetizzato preparato per l'impianto chirurgico del trasmettitore. (D-L) Sequenza di immagini che mostra la procedura chirurgica per l'incannulamento dell'arteria carotide sinistra. (D) Incisione cutanea cervicale. (E) Trachea esposta per identificare l'arteria carotide sinistra situata lateralmente alla trachea. (F) Dissezione smussata per isolare l'arteria dal tessuto adiacente e dal nervo vago. (G) Legatura permanente dell'arteria carotide sinistra con sutura di occlusione cranica. (H) Tensione applicata alla sutura di occlusione caudale per arrestare temporaneamente il flusso sanguigno. (I) Sutura sicura per mantenere il catetere in posizione durante l'incannulamento. (J) Cannula con punta curva per l'inserimento del catetere nel vaso sanguigno. (K) Il catetere a pressione viene inserito nell'arteria carotide. (L) La punta del catetere è posizionata nell'arco aortico e il catetere fissato con la sutura media. La barra della scala in D - L mostra 4 mm. Ristampato da16. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Posizionamento del corpo del dispositivo di telemetria in una tasca sottocutanea sul fianco sinistro del mouse (Figura 3).
- Formare un tunnel sottocutaneo dal collo diretto verso il fianco sinistro dell'animale e formare una piccola sacca usando piccole forbici da dissezione smussate (Figura 3B).
- Irrigare il tunnel con una siringa da 1 mL riempita con una soluzione calda e sterile di NaCl allo 0,9% e introdurre ~300 μL della soluzione nella busta (Figura 3C).
- Sollevare con cautela la pelle con una pinza smussata e introdurre il corpo del dispositivo trasmettitore nella custodia (Figura 3D). Durante questo passaggio, fare molta attenzione a non estrarre il catetere per la pressione sanguigna dall'arteria carotide.
- Posizionamento delle derivazioni ECG in configurazione Einthoven II.
- Formare un tunnel sottile al muscolo pettorale destro con forbici da dissezione smussate e posizionare il piombo negativo (incolore) nel tunnel usando una pinza smussata. Fissare l'estremità terminale del piombo con un punto al muscolo pettorale utilizzando materiale di sutura riassorbibile 6-0 (Figura 3E).
- Formare un anello nel piombo positivo (rosso), posizionare la punta nella regione della costola caudale sinistra e fissare la sua posizione con una sutura utilizzando materiale di sutura riassorbibile 6-0.
NOTA: È importante che entrambi gli elettrocateteri siano appoggiati al corpo per tutta la loro lunghezza per evitare irritazioni tissutali (Figura 3F). - Chiudere la pelle con nodi singoli utilizzando materiale di sutura 5-0 non assorbibile (Figura 3H). Inoltre, applicare una piccola quantità di adesivo tissutale su ogni nodo per impedire all'animale di mordere la sutura e prevenire la deiscenza.
- Applicare povidone-iodio idrogel 10% sulla ferita per prevenire l'infezione della ferita durante la fase di recupero.
- Per alleviare il dolore preventivamente, iniettare 5 mg/kg di carprofen in 0,9% di NaCl per via sottocutanea mentre il topo è ancora sotto anestesia.
- Impostare una piattaforma di riscaldamento a 39 ± 1 °C e posizionare il mouse in una gabbia separata. Posizionare metà della gabbia sulla piattaforma per 12 ore dopo l'intervento chirurgico e trasferire il mouse nella zona calda. Quando l'animale si risveglia dall'anestesia, ha la possibilità di rimanere nella zona calda o di spostarsi nella parte più fredda della gabbia.
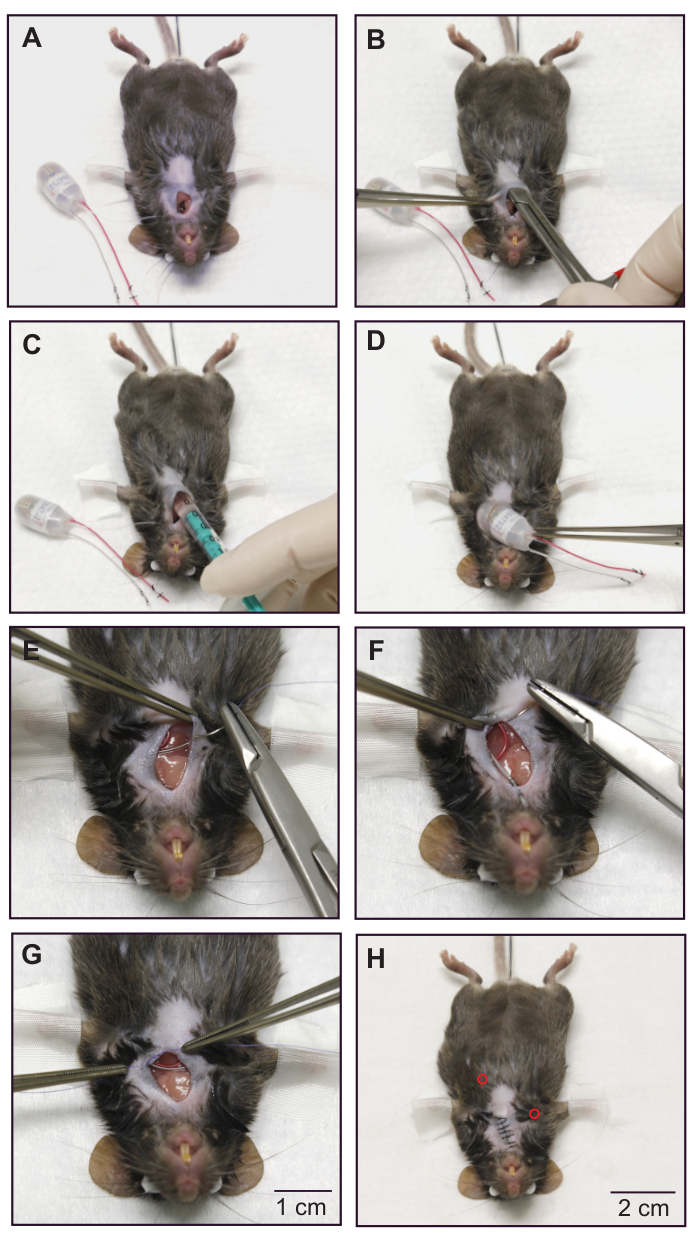
Figura 3: Impianto di un trasmettitore combinato di ECG e pressione sanguigna - posizionamento sottocutaneo degli elettrodi ECG e del corpo del dispositivo . (A) Mouse dopo l'inserimento del catetere per pressione sanguigna. La posizione del catetere è assicurata dalle suture di occlusione. (B) Formando una tasca sottocutanea sul fianco sinistro dell'animale con forbici smussate. (C) La sacca viene irrigata con ~300 μL di soluzione salina calda e sterile. (D) Il corpo del dispositivo è posto nella tasca sottocutanea. (E) L'estremità terminale dell'elettrodo negativo (incolore) è fissata al muscolo pettorale destro con materiale di sutura assorbibile. (F) Fissazione dell'elettrodo positivo (rosso) ai muscoli intercostali sinistri. (G) Posizionamento di una sutura permanente sul muscolo toracico per garantire la posizione degli elettrodi ECG. (H) Mouse dopo la chiusura della pelle. Le posizioni sottocutanee delle punte degli elettrodi ECG sono indicate da cerchi rossi. A scopo dimostrativo, un animale morto è stato utilizzato per scattare queste immagini. Si prega di seguire pratiche sterili durante l'utilizzo di un animale vivo. Ristampato dal16. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Assistenza post-operatoria
- Per alleviare il dolore post-operatorio iniettare 5 mg/kg di carprofene in NaCl allo 0,9% per via sottocutanea ogni 12 ore per 3-5 giorni fino a quando la ferita non è guarita.
- Iniettare 10 μL/g di soluzione calda di ringer-lattato per via intraperitoneale per proteggere l'animale dalla disidratazione.
- Lasciare che il mouse si riprenda per 2-3 settimane prima di eseguire le prime misurazioni telemetriche. Monitorare attentamente le condizioni generali di salute, la guarigione delle ferite, il peso corporeo e l'assunzione di cibo e acqua durante il periodo di recupero.
- Alla fine dell'esperimento, eutanasia del topo mediante inalazione di anidride carbonica (CO2).
NOTA: La dislocazione cervicale o la decapitazione non sono raccomandate come metodo di eutanasia poiché ciò potrebbe danneggiare parti del dispositivo trasmettitore ECG e BP.
- Acquisizione dati.
- Adottare misure per evitare il rumore acustico ed elettronico durante la registrazione dei dati. Inoltre, limitare l'accesso del personale durante la registrazione dei dati e completare tutte le procedure di allevamento prima dell'esperimento.
- Posizionare la gabbia dell'animale sulla piastra del ricevitore di telemetria e accendere il trasmettitore telemetrico avvicinando un magnete all'animale.
- Acquisisci ECG continuo, registrazione della pressione sanguigna e dell'attività nell'arco di 72 ore (ciclo buio/luce di 12 ore) con il software di acquisizione dati (Figura 4).
- Analisi del ritmo circadiano della frequenza cardiaca, della pressione sanguigna e dell'attività.
- Verificare la presenza di un ritmo circadiano regolare di HR, BP e attività utilizzando il software di acquisizione dati12 (Figura 5).
- Analisi dei dati, compresa la determinazione della sensibilità dei barocettori utilizzando il metodo di sequenza con software di analisi ECG e BP.
- Esportazione dei dati BP e HR dal software di acquisizione dati nel software di analisi ECG e BP (file supplementare 2). Utilizzare la seguente sequenza di comandi: Software di analisi ECG e BP aperto > File > Dati grezzi dal convertitore > Converti dati grezzi non IOX. Nella nuova finestra fare clic su File > Carica dati Dataquest ART4. Ancora una volta, si aprirà una nuova finestra, selezionare il file di dati per l'esportazione > si apre una nuova finestra, selezionare animale dall'elenco "soggetti" e selezionare ECG e BP da "elenco forme d'onda" e premere OK. Scegli gli animali da cui convertire i dati facendo clic su Converti dati > Crea file di sito binario IOX.
- Apri il file del sito binario IOX nel software di analisi ECG e BP utilizzando la seguente sequenza di comandi: File > Carica dati IOX > Selezionare la traccia BP ed ECG > premere il segno di spunta verde.
NOTA: I seguenti parametri di elaborazione dei dati sono ottimizzati per i dati acquisiti da topi wildtype e dovrebbero in linea di principio adattarsi a tutti i modelli murini utilizzati in campo preclinico. Tuttavia, l'adattamento di questi parametri potrebbe essere necessario quando si lavora con modelli sperimentali specifici, ad esempio topi con valori di HR e/o BP estremamente alti o bassi o diverse specie di roditori. In ogni caso, i parametri di elaborazione dei dati devono essere attentamente rivisti per garantire che si adattino al modello specifico in studio. - Per le impostazioni per l'analisi ECG, BP e BRS vedere il file supplementare 3,4. Per l'analisi BRS nei topi, regolare i parametri BRS per rilevare solo sequenze di tre (o più) battiti che mostrano un ritardo tra SBP e RR di un battito e impostare la soglia per la modifica di SBP e RR su 0,5 mmHg e 2 ms. Assicurarsi che il coefficiente di correlazione della pendenza della retta di regressione dai grafici RR/SBP sia maggiore di 0,75 e analizzare solo le sezioni che mostrano un ritmo sinusale stabile. Impostare i parametri per l'analisi ECG, BP e BRS di conseguenza utilizzando la seguente sequenza di comandi: Ottimizza le impostazioni di analisi > > si apre una nuova finestra
- Impostazioni ECG (fare clic con il pulsante destro del mouse nella finestra "Modalità ECG e filtraggio del segnale" (File supplementare 3)). Impostare i parametri come descritto qui. Modalità: ECG, solo RR, Modalità filtro: automatico, in base alla HR impostata, Frequenza cardiaca prevista: bpm > 300, Larghezza filtro rimozione valori basali (ms): 100,00, Larghezza filtro rimozione rumore: 1,00 ms, Filtro notch: 50,0 Hz, Filtro rimozione picchi: disattivato, Modalità di rilevamento drop-out: disattivato, Lunghezze massime RR (ms): 900,00, RR dai picchi R regolati: disattivato, modalità impostazioni RR_only: Xsmall: mouse, larghezza picco R (ms): 10.00, larghezza PR (ms): 20.00, larghezza RT (ms): 50.00, artefatto inter beat max (%): 50.00, rapporto di ampiezza R-altro: 3.00, segno di picco R: positivo e Parametro extra di calcolo: off
- Per le impostazioni della pressione sanguigna (BP, Impostazioni pressione) fare clic con il pulsante destro del mouse nella finestra "Analizzatore BP" (File supplementare 4). Impostare i parametri come descritto qui. Larghezza filtro rimozione rumore (ms): 10.00, Larghezza filtro derivato (ms): 6.00, Filtro notch: 50.0 Hz, Filtro rimozione picchi: off, Soglia di convalida (unità cal.): 12.00, Soglia di rifiuto (unità cal.): 8.00, Derivata all'inizio corsa (cal U/s): 10.00, Limiti di rifiuto: off, Ritardo dal riferimento ecg: finestra definita dall'utente, Ritardo minimo da ecg Rpeak (ms): 10.00, Ritardo max da ecg Rpeak (ms): 250.00, Conduct_time_1 dal segno: non calcolato, Conduct_time_2 dal segno: non calcolato, BR (frequenza respiratoria): off, BRS (sensibilità baroriflessa): on, Numero minimo di battiti consecutivi: 3, Numero di battiti di latenza: 1, Valore di pressione: SBP, Intervallo di impulso per il calcolo: R, Variazione minima di pressione (caIU): 0.50, Variazione minima dell'intervallo (ms): 2.00, Correlazione minima: 0.75
- Schermare il segnale di attività per una sequenza di 3 ore con bassa attività. Eseguire l'analisi BRS in questa finestra temporale poiché l'elevata attività degli animali interferisce con la correlazione BP e RR.
- Eseguire un'analisi BP e RR durante questa finestra temporale di 3 ore suddividendo l'analisi di 3 ore in passi di 10 minuti.
- Eseguire l'analisi BRS utilizzando la seguente sequenza di comandi: Apri la finestra Analisi BRS > Visualizza > Analisi BRS. Verrà aperto il pannello di analisi BRS. Ispeziona manualmente ogni sequenza visualizzata nel pannello di analisi BRS ed escludi battiti ectopici, pause sinusali, eventi aritmici o dati rumorosi. Assicurati di invalidare ogni singola battuta di tali sequenze per escluderle con successo dall'analisi.
- Esportare i risultati dell'analisi BRS in un file di foglio di calcolo (file dei risultati). Modificare i parametri esportati nel file del foglio di calcolo utilizzando la seguente sequenza di comandi (file supplementari 5-7):
- Ottimizzare > parametri nelle sezioni di > di list/to file > txt (file supplementare 5). Seleziona la sezione "beats" e qualsiasi altra sezione contenente informazioni di interesse tranne la sezione beats invalidata.
- Ottimizza > parametri in list/to file > passaggi > txt (file supplementare 6). Scegliere i valori del passo da esportare.
- Tune > Parameters in list/to file > beats -> txt (Supplemental File 7).
- Assicurati che la sezione beats del file contenga almeno i seguenti dati per ogni singola battuta. ECG_RR, ECG_HR, BP_SBP, BP_BRS_deltaP, BP_BRS_# (=intervalli di battiti consecutivi della sequenza), BP_BRS_slope, BP_BRS_correl, BP_BRS_shiftl (=RR della battuta successiva)
- Quindi fare clic su File > Salva file dei risultati.
- Ordinare i dati esportati per le sequenze su e giù utilizzando la funzione di filtro di Excel (file supplementare 8). Calcola separatamente il numero di sequenze, la pendenza media BRS, la deviazione standard e l'errore standard della pendenza BRS per le sequenze su e giù. Calcola anche la quantità totale di sequenze per 1000 battute.
NOTA: Un modello di foglio di calcolo (TemplateBRS) per l'ordinamento automatico e l'analisi delle sequenze su e giù è fornito nel supplemento (file supplementare 8) e facilita l'analisi. Regolando la funzione di filtro, è possibile ordinare le sequenze in base a diversi numeri di battuta (ad esempio, sequenze di tre o quattro battute). Per ulteriori dettagli vedere i file supplementari 9-13.- Aprire il file dei risultati e il file Excel TemplateBRS (file supplementare 8). Copiare i dati delle seguenti colonne dal file dei risultati: (Pressione)_BRS_deltaP, (Pressione)_BRS_# e (Pressione)_BRS_slope (File supplementare 9). Incollare i dati nelle rispettive colonne dei fogli di calcolo "Sequenze su" e "Sequenze giù" nel file TemplateBRS (file supplementare 10). Inoltre, copiare i dati della colonna (Pressione)_BRS_SBP dal file dei risultati (file supplementare 11) e incollarli nel foglio di calcolo "Tutte le sequenze" nel file TemplateBRS (file supplementare 12).
Nota : il numero nella colonna (Pressure)_BRS_# è elencato solo all'ultima battuta di una sequenza e rappresenta la lunghezza della sequenza. Le sequenze su e giù possono essere distinte dal segno del valore (Pressione_deltaP. I valori negativi per la seconda e la terza battuta di una sequenza di tre battute indicano una sequenza di discesa. I valori positivi indicano rispettivamente una sequenza up. - Filtrare i dati copiati con le impostazioni di filtro predefinite. Fare clic sull'icona del filtro della colonna (Pressure)_BRS_# e premere "ok" (file supplementare 13). Applica questo passaggio ai fogli di calcolo "Sequenze su" e "Sequenze giù".
NOTA: il foglio di calcolo filtra per le sequenze a tre battute. Se sono richieste altre lunghezze di sequenza, l'impostazione di questa colonna deve essere modificata nel menu a discesa. I calcoli per il numero di sequenze, la pendenza media BRS, la deviazione standard e l'errore standard della pendenza BRS vengono visualizzati nelle caselle verdi dei fogli di calcolo "Sequenze su" e "Sequenze giù". I calcoli per il numero totale di sequenze per 1000 battute vengono visualizzati nella casella verde del foglio di calcolo "Tutte le sequenze".
- Aprire il file dei risultati e il file Excel TemplateBRS (file supplementare 8). Copiare i dati delle seguenti colonne dal file dei risultati: (Pressione)_BRS_deltaP, (Pressione)_BRS_# e (Pressione)_BRS_slope (File supplementare 9). Incollare i dati nelle rispettive colonne dei fogli di calcolo "Sequenze su" e "Sequenze giù" nel file TemplateBRS (file supplementare 10). Inoltre, copiare i dati della colonna (Pressione)_BRS_SBP dal file dei risultati (file supplementare 11) e incollarli nel foglio di calcolo "Tutte le sequenze" nel file TemplateBRS (file supplementare 12).
Risultati
Risultati positivi per i dati grezzi ECG e BP
Utilizzando questo protocollo è possibile acquisire dati ECG e BP di alta qualità (Figura 4 e File supplementare 14), consentendo non solo un'analisi precisa della BRS, ma anche l'analisi di un'ampia gamma di parametri ECG o derivati dalla BP, ad esempio intervalli ECG (Figura 4B, pannello superiore), parametri della pressione sanguigna (Figura 4B, pannello inferiore), variabilità della frequenza cardiaca e della pressione sanguigna, rilevamento di aritmie ecc12,13,14,15.
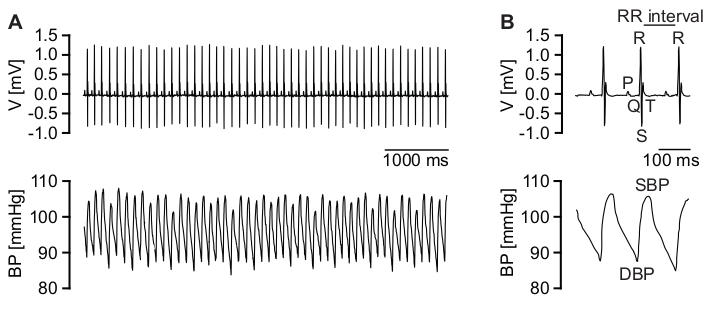
Figura 4: Registrazioni telemetriche ECG e BP. (A) Traccia ECG rappresentativa di alta qualità (pannello superiore) e corrispondenti registrazioni BP grezze di alta qualità (pannello inferiore). (B) Ingrandimento delle tracce ECG (pannello superiore). Sono indicati l'onda P, il complesso QRS, l'onda T e l'intervallo RR. Ingrandimento dei corrispondenti dati BP (pannello inferiore). Sono indicate la BP diastolica (DBP) e la BP sistolica (SBP). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati positivi per il ritmo circadiano
Un topo sano che si è sufficientemente ripreso dall'intervento chirurgico mostra un aumento fisiologico dell'attività, HR e BP durante la fase di attività (buio) (Figura 5). Molti fattori diversi possono disturbare questo ritmo circadiano regolare. Questi includono stress psicologico, rumore acustico o elettrico e dolore. Ad esempio, una condizione di dolore acuto immediatamente dopo l'intervento chirurgico comporterebbe un aumento della frequenza cardiaca con una diminuzione simultanea dell'attività. Pertanto, il ritmo circadiano è un indicatore importante per la salute e il benessere degli animali e deve essere controllato regolarmente prima dell'analisi BRS.
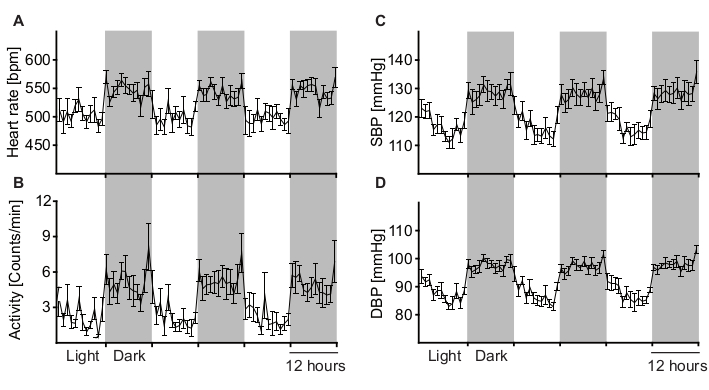
Figura 5: Analisi delle misure di telemetria a lungo termine per determinare le variazioni del ritmo circadiano. Il ritmo circadiano della frequenza cardiaca (A), dell'attività (B), della pressione arteriosa sistolica (C) e della pressione diastolica (D) è stato calcolato in media da 9 topi C57BL / 6J wild-type maschi durante i cicli di luce e buio di 12 ore. Le aree grigie rappresentano la fase di attività (scura) e le aree bianche rappresentano la fase di riposo (luce) degli animali. Tutti i parametri sono fisiologicamente elevati durante la fase di attività dell'animale (buio). I dati sono rappresentati come media +/- SEM. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati positivi per l'analisi BRS
Dopo aver eseguito l'analisi come descritto nella sezione 2.8 del protocollo, il software rileverà rispettivamente le sequenze su e giù. Il metodo utilizzato è chiamato metodo di sequenza poiché i cambiamenti negli intervalli SBP e RR sono esaminati su base beat-to-beat durante brevi sequenze di tre o più battiti con un aumento o una diminuzione spontanea di SBP (Figura 6). Un aumento continuo della SBP su tre battiti cardiaci provoca un aumento riflesso dell'attività parasimpatica e di conseguenza rallenta la FC, che equivale a intervalli RR più lunghi. La latenza per l'adattamento della reflex HR è di un battito. Tale sequenza è mostrata nella Figura 6A ed è definita come una sequenza up. Al contrario, una diminuzione continua della SBP su tre battiti con aumento parallelo della FC (diminuzione dell'intervallo RR) è definita come una sequenza di down (Figura 6B). Per valutare la correlazione tra RR e SBP, entrambi i parametri vengono tracciati l'uno contro l'altro e la pendenza (ms/mmHg) della linea di regressione lineare viene calcolata per ciascuna sequenza (Figura 6A,B, pannelli inferiori). Dopo l'ordinamento per sequenze su e giù, il numero medio di sequenze per 1000 battiti (Figura 6C) e il guadagno medio di BRS spontaneo possono essere calcolati rispettivamente per le sequenze su e giù (Figura 6D,E). Il guadagno di BRS spontaneo è riflesso dalla pendenza della retta di regressione lineare calcolata dalla relazione RR/SBP. La deviazione dai normali valori BRS può avere varie cause. Questi includono cambiamenti nell'input ANS o cambiamenti nella reattività del nodo senoatriale all'input del sistema nervoso autonomo. Nella Figura 6 è mostrato un aumento della BRS in un modello murino per la sindrome del seno malato (SSS) con una risposta esagerata del nodo senoatriale all'input vagale.
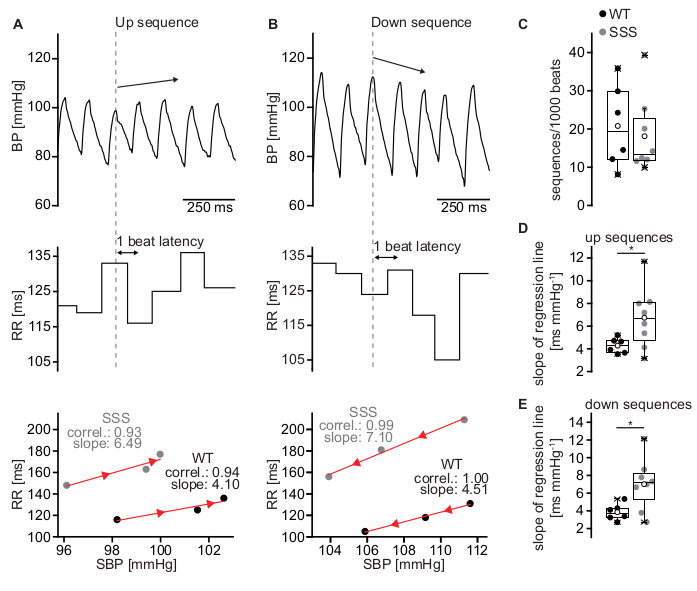
Figura 6: Stima del BRS utilizzando il metodo della sequenza. (A) Traccia BP rappresentativa di un topo wild-type C57BL/6J durante una sequenza up di tre battiti consecutivi (pannello superiore) associata ad un aumento parallelo dell'intervallo RR (pannello centrale) che equivale a una diminuzione della HR. Gli intervalli RR sono stati tracciati rispetto all'SBP (pannello inferiore). La pendenza della linea di regressione (linea rossa) per la sequenza verso l'alto raffigurata nel pannello superiore e centrale (WT, cerchi neri) era di 4,10 ms/mmHg. Una relazione rappresentativa RR/SBP del modello murino con sindrome del seno malato ha prodotto una pendenza aumentata di 6,49 ms/mmHg che indica BRS (SSS, cerchi grigi). (B) Sequenza di down rappresentativa di un topo wild-type con un calo di SBP (pannello superiore) e una successiva diminuzione dell'intervallo RR (pannello centrale) che si traduce in una pendenza BRS di 4,51 ms/mmHg (pannello inferiore; WT, cerchi neri). Una relazione rappresentativa RR/SBP del modello murino con sindrome del seno malato (SSS, cerchi grigi) con una pendenza di 7,10 ms/mmHg. L'orientamento delle punte delle frecce rosse indica la direzione delle sequenze (sequenza su o giù). (C) Quantità totale di sequenze per 1000 battiti per topi WT e SSS. (D) Pendenza media della relazione RR/SBP per le sequenze up per topi WT e SSS. (E) Pendenza media della relazione RR/SBP per le sequenze down per topi WT e SSS. Le statistiche in (C-E) sono state eseguite dai risultati di sei animali WT maschi e otto animali maschi del modello murino con sindrome del seno malato. I boxplot mostrano la linea mediana, perc 25/75 e il valore min/max; I simboli aperti rappresentano il valore medio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultato negativo per la qualità dei dati grezzi
Soprattutto durante le fasi di maggiore attività, la qualità del segnale potrebbe diminuire (Figura 7 e File supplementari 15,16). Ciò può essere causato da uno spostamento temporaneo o da una posizione errata del catetere BP o degli elettrocateteri ECG o di entrambi a causa del movimento dell'animale. Inoltre, l'attività del muscolo scheletrico potrebbe essere rilevata dagli elettrocateteri ECG e indurre rumore (Figura 7B, pannello superiore). Con le impostazioni software sopra descritte, questi battiti di bassa qualità non vengono rilevati e sono quindi esclusi dall'analisi. Tuttavia, l'ispezione manuale dei dati grezzi analizzati è obbligatoria.
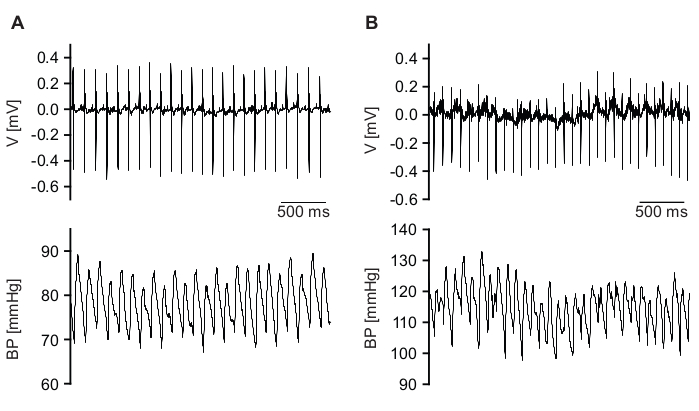
Figura 7: Esempi di segnali grezzi di bassa qualità. (A) Il segnale ECG (pannello superiore) viene rilevato con buona qualità, ma la qualità del segnale BP (pannello inferiore) è bassa. (B) Le qualità del segnale ECG (pannello superiore) e BP (pannello inferiore) non sono sufficienti. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati negativi per l'analisi BRS
Le impostazioni di analisi BRS elencate nella sezione 2.8.3 del protocollo sono in generale essenziali per il rilevamento rapido e corretto delle sequenze up e down. Il coefficiente di correlazione minimo per la linea di regressione è impostato su 0,75. L'impostazione di valori troppo bassi per il coefficiente di correlazione minimo provoca false rilevazioni di sequenze che non riflettono l'attività baroriflessa ma piuttosto derivano da battiti aritmici (Figura 8). Per l'analisi BRS devono essere analizzati solo gli episodi con ritmo sinusale stabile. I battiti ectopici o altri eventi aritmici, ad esempio le pause sinusali, possono essere trovati con l'opzione HRV del software di analisi ECG e BP e devono essere invalidati.
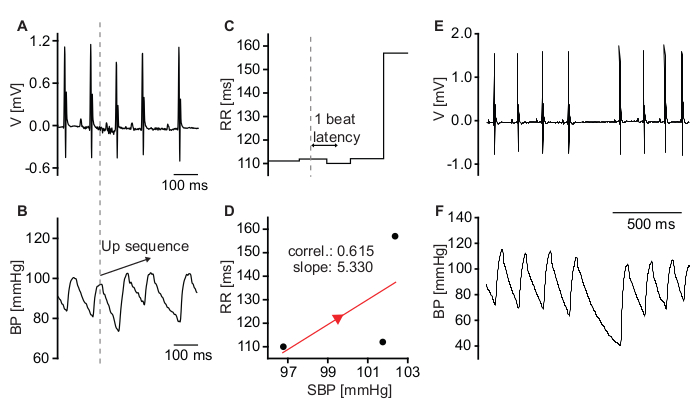
Figura 8: Sequenze che non riflettono l'attività baroriflessa . (A) Traccia ECG di un topo con lieve aritmia sinusale. (B) Registrazione BP che mostra un aumento spontaneo della SBP. (C) Gli intervalli RR corrispondenti indicano una diminuzione di HR all'aumento della BP. (D) Grafico di SBP e intervalli RR corrispondenti. Il basso coefficiente di correlazione della linea di regressione indica che la riduzione della HR non è stata causata dall'attività del baroriflesso ma piuttosto dalla aritmia sinusale. (E) Traccia ECG grezza raffigurante una pausa sinusale. (F) Segnale BP grezzo corrispondente. La pausa sinusale provoca un calo della pressione sanguigna diastolica. La pressione sanguigna sistolica del battito successivo è quasi inalterata. Fare clic qui per visualizzare una versione ingrandita di questa figura.
File supplementare 1: protocollo chirurgico. Modello per la documentazione della procedura chirurgica e delle cure post-operatorie. Clicca qui per scaricare questo file.
File supplementare 2: Conversione dei dati Dataquest A.R.T in dati IOX per l'analisi nel software ecgAUTO. Selezionare gli animali nell'elenco dei soggetti (a sinistra) e Pressione ed ECG nell'elenco delle forme d'onda (a destra). Premere OK per convertire i dati. Clicca qui per scaricare questo file.
File supplementare 3: impostazioni ECG per l'analisi BRS. Impostare i parametri come elencati, premere ok e applicare la configurazione. Clicca qui per scaricare questo file.
File supplementare 4: impostazioni BP per l'analisi BRS. Impostare i parametri come elencati, premere ok e applicare la configurazione. Salvare la configurazione come file di configurazione per poter caricare facilmente le impostazioni. Clicca qui per scaricare questo file.
File supplementare 5: Parametri nella finestra elenco/file per "sezioni". Scegliere le sezioni da esportare sotto l'intestazione sezioni > txt (selezionato) e premere Applica!. Clicca qui per scaricare questo file.
File supplementare 6: Parametri nella finestra elenco/file per "passi". Scegliere i dati dei passaggi da esportare sotto i passaggi >intestazione txt (selezionato) e premere Applica!. Clicca qui per scaricare questo file.
File supplementare 7: Parametri nella finestra elenco/file per "battute". Scegli i valori da esportare sotto l'intestazione beats > txt (selezionato) e premi Applica!. Per l'analisi BRS sono necessari i parametri contrassegnati. Notare l'ordine di selezione indicato dai numeri. Clicca qui per scaricare questo file.
File supplementare 8: file di foglio di calcolo TemplateBRS. Modello di foglio di calcolo per l'ordinamento automatico e l'analisi delle sequenze su e giù. Clicca qui per scaricare questo file.
File supplementare 9: Copia dei dati rilevanti dal file dei risultati I. Copiare le colonne (Pressione)_BRS_deltaP, (Pressione)_BRS_# e (Pressione)_BRS_slope dal file dei risultati. Clicca qui per scaricare questo file.
File supplementare 10: File modello di foglio di calcolo (TemplateBRS) per l'ordinamento e l'analisi dei dati I. Incolla i dati copiati nelle rispettive colonne del foglio di calcolo "Sequenze su" e "Sequenze giù" nel file del foglio di calcolo TemplateBRS. Clicca qui per scaricare questo file.
File supplementare 11: Copia dei dati rilevanti dal file dei risultati II. Copiare la colonna (Pressione)_BRS_SBP dal file dei risultati. Clicca qui per scaricare questo file.
Supplemental File 12: Un file modello di foglio di calcolo (TemplateBRS) per l'ordinamento e l'analisi dei dati II. Incolla i dati SBP copiati nel foglio di calcolo "Tutte le sequenze" nel file del foglio di calcolo TemplateBRS per calcolare il numero totale di sequenze. Clicca qui per scaricare questo file.
File supplementare 13: filtraggio e analisi delle sequenze. Nel foglio di calcolo "Up sequences" del file del foglio di calcolo TemplateBRS, aprire il menu a discesa del filtro di colonna (Pressure)_BRS_# e premere OK senza modificare alcun parametro. Questo ordinerà automaticamente i dati e aggiornerà i calcoli per le sequenze con 3 battute. Ripeti questa operazione per il foglio di calcolo "Sequenze giù". Clicca qui per scaricare questo file.
File supplementare 14: Screenshot di una registrazione di alta qualità rilevata con il software di analisi ECG e BP. La traccia superiore (ECG) mostra il rilevamento di ciascun picco R e la traccia inferiore (BP) mostra il rilevamento di ciascun picco di pressione diastolica (DP) e pressione sistolica (SP). Le aree sotto i picchi rilevati con successo sono contrassegnate in rosso. Clicca qui per scaricare questo file.
File supplementare 15: screenshot di una registrazione BP di bassa qualità in cui i parametri BP vengono rilevati solo parzialmente. La traccia superiore (ECG) mostra il rilevamento di ciascun picco R, ma la traccia inferiore (BP) mostra lacune tra i picchi BP rilevati. I picchi rilevati di pressione diastolica (DP) e pressione sistolica (SP) sono contrassegnati con aree rosse. Clicca qui per scaricare questo file.
File supplementare 16: Screenshot di una registrazione ECG e BP di bassa qualità in cui non è stato possibile rilevare i parametri ECG e BP. La traccia superiore (ECG) mostra una regione (sfondo viola) in cui non è stato possibile rilevare i parametri ECG. Anche il rilevamento BP (traccia inferiore) non è riuscito a causa della bassa qualità del segnale. Clicca qui per scaricare questo file.
Discussione
Significato del metodo rispetto ai metodi alternativi
Nel presente lavoro, presentiamo un protocollo dettagliato per quantificare la BRS spontanea usando il metodo della sequenza. Questo approccio utilizza cambiamenti spontanei della pressione arteriosa e dei riflessi HR misurati mediante ECG e telemetria BP. Il vantaggio di questo metodo è che entrambi i parametri possono essere registrati in animali coscienti, in movimento libero, senza freni agli animali camminando nella stanza in cui vengono eseguite le misurazioni o anche dall'interazione fisica richiesta per l'iniezione di farmaci. Questo punto è molto importante poiché è stato chiaramente dimostrato che tali disturbi interferiscono gravemente con le registrazioni HR e BP. Ad esempio, l'iniezione di farmaci richiede la fissazione dei topi, che provoca una risposta massima allo stress che aumenta la FC fino a 650-700 bpm. Per aggirare queste risposte allo stress, la BRS è stata precedentemente determinata nei topi anestetizzati. Tuttavia, gli anestetici standard utilizzati in medicina veterinaria come la ketamina/xilazina o l'isoflurano inducono bradicardia e influenzano le risposte riflesse autonomiche, limitando la validità di questi approcci e l'interpretazione dei risultati. Per superare parzialmente queste limitazioni sono stati utilizzati dispositivi impiantabili per la somministrazione di farmaci, cioè pompe osmotiche, che possono rilasciare farmaci nella cavità peritoneale. Tuttavia, con le pompe osmotiche non è possibile applicare un bolo di una dose definita di farmaco limitando l'applicazione di tali dispositivi. In alternativa, cateteri per infusione complessi17 può essere impiantato nei topi per somministrare farmaci. Tuttavia, questi cateteri sono difficili da maneggiare e richiedono competenze chirurgiche paragonabili a quelle richieste per l'impianto di dispositivi telemetrici, pur producendo risultati scientifici inferiori rispetto alle misurazioni di BRS spontanee. Oltre ai problemi tecnici associati alla misurazione della BRS mediante iniezione di farmaci, ci sono alcune limitazioni legate all'azione del farmaco di per sé. Gli approcci tradizionali per determinare la BRS includono iniezioni in bolo di farmaci vasoattivi. Tuttavia, l'iniezione in bolo di vasocostrittori (ad esempio, fenilefrina) o vasodilatatori (ad esempio, nitroprussiato di sodio) è stata considerata uno stimolo eccessivo e non fisiologico per l'adattamento riflesso della FC ai cambiamenti della BP.18. L'attività spontanea del riflesso del barocettore può anche essere quantificata usando metodi spettrali. Uno di questi metodi valuta la BRS nel dominio della frequenza calcolando il rapporto tra le variazioni della FC e le variazioni della pressione sanguigna in una specifica banda di frequenza.18,19. Altri metodi spettrali riguardano la determinazione della funzione di trasferimento di BP e HR o la quantificazione della coerenza tra BP e HR20,21. Questi metodi richiedono anche l'acquisizione telemetrica di parametri spontanei di BP e HR e, sebbene siano appropriati per la determinazione di BRS spontanei, richiedono strumenti computazionali intensivi e sono difficili da applicare. Inoltre, tutti i metodi spettrali soffrono della limitazione che i segnali non stazionari precludono l'applicazione di metodi spettrali. In particolare, i picchi spettrali indotti dai ritmi respiratori possono essere ridotti nei pazienti umani chiedendo al paziente di smettere di respirare, mentre questo non è ovviamente possibile nei topi. Pertanto, il rapporto segnale-rumore è spesso piuttosto basso nei topi. Date le limitazioni dei metodi discussi sopra, preferiamo il metodo di sequenza per determinare BRS nei topi. Un notevole vantaggio di questo metodo è il fatto che si tratta di una tecnica non invasiva che fornisce dati sulla BRS spontanea in condizioni di vita reale.22. Un altro punto importante è che la durata delle sequenze analizzate utilizzando il metodo della sequenza è piuttosto breve, coinvolgendo 3-5 battiti. La regolazione riflessa della FC da parte del nervo vagale è molto veloce e ben entro il lasso di tempo di queste sequenze. Pertanto, il metodo di sequenza è adatto per valutare il contributo del nervo vagale alla BRS. Al contrario, la regolazione da parte del sistema nervoso simpatico è molto più lenta. Infatti, durante queste brevi sequenze si può presumere che l'attività del sistema nervoso simpatico sia quasi costante. Pertanto, il metodo è personalizzato per rilevare selettivamente i cambiamenti riflessi della FC guidati dall'attività del nervo vago.
Interpretazione dei dati BRS
Per l'interpretazione della disfunzione BRS o dei dati BRS di per sé è importante considerare i singoli livelli funzionali che sono coinvolti nel riflesso del barocettore. A livello neuronale, le componenti afferenti, centrali o efferenti del riflesso potrebbero essere influenzate23. A livello cardiovascolare, la ridotta o esagerata reattività del nodo senoatriale all'input ANS potrebbe essere presente11,24. Un cambiamento ad ogni livello potrebbe portare a cambiamenti nel BRS. Al fine di analizzare se i meccanismi neuronali e / o cardiaci sono responsabili dei cambiamenti osservati nella BRS, potrebbero essere utilizzati approcci di eliminazione genica specifica cardiaca o neuronale, potrebbero essere utilizzati approcci di knock down o di modifica genetica.
Passaggi critici nel protocollo
Il passaggio più sofisticato e critico in questo protocollo è la preparazione e l'incannulamento dell'arteria carotide sinistra (Step 2.3). La tensione della sutura di occlusione caudale deve essere sufficientemente elevata da arrestare completamente il flusso sanguigno prima dell'incannulamento. Altrimenti, anche una piccola perdita di sangue durante l'incannulamento può limitare gravemente la visibilità o addirittura causare la morte del topo. L'incannulamento dovrebbe avere successo al primo tentativo. Tuttavia, al fallimento del primo tentativo, è ancora possibile riprovare attentamente l'incannulamento.
L'incisione della linea mediana e il tunnel sottocutaneo dal collo al fianco sinistro (Passo 2.3) devono essere abbastanza grandi da introdurre facilmente il trasmettitore senza forza, ma devono anche essere il più piccoli possibile per mantenere il trasmettitore in posizione. Altrimenti, sarà necessario bloccarlo in posizione con materiale di sutura o adesivo tissutale. Poiché i topi hanno una pelle molto delicata, la necrosi della pelle può verificarsi se il tunnel per il trasmettitore è troppo piccolo.
Se gli elettrodi ECG sono troppo lunghi per entrare nel tunnel sottocutaneo (Passo 2.4), è necessario formare una nuova punta accorciando l'elettrodo ad una lunghezza adeguata. L'elettrodo deve essere appoggiato al corpo per tutta la lunghezza del cavo. Elettrodi troppo lunghi disturberanno gli animali e cercheranno di aprire la ferita per rimuovere il trasmettitore, con conseguente rischio di irritazione dei tessuti e deiscenza della ferita. I cavi troppo corti non possono ovviamente essere estesi e può darsi che in questo caso gli elettrodi non possano essere posizionati in modo tale da corrispondere alla configurazione Einthoven II. Si consiglia quindi di determinare la lunghezza ottimale degli elettrocateteri ECG su un topo morto dello stesso sesso, peso e background genetico.
Ai topi deve essere dato un tempo di recupero più lungo dopo l'impianto del trasmettitore se non hanno un ritmo circadiano normale e questo non è il fenotipo della linea murina in studio (fase 2.7). Un altro motivo per i ritmi circadiani disturbati potrebbe essere l'isolamento acustico inadeguato della struttura animale o del personale che entra nella stanza durante la misurazione.
L'analisi dei dati ECG, BP e BRS è semplice (Fase 2.8). Il passo più critico è escludere dall'analisi dei dati i battiti ectopici, le pause sinusali, gli episodi aritmici o le sezioni con segnali di bassa qualità.
Divulgazioni
Nessuno
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fondazione tedesca per la ricerca [FE 1929/1-1 e WA 2597/3-1]. Ringraziamo Sandra Dirschl per l'eccellente assistenza tecnica e Julia Rilling per i consigli veterinari.
Materiali
| Name | Company | Catalog Number | Comments |
| Acepromazine maleate (Tranquisol KH) Solution Injectable 0.5 mg/mL | CP-Pharma, Germany | 1229 | anesthesia |
| B.Braun Injekt-F 1 mL syringe | Wolfram Droh GmbH, Germany | 9166017V | |
| Bepanthen eye and nose ointment | Bayer AG, Germany | ||
| Blunt dissecting scissors | Fine Science Tools GmbH, Germany | 14078-10 | |
| Carprofen (Carprosol) 50 mg/mL | CP-Pharma, Germany | 115 | preemptive and post-operative pain relief |
| Cutasept F skin desinfectant | BODE Chemie GmbH, Germany | 9803650 | |
| Cotton Tipped Applicator sterile | Paul Boettger GmbH & Co. KG, Germany | 09-119-9100 | |
| Forceps - Micro-Blunted Tips | Fine Science Tools GmbH, Germany | 11253-25 | |
| Forceps - straight | Fine Science Tools GmbH, Germany | 11008-13 | |
| Gauze swabs with cut edges, 7.5x7.5 cm, cotton | Paul Hartmann AG. Germany | 401723 | |
| HD?X11, Combined telemetric ECG and BP transmitters | Data Sciences International, United States | ||
| Homothermic blanket system with flexible probe | Harvard Apparatus, United States | ||
| Hot bead sterilizer | Fine Science Tools GmbH, Germany | 18000-45 | |
| Ketamine 10% | Ecuphar GmbH, Germany | 799-760 | anesthesia |
| Magnet | Data Sciences International, United States | transmitter turn on/off | |
| Needle holder, Olsen-Hegar with suture cutter | Fine Science Tools GmbH, Germany | 12502-12 | |
| Needle single use No. 17, 0.55 x 25 mm | Henke-Sass Wolf GmbH, Germany | 4710005525 | 24 G needle |
| Needle single use No. 20, 0.40 x 20 mm | Henke-Sass Wolf GmbH, Germany | 4710004020 | 27 G needle |
| Needle-suture combination, sterile, absorbable (6-0 USP, metric 0.7, braided) | Resorba Medical, Germany | PA10273 | lead fixation |
| Needle-suture combination, sterile, silk (5-0 USP, metric 1.5, braided) | Resorba Medical, Germany | 4023 | skin closure |
| OPMI 1FR pro, Dissecting microscope | Zeiss, Germany | ||
| Pilca depilatory mousse | Werner Schmidt Pharma GmbH, Germany | 6943151 | |
| PVP-Iodine hydrogel 10% | Ratiopharm, Germany | ||
| Ringer's lactate solution | B. Braun Melsungen AG, Germany | 401-951 | |
| Sensitive plasters, Leukosilk | BSN medical GmbH, Germany | 102100 | surgical tape |
| Sodium chloride solution 0.9% sterile Miniplasco Connect 5 ml | B. Braun Melsungen AG, Germany | ||
| Surgibond tissue adhesive | SMI, Belgium | ZG2 | |
| Suture, sterile, silk, non-needled (5-0 USP, metric 1 braided) | Resorba Medical, Germany | G2105 | lead preparation, ligation sutures |
| Trimmer, Wella Contura type 3HSG1 | Procter & Gamble | ||
| Vessel Cannulation Forceps | Fine Science Tools GmbH, Germany | 18403-11 | |
| Xylazine (Xylariem) 2% | Ecuphar GmbH, Germany | 797469 | anesthesia |
| Data acquisition and analysis | Source | ||
| DSI Data Exchange Matrix | Data Sciences International, United States | ||
| DSI Dataquest ART 4.33 | Data Sciences International, United States | data aquisition software | |
| DSI Ponemah | Data Sciences International, United States | data aquisition software | |
| DSI PhysioTel HDX-11 for mice | Data Sciences International, United States | ||
| DSI PhysioTel receivers RPC1 | Data Sciences International, United States | ||
| ecgAUTO v3.3.5.11 | EMKA Technologies | ECG and BP analysis software | |
| Microsoft Excel | Microsoft Corporation, United States |
Riferimenti
- Landgren, S. On the excitation mechanism of the carotid baroceptors. Acta Physiologica Scandinavica. 26 (1), 1-34 (1952).
- Heyman, C., Neil, E. Reflexogenic areas of the cardiovascular system. British Journal of Surgery. 46 (195), 92 (1958).
- Lu, Y., et al. The ion channel ASIC2 is required for baroreceptor and autonomic control of the circulation. Neuron. 64 (6), 885-897 (2009).
- Fadel, P. J., Raven, P. B. Human investigations into the arterial and cardiopulmonary baroreflexes during exercise. Experimental Physiology. 97 (1), 39-50 (2012).
- Nagura, S., Sakagami, T., Kakiichi, A., Yoshimoto, M., Miki, K. Acute shifts in baroreflex control of renal sympathetic nerve activity induced by REM sleep and grooming in rats. The Journal of Physiology. 558, 975-983 (2004).
- Crandall, C. G., Cui, J., Wilson, T. E. Effects of heat stress on baroreflex function in humans. Acta Physiologica Scandinavica. 177 (3), 321-328 (2003).
- Crandall, M. E., Heesch, C. M. Baroreflex control of sympathetic outflow in pregnant rats: effects of captopril. The American Journal of Physiology. 258 (6), 1417-1423 (1990).
- Mortara, A., et al. Arterial baroreflex modulation of heart rate in chronic heart failure: clinical and hemodynamic correlates and prognostic implications. Circulation. 96 (10), 3450-3458 (1997).
- La Rovere, M. T., Bigger, J. T., Marcus, F. I., Mortara, A., Schwartz, P. J. Baroreflex sensitivity and heart-rate variability in prediction of total cardiac mortality after myocardial infarction. ATRAMI (Autonomic Tone and Reflexes After Myocardial Infarction) Investigators. Lancet. 351 (9101), 478-484 (1998).
- Robinson, T. G., Dawson, S. L., Eames, P. J., Panerai, R. B., Potter, J. F. Cardiac baroreceptor sensitivity predicts long-term outcome after acute ischemic stroke. Stroke. 34 (3), 705-712 (2003).
- Fenske, S., et al. cAMP-dependent regulation of HCN4 controls the tonic entrainment process in sinoatrial node pacemaker cells. Nature Communications. 11 (1), 5555 (2020).
- Fenske, S., et al. Comprehensive multilevel in vivo and in vitro analysis of heart rate fluctuations in mice by ECG telemetry and electrophysiology. Nature Protocols. 11 (1), 61-86 (2016).
- Thireau, J., Zhang, B. L., Poisson, D., Babuty, D. Heart rate variability in mice: a theoretical and practical guide. Experimental Physiology. 93 (1), 83-94 (2008).
- Cesarovic, N., Jirkof, P., Rettich, A., Arras, M. Implantation of radiotelemetry transmitters yielding data on ECG, heart rate, core body temperature and activity in free-moving laboratory Mice. Journal of Visualized Experiments. (57), e3260 (2011).
- Alam, M. A., Parks, C., Mancarella, S. long-term blood pressure measurement in freely moving mice using telemetry. Journal of Visualized Experiments. (111), e53991 (2016).
- Optical and electrophysiological approaches to examine the role of cAMP-dependent regulation of the sinoatrial pacemaker channel HCN4. Dissertation, LMU Munich Available from: https://edoc.ub.uni-muenchen.de/24431/1/Brox_Verena.pdf (2019)
- Just, A., Faulhaber, J., Ehmke, H. Autonomic cardiovascular control in conscious mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 279 (6), 2214-2221 (2000).
- Parati, G., Di Rienzo, M., Mancia, G. How to measure baroreflex sensitivity: from the cardiovascular laboratory to daily life. Journal of Hypertension. 18 (1), 7-19 (2000).
- Robbe, H. W., et al. Assessment of baroreceptor reflex sensitivity by means of spectral analysis. Hypertension. 10 (5), 538-543 (1987).
- Pinna, G. D., Maestri, R., Raczak, G., La Rovere, M. T. Measuring baroreflex sensitivity from the gain function between arterial pressure and heart period. Clinical Science. 103 (1), 81-88 (2002).
- Pinna, G. D., Maestri, R. New criteria for estimating baroreflex sensitivity using the transfer function method. Medical and Biological Engineering and Computing. 40 (1), 79-84 (2002).
- Laude, D., Baudrie, V., Elghozi, J. L. Applicability of recent methods used to estimate spontaneous baroreflex sensitivity to resting mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 294 (1), 142-150 (2008).
- Ma, X., Abboud, F. M., Chapleau, M. W. Analysis of afferent, central, and efferent components of the baroreceptor reflex in mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 283 (5), 1033-1040 (2002).
- Fleming, S., et al. Impaired Baroreflex Function in Mice Overexpressing Alpha-Synuclein. Frontiers in Neurology. 4 (103), (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon