Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Construction de microélectrodes de potentiel de champ local pour des enregistrements in vivo à partir de plusieurs structures cérébrales simultanément
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le présent protocole décrit la construction de réseaux de microélectrodes sur mesure pour enregistrer les potentiels de champ local in vivo à partir de plusieurs structures cérébrales simultanément.
Résumé
Les chercheurs ont souvent besoin d’enregistrer simultanément les potentiels de champ local (LFP) de plusieurs structures cérébrales. L’enregistrement à partir de plusieurs régions cérébrales souhaitées nécessite différentes conceptions de microélectrodes, mais les réseaux de microélectrodes disponibles dans le commerce n’offrent souvent pas une telle flexibilité. Ici, le présent protocole décrit la conception simple de réseaux de microélectrodes sur mesure pour enregistrer des LFP de plusieurs structures cérébrales simultanément à différentes profondeurs. Ce travail décrit la construction des microélectrodes bilatérales corticales, striatales, thalamiques ventrolatérales et nigrales à titre d’exemple. Le principe de conception décrit offre de la flexibilité, et les microélectrodes peuvent être modifiées et personnalisées pour enregistrer les LFP de n’importe quelle structure en calculant les coordonnées stéréotaxiques et en modifiant rapidement la construction en conséquence pour cibler différentes régions du cerveau chez des souris en mouvement libre ou anesthésiées. L’assemblage de microélectrodes nécessite des outils et des fournitures standard. Ces réseaux de microélectrodes personnalisés permettent aux chercheurs de concevoir facilement des réseaux de microélectrodes dans n’importe quelle configuration pour suivre l’activité neuronale, fournissant des enregistrements LFP avec une résolution de l’ordre de la milliseconde.
Introduction
Les potentiels de champ local (LFP) sont les potentiels électriques enregistrés à partir de l’espace extracellulaire dans le cerveau. Ils sont générés par des déséquilibres de concentration d’ions en dehors des neurones et représentent l’activité d’une petite population localisée de neurones, permettant de surveiller avec précision l’activité d’une région spécifique du cerveau par rapport aux enregistrements EEG à l’échelle macro1. À titre d’estimation, les microélectrodes LFP séparées par 1 mm correspondent à deux populations de neurones complètement différentes. Alors que le signal EEG est filtré par le tissu cérébral, le liquide céphalo-rachidien, le crâne, les muscles et la peau, le signal LFP est un marqueur fiable de l’activité neuronale locale1.
Les chercheurs ont souvent besoin d’enregistrer simultanément des LFP à partir de plusieurs structures cérébrales, mais les réseaux de microélectrodes disponibles dans le commerce n’offrent souvent pas une telle flexibilité. Ici, le présent protocole décrit des microélectrodes entièrement personnalisables et faciles à construire pour enregistrer simultanément des LFP de n’importe quelle région cérébrale souhaitée à différentes profondeurs. Bien que les LFP aient été largement utilisés pour enregistrer l’activité neuronale d’une région spécifique du cerveau 2,3,4,5,6,7,8,9, la conception actuelle facilement personnalisable permet d’enregistrer des LFP à partir de plusieurs régions cérébrales superficielles ou profondes 11,12 . Le protocole peut également être modifié pour construire n’importe quel réseau de microélectrodes souhaité en déterminant les coordonnées stéréotaxiques des régions du cerveau et en assemblant le réseau en conséquence. Ces microélectrodes avec un taux d’échantillonnage de 10 kHz et une résistance de 60-70 kΩ (longueur de 2 cm) nous permettent d’enregistrer des LFP avec une précision de l’ordre de la milliseconde. Les données peuvent ensuite être amplifiées par un amplificateur à 16 canaux, filtrées (passe-bas 1 Hz, passe-haut 5 kHz) et numérisées.
Protocole
Le présent travail est approuvé par le Comité de soins et d’utilisation des animaux de l’Université de Virginie. Des souris C57Bl/6 des deux sexes (7-12 semaines) ont été utilisées pour les expériences. Les animaux ont été maintenus sur un cycle de lumière de 12 h / 12 h d’obscurité et avaient un accès ad libitum à la nourriture et à l’eau.
1. Construction de microélectrodes
- Pour construire les microélectrodes, utilisez un fil de nickel-chrome revêtu de 50 μm (diamètre) (voir tableau des matériaux). Collez une extrémité du fil à l’arrière de la plate-forme et enroulez le fil trois fois autour du bouton le plus proche de la plate-forme (Figure 1A, C).
REMARQUE: Une plate-forme acrylique avec deux boutons (2 x 5 pouces) a été utilisée ici, mais n’importe quelle plate-forme peut être utilisée.- Étirez le fil autour du deuxième bouton le plus éloigné pour faire deux boucles entre les boutons. Enroulez le fil trois fois de plus autour du premier bouton pour fixer le fil en place et collez à nouveau l’extrémité à l’arrière de la plate-forme.
REMARQUE: Une fois les fils séparés (étapes 1.2 à 1.3.1), il doit y avoir deux fils de chaque côté (quatre fils au total, Figure 1B).
- Étirez le fil autour du deuxième bouton le plus éloigné pour faire deux boucles entre les boutons. Enroulez le fil trois fois de plus autour du premier bouton pour fixer le fil en place et collez à nouveau l’extrémité à l’arrière de la plate-forme.
- Placez les barres de tension sous les fils avec le ruban adhésif enroulé autour d’eux (côté collant vers le haut) (Figure 1C).
REMARQUE: Des pièces en acrylique triangulaires ont été utilisées pour les barres de tension, avec du ruban adhésif enroulé autour d’elles (côté collant à l’extérieur pour attacher les fils). Le côté collant de la bande à l’extérieur des barres de tension maintiendra les fils en place pour ajuster la distance entre eux. Les barres de tension doivent être à environ 2,5 cm des boutons et les fils ne doivent pas être desserrés. - À l’aide d’un microscope et de pinces fines, faire un espace de 3 mm ou 4,5 mm entre les fils (3 mm d’écart entre les fils pour fabriquer des microélectrodes corticales (Ctx) - noyau thalamique ventrolatéral (VL); 4,5 mm d’écart pour fabriquer des microélectrodes striatales (Str) - nigrales (SNR)) (Figure 1B).
- Si le grossissement est utilisé sur le microscope, assurez-vous de calculer et d’ajuster la différence de grossissement et la distance réelle entre les fils.
REMARQUE: Si des microélectrodes sont construites pour des structures autres que celles utilisées ici, la distance entre les fils doit être ajustée à la distance stéréotaxique entre les structures. La figure 2B fournit un exemple de la façon dont les fils seront organisés; en conséquence, les coordonnées stéréotaxiques des autres structures doivent être ajustées.
- Si le grossissement est utilisé sur le microscope, assurez-vous de calculer et d’ajuster la différence de grossissement et la distance réelle entre les fils.
- Couper quatre petits morceaux de plastique (0,5 mm d’épaisseur) ~ 6 mm (largeur) x 3 mm (hauteur) (Figure 1C).
REMARQUE: Toutes les pièces en plastique peuvent être utilisées tant qu’elles ont une épaisseur de 0,5 mm; ici, des tubes carrés ont été utilisés dans lesquels les broches ont été vendues (épingles, voir Tableau des matériaux). Si une épaisseur différente est utilisée, veuillez ajouter plus ou moins de morceaux de plastique pour s’adapter aux coordonnées stéréotaxiques requises. - Appliquez de la colle (voir tableau des matériaux) sur le plastique et placez-les sur les fils (Figure 1C). Placez les morceaux de plastique à environ 1,0 cm du milieu du fil, soit à 1,0 cm de la barre de tension. Enlevez l’excès de superglue avec un coton-tige.
- Une fois la superglue sèche, coupez les fils à l’aide de ciseaux fins, dans l’ordre indiqué à la figure 1C.
- Coupez quatre tubes de verre de 7 mm à l’aide d’un kit disponible dans le commerce (voir tableau des matériaux) et insérez les fils d’électrode dans les tubes de verre comme indiqué à la figure 2A.
- Insérez des paires d’électrodes VL et SNR dans les tubes en verre.
REMARQUE: Seuls les fils pour les structures profondes doivent être insérés dans les tubes de verre pour soutenir l’implantation chirurgicale. Assurez-vous de ne pas insérer d’électrodes corticales dans le tube de verre.
- Insérez des paires d’électrodes VL et SNR dans les tubes en verre.
- Placez la colle à la base des tubes de verre pour les connecter au plastique. Attendez un peu jusqu’à ce que la colle sèche.
- Couper les tubes et les fils de verre à l’aide d’un scalpel comme indiqué dans le tableau 1; s’assurer que les longueurs des microélectrodes sont correctes. Si les microélectrodes ciblent différentes structures, ajustez la distance de coupe en fonction des coordonnées stéréotaxiques requises.
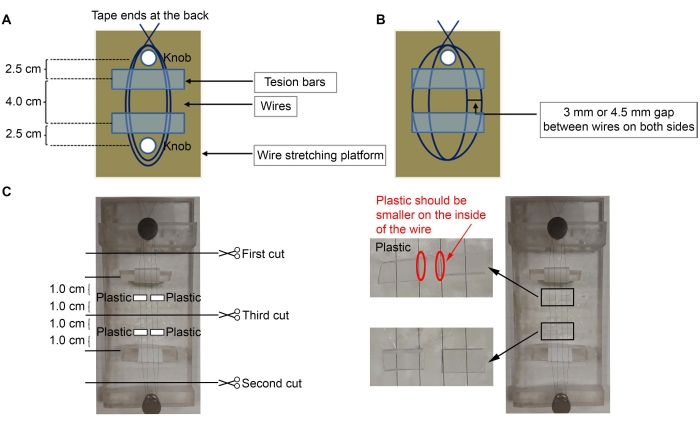
Figure 1: Schéma de la construction de la microélectrode. (A) Mise en place de fils sur la plate-forme avec des barres de tension sous les fils. (B) L’espace entre les fils. (C) Quatre morceaux de plastique sont collés aux fils. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Ctx | Str | VL | SNR | |
| AP (antérieur/postérieur) | 2.2 | 1.2 | -1.3 | -3.3 |
| ML (médial/latéral) | 1.8 | 1.5 | 1 | 1.5 |
| DV (dorsal/ventral) | 0.5 | 3.5 | 4 | 4.75 |
| Longueur de l’électrode | 4 | 4.75 | 5.25 | 6 |
Tableau 1 : Coordonnées d’implantation stéréotaxiques et dimensions des microélectrodes.
2. Assemblage de réseaux de microélectrodes
- Utilisez la colle pour fixer les plastiques dans l’ordre souhaité des régions cibles. Un exemple d’électrodes corticales, thalamiques, striatales et nigrales est illustré à la figure 2B,C.
- Placez la paire d’électrodes Ctx-VL face vers le bas (le côté avec les fils d’électrode doit être tourné vers le bas) et connectez deux morceaux de plastique vides de 6 mm x 3 mm sur le dessus avec de la colle.
- Au-dessus des trois morceaux de plastique, placez la deuxième paire d’électrodes Ctx-VL avec les électrodes tournées vers le haut (utilisez un microscope et assurez-vous que les électrodes VL sont alignées).
REMARQUE: L’alignement des électrodes bilatérales (ici, l’alignement des électrodes VL gauche et droite) est essentiel pour cibler de manière appropriée les structures bilatérales souhaitées. - Utilisez la colle pour fixer les électrodes SNR sur le dessus avec les électrodes SNR à 2,0 mm des électrodes VL et à environ 5,0 mm des électrodes corticales (les fils d’électrode SNR doivent être tournés vers le haut).
- Répétez l’étape 2.1.3. pour l’autre côté (les fils d’électrode SNR doivent faire face à l’extérieur du réseau de microélectrodes).
- Appliquez de la résine époxy autour du plastique pour lier les électrodes ensemble. Évitez de mettre de la résine époxy sur les électrodes.
- Prenez un fil épais et faites une boucle à une extrémité. Trempez la boucle dans la solution époxy et placez-la sur le plastique, en vous assurant que le fil épais est à plat (Figure 2D) afin que pour les étapes suivantes, ce fil puisse être utilisé comme poignée. Attendez que les électrodes soient complètement sèches.
- Coupez les fils à 2 cm, comme illustré à la figure 2E.
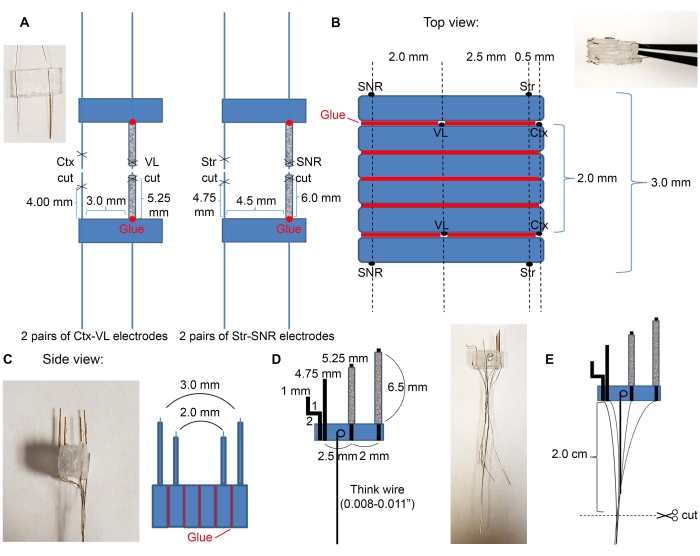
Figure 2: Construction et dimensions des microélectrodes. (A) Quatre paires d’électrodes formées après la coupe des fils avec des ciseaux, comme indiqué à la figure 1C (2 paires d’électrodes Ctx-VL et 2 paires d’électrodes Str-SNR). Insérez des électrodes de structure profonde (VL et SNR) dans les tubes de verre et collez leurs bases sur du plastique (points rouges). (B) Vue de dessus: Les paires d’électrodes de (A) sont collées dans une pile pour créer le noyau de microélectrode. Les lignes rouges indiquent les lignes de colle. (C) Vue latérale avant de (B). (D) Le fil épais a été attaché aux microélectrodes. (E) Les fils sont regroupés comme indiqué et les extrémités isolées sont grattées et coupées en 2 cm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
3. Connexion par microélectrode au casque
- Regroupez les fils comme indiqué à la figure 2E et grattez 1 mm des extrémités isolées avec un scalpel.
- Pliez les électrodes corticales comme illustré à la figure 3A. Séparez les fils comme illustré à la figure 3B. À l’aide de pinces fines, effectuez une boucle à l’extrémité de chaque fil (Figure 3B).
- Tenez un casque à 10 broches avec un hémostat (voir Tableau des matériaux) et utilisez l’extrémité en bois d’un coton-tige pour appliquer des quantités minimales de flux sur les broches (Figure 3C). Assurez-vous de ne pas mettre de flux à l’extérieur des broches pour éviter les courts-circuits entre les broches.
- À l’aide de l’extrémité en bois d’un coton-tige, appliquez un flux sur les boucles de fil.
- Soudez les boucles de fil au casque à 10 broches, comme illustré à la figure 3C. Après la soudure, séchez le casque pour éviter les courts-circuits entre les broches.
- Prenez un fil mince (0,005-0,008 pouce) pour la référence et les fils de terre et retirez le plastique d’une extrémité. Faites une boucle à l’autre extrémité du fil.
- Souder le côté dénudé des fils de référence et de terre à leurs broches respectives (Figure 3A,C).
- En tenant le fil épais (Figure 2D), appliquez du ciment cranioplastique autour des microélectrodes, en particulier là où les fils se connectent aux broches. Évitez de toucher les extrémités de l’électrode avec le ciment.
- Une fois le ciment séché, placez de la résine époxy à la base des tubes de verre, des fils de microélectrode striatale et de l’électrode entière. Évitez de toucher les extrémités de l’électrode avec de la résine époxy. Attendez que les électrodes soient complètement sèches.
- Les électrodes sont prêtes. Percez des trous dans le crâne de la souris (selon les coordonnées stéréotaxiques requises) à l’aide d’une perceuse dentaire et implantez le casque comme illustré à la figure 3D en abaissant le casque avec des microélectrodes faisant face au crâne et les trous appropriés. Le casque pourrait être attaché au bras stéréotaxique pour le soutien pendant l’implantation.
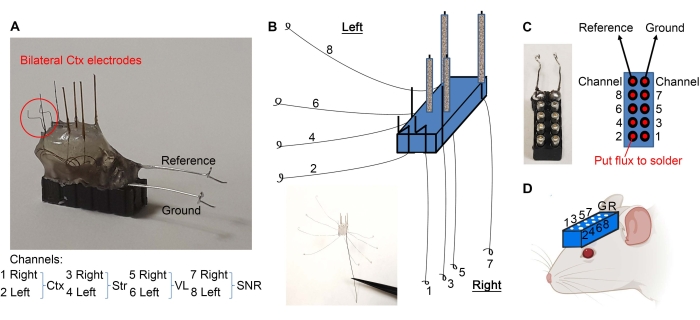
Figure 3 : Implantation de microélectrodes. (A) Les électrodes corticales sont pliées comme indiqué. (B) Les fils sont séparés pour faire des boucles aux extrémités. (C) Le flux (aux points rouges) et les fils en boucle sont soudés au casque à 10 broches, ce qui garantit que chaque fil va à sa broche appropriée. (D) Le casque est implanté pour enregistrer des LFP. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Marquage de l’emplacement de l’électrode après les enregistrements
- À la fin des enregistrements LFP, confirmez la position correcte des électrodes dans la région cible en appliquant un courant aux extrémités des électrodes pour faire une lésion et en attendant 30 minutes avant de perfuser la souris.
REMARQUE: Réglages de la lésion pour confirmer l’emplacement des extrémités de l’électrode: sursaut unique, 40 μA, impulsion d’onde carrée monophasique de 0,75 ms, 50 Hz, 30 s. - Anesthésier les souris avec de l’isoflurane (jusqu’à ce que la souris s’endorme) et perfuser10 par voie transcardique avec 4% de paraformaldéhyde (PFA) dans un tampon de phosphate de sodium de 0,1 M. Couper le cerveau (40 μm d’épaisseur) sur un cryostat (voir tableau des matériaux) et le colorer avec du DAPI (0,02% dans le PBS). Confirmez l’emplacement correct des électrodes par la présence des lésions de la pointe de l’électrode comme illustré à la figure 4B,C.
REMARQUE: Le pourcentage de l’isoflurane doit être appliqué conformément aux directives de chaque établissement.
5. Mesure de la résistance de l’électrode
- Mesurez la résistance des électrodes et vérifiez le court-circuit entre les électrodes à l’aide d’un ohmmètre multi-gamme (voir Tableau des matériaux). Réglez l’échelle de résistance à R x 10 000, indiquant qu’une déviation unitaire dans le pointeur correspond à une résistance de 1 kΩ. Les électrodes de 2 cm de long doivent avoir une résistance de 60 à 70 kΩ.
- Personnalisez le casque en prenant dix broches individuelles (voir Tableau des matériaux). Soudez chaque broche avec un fil de cuivre mince et multibrin dans un câble.
- Pressez les broches soudées avec leurs queues de câble correspondantes dans la prise d’accouplement à double rangée à 10 broches (prises correspondantes). Appuyez sur les broches ouvertes de la prise d’accouplement dans le casque LFP. De cette façon, chaque électrode LFP a un fil de câble désigné dans l’assemblage.
- Trempez l’extrémité de chaque électrode LFP (dont la résistance doit être mesurée) dans une solution saline nacl à 0,9% (concentration de NaCl dans le sang). Connectez l’extrémité du fil de câble qui correspond à l’électrode LFP à la borne positive de l’ohmmètre.
- Utilisez un fil à faible résistance (̴100 Ω) avec un côté dans l’eau saline et l’autre côté comme extrémité ouverte. Connectez l’extrémité ouverte du fil à faible résistance à la terre du pointeur d’ohmmètre.
REMARQUE: Cette disposition complète le circuit et provoque une déviation du pointeur ohmmétrique.
- Utilisez un fil à faible résistance (̴100 Ω) avec un côté dans l’eau saline et l’autre côté comme extrémité ouverte. Connectez l’extrémité ouverte du fil à faible résistance à la terre du pointeur d’ohmmètre.
- Assurez-vous qu’il n’y a pas de connexion électrique entre deux électrodes du casque. Vérifiez l’isolation électrique des électrodes LFP par paires (masse : un câble correspond à une électrode ; positif : un autre câble correspond à une autre électrode). Jetez les électrodes si une déviation est observée dans ce cas.
Résultats
Dans ce travail, les microélectrodes LFP ont été utilisées pour cartographier la propagation de la crise à travers les noyaux gris centraux11. Des enregistrements LFP simultanés ont été effectués à partir du cortex prémoteur droit (où se trouvait le foyer de la crise) et du VL gauche, du striatum et du SNR (Figure 4). Le début de la crise a été identifié comme une déviation de la trace de tension au moins deux fois supérieure à la ligne de base (
Discussion
Historiquement, les réseaux de microélectrodes ont été largement utilisés pour enregistrer l’activité neuronale d’une région spécifique du cerveau d’intérêt 2,3,4,5,6,7,8,9,13. Cependant, notre conception f...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le National Institute of Health (RO1 NS120945, R37NS119012 à JK) et l’UVA Brain Institute.
matériels
| Name | Company | Catalog Number | Comments |
| Amplifier 16-Channel | A-M Systems | Model 3600 | Amplifier |
| Cranioplasty cement | Coltene | Perm Reeline/Repair Resin Type II Class I Shade - Clear | Cement to hold microelectrodes |
| Cryostat Microtome | Precisionary | CF-6100 | To slice brain |
| Diamel-coatednickel-chromium wire | Johnson Matthey Inc. | 50 µm | Microelectrode wire |
| Dremel | Dremel | 300 Series | To drill holes in mouse skull |
| Epoxy | CEC Corp | C-POXY 5 | Fast setting adhesive |
| Hemostat | Any | To hold the headset | |
| Forceps | Any | To hold microelectrodes | |
| Light microscope | Nikon | SMZ-10 | To see alignment |
| Ohmmeter | Any | To measurre resistance | |
| Pins (Headers and matching Sockets) | Mill-Max | Interconnects, 833 series, 2 mm grid gull wing surface mount headers and sockets | To attach microelectrodes to |
| Polymicro Tubing Kit | Neuralynx | ID 100 ± 04 µm, OD 164 ± 06 µm, coating thickness 12 µm | Glass tubes |
| Pulse Stimulator | A-M Systems | Model 2100 | To mark the microelectrode location at the end of the recordings |
| Scissors | Any | To cut microelectrodes | |
| Superglue | Gorilla | Adhesive | |
| Thick wire 0.008 in. – 0.011 in. | A-M Systems | 791900 | Tick wire to hold the microelectrode array |
| Thin wire 0.005 in. - 0.008 in. | A-M Systems | 791400 | Thin wire for reference and ground |
Références
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13, 407-420 (2012).
- Hubel, D. H., Wiesel, T. N. Receptive fields of single neurones in the cat's striate cortex. The Journal of Physiology. 148 (3), 574-591 (1959).
- O'Keefe, J. Place units in the hippocampus of the freely moving rat. Experimental Neurology. 51 (1), 78-109 (1976).
- Fyhn, M., Molden, S., Witter, M. P., Moser, E. I., Moser, M. B. Spatial representation in the entorhinal cortex. Science. 305 (5688), 1258-1264 (2004).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7, 446-451 (2004).
- Buckmaster, P. S., Edward Dudek, F. In vivo intracellular analysis of granule cell axon reorganization in epileptic rats. Journal of Neurophysiology. 81 (2), 712-721 (1999).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Communications Biology. 4, 1-14 (2021).
- Roy, D. S., et al. Memory retrieval by activating engram cells in mouse models of early Alzheimer's disease. Nature. 531, 508-512 (2016).
- Igarashi, K. M., Lu, L., Colgin, L. L., Moser, M. B., Moser, E. I. Coordination of entorhinal-hippocampal ensemble activity during associative learning. Nature. 510, 143-147 (2014).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Brodovskaya, A., Shiono, S., Kapur, J. Activation of the basal ganglia and indirect pathway neurons during frontal lobe seizures. Brain. 144 (7), 2074-2091 (2021).
- Ren, X., Brodovskaya, A., Hudson, J. L., Kapur, J. Connectivity and neuronal synchrony during seizures. The Journal of Neuroscience. 41 (36), 7623-7635 (2021).
- Chang, E. H., Frattini, S. A., Robbiati, S., Huerta, P. T. Construction of microdrive arrays for chronic neural recordings in awake behaving mice. Journal of Visualized Experiments. (77), e50470 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon