É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Construção de microeletrodos potenciais de campo local para gravações in vivo de múltiplas estruturas cerebrais simultaneamente
Neste Artigo
Resumo
O presente protocolo descreve a construção de matrizes de microeletrodos personalizadas para registrar potenciais de campo locais in vivo a partir de múltiplas estruturas cerebrais simultaneamente.
Resumo
Os pesquisadores muitas vezes precisam registrar potenciais de campo locais (LFPs) simultaneamente a partir de várias estruturas cerebrais. A gravação de várias regiões cerebrais desejadas requer diferentes projetos de microeletrodos, mas matrizes de microeletrodos disponíveis comercialmente muitas vezes não oferecem tal flexibilidade. Aqui, o presente protocolo descreve o design simples de matrizes de microeletrodos feitos sob medida para registrar LFPs de múltiplas estruturas cerebrais simultaneamente em diferentes profundidades. Este trabalho descreve como exemplo a construção dos microeletrorgéticos cortical, estiregal, ventrolateral e nigral. O princípio de design delineado oferece flexibilidade, e os microeletrodos podem ser modificados e personalizados para gravar LFPs de qualquer estrutura, calculando coordenadas estereoléxicas e mudando rapidamente a construção de acordo com diferentes regiões cerebrais em camundongos livremente móveis ou anestesiados. O conjunto de microeletrísmo requer ferramentas e suprimentos padrão. Essas matrizes personalizadas de microeletrorosão permitem que os pesquisadores projetem facilmente matrizes de microeletrodos em qualquer configuração para rastrear a atividade neuronal, fornecendo gravações LFP com resolução de milissegundos.
Introdução
Os potenciais de campo locais (LFPs) são os potenciais elétricos registrados a partir do espaço extracelular no cérebro. Eles são gerados por desequilíbrios de concentração de íons fora dos neurônios e representam a atividade de uma pequena população localizada de neurônios, permitindo monitorar precisamente a atividade de uma região cerebral específica em comparação com as gravações de EEG de macroescala1. Como estimativa, as microeletrões LFP separadas por 1 mm correspondem a duas populações completamente diferentes de neurônios. Enquanto o sinal EEG é filtrado por tecido cerebral, fluido cefalorraquidiano, crânio, músculo e pele, o sinal LFP é um marcador confiável da atividade neuronal local1.
Os pesquisadores muitas vezes precisam gravar LFPs simultaneamente de várias estruturas cerebrais, mas matrizes de microeletrodos disponíveis comercialmente muitas vezes não oferecem tal flexibilidade. Aqui, o presente protocolo descreve microeletrodos totalmente personalizáveis e facilmente construídos para registrar simultaneamente LFPs de qualquer região cerebral desejada em diferentes profundidades. Embora os LFPs tenham sido amplamente usados para registrar a atividade neuronal de uma região cerebral específica 2,3,4,5,6,7,8,9, o design personalizável atual permite registrar LFPs de várias regiões cerebrais superficiais ou profundas 11,12 . O protocolo também pode ser modificado para construir qualquer matriz de microeletrodos desejada, determinando coordenadas estereoléxicas das regiões cerebrais e montando a matriz de acordo. Estes microeletrodos com uma taxa de amostragem de 10 kHz e resistência de 60-70 kΩ (2 cm de comprimento) permitem gravar LFPs com precisão de milissegundos. Os dados podem então ser amplificados por um amplificador de 16 canais, filtrado (low pass 1 Hz, high pass de 5 kHz) e digitalizado.
Protocolo
O presente trabalho é aprovado pelo Comitê de Cuidados e Uso de Animais da Universidade da Virgínia. C57Bl/6 camundongos de ambos os sexos (7-12 semanas) foram usados para os experimentos. Os animais foram mantidos em um ciclo escuro de 12h/12h e tiveram acesso a ad libitum a alimentos e água.
1. Construção de microeletrodo
- Para construir os microeletrodos, utilize 50 μm (diâmetro) de fio de níquel-cromo revestido de diamel (ver Tabela de Materiais). Grave uma extremidade do fio na parte de trás da plataforma e enrole o fio três vezes ao redor do botão mais próximo da plataforma (Figura 1A,C).
NOTA: Uma plataforma acrílica com dois botões (2 x 5 polegadas) foi usada aqui, mas qualquer plataforma pode ser usada.- Estique o fio ao redor do segundo botão mais distante para fazer dois loops entre os botões. Enrole o fio mais três vezes ao redor do primeiro botão para fixar o fio no lugar e tape a extremidade novamente na parte de trás da plataforma.
NOTA: Depois que os fios forem separados (etapas 1.2-1.3.1), deve haver dois fios em cada lado (quatro fios no total, Figura 1B).
- Estique o fio ao redor do segundo botão mais distante para fazer dois loops entre os botões. Enrole o fio mais três vezes ao redor do primeiro botão para fixar o fio no lugar e tape a extremidade novamente na parte de trás da plataforma.
- Coloque as barras de tensão sob os fios com a fita enrolada ao redor delas (lado pegajoso para cima) (Figura 1C).
NOTA: Foram utilizadas peças de acrílico triangular para as barras de tensão, com fita enrolada ao redor delas (lado pegajoso do lado de fora para fixar os fios). O lado pegajoso da fita fora das barras de tensão manterá os fios no lugar para ajustar a distância entre eles. As barras de tensão devem estar a ~2,5 cm de distância dos botões, e os fios não devem estar soltos. - Utilizando um microscópio e fórceps finos, faça uma lacuna de 3 mm ou 4,5 mm entre os fios (3 mm de distância entre os fios para fazer microeletrodos cortical (Ctx) - núcleo dislamático ventrolateral (VL); 4,5 mm de lacuna para fazer microeletrodos estriais (Str) - nigral (SNR) (Figura 1B).
- Se a ampliação for usada no microscópio, certifique-se de calcular e ajustar para a diferença na ampliação e a distância real entre os fios.
NOTA: Se microeletrodos forem construídos para estruturas diferentes das utilizadas aqui, a distância entre os fios precisa ser ajustada à distância estereotipada entre as estruturas. A Figura 2B fornece um exemplo de como os fios serão organizados; assim, as coordenadas estereotribílicas para outras estruturas devem ser ajustadas.
- Se a ampliação for usada no microscópio, certifique-se de calcular e ajustar para a diferença na ampliação e a distância real entre os fios.
- Corte quatro pequenos pedaços de plástico (0,5 mm de espessura) ~6 mm (largura) x 3 mm (altura) (Figura 1C).
NOTA: Quaisquer peças plásticas podem ser usadas desde que tenham 0,5 mm de espessura; aqui, foi utilizada tubulação quadrada em que os pinos foram vendidos (Pinos, ver Tabela de Materiais). Se for usada uma espessura diferente, adicione mais ou menos pedaços de plástico para caber nas coordenadas estereotribíticas necessárias. - Aplique cola (ver Tabela de Materiais) no plástico e coloque-as nos fios (Figura 1C). Coloque peças plásticas ~1,0 cm de distância do meio do fio, que fica a 1,0 cm da barra de tensão. Remova o excesso de supercola com um cotonete.
- Após a supercola seque, corte os fios usando uma tesoura fina, na ordem indicada na Figura 1C.
- Corte quatro tubos de vidro de 7 mm usando um kit comercialmente disponível (ver Tabela de Materiais) e insira os fios de eletrodo nos tubos de vidro, conforme indicado na Figura 2A.
- Insira pares de eletrodos VL e SNR nos tubos de vidro.
NOTA: Apenas os fios para estruturas profundas precisam ser inseridos nos tubos de vidro para suportar a implantação cirúrgica. Certifique-se de não inserir eletrodos corticais no tubo de vidro.
- Insira pares de eletrodos VL e SNR nos tubos de vidro.
- Coloque a cola na base dos tubos de vidro para conectá-los ao plástico. Espere algum tempo até a cola ser.
- Corte os tubos de vidro e os fios usando um bisturi como indicado na Tabela 1; garantir que os comprimentos dos microeletros estejam corretos. Se os microeletrodos atingirem diferentes estruturas, ajuste a distância de corte de acordo com as coordenadas estereotributivas necessárias.
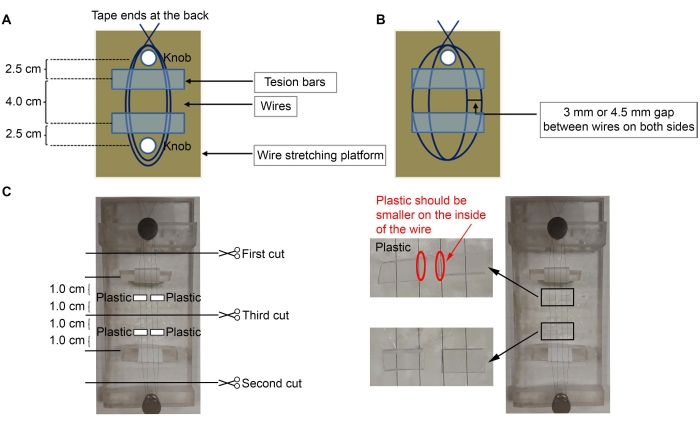
Figura 1: Esquema da construção de microeletrodo. (A) Fixação de fios na plataforma com barras de tensão abaixo dos fios. (B) A distância entre os fios. (C) Quatro pedaços de plástico estão colados nos fios. Clique aqui para ver uma versão maior desta figura.
| Ctx | Str | VL | SNR | |
| AP (Anterior/Posterior) | 2.2 | 1.2 | -1.3 | -3.3 |
| ML (Medial/Lateral) | 1.8 | 1.5 | 1 | 1.5 |
| DV (Dorsal/Ventral) | 0.5 | 3.5 | 4 | 4.75 |
| Comprimento do eletrodo | 4 | 4.75 | 5.25 | 6 |
Tabela 1: Coordenadas e dimensões de implantação estereotaxic dos microeletrodos.
2. Montagem da matriz de microeletrodos
- Use a cola para fixar plásticos na ordem desejada das regiões-alvo. Um exemplo para eletrodos cortical, talâmico, estriatal e nigral é mostrado na Figura 2B,C.
- Coloque o par de eletrodos Ctx-VL de frente para baixo (lado com fios de eletrodo tem que ficar de frente para baixo) e conecte duas peças vazias de 6 mm x 3 mm de plástico na parte superior com cola.
- Em cima das três peças de plástico, coloque o segundo par de eletrodos Ctx-VL com os eletrodos voltados para cima (use um microscópio e certifique-se de que os eletrodos VL estejam alinhados).
NOTA: O alinhamento dos eletrodos bilaterais (aqui, o alinhamento dos eletrodos VL esquerdo e direito) é essencial para atingir adequadamente as estruturas bilaterais desejadas. - Use a cola para fixar os eletrodos SNR na parte superior com os eletrodos SNR a 2,0 mm de distância dos eletrodos VL e ~5,0 mm de distância dos eletrodos corticais (os fios de eletrodo SNR têm que enfrentar para cima).
- Repita o passo 2.1.3. para o outro lado (os fios de eletrodo SNR têm que enfrentar fora da matriz de microeletrodos).
- Aplique resina epóxi ao redor do plástico para unir os eletrodos. Evite colocar resina epóxi nos eletrodos.
- Pegue um fio grosso e faça um loop em uma extremidade. Mergulhe o laço na solução epóxi e coloque-o sobre o plástico, garantindo que o fio grosso esteja deitado plano (Figura 2D) para que para os próximos passos, este fio possa ser usado como uma alça. Espere até que os eletrodos estejam totalmente secos.
- Corte os fios para 2 cm, como mostrado na Figura 2E.
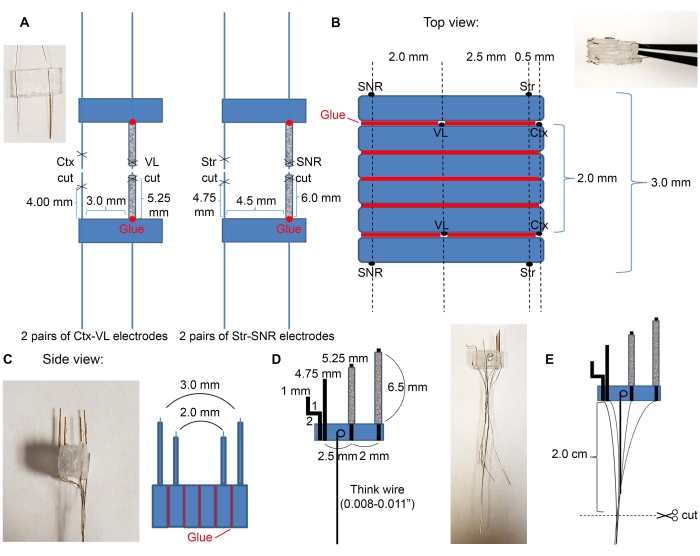
Figura 2: Construção e dimensões microeletrodes. (A) Quatro pares de eletrodos formados após o corte dos fios com tesouras, conforme indicado na Figura 1C (2 pares de eletrodos Ctx-VL e 2 pares de eletrodos Str-SNR). Insira eletrodos de estrutura profunda (VL e SNR) nos tubos de vidro e cole suas bases em plástico (pontos vermelhos). (B) Visão superior: Os pares de eletrodos de (A) são colados em uma pilha para criar o núcleo de microeletrodo. Linhas vermelhas indicam linhas de cola. (C) Vista lateral frontal de (B). (D) O fio espesso foi ligado aos microeletrodos. (E) Os fios são agrupados conforme indicado, e as extremidades isoladas são raspadas e cortadas em 2 cm. Por favor clique aqui para ver uma versão maior desta figura.
3. Conexão microeletrísmo ao fone de ouvido
- Agrupar os fios conforme indicado na Figura 2E e raspar 1 mm das extremidades isoladas com um bisturi.
- Dobre os eletrodos cortical como mostrado na Figura 3A. Separe os fios conforme mostrado na Figura 3B. Usando fórceps finos, faça um loop na extremidade de cada fio (Figura 3B).
- Segure um fone de ouvido de 10 pinos com um hemostat (ver Tabela de Materiais) e use a extremidade de madeira de um cotonete para aplicar quantidades mínimas de fluxo nos pinos (Figura 3C). Certifique-se de não colocar o fluxo fora dos pinos para evitar um curto-circuito entre os pinos.
- Usando a extremidade de madeira de um cotonete, aplique fluxo nas alças do fio.
- Soldar os laços de fio para o fone de ouvido de 10 pinos, como mostrado na Figura 3C. Após soldar, seque o fone de ouvido para evitar um curto-circuito entre os pinos.
- Pegue um fio fino (0,005-0,008 polegadas) para a referência e os fios de terra e retire o plástico de uma extremidade. Faça um loop na outra extremidade do fio.
- Soldar o lado despojado da referência e fios de terra para seus respectivos pinos (Figura 3A,C).
- Segurando o fio grosso (Figura 2D), aplique cimento cranioplastia ao redor dos microeletrodos, especialmente quando os fios se conectam aos pinos. Evite tocar nas extremidades reais do eletrodo com o cimento.
- Depois que o cimento secar, coloque resina epóxi na base dos tubos de vidro, fios de microeletrodo striatal, e todo o eletrodo. Evite tocar nas extremidades reais do eletrodo com resina epóxi. Espere até que os eletrodos estejam totalmente secos.
- Os eletrodos estão prontos. Faça furos no crânio do mouse (de acordo com as coordenadas estereotaxas necessárias) usando uma broca dentária e implante o fone de ouvido como mostrado na Figura 3D , baixando o fone de ouvido com microeletrodos voltados para o crânio e os orifícios apropriados. O fone de ouvido pode ser anexado ao braço estereotaxico para suporte durante a implantação.
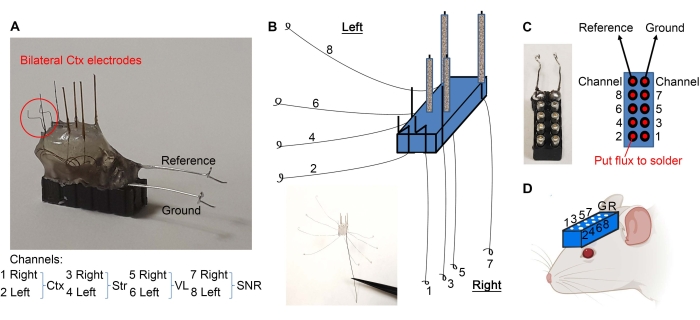
Figura 3: Implantação de microeletrodo. (A) Os eletrodos cortical são dobrados conforme indicado. (B) Os fios são separados para fazer loops nas extremidades. (C) O fluxo (nos pontos vermelhos) e os fios em loop são soldados para o fone de ouvido de 10 pinos, garantindo que cada fio vá para o pino apropriado. (D) O fone de ouvido é implantado para gravar LFPs. Clique aqui para ver uma versão maior desta figura.
4. Marcando localização do eletrodo após gravações
- Ao final das gravações de LFP, confirme a posição correta dos eletrodos na região alvo aplicando uma corrente nas pontas do eletrodo para fazer uma lesão e esperando por 30 minutos antes de perfumar o mouse.
NOTA: Configurações de lesão para confirmar a localização das pontas do eletrodo: Estouro único, 40 μA, pulso de onda quadrada monofásica de 0,75 ms, 50 Hz, 30 s. - Anestesiar os camundongos com isoflurano (até o rato dormir) e perfumar10 transcardialmente com 4% de paraformaldeído (PFA) em 0,1 M tampão de fosfato de sódio. Seção o cérebro (40 μm de espessura) em um criostat (ver Tabela de Materiais) e colora com DAPI (0,02% em PBS). Confirme a localização correta dos eletrodos pela presença das lesões da ponta do eletrodo, conforme mostrado na Figura 4B,C.
NOTA: O percentual do isoflurane precisa ser aplicado seguindo as diretrizes individuais da instituição.
5. Medir a resistência ao eletrodo
- Meça a resistência dos eletrodos e verifique o curto-circuito entre os eletrodos usando um ohmímetro multi-alcance (ver Tabela de Materiais). Coloque a escala de resistência em R x 10.000, indicando que uma deflexão unitária no ponteiro corresponde à resistência de 1 kΩ. Eletrodos de 2 cm de comprimento precisam ter resistência de 60-70 kΩ.
- Personalize o fone de ouvido levando dez pinos individuais (ver Tabela de Materiais). Soldar cada pino com um fio de cobre fino e multi-encalhado em um cabo.
- Pressione os pinos soldados com as caudas correspondentes do cabo no soquete de acasalamento de linha dupla de 10 pinos (soquetes correspondentes). Pressione os pinos abertos do soquete de acasalamento no fone de ouvido LFP. Desta forma, cada eletrodo LFP tem um fio de cabo designado no conjunto.
- Mergulhe a ponta de cada eletrodo LFP (a resistência a ser medida) em solução salina NaCl de 0,9% (concentração de NaCl no sangue). Conecte a extremidade do fio do cabo que corresponde ao eletrodo LFP ao terminal positivo do ohmmeter.
- Use um fio de baixa resistência (100 Ω) com um lado na água salina e o outro lado como a extremidade aberta. Conecte a extremidade aberta do fio de baixa resistência ao chão do ponteiro ohmmeter.
NOTA: Este arranjo completa o circuito e solicita uma deflexão do ponteiro ohmmeter.
- Use um fio de baixa resistência (100 Ω) com um lado na água salina e o outro lado como a extremidade aberta. Conecte a extremidade aberta do fio de baixa resistência ao chão do ponteiro ohmmeter.
- Certifique-se de que não há conexão elétrica entre dois eletrodos no fone de ouvido. Verifique o isolamento elétrico dos eletrodos LFP pairwise (terra: um cabo corresponde a um eletrodo; positivo: outro cabo corresponde a outro eletrodo). Descarte os eletrodos se houver alguma deflexão neste caso.
Resultados
Neste trabalho, as microeletroletórias LFP foram utilizadas para mapear a apreensão espalhada pelo gânglio basal11. Foram realizadas gravações simultâneas de LFP a partir do córtex pré-motor direito (onde estava o foco da convulsão) e da VL esquerda, estriatum e SNR (Figura 4). O início da convulsão foi identificado como deflexão do traço de tensão pelo menos duas vezes a linha de base (Figura 4A, seta vermelha). O gráfico ...
Discussão
Historicamente, as matrizes de microeletrodos têm sido amplamente utilizadas para registrar atividade neuronal de uma região cerebral específica de interesse 2,3,4,5,6,7,8,9,13. No entanto, nosso design fácil de microe...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo Instituto Nacional de Saúde (RO1 NS120945, R37NS119012 para JK) e pelo Instituto do Cérebro uva.
Materiais
| Name | Company | Catalog Number | Comments |
| Amplifier 16-Channel | A-M Systems | Model 3600 | Amplifier |
| Cranioplasty cement | Coltene | Perm Reeline/Repair Resin Type II Class I Shade - Clear | Cement to hold microelectrodes |
| Cryostat Microtome | Precisionary | CF-6100 | To slice brain |
| Diamel-coatednickel-chromium wire | Johnson Matthey Inc. | 50 µm | Microelectrode wire |
| Dremel | Dremel | 300 Series | To drill holes in mouse skull |
| Epoxy | CEC Corp | C-POXY 5 | Fast setting adhesive |
| Hemostat | Any | To hold the headset | |
| Forceps | Any | To hold microelectrodes | |
| Light microscope | Nikon | SMZ-10 | To see alignment |
| Ohmmeter | Any | To measurre resistance | |
| Pins (Headers and matching Sockets) | Mill-Max | Interconnects, 833 series, 2 mm grid gull wing surface mount headers and sockets | To attach microelectrodes to |
| Polymicro Tubing Kit | Neuralynx | ID 100 ± 04 µm, OD 164 ± 06 µm, coating thickness 12 µm | Glass tubes |
| Pulse Stimulator | A-M Systems | Model 2100 | To mark the microelectrode location at the end of the recordings |
| Scissors | Any | To cut microelectrodes | |
| Superglue | Gorilla | Adhesive | |
| Thick wire 0.008 in. – 0.011 in. | A-M Systems | 791900 | Tick wire to hold the microelectrode array |
| Thin wire 0.005 in. - 0.008 in. | A-M Systems | 791400 | Thin wire for reference and ground |
Referências
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13, 407-420 (2012).
- Hubel, D. H., Wiesel, T. N. Receptive fields of single neurones in the cat's striate cortex. The Journal of Physiology. 148 (3), 574-591 (1959).
- O'Keefe, J. Place units in the hippocampus of the freely moving rat. Experimental Neurology. 51 (1), 78-109 (1976).
- Fyhn, M., Molden, S., Witter, M. P., Moser, E. I., Moser, M. B. Spatial representation in the entorhinal cortex. Science. 305 (5688), 1258-1264 (2004).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7, 446-451 (2004).
- Buckmaster, P. S., Edward Dudek, F. In vivo intracellular analysis of granule cell axon reorganization in epileptic rats. Journal of Neurophysiology. 81 (2), 712-721 (1999).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Communications Biology. 4, 1-14 (2021).
- Roy, D. S., et al. Memory retrieval by activating engram cells in mouse models of early Alzheimer's disease. Nature. 531, 508-512 (2016).
- Igarashi, K. M., Lu, L., Colgin, L. L., Moser, M. B., Moser, E. I. Coordination of entorhinal-hippocampal ensemble activity during associative learning. Nature. 510, 143-147 (2014).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Brodovskaya, A., Shiono, S., Kapur, J. Activation of the basal ganglia and indirect pathway neurons during frontal lobe seizures. Brain. 144 (7), 2074-2091 (2021).
- Ren, X., Brodovskaya, A., Hudson, J. L., Kapur, J. Connectivity and neuronal synchrony during seizures. The Journal of Neuroscience. 41 (36), 7623-7635 (2021).
- Chang, E. H., Frattini, S. A., Robbiati, S., Huerta, P. T. Construction of microdrive arrays for chronic neural recordings in awake behaving mice. Journal of Visualized Experiments. (77), e50470 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados