Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Построение микроэлектродов локального потенциала поля для записи in vivo из нескольких структур мозга одновременно
В этой статье
Резюме
Настоящий протокол описывает построение специально изготовленных микроэлектродных массивов для записи локальных потенциалов поля in vivo от нескольких структур мозга одновременно.
Аннотация
Исследователям часто необходимо регистрировать локальные полевые потенциалы (LFP) одновременно из нескольких структур мозга. Запись из нескольких желаемых областей мозга требует различных конструкций микроэлектродов, но коммерчески доступные микроэлектродные массивы часто не предлагают такой гибкости. Здесь настоящий протокол описывает простую конструкцию изготовленных на заказ микроэлектродных массивов для записи LFP из нескольких структур мозга одновременно на разных глубинах. В данной работе описывается построение двустороннего кортикального, полосатого, вентролатерального таламического и нигрального микроэлектродов в качестве примера. Изложенный принцип проектирования обеспечивает гибкость, а микроэлектроды могут быть модифицированы и настроены для записи LFP из любой структуры путем вычисления стереотаксических координат и быстрого изменения конструкции соответственно для нацеливания на различные области мозга у свободно движущихся или анестезированных мышей. Для микроэлектродной сборки требуются стандартные инструменты и расходные материалы. Эти пользовательские микроэлектродные массивы позволяют исследователям легко проектировать микроэлектродные массивы в любой конфигурации для отслеживания активности нейронов, обеспечивая записи LFP с миллисекундным разрешением.
Введение
Локальные полевые потенциалы (LFP) — это электрические потенциалы, записанные из внеклеточного пространства мозга. Они генерируются дисбалансом концентрации ионов вне нейронов и представляют собой активность небольшой, локализованной популяции нейронов, что позволяет точно контролировать активность конкретной области мозга по сравнению с макромасштабными записями ЭЭГ1. По оценкам, микроэлектроды LFP, разделенные 1 мм, соответствуют двум совершенно разным популяциям нейронов. В то время как сигнал ЭЭГ фильтруется тканью мозга, спинномозговой жидкостью, черепом, мышцами и кожей, сигнал LFP является надежным маркером местной нейронной активности1.
Исследователям часто необходимо одновременно записывать LFP из нескольких структур мозга, но коммерчески доступные микроэлектродные массивы часто не предлагают такой гибкости. Здесь настоящий протокол описывает полностью настраиваемые, легко построенные микроэлектроды для одновременной записи LFP из любой желаемой области мозга на разной глубине. Хотя LFP широко используются для записи нейронной активности определенной области мозга 2,3,4,5,6,7,8,9, текущий простой настраиваемый дизайн позволяет записывать LFP из любых множественных поверхностных или глубоких областей мозга 11,12 . Протокол также может быть модифицирован для построения любого желаемого микроэлектродного массива путем определения стереотаксических координат областей мозга и сборки массива соответствующим образом. Эти микроэлектроды с частотой дискретизации 10 кГц и сопротивлением 60-70 кОм (длина 2 см) позволяют записывать LFP с точностью до миллисекунд. Затем данные могут быть усилены 16-канальным усилителем, отфильтрованы (нижние частоты 1 Гц, высокие частоты 5 кГц) и оцифрованы.
протокол
Настоящая работа одобрена Комитетом по уходу и использованию животных Университета Вирджинии. Для экспериментов использовали мышей C57Bl/6 обоих полов (7-12 недель). Животные содержались в 12-часовом светлом / 12-часовом темном цикле и имели доступ ad libitum к пище и воде.
1. Микроэлектродная конструкция
- Для построения микроэлектродов используйте никель-хромовую проволоку диаметром 50 мкм (диаметр) (см. Таблицу материалов). Заклейте один конец провода в задней части платформы и обмотайте провод три раза вокруг ближайшей ручки на платформе (рисунок 1A,C).
ПРИМЕЧАНИЕ: Здесь использовалась акриловая платформа с двумя ручками (2 х 5 дюймов), но можно использовать любую платформу.- Растяните проволоку вокруг самой дальней второй ручки, чтобы сделать две петли между ручками. Оберните проволоку еще три раза вокруг первой ручки, чтобы закрепить провод на месте, и снова заклейте конец в задней части платформы.
ПРИМЕЧАНИЕ: После разделения проводов (этапы 1.2-1.3.1) с каждой стороны должно быть два провода (всего четыре провода, рис. 1В).
- Растяните проволоку вокруг самой дальней второй ручки, чтобы сделать две петли между ручками. Оберните проволоку еще три раза вокруг первой ручки, чтобы закрепить провод на месте, и снова заклейте конец в задней части платформы.
- Поместите натяжные стержни под провода с лентой, обернутой вокруг них (липкой стороной вверх) (рисунок 1С).
ПРИМЕЧАНИЕ: Треугольные акриловые куски использовались для натяжных стержней, с лентой, обернутой вокруг них (липкая сторона снаружи для крепления проводов). Липкая сторона ленты за пределами натяжных стержней будет удерживать провода на месте, чтобы регулировать расстояние между ними. Натяжные стержни должны находиться на расстоянии ~2,5 см от ручек, а провода не должны быть свободными. - Используя микроскоп и тонкие щипцы, сделайте либо 3 мм, либо 4,5 мм зазор между проводами (3 мм зазор между проводами, чтобы сделать кортикальные (Ctx) - вентролатеральные таламические ядра (VL) микроэлектродами; 4,5 мм зазор, чтобы сделать стриатальные (Str) - нигральные (SNR) микроэлектроды) (рисунок 1B).
- Если на микроскопе используется увеличение, убедитесь, что вычислите и отрегулируйте разницу в увеличении и фактическое расстояние между проводами.
ПРИМЕЧАНИЕ: Если микроэлектроды построены для конструкций, отличных от тех, которые используются здесь, расстояние между проводами должно быть отрегулировано в соответствии со стереотаксическим расстоянием между структурами. На рисунке 2B приведен пример того, как будут организованы провода; соответственно, стереотаксические координаты для других структур должны быть скорректированы.
- Если на микроскопе используется увеличение, убедитесь, что вычислите и отрегулируйте разницу в увеличении и фактическое расстояние между проводами.
- Вырежьте четыре небольших кусочка пластика (толщиной 0,5 мм) ~ 6 мм (ширина) x 3 мм (высота) (рисунок 1C).
ПРИМЕЧАНИЕ: Любые пластиковые куски могут быть использованы, если они имеют толщину 0,5 мм; здесь использовались квадратные трубки, в которых продавались штифты (Pins, см. Таблица материалов). Если используется другая толщина, пожалуйста, добавьте больше или меньше кусков пластика, чтобы соответствовать требуемым стереотаксическим координатам. - Нанесите клей (см. Таблицу материалов) на пластик и поместите их на провода (рисунок 1С). Поместите пластиковые куски ~ 1,0 см от середины проволоки, которая находится на расстоянии 1,0 см от натяжного стержня. Удалите излишки суперклея ватным тампоном.
- После того, как суперклей высохнет, отрежьте провода тонкими ножницами, в порядке, указанном на рисунке 1С.
- Вырежьте четыре стеклянные трубки диаметром 7 мм с помощью коммерчески доступного комплекта (см. Таблицу материалов) и вставьте электродные провода в стеклянные трубки, как указано на рисунке 2А.
- Вставьте пары электродов VL и SNR в стеклянные трубки.
ПРИМЕЧАНИЕ: Только провода для глубоких структур должны быть вставлены в стеклянные трубки для поддержки хирургической имплантации. Убедитесь, что вы не вставляете корковые электроды в стеклянную трубку.
- Вставьте пары электродов VL и SNR в стеклянные трубки.
- Положите клей на основание стеклянных трубок, чтобы соединить их с пластиком. Подождите некоторое время, пока клей высохнет.
- Вырежьте стеклянные трубки и провода с помощью скальпеля, как указано в таблице 1; убедитесь, что длина микроэлектродов правильная. Если микроэлектроды нацелены на различные структуры, отрегулируйте расстояние резания в соответствии с требуемыми стереотаксическими координатами.
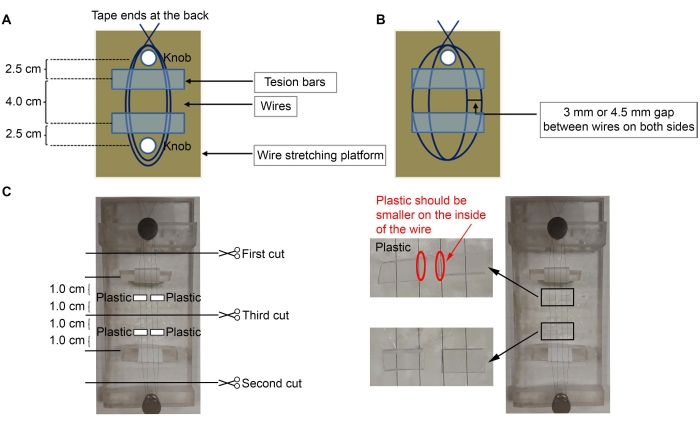
Рисунок 1: Схема микроэлектродной конструкции. (А) Установка проводов на платформе с натяжными стержнями под проводами. (B) Зазор между проводами. (C) Четыре куска пластика приклеиваются к проводам. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Ctx | Ул | ВЛ | СНР | |
| AP (Передний/Задний) | 2.2 | 1.2 | -1.3 | -3.3 |
| ML (Медиальный/Боковой) | 1.8 | 1.5 | 1 | 1.5 |
| DV (Дорсальный/Вентральный) | 0.5 | 3.5 | 4 | 4.75 |
| Длина электрода | 4 | 4.75 | 5.25 | 6 |
Таблица 1: Координаты стереотаксической имплантации и размеры микроэлектродов.
2. Микроэлектродный массив в сборе
- Используйте клей для крепления пластмасс в нужном порядке целевых областей. Пример кортикальных, таламических, стриатальных и нигральных электродов показан на рисунке 2B,C.
- Поместите пару электродов Ctx-VL лицевой стороной вниз (сторона с электродными проводами должна быть лицевой стороной вниз) и соедините два пустых куска пластика размером 6 мм х 3 мм сверху с помощью клея.
- Поверх трех кусков пластика поместите вторую пару электродов Ctx-VL с электродами, обращенными вверх (используйте микроскоп и убедитесь, что электроды VL выровнены).
ПРИМЕЧАНИЕ: Выравнивание двусторонних электродов (здесь выравнивание левого и правого электродов VL) имеет важное значение для надлежащего нацеливания на желаемые двусторонние структуры. - Используйте клей для прикрепления электродов SNR сверху с электродами SNR на расстоянии 2,0 мм от электродов VL и ~ 5,0 мм от корковых электродов (электродные провода SNR должны быть обращены вверх).
- Повторите шаг 2.1.3. с другой стороны (электродные провода SNR должны быть обращены за пределы микроэлектродного массива).
- Нанесите эпоксидную смолу вокруг пластика, чтобы связать электроды вместе. Избегайте попадания эпоксидной смолы на электроды.
- Возьмите толстую проволоку и сделайте петлю на одном конце. Опустите петлю в эпоксидный раствор и поместите ее на пластик, убедившись, что толстая проволока лежит плоско (рисунок 2D), чтобы для следующих шагов этот провод можно было использовать в качестве ручки. Подождите, пока электроды полностью высохнут.
- Отрежьте провода до 2 см, как показано на рисунке 2E.
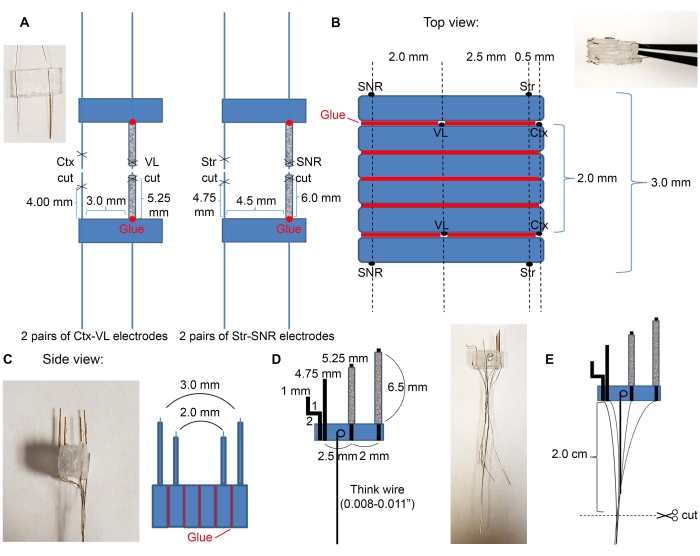
Рисунок 2: Конструкция и размеры микроэлектрода. (A) Четыре пары электродов, образованных после того, как провода были разрезаны ножницами, как показано на рисунке 1C (2 пары электродов Ctx-VL и 2 пары электродов Str-SNR). Вставьте электроды глубокой структуры (VL и SNR) в стеклянные трубки и приклейте их основания к пластику (красные точки). (B) Вид сверху: пары электродов из (A) склеены в стек для создания микроэлектродного ядра. Красными линиями обозначены клеевые линии. (C) Вид сбоку спереди (B). (D) Толстая проволока была прикреплена к микроэлектродам. (E) Провода сгруппированы, как указано, а изолированные концы соскоблены и разрезаны на 2 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Микроэлектродное подключение к гарнитуре
- Сгруппируйте провода, как показано на рисунке 2E , и соскоблите скальпелем 1 мм изолированных концов.
- Согните корковые электроды, как показано на рисунке 3А. Разделите провода, как показано на рисунке 3B. Используя тонкие щипцы, сделайте петлю на конце каждого провода (рисунок 3B).
- Держите 10-контактную гарнитуру с гемостатом (см. Таблицу материалов) и используйте деревянный конец ватного тампона, чтобы нанести минимальное количество флюса на штифты (рисунок 3C). Убедитесь, что флюс не выходит за пределы штифтов, чтобы предотвратить короткое замыкание между контактами.
- Используя деревянный конец ватного тампона, нанесите флюс на проволочные петли.
- Припаяйте петли провода к 10-контактной гарнитуре, как показано на рисунке 3C. После пайки высушите гарнитуру, чтобы предотвратить короткое замыкание между штифтами.
- Возьмите тонкий провод (0,005-0,008 дюйма) для эталонного и заземляющего проводов и снимите пластик с одного конца. Сделайте петлю на другом конце провода.
- Припаяйте зачищенную сторону опорного и заземляющего проводов к соответствующим контактам (рис. 3А, С).
- Держась за толстую проволоку (рисунок 2D), нанесите краниопластиковый цемент вокруг микроэлектродов, особенно там, где провода соединяются со штифтами. Избегайте прикосновения к фактическим торцам электрода с цементом.
- После того, как цемент высохнет, положите эпоксидную смолу в основание стеклянных трубок, стриатальных микроэлектродных проводов и весь электрод. Избегайте прикосновения к фактическим торцам электрода эпоксидной смолой. Подождите, пока электроды полностью высохнут.
- Электроды готовы. Просверлите отверстия в черепе мыши (в соответствии с требуемыми стереотаксическими координатами) с помощью зубной бормашины и имплантируйте гарнитуру, как показано на рисунке 3D , опустив гарнитуру с микроэлектродами, обращенными к черепу, и соответствующими отверстиями. Гарнитура может быть прикреплена к стереотаксической руке для поддержки во время имплантации.
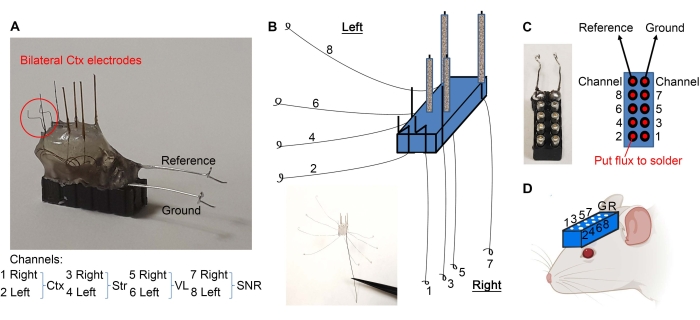
Рисунок 3: Имплантация микроэлектрода. (А) Кортикальные электроды изогнуты, как указано. (B) Провода разделены для создания петель на концах. (C) Флюс (в красных точках) и закольцованные провода припаяны к 10-контактной гарнитуре, гарантируя, что каждый провод идет к соответствующему контакту. (D) Гарнитура имплантирована для записи LFP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Маркировка расположения электрода после записи
- В конце записей LFP подтвердите правильное положение электродов в целевой области, подав ток на кончики электродов, чтобы сделать поражение, и подождите 30 минут, прежде чем перфузить мышь.
ПРИМЕЧАНИЕ: Настройки поражения для подтверждения расположения кончиков электрода: одиночный всплеск, 40 мкА, монофазный импульс квадратной волны 0,75 мс, 50 Гц, 30 с. - Анестезируют мышей изофлураном (до тех пор, пока мышь не засыпает) и перфецируют10 транскардиально с 4% параформальдегидом (PFA) в 0,1 М буфера фосфата натрия. Секция мозга (толщиной 40 мкм) на криостате (см. Таблицу материалов) и окрашивание с помощью DAPI (0,02% в PBS). Подтвердите правильное расположение электродов наличием поражений кончика электрода, как показано на рисунке 4B,C.
ПРИМЕЧАНИЕ: Процентное содержание изофлурана должно применяться в соответствии с руководящими принципами отдельного учреждения.
5. Измерение сопротивления электрода
- Измерьте сопротивление электродов и проверьте короткое замыкание среди электродов с помощью многодиапазонного омметра (см. Таблицу материалов). Установите шкалу сопротивления на R x 10 000, указывая, что отклонение единицы в указателе соответствует сопротивлению 1 кОм. Электроды длиной 2 см должны иметь сопротивление 60-70 кОм.
- Настройте гарнитуру, взяв десять отдельных контактов (см. Таблицу материалов). Припаяйте каждый штифт тонким многожильным медным проводом в кабель.
- Прижмите паяные штифты соответствующими хвостиками кабеля к 10-контактному двухрядному гнезду для сопряжения (соответствующие гнезда). Вставьте открытые контакты сопрягаемого разъема в гарнитуру LFP. Таким образом, каждый электрод LFP имеет обозначенный кабельный провод в сборке.
- Окуните наконечник каждого электрода LFP (сопротивление которого необходимо измерить) в 0,9% физиологический раствор NaCl (концентрация NaCl в крови). Подключите конец провода кабеля, соответствующий электроду LFP, к положительной клемме омметра.
- Используйте проволоку с низким сопротивлением (̴100 Ω) с одной стороны в соленой воде, а другой стороной в качестве открытого конца. Подключите открытый конец провода низкого сопротивления к заземлению указателя омметра.
ПРИМЕЧАНИЕ: Такое расположение завершает схему и вызывает отклонение указателя омметра.
- Используйте проволоку с низким сопротивлением (̴100 Ω) с одной стороны в соленой воде, а другой стороной в качестве открытого конца. Подключите открытый конец провода низкого сопротивления к заземлению указателя омметра.
- Убедитесь, что на гарнитуре нет электрического соединения между любыми двумя электродами. Проверьте электрическую изоляцию попарных электродов LFP (заземление: один кабель соответствует одному электроду; положительный: другой кабель соответствует другому электроду). Отбросьте электроды, если в этом случае наблюдается какое-либо отклонение.
Результаты
В этой работе микроэлектроды LFP использовались для картирования припадка, распространяющегося через базальные ганглии11. Одновременные записи LFP выполнялись из правой премоторной коры (где был очаг судорог) и левой ВЛ, полосатого тела и SNR (рисунок 4). Начало ?...
Обсуждение
Исторически сложилось так, что микроэлектродные массивы широко использовались для записи активности нейронов из определенной области мозга, представляющей интерес 2,3,4,5,6,7,8,9,13.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Национальным институтом здравоохранения (RO1 NS120945, R37NS119012 to JK) и Институтом мозга UVA.
Материалы
| Name | Company | Catalog Number | Comments |
| Amplifier 16-Channel | A-M Systems | Model 3600 | Amplifier |
| Cranioplasty cement | Coltene | Perm Reeline/Repair Resin Type II Class I Shade - Clear | Cement to hold microelectrodes |
| Cryostat Microtome | Precisionary | CF-6100 | To slice brain |
| Diamel-coatednickel-chromium wire | Johnson Matthey Inc. | 50 µm | Microelectrode wire |
| Dremel | Dremel | 300 Series | To drill holes in mouse skull |
| Epoxy | CEC Corp | C-POXY 5 | Fast setting adhesive |
| Hemostat | Any | To hold the headset | |
| Forceps | Any | To hold microelectrodes | |
| Light microscope | Nikon | SMZ-10 | To see alignment |
| Ohmmeter | Any | To measurre resistance | |
| Pins (Headers and matching Sockets) | Mill-Max | Interconnects, 833 series, 2 mm grid gull wing surface mount headers and sockets | To attach microelectrodes to |
| Polymicro Tubing Kit | Neuralynx | ID 100 ± 04 µm, OD 164 ± 06 µm, coating thickness 12 µm | Glass tubes |
| Pulse Stimulator | A-M Systems | Model 2100 | To mark the microelectrode location at the end of the recordings |
| Scissors | Any | To cut microelectrodes | |
| Superglue | Gorilla | Adhesive | |
| Thick wire 0.008 in. – 0.011 in. | A-M Systems | 791900 | Tick wire to hold the microelectrode array |
| Thin wire 0.005 in. - 0.008 in. | A-M Systems | 791400 | Thin wire for reference and ground |
Ссылки
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13, 407-420 (2012).
- Hubel, D. H., Wiesel, T. N. Receptive fields of single neurones in the cat's striate cortex. The Journal of Physiology. 148 (3), 574-591 (1959).
- O'Keefe, J. Place units in the hippocampus of the freely moving rat. Experimental Neurology. 51 (1), 78-109 (1976).
- Fyhn, M., Molden, S., Witter, M. P., Moser, E. I., Moser, M. B. Spatial representation in the entorhinal cortex. Science. 305 (5688), 1258-1264 (2004).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7, 446-451 (2004).
- Buckmaster, P. S., Edward Dudek, F. In vivo intracellular analysis of granule cell axon reorganization in epileptic rats. Journal of Neurophysiology. 81 (2), 712-721 (1999).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Communications Biology. 4, 1-14 (2021).
- Roy, D. S., et al. Memory retrieval by activating engram cells in mouse models of early Alzheimer's disease. Nature. 531, 508-512 (2016).
- Igarashi, K. M., Lu, L., Colgin, L. L., Moser, M. B., Moser, E. I. Coordination of entorhinal-hippocampal ensemble activity during associative learning. Nature. 510, 143-147 (2014).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Brodovskaya, A., Shiono, S., Kapur, J. Activation of the basal ganglia and indirect pathway neurons during frontal lobe seizures. Brain. 144 (7), 2074-2091 (2021).
- Ren, X., Brodovskaya, A., Hudson, J. L., Kapur, J. Connectivity and neuronal synchrony during seizures. The Journal of Neuroscience. 41 (36), 7623-7635 (2021).
- Chang, E. H., Frattini, S. A., Robbiati, S., Huerta, P. T. Construction of microdrive arrays for chronic neural recordings in awake behaving mice. Journal of Visualized Experiments. (77), e50470 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены