JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
여러 뇌 구조에서 동시에 생체 내 녹음을위한 로컬 필드 잠재적 인 미세 전극 구축
요약
본 프로토콜은 다수의 뇌 구조로부터 생체 내 국소 장 전위를 동시에 기록하기 위해 맞춤 제작된 마이크로전극 어레이의 구축을 기술한다.
초록
연구자들은 종종 여러 뇌 구조에서 동시에 국소 필드 잠재력 (LFP)을 기록해야합니다. 원하는 여러 뇌 영역에서 기록하려면 서로 다른 미세 전극 설계가 필요하지만 상업적으로 이용 가능한 마이크로 전극 어레이는 종종 이러한 유연성을 제공하지 않습니다. 여기서 본 프로토콜은 여러 뇌 구조의 LFP를 서로 다른 깊이에서 동시에 기록하기 위해 맞춤 제작된 마이크로 전극 어레이의 간단한 설계를 간략하게 설명합니다. 이 연구는 양측 피질, striatal, ventrolateral thalamic, 및 nigral microelectrodes의 건설을 예로 설명합니다. 개략적인 설계 원리는 유연성을 제공하며, 미세전극은 입체형 좌표를 계산하고 자유롭게 움직이거나 마취된 마우스의 다른 뇌 영역을 대상으로 하기 위해 구조를 신속하게 변경하여 모든 구조에서 LFP를 기록하도록 수정하고 사용자 정의 할 수 있습니다. 마이크로 전극 어셈블리에는 표준 공구 및 공급 장치가 필요합니다. 이러한 맞춤형 마이크로 전극 어레이를 통해 조사관은 뉴런 활동을 추적하기 위해 모든 구성에서 마이크로 전극 어레이를 쉽게 설계 할 수 있으므로 LFP 기록에 밀리 초 분해능을 제공합니다.
서문
국부장 전위 (LFPs)는 뇌의 세포외 공간에서 기록 된 전기 전위입니다. 이들은 뉴런 외부의 이온 농도 불균형에 의해 생성되며 작고 국부적 인 뉴런 집단의 활동을 나타내며 거대 규모의 EEG 기록1과 비교하여 특정 뇌 영역의 활동을 정확하게 모니터링 할 수 있습니다. 추정치로서, 1 mm로 분리된 LFP 미세전극은 완전히 상이한 두 개의 뉴런 집단에 상응한다. 뇌파 신호는 뇌 조직, 뇌척수액, 두개골, 근육 및 피부에 의해 필터링되는 반면, LFP 신호는 국소 신경 활동의 신뢰할 수있는 마커입니다1.
연구자들은 종종 여러 뇌 구조에서 LFP를 동시에 기록해야하지만, 상업적으로 이용 가능한 마이크로 전극 어레이는 종종 그러한 유연성을 제공하지 않습니다. 여기서, 본 프로토콜은 서로 다른 깊이에서 원하는 뇌 영역으로부터의 LFP를 동시에 기록하기 위해 완전히 사용자 정의 가능하고 쉽게 구성된 미세전극을 기술한다. LFP가 특정 뇌 영역 2,3,4,5,6,7,8,9의 신경 활동을 기록하는 데 광범위하게 사용되었지만, 현재의 쉬운 사용자 정의 가능한 설계는 여러 표면 또는 심부 뇌 영역으로부터 LFP를 기록 할 수있게합니다 11,12 . 프로토콜은 또한 뇌 영역의 입체택시 좌표를 결정하고 그에 따라 어레이를 조립함으로써 임의의 원하는 마이크로전극 어레이를 구성하도록 변형될 수 있다. 10kHz 샘플링 속도와 60-70kΩ 저항(2cm 길이)을 갖춘 이 미세전극을 통해 LFP를 밀리초 정밀도로 기록할 수 있습니다. 그런 다음 데이터를 16채널 증폭기로 증폭하고, 필터링하고(저역 통과 1Hz, 하이 패스 5kHz) 디지털화할 수 있습니다.
프로토콜
본 연구는 버지니아 대학교 동물 관리 및 사용위원회의 승인을 받았습니다. 남녀 모두(7-12주)의 C57Bl/6 마우스를 실험에 사용하였다. 동물들은 12 h 빛/12 h 암주기에서 유지되었고, 음식과 물에 대한 광고 리비툼 접근을 가졌다.
1. 미세전극 구성
- 미세전극을 구성하려면 50μm(직경) 직경의 다이멜 코팅 니켈-크롬 와이어를 사용합니다(재료 표 참조). 플랫폼 뒷면에 와이어의 한쪽 끝을 테이프로 붙이고 플랫폼에서 가장 가까운 손잡이 주위로 와이어를 세 번 감쌉니다(그림 1A,C).
참고 : 두 개의 손잡이 (2 x 5 인치)가있는 아크릴 플랫폼이 여기에 사용되었지만 모든 플랫폼을 사용할 수 있습니다.- 가장 먼 두 번째 손잡이 주위에 와이어를 뻗어 손잡이 사이에 두 개의 루프를 만듭니다. 첫 번째 손잡이 주위에 와이어를 세 번 더 감싸서 와이어를 제자리에 고정하고 끝을 플랫폼 뒤쪽에 다시 테이프로 붙입니다.
참고: 전선을 분리한 후(1.2-1.3.1단계) 양쪽에 두 개의 전선이 있어야 합니다(총 네 개의 전선, 그림 1B).
- 가장 먼 두 번째 손잡이 주위에 와이어를 뻗어 손잡이 사이에 두 개의 루프를 만듭니다. 첫 번째 손잡이 주위에 와이어를 세 번 더 감싸서 와이어를 제자리에 고정하고 끝을 플랫폼 뒤쪽에 다시 테이프로 붙입니다.
- 장력 막대를 테이프를 감싸고 와이어 아래에 놓습니다(끈끈한 면이 위쪽으로)(그림 1C).
참고 : 삼각형 아크릴 조각은 장력 막대에 사용되었으며, 테이프는 그 주위에 감겨 있습니다 (전선을 부착하기 위해 끈적 끈적한면). 텐션 바 외부의 테이프의 끈적 끈적한면은 와이어를 제자리에 유지하여 그 사이의 거리를 조정합니다. 텐션 바는 손잡이에서 ~ 2.5cm 떨어져 있어야하며 와이어가 느슨해서는 안됩니다. - 현미경과 미세 포셉을 사용하여 와이어 사이에 3mm 또는 4.5mm 간격(피질(Ctx)을 만들기 위한 와이어 사이의 3mm 간격 - 복부 시상 핵(VL) 미세전극, 삼중항(Str) - 니그랄(SNR) 미세전극)을 만들기 위한 4.5mm 간격)을 만듭니다(그림 1B).
- 현미경에서 배율을 사용하는 경우 배율 차이와 와이어 사이의 실제 거리를 계산하고 조정하십시오.
참고 : 미세 전극이 여기에 사용 된 것 이외의 구조물을 위해 구성된 경우 와이어 사이의 거리를 구조물 사이의 입체 택시 거리로 조정해야합니다. 도 2B는 와이어들이 어떻게 조직될 것인가의 예를 제공한다; Figure 2B provides a example of the wire will be organ the predetermined to the method; 따라서 다른 구조물에 대한 입체 좌표를 조정해야합니다.
- 현미경에서 배율을 사용하는 경우 배율 차이와 와이어 사이의 실제 거리를 계산하고 조정하십시오.
- 플라스틱 4개(두께 0.5mm) ~ 6mm(너비) x 3mm(높이) 4개를 자릅니다(그림 1C).
참고 : 모든 플라스틱 조각은 두께가 0.5mm 인 한 사용할 수 있습니다. 여기에서, 핀이 판매된 사각형 튜빙이 사용되었다(핀, 재료 표 참조). 다른 두께를 사용하는 경우 필요한 고정 관념 좌표에 맞게 플라스틱 조각을 더 많거나 적게 추가하십시오. - 플라스틱에 접착제( 재료 표 참조)를 바르고 전선에 놓습니다(그림 1C). 장력 막대에서 1.0cm 떨어진 와이어 중앙에서 ~ 1.0cm 떨어진 곳에 플라스틱 조각을 놓습니다. 면봉으로 과도한 수퍼 접착제를 제거하십시오.
- 수퍼 접착제가 건조 된 후 그림 1C에 표시된 순서대로 미세한 가위를 사용하여 전선을 자릅니다.
- 시판되는 키트( 표 재질 참조)를 사용하여 네 개의 7mm 유리 튜브를 절단하고 그림 2A에 표시된 대로 전극 와이어를 유리 튜브에 삽입합니다.
- VL 및 SNR 전극 쌍을 유리 튜브에 삽입합니다.
참고 : 외과 적 이식을 지원하기 위해 깊은 구조물을위한 와이어 만 유리 튜브에 삽입해야합니다. 피질 전극을 유리 튜브에 삽입하지 않도록하십시오.
- VL 및 SNR 전극 쌍을 유리 튜브에 삽입합니다.
- 접착제를 유리 튜브의 바닥에 두어 플라스틱에 연결하십시오. 접착제가 마를 때까지 잠시 기다리십시오.
- 표 1에 나타낸 바와 같이 메스를 이용하여 유리관 및 전선을 절단 하는 단계; 미세 전극의 길이가 올바른지 확인하십시오. 미세전극이 다른 구조물을 대상으로 하는 경우, 필요한 입체택시 좌표에 따라 절단 거리를 조정하십시오.
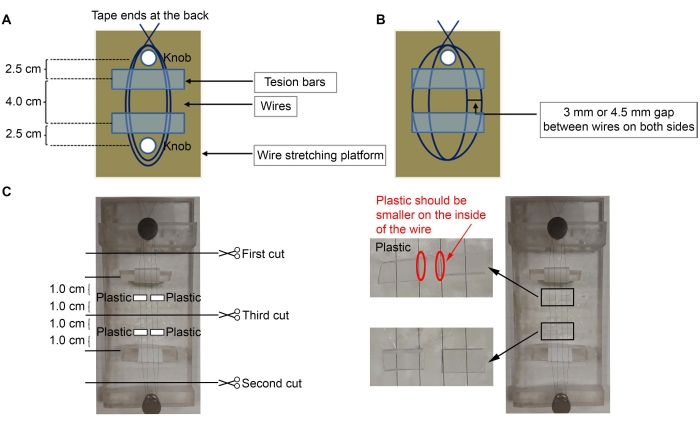
그림 1: 미세전극 구성의 회로도 . (A) 전선 아래에 장력 막대가 있는 플랫폼에 전선을 설치합니다. (B) 전선 사이의 간격. (C) 네 조각의 플라스틱이 전선에 접착됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 증권 시세 표시기 | 스트릿 | VL | 증권 시세 표시기 | |
| AP(전방/후방) | 2.2 | 1.2 | -1.3 | -3.3 |
| ML(중앙/측면) | 1.8 | 1.5 | 1 | 1.5 |
| DV (등쪽/복부) | 0.5 | 3.5 | 4 | 4.75 |
| 전극 길이 | 4 | 4.75 | 5.25 | 6 |
표 1: 입체택시 주입 좌표 및 미세전극의 치수.
2. 마이크로 전극 어레이 어셈블리
- 접착제를 사용하여 대상 영역의 원하는 순서로 플라스틱을 부착하십시오. 피질, 시상, 선조체 및 니그랄 전극에 대한 예가 도 2B,C에 도시되어 있다.
- Ctx-VL 전극 쌍을 아래로 향하게 하고(전극 와이어가 있는 면은 아래로 향해야 함) 접착제로 위에 6mm x 3mm 빈 플라스틱 조각 두 개를 연결합니다.
- 세 개의 플라스틱 조각 위에 전극이 위쪽을 향하도록 두 번째 Ctx-VL 전극 쌍을 놓습니다 (현미경을 사용하고 VL 전극이 정렬되어 있는지 확인하십시오).
참고: 양측 전극의 정렬(여기서는 왼쪽 및 오른쪽 VL 전극의 정렬)은 원하는 양측 구조를 적절하게 타겟팅하는 데 필수적입니다. - 접착제를 사용하여 SNR 전극을 VL 전극에서 2.0mm 떨어져 있고 피질 전극에서 ~ 5.0mm 떨어진 SNR 전극으로 위에 부착하십시오 (SNR 전극 와이어는 위쪽을 향해야합니다).
- 2.1.3단계를 반복합니다. 다른 쪽(SNR 전극 와이어는 마이크로전극 어레이의 외부를 향해야 함)을 위해.
- 플라스틱 주위에 에폭시 수지를 바르고 전극을 함께 결합하십시오. 에폭시 수지를 전극에 올려 놓지 마십시오.
- 두꺼운 와이어를 가져 와서 한쪽 끝에 루프를 만드십시오. 루프를 에폭시 용액에 담그고 플라스틱 위에 올려 놓고 두꺼운 와이어가 평평하게 놓여 있는지 확인하고(그림 2D) 다음 단계에서 이 와이어를 핸들로 사용할 수 있도록 합니다. 전극이 완전히 건조 될 때까지 기다리십시오.
- 그림 2E와 같이 전선을 2cm로 자릅니다.
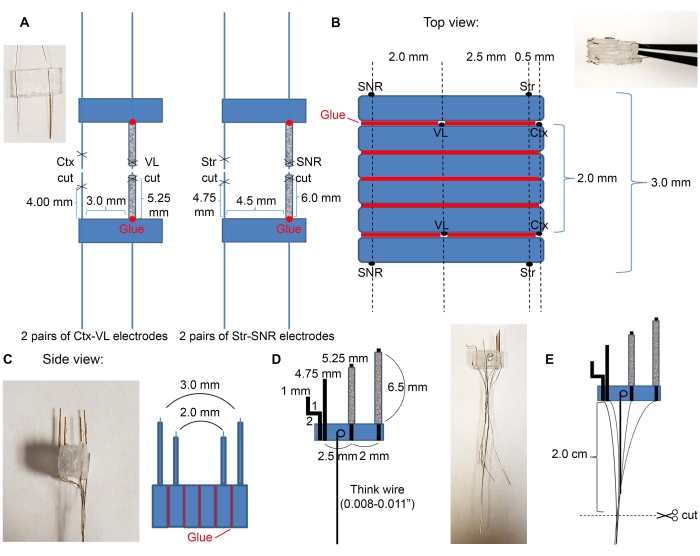
그림 2: 미세전극 구성 및 치수. (A) 도 1C에 표시된 바와 같이 전선을 가위로 절단한 후에 형성된 네 쌍의 전극(Ctx-VL 전극 2쌍 및 Str-SNR 전극 2쌍). 깊은 구조 전극 (VL 및 SNR)을 유리 튜브에 삽입하고 플라스틱에 접착하십시오 (빨간색 점). (B) 상면도: (A)로부터의 전극 쌍은 마이크로전극 코어를 생성하기 위해 스택에 접착된다. 빨간색 선은 접착제 선을 나타냅니다. (C) (B)의 정면도. (d) 두꺼운 와이어를 미세전극에 부착하였다. (E) 전선은 표시된 대로 그룹화되고 격리된 끝은 긁어내어 2cm로 절단됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 헤드셋에 마이크로 전극 연결
- 그림 2E에 표시된 대로 전선을 그룹화하고 분리된 끝 부분을 메스로 1mm씩 긁어냅니다.
- 피질 전극을 도 3A에 도시된 바와 같이 구부린다. 도 3B와 같이 전선을 분리한다. 미세한 포셉을 사용하여 각 와이어의 끝에 루프를 만듭니다(그림 3B).
- 지혈제가 있는 10핀 헤드셋( 재료 표 참조)을 잡고 면봉의 나무 끝을 사용하여 핀에 최소한의 플럭스를 적용합니다(그림 3C). 핀 사이의 단락을 방지하기 위해 플럭스를 핀 외부에 두지 마십시오.
- 면봉의 나무 끝을 사용하여 와이어 루프에 플럭스를 적용하십시오.
- 그림 3C와 같이 와이어 루프를 10핀 헤드셋에 납땜합니다. 납땜 후 헤드셋을 건조하여 핀 사이의 단락을 방지하십시오.
- 참조 및 접지선을 위해 얇은 와이어 (0.005-0.008 인치)를 가져 와서 한쪽 끝에서 플라스틱을 벗겨냅니다. 와이어의 다른 쪽 끝에 루프를 만듭니다.
- 참조 및 접지선의 벗겨진 면을 해당 핀에 납땜합니다(그림 3A,C).
- 두꺼운 와이어(그림 2D)를 잡고 미세전극 주위, 특히 전선이 핀에 연결되는 곳에 두개골성형술 시멘트를 적용합니다. 시멘트로 실제 전극 끝을 만지지 마십시오.
- 시멘트가 건조 된 후, 유리 튜브, 스트리아탈 미세 전극 와이어 및 전체 전극의 바닥에 에폭시 수지를 넣으십시오. 에폭시 수지로 실제 전극 끝을 만지지 마십시오. 전극이 완전히 건조 될 때까지 기다리십시오.
- 전극이 준비되었습니다. 치과용 드릴을 사용하여 마우스의 두개골(필요한 입체 택시 좌표에 따라)에 구멍을 뚫고 두개골과 적절한 구멍을 향하는 미세 전극으로 헤드셋을 낮추어 그림 3D 와 같이 헤드셋을 이식합니다. 헤드셋은 이식 중 지지를 위해 입체 택시 암에 부착될 수 있습니다.
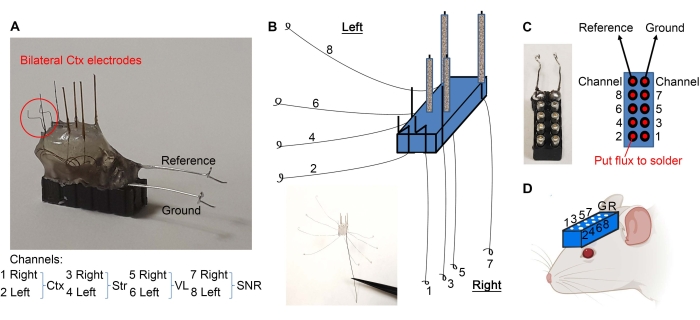
도 3: 미세전극 이식 . (A) 피질 전극은 지시된 바와 같이 구부러져 있다. (B) 전선은 끝에 루프를 만들기 위해 분리되어 있습니다. (C) 플럭스 (빨간색 점에서) 및 루프 와이어는 10 핀 헤드셋에 납땜되어 각 와이어가 적절한 핀으로 이동하도록합니다. (D) 헤드셋이 LFP를 기록하기 위해 이식되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 녹음 후 전극 위치 표시
- LFP 기록의 끝에서, 전극 팁에 전류를 인가하여 병변을 만들고 마우스를 관류하기 전에 30 분 동안 기다림으로써 표적 영역에서 전극의 정확한 위치를 확인한다.
참고: 전극 팁의 위치를 확인하기 위한 병변 설정: 단일 버스트, 40μA, 0.75ms 단방향 구형파 펄스, 50Hz, 30초. - 마우스를 이소플루란으로 마취시키고(마우스가 잠들 때까지) 0.1M 인산나트륨 완충액에 4% 파라포름알데히드(PFA)로10개를 심경 관류시킨다. 뇌를 냉동 ( 물질 표 참조) 상에 절편 (40 μm 두께) DAPI (PBS에서 0.02 %)로 염색한다. 도 4B, C에 도시된 바와 같이 전극 팁 병변의 존재에 의해 전극의 정확한 위치를 확인한다.
참고 : 이소 플루란의 비율은 개별 기관의 지침에 따라 적용해야합니다.
5. 전극 저항 측정
- 전극의 저항을 측정하고 다중 범위 옴미터를 사용하여 전극 간의 단락을 확인합니다 ( 재료 표 참조). 저항 스케일을 R x 10,000으로 설정하여 포인터의 단위 편향이 1kΩ 저항에 해당함을 나타냅니다. 2cm 길이의 전극은 60-70kΩ 저항을 가져야 합니다.
- 열 개의 개별 핀을 사용하여 헤드셋을 사용자 정의 하십시오 (자료 표 참조). 케이블에 얇은 다중 가닥 구리 와이어로 각 핀을 납땜합니다.
- 납땜된 핀을 해당 케이블 테일과 함께 10핀 이중 행 결합 소켓(일치하는 소켓)에 프레스 장착합니다. 결합 소켓의 개방형 핀을 LFP 헤드셋에 프레스 장착합니다. 이러한 방식으로, 각각의 LFP 전극은 어셈블리에 지정된 케이블 와이어를 갖는다.
- 각 LFP 전극의 팁(그 저항이 측정되어야 함)을 0.9% NaCl 식염수 용액(혈액 중의 NaCl 농도)에 담그십시오. LFP 전극에 해당하는 케이블 와이어 끝을 옴미터의 양극 단자에 연결합니다.
- 낮은 저항 (̴100 Ω) 와이어를 사용하여 한쪽은 식염수에 있고 다른면은 열린 끝으로 사용하십시오. 저저항 와이어의 열린 끝을 옴미터 포인터의 접지에 연결하십시오.
참고: 이 배열은 회로를 완료하고 옴미터 포인터의 편향을 프롬프트합니다.
- 낮은 저항 (̴100 Ω) 와이어를 사용하여 한쪽은 식염수에 있고 다른면은 열린 끝으로 사용하십시오. 저저항 와이어의 열린 끝을 옴미터 포인터의 접지에 연결하십시오.
- 헤드셋의 두 전극 사이에 전기적 연결이 없는지 확인하십시오. 쌍으로 된 LFP 전극의 전기 절연을 확인하십시오 (접지 : 하나의 케이블은 한 전극에 해당하고 양수 : 다른 케이블은 다른 전극에 해당). 이 경우 편향이 관찰되면 전극을 버리십시오.
결과
이 작업에서, LFP 미세전극은 기저 신경절11을 통한 발작 확산을 지도화하기 위해 사용되었다. 동시 LFP 기록은 오른쪽 전운동 피질(발작 초점이 있는 곳)과 왼쪽 VL, 선조체 및 SNR(그림 4)에서 수행되었다. 발작 개시는 기준선의 적어도 두 배 이상의 전압 트레이스의 편향으로 확인되었다(도 4A, 적색 화살표). 전력 스펙트럼 플롯(
토론
역사적으로, 마이크로전극 어레이는 관심 2,3,4,5,6,7,8,9,13의 특정 뇌 영역으로부터의 뉴런 활동을 기록하기 위해 광범위하게 사용되어 왔다. 그러나, 우리의 쉬운 마이?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 국립 보건원 (RO1 NS120945, R37NS119012에서 JK까지)과 UVA Brain Institute의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Amplifier 16-Channel | A-M Systems | Model 3600 | Amplifier |
| Cranioplasty cement | Coltene | Perm Reeline/Repair Resin Type II Class I Shade - Clear | Cement to hold microelectrodes |
| Cryostat Microtome | Precisionary | CF-6100 | To slice brain |
| Diamel-coatednickel-chromium wire | Johnson Matthey Inc. | 50 µm | Microelectrode wire |
| Dremel | Dremel | 300 Series | To drill holes in mouse skull |
| Epoxy | CEC Corp | C-POXY 5 | Fast setting adhesive |
| Hemostat | Any | To hold the headset | |
| Forceps | Any | To hold microelectrodes | |
| Light microscope | Nikon | SMZ-10 | To see alignment |
| Ohmmeter | Any | To measurre resistance | |
| Pins (Headers and matching Sockets) | Mill-Max | Interconnects, 833 series, 2 mm grid gull wing surface mount headers and sockets | To attach microelectrodes to |
| Polymicro Tubing Kit | Neuralynx | ID 100 ± 04 µm, OD 164 ± 06 µm, coating thickness 12 µm | Glass tubes |
| Pulse Stimulator | A-M Systems | Model 2100 | To mark the microelectrode location at the end of the recordings |
| Scissors | Any | To cut microelectrodes | |
| Superglue | Gorilla | Adhesive | |
| Thick wire 0.008 in. – 0.011 in. | A-M Systems | 791900 | Tick wire to hold the microelectrode array |
| Thin wire 0.005 in. - 0.008 in. | A-M Systems | 791400 | Thin wire for reference and ground |
참고문헌
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13, 407-420 (2012).
- Hubel, D. H., Wiesel, T. N. Receptive fields of single neurones in the cat's striate cortex. The Journal of Physiology. 148 (3), 574-591 (1959).
- O'Keefe, J. Place units in the hippocampus of the freely moving rat. Experimental Neurology. 51 (1), 78-109 (1976).
- Fyhn, M., Molden, S., Witter, M. P., Moser, E. I., Moser, M. B. Spatial representation in the entorhinal cortex. Science. 305 (5688), 1258-1264 (2004).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7, 446-451 (2004).
- Buckmaster, P. S., Edward Dudek, F. In vivo intracellular analysis of granule cell axon reorganization in epileptic rats. Journal of Neurophysiology. 81 (2), 712-721 (1999).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Communications Biology. 4, 1-14 (2021).
- Roy, D. S., et al. Memory retrieval by activating engram cells in mouse models of early Alzheimer's disease. Nature. 531, 508-512 (2016).
- Igarashi, K. M., Lu, L., Colgin, L. L., Moser, M. B., Moser, E. I. Coordination of entorhinal-hippocampal ensemble activity during associative learning. Nature. 510, 143-147 (2014).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Brodovskaya, A., Shiono, S., Kapur, J. Activation of the basal ganglia and indirect pathway neurons during frontal lobe seizures. Brain. 144 (7), 2074-2091 (2021).
- Ren, X., Brodovskaya, A., Hudson, J. L., Kapur, J. Connectivity and neuronal synchrony during seizures. The Journal of Neuroscience. 41 (36), 7623-7635 (2021).
- Chang, E. H., Frattini, S. A., Robbiati, S., Huerta, P. T. Construction of microdrive arrays for chronic neural recordings in awake behaving mice. Journal of Visualized Experiments. (77), e50470 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유