Method Article
Phénotypage basé sur l’image à haut débit pour déterminer les réponses morphologiques et physiologiques à des stress uniques et combinés chez la pomme de terre
Dans cet article
Résumé
Nous avons conçu un protocole de phénotypage basé sur l’image pour déterminer les réponses morphologiques et physiologiques aux traitements simples et combinés de chaleur, de sécheresse et d’engorgement. Cette approche a permis d’identifier les réponses précoces, tardives et de récupération à l’échelle de l’ensemble de la plante, en particulier dans les parties aériennes, et a mis en évidence la nécessité d’utiliser plusieurs capteurs d’imagerie.
Résumé
Le phénotypage basé sur l’image à haut débit est un outil puissant pour déterminer de manière non invasive le développement et les performances des plantes dans des conditions spécifiques au fil du temps. En utilisant plusieurs capteurs d’imagerie, de nombreux traits d’intérêt peuvent être évalués, notamment la biomasse végétale, l’efficacité photosynthétique, la température du couvert forestier et les indices de réflectance des feuilles. Les plantes sont fréquemment exposées à de multiples stress dans des conditions de terrain où de graves vagues de chaleur, des inondations et des sécheresses menacent gravement la productivité des cultures. Lorsque les stress coïncident, les effets qui en résultent sur les plantes peuvent être distincts en raison d’interactions synergiques ou antagonistes. Pour élucider comment les plants de pomme de terre réagissent à des stress uniques et combinés qui ressemblent à des scénarios de stress naturels, cinq traitements différents ont été imposés à un cultivar de pomme de terre sélectionné (Solanum tuberosum L., cv. Lady Rosetta) au début de la tubérisation, c’est-à-dire le contrôle, la sécheresse, la chaleur, l’engorgement et les combinaisons de stress de chaleur, de sécheresse et d’engorgement. Notre analyse montre que le stress d’engorgement a eu l’effet le plus néfaste sur les performances des plantes, entraînant des réponses physiologiques rapides et drastiques liées à la fermeture stomatique, y compris une réduction du rendement quantique et de l’efficacité du photosystème II et une augmentation de la température de la canopée et de l’indice d’eau. Dans le cadre de traitements thermiques et de stress combinés, le taux de croissance relatif a été réduit dans la phase précoce du stress. Sous l’effet de la sécheresse et de stress combinés, le volume des plantes et les performances photosynthétiques ont chuté avec une augmentation de la température et la fermeture des stomates dans la phase tardive du stress. La combinaison d’un traitement optimisé du stress dans des conditions environnementales définies et de protocoles de phénotypage sélectionnés a permis de révéler la dynamique des réponses morphologiques et physiologiques à des stress uniques et combinés. Ici, un outil utile est présenté pour les chercheurs en plantes qui cherchent à identifier les traits des plantes indiquant la résilience à plusieurs stress liés au changement climatique.
Introduction
Les effets potentiels du changement climatique, y compris l’augmentation de l’intensité et de la fréquence des vagues de chaleur, des inondations et des sécheresses, ont des impacts négatifs sur les culturesen croissance 1. Il est important de comprendre l’influence du changement climatique sur la variabilité des cultures et les fluctuations qui en résultent dans la production agricole annuelle2. Avec l’augmentation de la population et de la demande alimentaire, le maintien du rendement des plantes cultivées est un défi, il est donc urgent de trouver des cultures résistantes au climat pour la sélection 3,4. La pomme de terre (Solanum tuberosum L.) est l’une des cultures vivrières essentielles qui contribue à la sécurité alimentaire mondiale en raison de sa valeur nutritionnelle élevée et de l’efficacité accrue de l’utilisation de l’eau. Cependant, la réduction de la croissance et du rendement dans des conditions défavorables est un problème majeur, en particulier chez les variétés sensibles 5,6. De nombreuses études ont souligné l’importance d’étudier d’autres approches pour maintenir la productivité des cultures de pommes de terre, y compris les pratiques agricoles, la recherche de génotypes tolérants et la compréhension de l’impact du stress sur le développement etle rendement7,8,9, qui est également très demandé par les producteurs (ou agriculteurs) européens de pommes de terre10.
Les plateformes de phénotypage automatisées, y compris le phénotypage basé sur l’image, permettent des analyses quantitatives de la structure et de la fonction des plantes qui sont essentielles pour sélectionner les caractères d’intérêtpertinents 11,12. Le phénotypage à haut débit est une technique avancée et non invasive permettant de déterminer divers traits morphologiques et physiologiques d’intérêt de manière reproductible et rapide 13. Bien que le phénotype reflète des différences génotypiques en relation avec les effets environnementaux, la comparaison des plantes dans des conditions contrôlées avec un stress permet de relier les informations de phénotypage étendues à une condition spécifique (stress)14. Le phénotypage basé sur l’image est essentiel pour décrire la variabilité phénotypique, et il est également capable de cribler un ensemble de traits tout au long du développement des plantes, quelle que soit la taille de la population15. Par exemple, la mesure des traits morphologiques, y compris la forme, la taille et l’indice de couleur des feuilles à l’aide de capteurs d’imagerie rouge-vert-bleu (RVB), est utilisée pour déterminer la croissance et le développement des plantes. De plus, les mesures des traits physiologiques, y compris les performances photosynthétiques, la température du couvert forestier et la réflectance des feuilles, sont quantifiées à l’aide de plusieurs types de capteurs, tels que la fluorescence de la chlorophylle, l’infrarouge thermique (IR) et l’imagerie hyperspectrale16. Des études récentes dans des environnements contrôlés ont montré le potentiel de l’utilisation du phénotypage basé sur l’image pour évaluer différents mécanismes et réponses physiologiques des plantes soumises à des stress abiotiques tels que la chaleur chez la pomme de terre17, la sécheresse dans l’orge18, le riz19 et les traitements combinés de sécheresse et de chaleur chez le blé20. Même si l’étude des réponses des plantes à de multiples interactions de stress est complexe, les résultats révèlent de nouvelles perspectives dans la compréhension des mécanismes des plantes pour faire face aux changements rapides des conditions climatiques21.
Les réponses physiologiques et morphologiques des plantes sont directement influencées par les conditions de stress abiotique (température élevée, déficit hydrique et inondations), ce qui entraîne une réduction du rendement22. Même si les pommes de terre ont une efficacité d’utilisation de l’eau élevée par rapport à d’autres cultures, le déficit hydrique affecte négativement la quantité et la qualité du rendement en raison de l’architecture racinaire peu profonde5. En fonction de l’intensité et de la durée du niveau de sécheresse, l’indice de surface foliaire est réduit, et le retard de croissance de la canopée avec inhibition de la formation de nouvelles feuilles est prononcé au cours des stades ultérieurs du stress, conduisant à une réduction du taux de photosynthèse23. Le niveau seuil d’eau est critique en cas d’excès d’eau ou de périodes de sécheresse prolongées, ce qui a un effet négatif sur la croissance des plantes et le développement des tubercules en raison de la limitation de l’oxygène, de la diminution de la conductivité hydraulique des racines et de la restriction des échanges gazeux24,25. De plus, les pommes de terre sont sensibles aux températures élevées où les températures supérieures aux niveaux optimaux entraînent un retard dans l’initiation, la croissance et les taux d’assimilation des tubercules26. Lorsque les stress apparaissent en combinaison, les régulations biochimiques et les réponses physiologiques diffèrent des réponses individuelles au stress, soulignant la nécessité d’étudier les réponses des plantes aux combinaisons de stress27. Les stress combinés peuvent entraîner (encore plus) de réductions sévères de la croissance des plantes et des effets déterminants sur les caractères liés à la reproduction28. L’impact de la combinaison de stress dépend de la dominance de chaque stress sur les autres, ce qui entraîne une réponse accrue ou supprimée de la plante (p. ex., la sécheresse entraîne généralement la fermeture des stomates alors que les stomates sont ouverts pour permettre le refroidissement de la surface des feuilles en cas de stress thermique). Cependant, la recherche combinée sur le stress est encore émergente et d’autres investigations sont nécessaires pour mieux comprendre la régulation complexe qui médie les réponses des plantes dans ces conditions29. Ainsi, cette étude vise à mettre en évidence et à recommander un protocole de phénotypage utilisant plusieurs capteurs d’imagerie qui peut être adapté pour évaluer les réponses morpho-physiologiques et comprendre les mécanismes sous-jacents de la performance globale de la pomme de terre dans le cadre de traitements de stress simples et combinés. Comme on l’avait supposé, la combinaison de plusieurs capteurs d’imagerie s’est avérée être un outil précieux pour caractériser les stratégies précoces et ultérieures lors de la réponse au stress des plantes. L’optimisation du protocole de phénotypage basé sur l’image sera un outil interactif permettant aux chercheurs et aux sélectionneurs de plantes de trouver des caractères d’intérêt pour la tolérance au stress abiotique.
Protocole
1. Préparation du matériel végétal et conditions de croissance
- Transpiquer in vitro des boutures de pommes de terre (Solanum tuberosum L., cv. Lady Rosetta) issues d’une culture tissulaire dans des pots de 250 ml.
- Remplissez les pots avec du substrat Klasmman 2 entièrement saturé et conservez-les dans la chambre de culture dans des conditions de faible luminosité pendant 1 semaine.
- Ajustez les conditions d’éclairage au niveau de la canopée à 160 μmol·m-2·s-1 avec une combinaison de 25 % de lumière blanche et de 35 % d’infrarouge à l’aide d’un posemètre.
- Repiquez les plantes après 10 jours de culture des boutures in vitro en terre dans des pots de 3 L (15,5 cm de diamètre, 20,5 cm de hauteur).
- Remplissez le pot de 3 L avec 1850 g de substrat Klasmann 3:1 2 : Sable.
- Placez les plantes dans la chambre de culture dans des conditions de lumière de 320 μmol·m-2·s-1 avec une combinaison de 55% de lumière blanche et de 81% d’infrarouge et réglez-la sur un régime de jours longs (photopériode de 16 h).
- Réglez la température dans la chambre de culture à 22 °C/19 °C pour le jour et la nuit et l’humidité relative (HR) à 55 % pour toute l’expérience.
- Maintenir le poids du pot à 60% de la teneur en eau relative du sol (SRWC) comme niveau de contrôle approprié pour maintenir la croissance et le rendement30,31.
REMARQUE : D’après des essais antérieurs, le maintien d’une teneur en eau volumétrique supérieure à 60 % a favorisé la croissance de mousse à la surface du sol et a augmenté le risque de maladies des plantes. De plus, la présence de mousse pourrait générer des signaux positifs trompeurs à partir de l’imagerie de fluorescence de la chlorophylle, qui est difficile à filtrer. Utilisez l’équation suivante : SRWC% = (FW-DW)/(TW-DW) × 100, où FW est le poids frais du sol, TW est le poids de turgescence et DW est le poids sec32.- Prélever les échantillons de sol (100 g) dans trois sacs de mélange différents de substrat Klasmman 2 comme répétitions et peser le poids frais du sol.
- Saturez le sol avec de l’eau jusqu’à ce que les pots retiennent l’eau sans couler et pesez le poids de la turgescence du sol.
- Placez l’échantillon dans le four à 80 °C pendant 3 jours jusqu’à ce que les échantillons de sol soient complètement secs et pesez le poids sec du solà 33.
- Placez les tapis bleus sur la surface du pot pour réduire l’évaporation.
REMARQUE : La couleur bleue est nécessaire pour soustraire le fond de sol des pixels de la plante dans la segmentation de l’image. - Sélectionnez dix répétitions biologiques par traitement.
- Randomisez les pots pendant l’irrigation (au total, 50 pots).
- Ajoutez les supports bleus pour soutenir les plantes et éviter les dommages mécaniques lors de leur placement dans le système de phénotypage.
2. Application du stress
- Au stade précoce de la tubération (28 jours après le repiquage des boutures in vitro ), divisez les plantes en cinq groupes de traitement et phénotypez dix plantes par traitement (figure 1).
- Induire la contrainte simple et combinée à un niveau qui n’est pas préjudiciable comme suit :
- Dans la chambre de culture, gardez les plantes sous contrôle, les traitements de sécheresse et d’engorgement à 22 °C/19 °C jour/nuit (étape 1.7), avec différents pourcentages de SRWC :
Contrôle (C) avec 60 % de SRWC pour l’ensemble de l’expérience.
Sécheresse (D) avec 20% de SRWC progressivement pendant 7 jours, suivie d'1 jour de récupération.
Engorgement (W) avec 160 % de SRWC pendant 5 jours, suivi de 10 jours de récupération. - Pour maintenir le niveau d’eau au-dessus de la surface du sol lors du traitement d’engorgement, insérez un sac en plastique dans le pot vide, puis placez le pot principal avec de la terre dans le deuxième pot préparé.
- Placez les plantes dans une capsule de croissance à 30/28 °C jour/nuit et à 55 % HR pour les traitements thermiques. Imposer des contraintes thermiques simples et combinées comme suit :
- Pour la chaleur (H), maintenez la température de 30 à 28 °C avec 60 % de SRWC pendant 15 jours.
- Pour le triple stress Chaleur + Sécheresse + Engorgement (HDW), exposez les plantes à un traitement thermique à une température jour/nuit de 30 °C/28 °C pendant les 7 premiers jours (en gardant 60% de SRWC), suivi d’un traitement combiné sécheresse + chaleur pendant les 7 autres jours (20% de SRWC et 30 °C/28 °C) et enfin exposez les plantes à un stress d’engorgement pendant 1 jour. Pour ce dernier, remettez les plantes dans la chambre de culture (voir l’étape 1.7 pour les conditions) et induisez un engorgement à 160% de SRWC pendant 1 jour.
REMARQUE : Les durées sélectionnées des stress induits ont été basées sur une expérience pilote qui a montré des effets de stress sans impacts néfastes avec un taux de survie de 100 % des plantes traitées. Dans l’environnement de la chambre de croissance, la variation des conditions environnementales était de l’ordre ± 0,2 °C pour la température et ± 3 % pour l’humidité.
- Dans la chambre de culture, gardez les plantes sous contrôle, les traitements de sécheresse et d’engorgement à 22 °C/19 °C jour/nuit (étape 1.7), avec différents pourcentages de SRWC :
3. Préparation de la plante pour le phénotypage
- Après l’allumage des lumières à 6h00 dans les chambres de croissance, laisser les plantes s’acclimater dans des conditions de lumière de croissance constante (320 μmol·m-2·s-1) pendant au moins 2-3 h avant le début du protocole de phénotypage. Cela garantit que la photosynthèse et la régulation stomatique sont dans un état d’équilibre34.
- Avant la mesure, transférez les plantes de leur lieu de culture dans la zone tampon de croissance du système de phénotypage utilisé pour le chargement manuel des plantes dans le système pendant que l’évaluation automatisée est en mode veille et positionnée dans la serre (figure supplémentaire 1, figure supplémentaire 2 et figure supplémentaire 3).
REMARQUE : Les plantes ont été maintenues dans la zone tampon de croissance pendant la période de phénotypage qui a duré 3,5 h. Dans la serre, la variation des conditions environnementales était de l’ordre de ± 2 °C pour la température, ± 5 % pour l’humidité et 20 % de fluctuation de l’intensité lumineuse. Ainsi, considérez que les mesures doivent commencer immédiatement et être courtes, en évitant l’influence des conditions de serre sur les plantes. - Dans la plate-forme de phénotypage, placez les pots dans les disques qui se déplacent automatiquement sur un tapis roulant à des intervalles donnés vers le capteur d’imagerie selon les protocoles de mesure spécifiés au paragraphe 4.
- Étiquetez chaque plante/plateau avec un identifiant unique pour vous assurer que les données mesurées sont attribuées à la bonne plante tout au long de l’expérience.
4. Protocole de phénotypage
- Optimiser le protocole de phénotypage à l’aide de plusieurs capteurs d’imagerie (fluorescence de la chlorophylle, IR thermique, RVB et imagerie hyperspectrale), permettant ainsi de mesurer simultanément les paramètres physiologiques et morphologiques des plantes (Figure 2).
REMARQUE : Étant donné que les réponses des plantes reflètent les conditions environnementales et les effets diurnes, il est important d’envisager la randomisation des pots et d’effectuer le phénotypage au cours de la même période de la journée. - Dans la plateforme de phénotypage, assurez-vous que les plantes entrent dans le système par un tunnel d’adaptation (Figure 2A) où la hauteur de la plante est d’abord capturée, puis la hauteur de chaque capteur est ajustée en fonction de la distance de travail fixe.
- Effectuer les mesures en deux tours comme justifié dans le protocole de mesure à l’aide du logiciel.
- Dans un premier temps, il s’agit de mesurer les réponses physiologiques quantifiées en tant que « réactions rapides » à l’aide de la fluorescence de la chlorophylle et de l’imagerie thermique.
- Commencez par mesurer les paramètres physiologiques sous traitement de stress thermique, puis le reste des traitements.
- Dans le deuxième tour, procédez à d’autres mesures pour évaluer les réponses plus lentes, y compris l’imagerie structurelle RVB et hyperspectrale, suivie d’une évaluation du poids et de l’arrosage.
- Lors de l’étape de pesée et d’arrosage, définissez le poids de référence pour chaque plante afin de permettre l’arrosage et la pesée automatisés selon le traitement donné.
- Assurez-vous que le poids de référence total comprend le poids du disque, de l’insert situé sur la bande transporteuse, du support bleu, du tapis bleu, du pot, du sol et de la biomasse végétale dans le protocole défini.
- Pour une mesure précise de l’évapotranspiration lors de l’étape de pesée et d’arrosage, préparez des pots vides comme référence. De plus, préparez des pots supplémentaires pour corriger le poids de la biomasse végétale.
- Pour mesurer 50 plantes, la durée totale du protocole de phénotypage est de 215 min (85 min au1er tour et 130 min au2ème tour).
- Phénotypez quotidiennement toutes les plantes dans des conditions de contrôle (1 jour avant le traitement) puis induisez les traitements de stress pour surveiller les réponses dynamiques et évaluer les phases précoces et tardives du stress induit.
5. Ajuster les paramètres de chaque capteur d’image
- Imagerie par fluorescence cinétique de chlorophylle
REMARQUE : La fluorescence cinétique de la chlorophylle est utilisée pour étudier la capacité photosynthétique des plantes en réponse à différentes conditions environnementales, y compris les stress abiotiques, et pour fournir des informations précieuses sur l’efficacité quantique de la photochimie et de la dissipation de la chaleur (processus non photochimique).- Effectuer une mesure de fluorescence de la chlorophylle sur des plantes adaptées à la lumière en utilisant un protocole de lumière courte pour discriminer les réponses des plantes sous différents traitements.
- Acclimater35 plantes pendant 5 min sous la lumière dans le tunnel d’adaptation équipé de LED blanc froid (6500 K) à 500 μmol·m-2·s-1.
REMARQUE : L’imagerie par fluorescence de la chlorophylle est la première mesure après l’adaptation à la lumière utilisée pour suivre l’évolution des capacités photosynthétiques des plantes. - Sélectionner et optimiser le protocole prédéfini en fonction de la taille de l’installation et des intensités lumineuses requises.
- Optimisez les paramètres de mesure, y compris les paramètres de la caméra et de l’intensité lumineuse pour assurer l’acquisition d’un signal fort avec un rapport signal/bruit optimal.
- Ajustez les paramètres de l’appareil photo tels que l’obturateur (temps d’exposition, durée de mesure des flashs) et la sensibilité (gain électrique de l’appareil photo). Utilisez l’obturateur à 2 ms et la sensibilité à 12%.
REMARQUE : Ces valeurs sont ajustées en fonction de la taille et de la forme des feuilles et de la distance définie entre le haut de la canopée et le capteur d’imagerie. - Réglez l’intensité de la lumière actinique à 500 μmol·m-2·s-1 et réglez l’impulsion de saturation à 3200 μmol·m-2·s-1, ce qui est au moins 6 à 7 fois plus élevé que la lumière actinique.
- Ajustez les paramètres de l’appareil photo tels que l’obturateur (temps d’exposition, durée de mesure des flashs) et la sensibilité (gain électrique de l’appareil photo). Utilisez l’obturateur à 2 ms et la sensibilité à 12%.
- Pour mesurer les paramètres à l’état stationnaire de la lumière (Lss) (décrits ci-dessous), adaptez les plantes à la lumière pendant 5 minutes avant les mesures dans le tunnel d’adaptation à la lumière.
- Pour estimer le rendement quantique du photosystème à l’état stationnaire II (PSII) des plantes adaptées à la lumière, sélectionnez le protocole de lumière courte (Figure 3) et définissez le protocole comme suit.
REMARQUE : La durée du protocole était de 10 s par plante.- Commencez la mesure en allumant la lumière actinique blanc froid à 500 μmol·m-2·s-1 pendant 3 s pour mesurer la fluorescence à l’état d’équilibre dans la lumière (Ft_Lss aka. Ft')
- Appliquez une impulsion de saturation à 3200 μmol·m-2·s-1 pendant 800 ms pour mesurer la fluorescence maximale à l’état stationnaire dans la lumière (Fm_Lss aka. Fm')
- Éteignez la lumière actinique, puis allumez la lumière rouge lointain (735 nm) pour permettre au PSII de se détendre dans l’obscurité pendant 800 ms et de mesurer la fluorescence minimale à l’état stationnaire dans la lumière (Fo_Lss aka. Fo').
- Pour calculer les paramètres relatifs, utilisez un logiciel d’analyse de données qui soustrait l’arrière-plan et extrait les paramètres pertinents.
REMARQUE : Les paramètres extraits du protocole utilisé sont : l’efficacité maximale de la photochimie PSII d’un échantillon adapté à la lumière à l’état stationnaire déterminée comme Fv/Fm_Lss aka. Fv'/Fm', rendement quantique du photosystème II ou efficacité de fonctionnement du photosystème II à l’état stationnaire léger défini comme QY_Lss aka. φPSII = Fq'/Fm', et la fraction de centres de réaction ouverts dans le PSII (QA oxydé) est déterminée comme qL_Lss = (Fq'/Fv') x (F0'/Ft').
- Imagerie thermique infrarouge (IR)
REMARQUE : L’imagerie thermique IR est utilisée pour la mesure non invasive de la température réelle de la canopée, déterminant ainsi les différentes régulations stomatiques. Dans l’unité d’imagerie IR thermique, une caméra thermique est montée latéralement sur le bras robotique pour mesurer la température de la canopée depuis la vue latérale.- Pour augmenter le contraste de la température de fond par rapport à la température de l’objet imagé pendant le traitement de l’image, utilisez une paroi chauffante contrôlée automatiquement sur le côté opposé de la caméra thermique pour augmenter le contraste. Réglez la température de la paroi à 8 °C au-dessus de la température de l’air dans l’unité d’imagerie.
REMARQUE : Les images thermiques ont été acquises dans l’obscurité en utilisant le mode de balayage linéaire35. - Après l’acquisition de l’image, générez un masque végétal basé sur des données de vue latérale RVB et utilisez-le pour co-enregistrer les données thermiques dans l’analyse d’image. Cela garantit une identification précise de l’objet numérisé tout en éliminant les interférences de fond telles que le support de plante.
- Pour éviter l’influence des conditions environnementales fluctuantes tout au long de l’expérience, calculez le paramètre différence de température (delta T ou ΔT).
REMARQUE : Le delta T (ΔT) est défini comme la différence entre la température mesurée de la surface de la feuille (la moyenne de tous les pixels de l’ensemble de la surface détectée de la plante) et la température de l’air ambiant à l’intérieur de la boîte d’imagerie.
- Pour augmenter le contraste de la température de fond par rapport à la température de l’objet imagé pendant le traitement de l’image, utilisez une paroi chauffante contrôlée automatiquement sur le côté opposé de la caméra thermique pour augmenter le contraste. Réglez la température de la paroi à 8 °C au-dessus de la température de l’air dans l’unité d’imagerie.
- Imagerie RVB
REMARQUE : L’imagerie RVB est basée sur des caméras à système inertiel visuel (VIS) qui détectent la lumière dans la gamme visible de 400 à 700 nm, où elle est utilisée pour l’analyse approfondie de la morphologie et de l’architecture des plantes et l’extraction des caractéristiques de l’indice de couleur.- L’unité d’imagerie contient une table tournante pour un positionnement précis du plateau et permet simultanément une imagerie multi-angle pour les vues latérales.
- Réglez l’imagerie RVB sur l’imagerie latérale pour capturer l’usine sous trois angles (0°, 120° et 240°), qui est prise en mode de balayage linéaire (RGB1) et l’imagerie de vue de dessus en mode instantané (RGB2).
- Les deux caméras disposent d’une source lumineuse à base de LED, assurant un éclairage homogène de la plante imagée et, ainsi, déterminant avec précision les caractéristiques morphologiques et de couleur.
- Extrayez les paramètres calculés à l’aide d’un logiciel d’analyse de données.
- Pour des paramètres supplémentaires basés sur les vues latérales et supérieures, calculez le volume de la plante (biomasse numérique)36 :
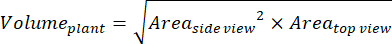
- Calculez le taux de croissance relatif (RGR)37 :
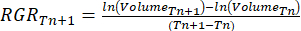
Où Tn et Tn+1 indiquent l’intervalle de temps (jours).
- Imagerie hyperspectrale
REMARQUE : L’imagerie hyperspectrale est utilisée pour la visualisation de la réflectance spectrale des plantes. Les changements dans la réflectance des feuilles sont des indicateurs de l’état physiologique différent d’une plante donnée.- Utilisez le capteur d’imagerie hyperspectrale pour quantifier la réflectance de la canopée dans la partie visible des spectres lumineux, avec une caméra hyperspectrale dans le visible-proche infrarouge (VNIR) dans la plage 380-900 nm et une caméra infrarouge à courte longueur d’onde (SWIR) dans la plage 900-1700 nm.
- Les caméras sont montées sur un bras robotique avec une source lumineuse à tube halogène (600 W) pour un éclairage homogène et spectralement approprié de l’échantillon lors de l’acquisition d’images se déplaçant sur la zone XZ.
- Les deux caméras fonctionnent en mode balayage linéaire et sont placées dans un boîtier d’imagerie isolé par la lumière.
- Avant chaque tour de mesure, effectuez deux mesures d’étalonnage (automatiquement) : l’étalonnage du courant d’obscurité et l’étalonnage radiométrique à l’aide de l’étalon de téflon à réflectance spectrale.
- L’image d’étalonnage sombre est soustraite de l’image d’étalonnage brute et blanche pour supprimer le bruit de courant d’obscurité. Ensuite, générez l’hyperspectral final en divisant l’image brute après soustraction par l’image d’étalonnage blanche.
6. Exportation de données et analyse d’images
- Utilisez le logiciel d’analyse de données pour l’extraction automatique, la soustraction d’arrière-plan et la segmentation Plant Mask du pipeline de traitement d’images (Figure 2B).
- Le logiciel effectue une analyse entièrement automatisée où l’application du masque, la soustraction de l’arrière-plan dans laquelle les plantes sont isolées de leur arrière-plan et le calcul des paramètres sont traités comme décrit pour l’imagerie RVB38 et l’imagerie thermique20.
- Extrayez les paramètres mesurés et calculés à partir des pixels spécifiques à la plante, tels que définis par le masque de plante et le masque de plateau générés par l’image RVB.
- Si les images n’ont pas été entièrement sélectionnées, ce qui peut se produire en raison de changements dans la verdure de la végétation au cours des stades ultérieurs du développement ou de l’effet du traitement du stress, ouvrez la partie analyse des données locales dans le logiciel et réajustez les paramètres du masque végétal dans le logiciel de l’analyseur de données en fonction de chaque capteur.
- Dans le traitement d’images par fluorescence de chlorophylle, ajustez les paramètres d’analyse des paramètres de fluorescence de la chlorophylle (figure supplémentaire 4).
- Définissez le seuil sur True, ce qui signifie que la segmentation de l’usine est effectuée automatiquement.
- Définissez l’index de trame du masque sur False, ce qui signifie que pour la détection du masque végétal , la trame Time-Visual est utilisée comme défini dans le protocole de fluorescence de la chlorophylle.
- Dans le traitement d’images thermiques, définissez les paramètres pour l’analyse du masque végétal (figure supplémentaire 5).
- Définissez le seuil automatique de génération du masque d’objet sur False.
- Définissez le masque de l’image latérale RVB sur True à utiliser pour l’analyse.
- Dans le traitement d’image RVB, ajustez les paramètres d’analyse des paramètres du masque végétal (figure supplémentaire 6 et figure supplémentaire 7) en fonction de l’espèce et du stade de développement.
- Sélectionnez la formule 4*G-3*B-R, qui est la définition pour la génération du masque d’objet et définit le composant de couleur utilisé (composant Rouge, Vert, Bleu).
REMARQUE : Cette formule standard et d’autres paramètres peuvent changer en fonction du type d’appareil photo utilisé (vue de dessus ou vue de la taille), du traitement appliqué et des différents cultivars. - Ajustez le seuil utilisé pour la conversion de l’image en niveaux de gris avec un canal vert amélioré en une image binaire, déterminant la surface couverte par la plante.
- Ajustez la taille médiane du filtre utilisée pour réduire le bruit et les pixels invalides et remplissez ceux qui manquent.
- Ajustez la taille minimale de l’objet en pixels à inclure dans l’analyse.
- Ajustez la taille minimale des trous dans les objets de masque en pixels, généralement des dizaines de pixels. Les trous plus petits que cette valeur sont fermés et insérés dans les pixels de l’objet.
- Définissez l’option Utiliser la réduction de la réflexion sur True pour normaliser les valeurs RVB dans chaque pixel.
- Définissez l’option Ignorer les mauvais points exposés sur True pour recadrer les pixels sur/sous-exposés du masque végétal (par exemple, l’omission des reflets de surface ou des pixels sombres où le bruit est plus grand que le signal).
- Sélectionnez la formule 4*G-3*B-R, qui est la définition pour la génération du masque d’objet et définit le composant de couleur utilisé (composant Rouge, Vert, Bleu).
- Colorez les paramètres de segmentation analysés à partir de RVB à l’aide du logiciel d’analyse de données pour fournir des informations sur les changements de couleur liés aux réponses au stress et à la sénescence des plantes.
REMARQUE : La verdure est estimée à l’aide d’une gamme prédéfinie de couleurs représentant tous les stades de développement des plantes. L’intensité des canaux de couleur de tous les pixels correspondant à la surface de l’usine a été regroupée et regroupée pour être utilisée comme carte de couleurs source pour la segmentation des couleurs.- Fournissez l’image RVB traitée (arrière-plan supprimé), la carte des couleurs - liste de teintes pour une analyse spécifique, en tant qu’entrée dans le logiciel.
- Pour obtenir des résultats impartiaux, effectuez la sélection des teintes à l’aide d’un ensemble de données d’entraînement et sélectionnez différents stades de développement et traitements.
REMARQUE : L’analyse enregistre les valeurs R, V et B de chaque pixel de chaque image à partir de ce jeu de données d’entraînement. - Définissez le nombre de teintes (sélectionnez 6 teintes) à l’aide du logiciel pour la sortie de définition des couleurs, allant de 0 à 255 pour chaque canal.
- Fournissez la liste des teintes générées dans le logiciel d’analyse de données (Couleurs).
- Dans le traitement d’images hyperspectrales, traitez les données hyperspectrales acquises à l’aide de l’analyse pixel par pixel implémentée dans le logiciel de l’analyseur hyperspectral, avec étalonnage radiométrique et du bruit sombre, soustraction de l’arrière-plan et segmentation du masque végétal. Utilisez les spectres moyens et les indices de végétation pour une analyse plus approfondie.
- Créez le masque pour l’extraction de données à partir de l’image hyperspectrale à partir de l’image VNIR prise par la caméra hyperspectrale VNIR. Pour le balayage hyperspectral SWIR, générez un masque végétal basé sur l’analyse SWIR.
- Dans VNIR Plant Mask, utilisez la formule 1.2*(2.5*(R740-R672)-1.3*(R740-R556)) pour visualiser les images où R représente la valeur de réflectance dans une longueur d’onde spécifique (Figure supplémentaire 8).
- Dans SWIR Plant Mask, utilisez la formule (R960-R1450)-(R960-R1200) dans le traitement d’images pour visualiser les images (Figure supplémentaire 9).
7. Pesée et arrosage
- Stockez le poids (avant) l’arrosage pendant la procédure de pesée et d’arrosage. Appliquez ensuite un arrosage et gardez également le poids après l’arrosage.
- Arrosez les plateaux en mode référence - chaque plateau avait une valeur de référence stockée dans la base de données, à laquelle il était toujours arrosé. Déterminer la référence en fonction du traitement.
8. Analyse des données
- Analysez les données à l’aide de l’ANOVA et du test de Shapiro.
- Effectuez des comparaisons par paires entre différents traitements par test Pairwise Wilcox dans R studio (version 4.2.3) à l’aide des packages (dplyr), (tidyverse), (rstatix) et (ggpubr).
REMARQUE : L’analyse de l’image a été effectuée automatiquement à l’aide d’un logiciel d’analyse de données. Pour une analyse plus approfondie de l’acquisition d’images, utilisez un logiciel d’analyse de données spécifique au capteur.
Résultats
Dans cette étude, le phénotypage automatisé basé sur l’image a été utilisé pour étudier les réponses morphologiques et physiologiques de la pomme de terre (cv. Lady Rosetta) en stress unique et combiné. L’approche appliquée a montré les réponses dynamiques des plantes en haute résolution spatio-temporelle lorsque le stress était induit au stade d’initiation des tubercules. Pour évaluer les phases précoces et tardives du stress, les résultats ont été présentés sur 3 périodes ([0-5 jours de phénotypage (DOP)], [6-10 DOP] et [11-15 DOP]) (Figure 1). Jusqu’à 0 DOP, toutes les plantes ont été cultivées dans des conditions de contrôle (C), puis de 1 à 5 DOP, où un stress d’engorgement (W) et un stress thermique (H) ont été appliqués. Ainsi, les réponses ont été observées comme suit : (i) dans 0-5 DOP, indique la chaleur et l’engorgement initiaux ; (ii) dans 6-10 DOP, reflétait la sécheresse précoce (D) et la chaleur et la sécheresse combinées (HD) ont été observées et (iii) dans 11-15 DOP, montrait les stress de chaleur tardive, de sécheresse et de chaleur combinée + sécheresse + engorgement (HDW). La récupération de l’engorgement a été observée dans 6-10 DOP et 11-15 DOP.
Traits morphologiques
L’imagerie RVB a été appliquée pour déterminer l’effet de différents stress et combinaisons sur la croissance des plantes au-dessus du sol. Les résultats de la figure 4 montrent que le traitement thermique et le stress d’engorgement (0-5 DOP) entraînent déjà une réduction du volume de la plante et du RGR par rapport au contrôle. Au cours de la période 6-10 DOP, le volume des plantes et le RGR des plantes témoins ont continuellement augmenté, tandis qu’en cas de chaleur, de chaleur combinée, de sécheresse et d’engorgement, cette augmentation du volume des plantes a été clairement réduite (Figure 4A). Comme les plantes sont très sensibles au stress d’engorgement, une diminution a été prononcée dans le RGR (figure 4B). Au cours du stress hydrique tardif (11-15 DOP), où le SRWC a été maintenu à 20%, une nette réduction du RGR a été observée par rapport au contrôle. Cependant, dans la phase tardive de l’HDW combiné, l’application du traitement de l’engorgement a provoqué une augmentation du RGR le dernier jour de stress.
Traits physiologiques
La combinaison de phénotypage structurel et physiologique a été appliquée pour révéler d’autres réponses au stress. L’utilisation de plusieurs capteurs d’imagerie permet de déterminer les réponses physiologiques dans la phase précoce du stress. Une analyse plus poussée des données de fluorescence de la chlorophylle a montré que l’engorgement affectait négativement l’efficacité photosynthétique où Fv'/Fm'(Fv/Fm_Lss) diminuait considérablement dans les degrés 0-5 et 6-10 DOP, mais une réponse récupératrice était observée dans les niveaux 11-15 DOP où Fv'/Fm’augmentait légèrement (figure 5A). Au cours de la phase de stress tardive (11-15 DOP), une réduction de Fv'/Fm’a été observée en cas de sécheresse et de chaleur et de sécheresse combinées. Dans les usines gorgées d’eau, l’efficacité opérationnelle des plantes (QY_Lss aliasφ PSII) était significativement plus faible par rapport aux autres traitements à 0-5 DOP et 6-10 DOP, mais une légère augmentation à 11-15 DOP, indiquant ainsi une récupération de la plante (figure 5B). De plus, les différents mécanismes de régulation de l’efficacité contribuant à la protection du PSII ont été déterminés en calculant la fraction de centres de réaction ouverts dans le PSII à l’état stationnaire léger (qL_Lss) (Figure 5C). Ce n’est qu’en période de sécheresse qu’une augmentation de qL a été observée, probablement en raison de la photoinhibition.
Ces résultats étaient conformes aux données IR qui reflétaient différents mécanismes sous-jacents sous stress (figure 6). Une augmentation du deltaT (ΔT) a été observée dans l’engorgement, réduisant le taux d’échange gazeux. En cas de sécheresse tardive et de stress combiné de chaleur et de sécheresse, une augmentation de ΔT était due à la fermeture des stomates, considérée comme l’une des principales réponses pour éviter les pertes d’eau excessives. D’autre part, une réduction de ΔT sous les traitements thermiques a été observée lorsque les stomates s’ouvrent pour améliorer l’efficacité de la transpiration et refroidir la surface des feuilles.
En examinant les données hyperspectrales, deux paramètres ont été sélectionnés à partir des données VNIR hyperspectrales pour évaluer les indices de réflectance foliaire, y compris le NDVI comme indicateur de la teneur en chlorophylle et le PRI comme indicateur de l’efficacité de la photosynthèse. Les résultats ont montré une diminution du NDVI et du PRI uniquement en cas d’engorgement, en lien avec la réduction observée des traits morphologiques (Figure 7A,B). De plus, d’après les données hyperspectrales SWIR utilisées pour évaluer la teneur en eau dans les plantes, une augmentation de l’indice d’eau dans l’engorgement a été observée pendant 0-5 DOP (Figure 7C). Cependant, lors des traitements thermiques, une réponse opposée a été observée lorsque l’indice d’eau était inférieur à celui du témoin. Ces résultats étaient en accord avec un examen de la végétation à partir de la segmentation des couleurs de la vue de dessus RVB. Les changements dans la proportion de teintes indiquent les réponses au stress au fil du temps (figure 8). L’indice de verdissement a montré une réduction de la teneur en pigments en cas de sécheresse et combinait HDW à la fin de la phase de stress et récupération progressive après le traitement par engorgement. Ainsi, l’utilisation des multiples capteurs d’imagerie a reflété la corrélation des traits morpho-physiologiques et a permis d’évaluer la performance globale de la plante sous stress abiotique.
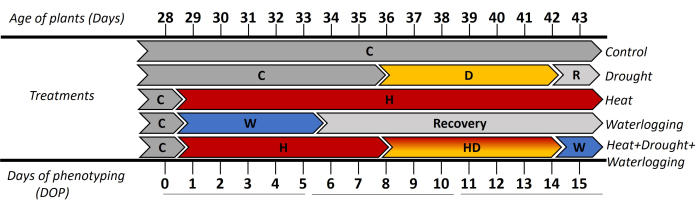
Figure 1 : Chronologie de l’application des différents traitements, y compris l’âge des plantes en jours après le repiquage des boutures in vitro. Le jour 0 du phénotypage (DOP) a été mesuré dans des conditions de contrôle (C), puis les différents stress ont été induits avec des durées différentes. De 1 à 5 DOP, une contrainte d’engorgement (W) a été appliquée et la réponse initiale du traitement thermique (H). Les jours suivants, du 6 au 10 DOP, où la phase initiale du stress hydrique (D) et du stress combiné thermique et sécheresse (HD) a été présentée. Au cours de la période 11-15 DOP, la réponse des plantes à la phase tardive de sécheresse et aux traitements thermiques et à l’application de l’engorgement à l’HD (HDW) pendant 1 jour a été reflétée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
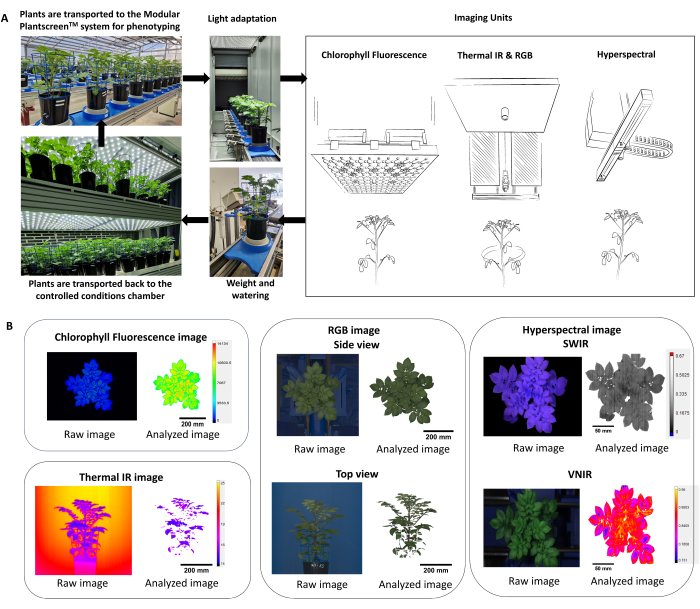
Figure 2 : Schéma résumant le protocole de phénotypage et l’analyse des données. (A) Vue d’ensemble du protocole de phénotypage. Les plantes sont transportées vers le système de phénotypage à partir des conditions contrôlées de la chambre de croissance FS-WI (PSI). Les plantes ont été acclimatées à la lumière dans la chambre d’adaptation à la lumière pendant 5 min à 500 μmol.m-2.s-1 avant les mesures. Plusieurs capteurs d’imagerie ont été utilisés pour déterminer les traits morphologiques et physiologiques, suivis de la station de pesée et d’abreuvement. En fonction du traitement, les plantes ont été remises dans des conditions contrôlées, soit à 22 °C/19 °C, soit à 30 °C/28 °C. (B) Extraction et segmentation automatiques du pipeline de traitement d’images de chaque capteur d’imagerie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
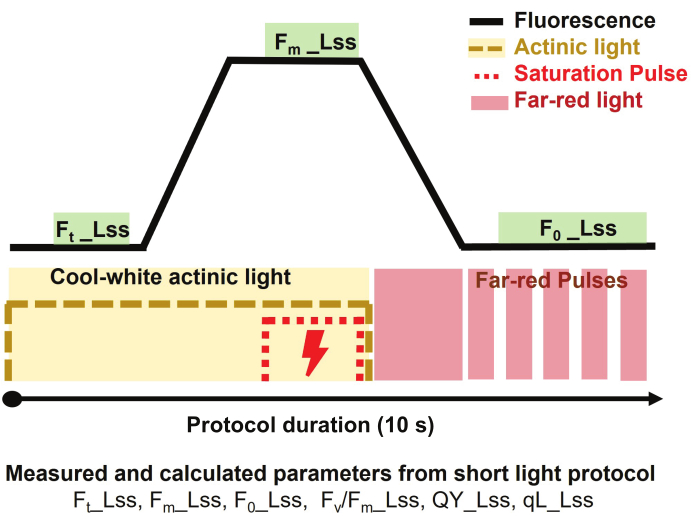
Figure 3 : Aperçu du protocole de lumière brève, pour l’imagerie par fluorescence de la chlorophylle. Le protocole de mesure a commencé par l’allumage de la lumière actinique blanc froid pour mesurer la fluorescence stationnaire dans la lumière (Ft_Lss), puis l’application d’une impulsion de saturation pour mesurer la fluorescence maximale stationnaire dans la lumière (Fm_Lss). La lumière actinique a été éteinte et la lumière rouge lointaine a été allumée pour déterminer la fluorescence minimale à l’état d’équilibre dans la lumière (Fo_Lss). La durée du protocole était de 10 s par plante. Veuillez cliquer ici pour voir une version agrandie de cette figure.
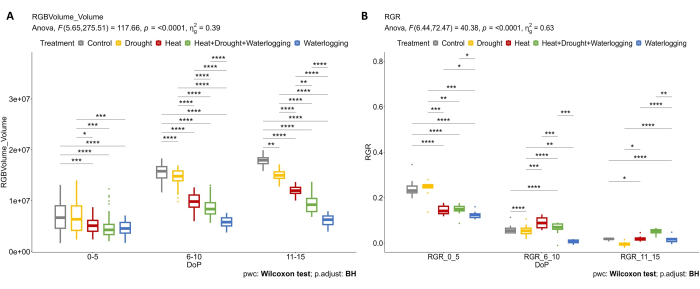
Figure 4 : Imagerie RVB utilisée pour l’évaluation morphologique. (A) Volume de la plante calculé à partir de la zone des vues supérieures et latérales RVB. (B) Taux de croissance relatif (RGR) au stade d’initiation des tubercules. Les données représentent des valeurs moyennes ±écart-type (n = 10). Veuillez cliquer ici pour voir une version agrandie de cette figure.
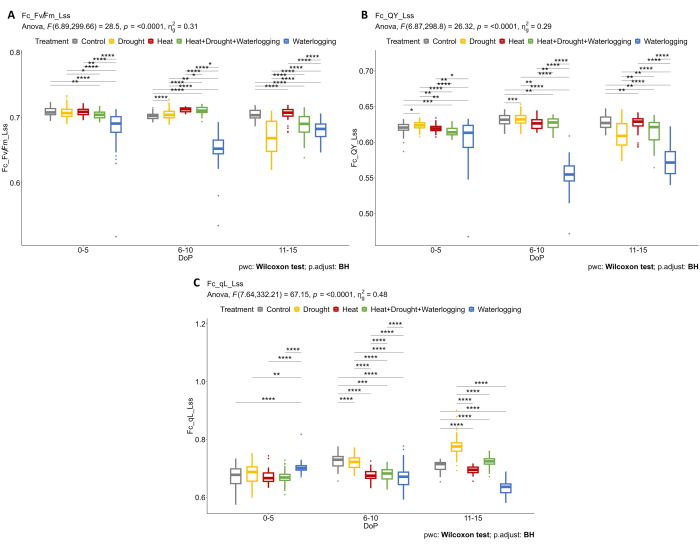
Figure 5 : Imagerie par fluorescence de la chlorophylle sur des plantes adaptées à la lumière. (A) Efficacité maximale de la photochimie PSII d’un échantillon adapté à la lumière à l’état stationnaire (Fv/Fm_Lss). (B) Rendement quantique du photosystème II ou efficacité de fonctionnement du photosystème II à l’état stationnaire léger (QY_Lss). (C) Fraction de centres de réaction ouverts dans le PSII à l’état stationnaire léger (QA oxydé) (qL_Lss). Les données représentent des valeurs moyennes ±écart-type (n = 10). Veuillez cliquer ici pour voir une version agrandie de cette figure.
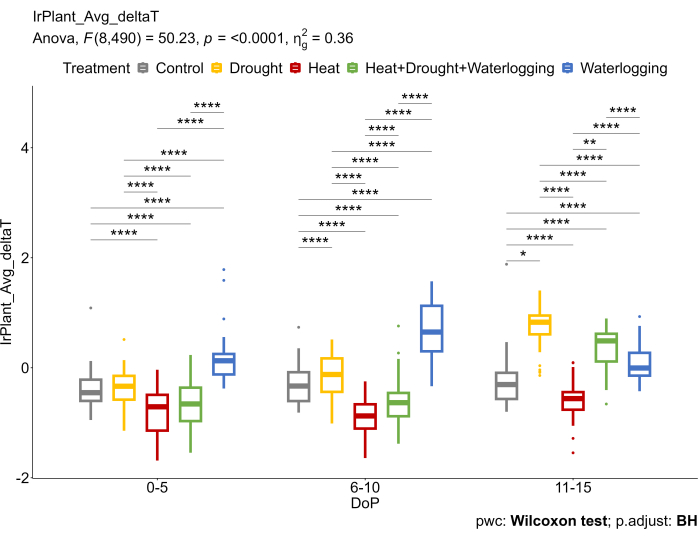
Figure 6 : L’imagerie IR thermique a été utilisée pour calculer la différence entre la température moyenne de la canopée extraite des images IR thermiques et la température de l’air (ΔT). Les données représentent des valeurs moyennes ±écart-type (n = 10). Veuillez cliquer ici pour voir une version agrandie de cette figure.
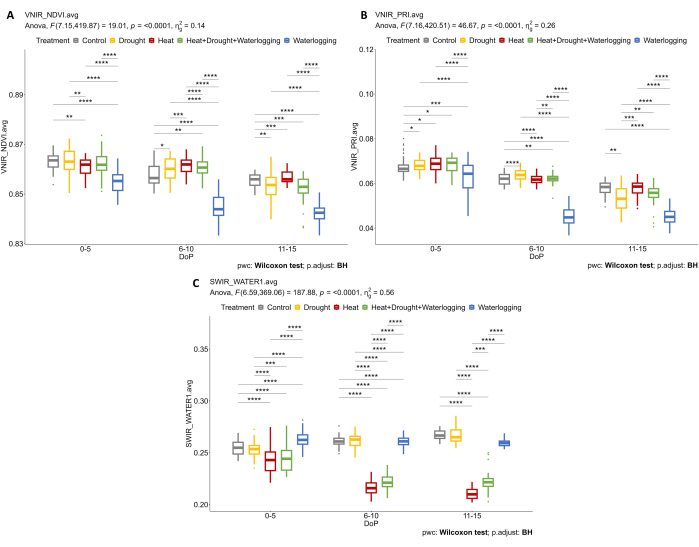
Figure 7 : Imagerie hyperspectrale pour la détermination des indices de végétation et de la teneur en eau. (A) Indice de végétation par différence normalisée (NDVI). (B) Indice de réflectance photochimique (PRI) calculé à partir de l’imagerie VNIR. (C) Indice d’eau calculé à partir de l’imagerie SWIR. Les données représentent des valeurs moyennes ±écart-type (n = 10). Veuillez cliquer ici pour voir une version agrandie de cette figure.
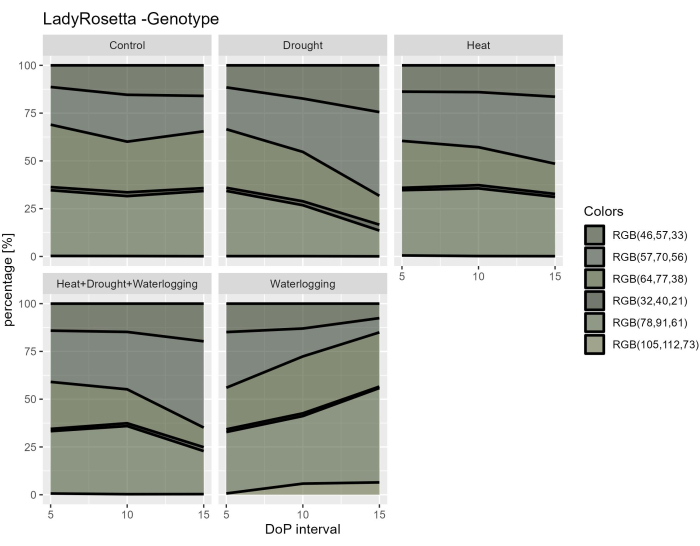
Figure 8 : Indice de verdissement des plantes sous différents traitements. Le traitement de l’image est basé sur la transformation de l’image RVB d’origine en une palette de couleurs composée de 6 teintes définies. Les données représentent des valeurs moyennes ±écart-type (n = 10). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Intensité lumineuse mesurée pendant les jours de phénotypage (DOP). La durée des mesures est de 9h00 à 12h35. LI_Buff correspond aux données médianes de 5 capteurs de lumière répartis dans la serre. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Humidité relative (HR) mesurée pendant les jours de phénotypage (DOP). La durée des mesures de 9h00 à 12h35 RH_Buff correspond aux données médianes de 5 capteurs d’humidité répartis dans la serre. RH2 fait référence à l’humidité relative dans la chambre d’adaptation. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Température mesurée pendant les jours de phénotypage (DOP). La durée des mesures de 9h00 à 12h35 T_Buff fait référence aux données médianes de 5 capteurs de température répartis dans la serre. T2 fait référence à la température dans la chambre d’adaptation. T3 fait référence à la température de la paroi chauffante. T4 fait référence à la température dans l’unité d’imagerie IR thermique. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 4 : Capture d’écran d’un logiciel d’analyse de données montrant les paramètres ajustés pour l’analyse du masque végétal dans les capteurs d’imagerie par fluorescence de chlorophylle. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 5 : Capture d’écran d’un logiciel d’analyse de données montrant les paramètres ajustés pour l’analyse des masques végétaux dans les capteurs d’imagerie infrarouge thermique. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 6 : Capture d’écran d’un logiciel d’analyse de données montrant les paramètres ajustés pour l’analyse du masque végétal dans les capteurs d’imagerie RVB à 1 vue latérale. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 7 : Capture d’écran d’un logiciel d’analyse de données montrant les paramètres ajustés pour l’analyse du masque végétal dans les capteurs d’imagerie RGB2 à vue de dessus. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 8 : Capture d’écran d’un logiciel d’analyse de données montrant les paramètres ajustés pour l’analyse des masques végétaux dans les capteurs d’imagerie VNIR. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 9 : Capture d’écran d’un logiciel d’analyse de données montrant les paramètres ajustés pour l’analyse des masques végétaux dans les capteurs d’imagerie SWIR. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Des outils d’imagerie avancés à haute résolution améliorés et des techniques de vision par ordinateur ont permis le développement rapide du phénotypage des plantes pour obtenir des données quantitatives à partir d’images massives de plantes de manière reproductible39. Cette étude visait à adapter et à optimiser la méthodologie basée sur l’imagerie à haut débit en utilisant un ensemble de capteurs d’imagerie actuellement disponibles pour surveiller les réponses dynamiques des plantes soumises à des stress abiotiques simples et combinés. Quelques étapes critiques de l’approche appliquée nécessitent des ajustements, notamment l’application de contraintes et la sélection d’un protocole d’imagerie approprié pour les mesures. L’utilisation de plusieurs capteurs pour l’acquisition d’images permet de quantifier des traits phénotypiques clés (tels que la croissance des plantes, l’efficacité photosynthétique, la régulation stomatique, la réflectance des feuilles, etc.). De plus, améliore la compréhension de la façon dont les plants de pomme de terre réagissent à différents stress abiotiques. Il s’agit d’une condition préalable essentielle à l’accélération des projets de sélection végétale visant à développer des génotypes tolérants au climat40. Les réponses morphologiques au stress induit dépendent du stade de développement. Par exemple, induire un stress au stade d’initiation du stolon ou du tubercule inhibe le développement des feuilles et des plantes et limite le nombre de stolons, réduisant ainsi le rendement final41. Cependant, dans des conditions défavorables, les plantes utilisent les réponses au stress comme réponse adaptative pour prévenir et réparer les dommages cellulaires induits par le stress42. Les plantes ont des mécanismes d’adaptation pour éviter et tolérer les conditions de stress en fonction du niveau de gravité43.
Pour comprendre les mécanismes des plantes, l’induction de la durée et de l’intensité appropriées du stress et la détermination des réponses des plantes au stress à l’aide de capteurs d’imagerie sont considérées comme l’une des étapes critiques. Lorsque plusieurs contraintes coïncident, l’intensité d’une contrainte peut l’emporter sur l’effet des autres en fonction de la combinaison, de l’intensité et de la durée des contraintes. Ainsi, les effets du stress peuvent s’additionner, ou des réponses opposées peuvent s’annuler (partiellement), ce qui entraîne finalement des effets positifs ou négatifs sur les plantes. Le protocole choisi dans cette étude était basé sur l’expérience antérieure pour s’assurer que des niveaux de stress suffisants étaient appliqués. Par exemple, l’application du stress de sécheresse a été ajustée à un niveau modéré car dans une expérience précédente, la réponse n’était pas différente des traitements de contrôle à un stade précoce du stress basés sur l’imagerie de fluorescence de la chlorophylle. Cela est dû à l’apparition de la photorespiration qui agit comme un puits alternatif pour les électrons dans la membrane thylakoïde et un mécanisme de protection pour le photosystème II44,45. Dans le cadre de la réponse combinée au stress, l’exposition des plantes à un facteur de stress primaire léger pourrait améliorer la tolérance à un facteur de stress suivant, ce qui peut avoir un impact bénéfique ou néfaste46. Dans cette étude, une réponse plus forte a été observée en cas de stress combiné par rapport au stress hydrique individuel. En étudiant d’autres réponses physiologiques, les résultats ont montré une augmentation de ΔT (deltaT) en cas de sécheresse lorsque les stomates se ferment pour éviter une perte d’eau excessive. En revanche, la réponse inverse a été observée en cas de stress thermique, où ΔT était plus faible que celui du témoin reflétant l’ouverture des stomates pour améliorer le refroidissement des feuilles, conformément aux résultats obtenus chez le blé sous stress combiné à la chaleur et à la sécheresse20. Au cours de l’engorgement, l’augmentation de ΔT due à la fermeture stomatique a résulté d’un manque d’oxygène dans le sol et d’une perturbation de l’homéostasie de l’eau racinaire, réduisant ainsi le flux de transpiration avec une augmentation de l’ABA, une hormone clé dans les réponses au stress hydrique47.
Dans les études sur le stress des plantes, la durée du stress et des traitements de récupération ultérieurs est directement proportionnelle à l’intensité du stress. Par exemple, un stress hydrique modéré, comme le maintien de l’humidité du sol à 20 % de sa capacité au champ, induit des changements phénotypiques réversibles qui se rétablissent généralement après une seule journée de réirrigation. En revanche, des conditions de stress sévères comme l’engorgement entraînent des dommages phénotypiques étendus, nécessitant une période de récupération plus longue. Bien que la normalisation des durées de traitement soit idéale, la variabilité inhérente aux intensités de contrainte doit être prise en compte dans la conception expérimentale.
La deuxième étape critique consiste à sélectionner un protocole approprié et à optimiser les paramètres de chaque capteur. La fluorescence de la chlorophylle est un outil puissant pour déterminer les performances de l’appareil photosynthétique sous stress48. Différents protocoles de mesure de la fluorescence de la chlorophylle peuvent être sélectionnés avec des plantes adaptées à la lumière ou à l’obscurité en fonction de la question de recherche et de la conception de l’expérience49. Dans cette étude, le protocole choisi (réponse à la lumière courte) permet de déterminer divers caractères, notamment F,v'/F,m', φPSII et qL, qui indiquent la performance de photosynthèse dans différentes conditions50. Des études antérieures ont montré que le protocole utilisé dans le phénotypage à haut débit est efficace pour étudier l’efficacité photosynthétique des plantes sous différentes applications de traitements de stress et pour discriminer entre les plantes saines et stressées14,20. Sur la base du plan expérimental, il est très important de prendre en compte la durée du protocole sélectionné lors de la mesure dans un système à haut débit avec une population végétale élevée. Ainsi, la mesure de la fluorescence de la chlorophylle sur des plantes adaptées à la lumière à l’aide d’un protocole de courte durée a été sélectionnée pour discriminer les réponses sous différents traitements. Les interactions génotype-environnement peuvent influencer de nombreux traits phénotypiques, ce qui est essentiel lors de la mesure12. Il est essentiel de considérer que la durée de la mesure doit être terminée dans un court laps de temps afin de minimiser l’effet diurne sur les limitations photosynthétiques51.
L’imagerie IR thermique a été utilisée pour déterminer la température de la canopée et comprendre la régulation stomatique sous différents traitements52. Il convient de mentionner que l’optimisation technologique a été utilisée lorsque le mur chauffant était situé du côté opposé de la caméra, et que la température du mur était contrôlée et programmable de manière dynamique. Ainsi, l’ajustement de la paroi chauffante de fond avec des capteurs environnementaux intégrés est nécessaire pour sélectionner correctement les plantes de l’arrière-plan en augmentant le contraste de la température de fond sur la température de l’objet imagé.
Même si l’analyse des images est automatisée, l’ajustement des indices de seuillage RVB est toujours nécessaire pour obtenir un masque binaire approprié en imagerie RVB afin de sélectionner précisément les plantes53. De plus, le choix de plusieurs angles est important pour estimer correctement les paramètres quantitatifs, notamment la biomasse numérique et le taux de croissance. Dans cette étude, trois angles (0°, 120° et 240°) sur la vue latérale RVB ont été sélectionnés et moyennés pour calculer avec précision le volume de la plante et le taux de croissance relatif.
Selon la gamme spectrale, de nombreux traits physiologiques peuvent être étudiés à l’aide de l’imagerie hyperspectrale54. Il est nécessaire de déterminer lequel des indices de réflectance fournit les informations nécessaires et montre la réponse des plantes dans différentes conditions14. Il est très demandé dans le dépistage des variétés tolérantes et le phénotypage des plantes pour déterminer la corrélation entre les indices hyperspectraux et d’autres traits physiologiques55. Dans cette étude, les plantes sous traitement d’engorgement ont montré une réponse prononcée de la teneur en chlorophylle et de l’efficacité photosynthétique de l’imagerie VNIR. De plus, des réponses différentes ont été observées dans l’indice d’eau calculé à partir de l’imagerie SWIR sous traitements thermiques et engorgement en raison de différentes régulations stomatiques et de la teneur en eau des feuilles.
Ainsi, ces résultats soulignent l’utilité d’une telle approche après avoir optimisé les paramètres et le potentiel de l’utilisation de plusieurs capteurs pour trouver des traits de stress pertinents pour la tolérance au climat. L’évaluation de la dynamique des réponses à l’aide de plusieurs capteurs d’imagerie peut être utilisée comme l’un des outils puissants pour améliorer les programmes de reproduction.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents connus ou de relations personnelles qui auraient pu sembler influencer les travaux rapportés dans cet article.
Remerciements
Ce projet ADAPT (Accelerated Development of multiple-stress tolerant Potato) a reçu un financement du programme de recherche et d’innovation Horizon 2020 de l’Union européenne dans le cadre de la convention de subvention n° GA 2020 862-858. Ce travail a été partiellement soutenu par le ministère de l’Éducation, de la Jeunesse et des Sports de la République tchèque dans le cadre du projet du Fonds européen de développement régional « SINGING PLANT » (n°. CZ.02.1.01/0.0/0.0/16_026/0008446). La plateforme Sciences végétales de CEITEC MU est reconnue pour son soutien aux installations de culture. Nous remercions Meijer BV d’avoir fourni les boutures in vitro utilisées dans cette étude. Nous remercions Lenka Sochurkova pour son aide à la conception graphique de la figure 2 et Pavla Homolová pour son aide à la préparation du matériel végétal lors des expériences au Centre de recherche sur les instruments à systèmes photoniques (PSI) (Drásov, République tchèque).
matériels
| Name | Company | Catalog Number | Comments |
| 1.1” CMOS Sensor with RGB camera | PSI, Drásov, Czech Republic | https://psi.cz/ | The sensor delivers a resolution of 4112 × 4168 pixels for side view and 2560 × 1920 pixels for top view. The sensor is extremely sensitive and is a real megapixel CCD replacement and produces sharp, low-noise images |
| FluorCam | PSI, Drásov, Czech Republic | FC1300/8080-15 | Pulse amplitude modulated (PAM) chlorophyll fluorometer |
| Fluorcam 10 software | PSI, Drásov, Czech Republic | Version 1.0.0.18106 | For Chlorophyll fluorescence images visualization and analysis |
| GigE PSI RGB – 12.36 Megapixels Camera | PSI, Drásov, Czech Republic | https://psi.cz/ | For the side view projections, line scan mode was used with a resolution of 4112 px/line, 200 lines per second. The imaged area from the side view was 1205 × 1005 mm (height × width), while the imaged area from the top view position was 800 × 800 mm. |
| Hyperspectral Analyzer software | PSI, Drásov, Czech Republic | Version 1.0.0.14 | For hyperspectral images visualization and analysis |
| Hyperspectral camera HC-900 Series | PSI, Drásov, Czech Republic | https://hyperspec.org/products/ | Visible-near-infrared (VNIR) camera 380-900 nm with a spectral resolution of 0.8 nm FWHM |
| Hyperspectral camera SWIR1700 | PSI, Drásov, Czech Republic | https://hyperspec.org/products/ | Short-wavelength infrared camera (SWIR) camera 900 - 1700 nm with a spectral resolution of 2 nm FWHM |
| InfraTec thermal camera (VarioCam HEAD 820(800)) | Flir, United States | https://www.infratec.eu/thermography/infrared-camera/variocam-hd-head-800/ | Resolution of 1024 × 768 pixels, thermal sensitivity of < 20 mK and thermal emissivity value set default to 0.95. with a scanning speed of 30 Hz and each line consisting of 768 pixels. The imaged area was 1205 × 1005 mm (height × width). |
| LED panel | PSI, Drásov, Czech Republic | https://led-growing-lights.com/products/ | Equipped with 4 × 240 red-orange (618 nm), 120 cool-white LEDs (6500 K) and 240 far-red LEDs (735 nm) distributed equally over an imaging area of 80 × 80 cm |
| Light, temperature and relative humidity sensors | PSI, Drásov, Czech Republic | https://psi.cz/ | Sensors used to monitor controlled conditions in greenhouse |
| MEGASTOP Blue mats | Friedola | 75831 | To cover soil surface |
| Morphoanalyzer software | PSI, Drásov, Czech Republic | Version 1.0.9.8 | For RGB images visualization and analysis and color segmentation analysis |
| PlantScreen Data Analyzer software (Version 3.3.17.0) | PSI, Drásov, Czech Republic | https://plantphenotyping.com/products/plantscreen-modular-system/ | To visualize and analyze the data from all imaging sensors, watering-weighing unit and environmental conditions in greenhouse |
| PlantScreen Modular system | PSI, Drásov, Czech Republic | https://plantphenotyping.com/products/plantscreen-modular-system/ | Type of phenotyping platform |
| Plantscreen Scheduler software | PSI, Drásov, Czech Republic | Version 2.6.8368.25987 | To plan the experiment and set the measuring protocol |
| SpectraPen MINI | PSI, Drásov, Czech Republic | https://handheld.psi.cz/products/spectrapen-mini/#details | Light meter to adjust light level on a canopy level |
| TOMI-2 high-resolution camera | PSI, Drásov, Czech Republic | https://fluorcams.psi.cz/products/handy-fluorcam/ | Resolution of 1360 × 1024 pixels, frame rate 20 fps and 16-bit depth) with a 7-position filter wheel is mounted on a robotic arm positioned in the middle of the multi-color LED light panel with dimensions of 1326 x 1586 mm. |
| Walk-in FytoScope growth chamber | PSI, Drásov, Czech Republic | https://growth-chambers.com/products/walk-in-fytoscope-fs-wi/ | Type of chambers used to grow the plant |
Références
- Climate Change 2021: The Physical Science Basis. IPCC Available from: https://www.ipcc.ch/report/ar6/wg1/ (2021)
- Ray, D. K., Gerber, J. S., Macdonald, G. K., West, P. C. Climate variation explains a third of global crop yield variability. Nat Commun. 6, 5989 (2015).
- Acevedo, M., et al. A scoping review of adoption of climate-resilient crops by small-scale producers in low- and middle-income countries. Nat Plants. 6 (10), 1231-1241 (2020).
- van Dijk, M., Morley, T., Rau, M. L., Saghai, Y. A meta-analysis of projected global food demand and population at risk of hunger for the period 2010-2050. Nat Food. 2 (7), 494-501 (2021).
- Handayani, T., Gilani, S. A., Watanabe, K. N. Climatic changes and potatoes: How can we cope with the abiotic stresses. Breed Sci. 69 (4), 545-563 (2019).
- Devaux, A., Goffart, J. P., Kromann, P., Andrade-Piedra, J., Polar, V., Hareau, G. The potato of the future: Opportunities and challenges in sustainable agri-food systems. Potato Res. 64 (4), 681-720 (2021).
- Dahal, K., Li, X. Q., Tai, H., Creelman, A., Bizimungu, B. Improving potato stress tolerance and tuber yield under a climate change scenario - a current overview. Front Plant Sci. 10, 563 (2019).
- Ahmad, U., Sharma, L. A review of best management practices for potato crop using precision agricultural technologies. Smart Agricultural Technology. 4, 100220 (2023).
- Cabello, R., Monneveux, P., De Mendiburu, F., Bonierbale, M. Comparison of yield based drought tolerance indices in improved varieties, genetic stocks and landraces of potato (Solanum tuberosum L). Euphytica. 193 (2), 147-156 (2013).
- von Gehren, P., et al. Farmers feel the climate change: Variety choice as an adaptation strategy of European potato farmers. Climate. 11 (9), 189 (2023).
- Fiorani, F., Schurr, U. Future scenarios for plant phenotyping. Annu Rev Plant Biol. 64, 267-291 (2013).
- Poorter, H., et al. Pitfalls and potential of high-throughput plant phenotyping platforms. Front Plant Sci. 14, 1233794 (2023).
- Berger, B., de Regt, B., Tester, M. High-throughput phenotyping of plant shoots. Methods Mol Biol. 918, 9-20 (2012).
- Humplík, J. F., Lazár, D., Husičková, A., Spíchal, L. Automated phenotyping of plant shoots using imaging methods for analysis of plant stress responses - a review. Plant Methods. 11, 29 (2015).
- Danilevicz, M. F., Bayer, P. E., Nestor, B. J., Bennamoun, M., Edwards, D. Resources for image-based high-throughput phenotyping in crops and data sharing challenges. Plant Physiol. 187 (2), 699-715 (2021).
- Abebe, A. M., Kim, Y., Kim, J., Kim, S. L., Baek, J. Image-based high-throughput phenotyping in horticultural crops. Plants. 12 (10), 2061 (2023).
- Lazarević, B., Carović-Stanko, K., Safner, T., Poljak, M. Study of high-temperature-induced morphological and physiological changes in potato using nondestructive plant phenotyping. Plants. 11 (24), 3534 (2022).
- Marchetti, C. F., et al. A novel image-based screening method to study water-deficit response and recovery of barley populations using canopy dynamics phenotyping and simple metabolite profiling. Front Plant Sci. 10, 1252 (2019).
- Kim, S. L., et al. High-throughput phenotyping platform for analyzing drought tolerance in rice. Planta. 252 (3), 38 (2020).
- Abdelhakim, L. O. A., Rosenqvist, E., Wollenweber, B., Spyroglou, I., Ottosen, C. O., Panzarová, K. Investigating combined drought- and heat stress effects in wheat under controlled conditions by dynamic image-based phenotyping. Agronomy. 11 (2), 364 (2021).
- Zandalinas, S. I., Sengupta, S., Fritschi, F. B., Azad, R. K., Nechushtai, R., Mittler, R. The impact of multifactorial stress combination on plant growth and survival. New Phytologist. 230 (3), 1034-1048 (2021).
- Raza, A., et al. Impact of climate change on crops adaptation and strategies to tackle its outcome: A review. Plants. 8 (2), 34 (2019).
- Nasir, M. W., Toth, Z. Effect of drought stress on potato production: A review. Agronomy. 12 (3), 635 (2022).
- Wagg, C., Hann, S., Kupriyanovich, Y., Li, S. Timing of short period water stress determines potato plant growth, yield and tuber quality. Agric Water Manag. 247, 106731 (2021).
- Yamauchi, T., Colmer, T. D., Pedersen, O., Nakazono, M. Regulation of root traits for internal aeration and tolerance to soil waterlogging-flooding stress. Plant Physiol. 176 (2), 1118-1130 (2018).
- Aien, A., Chaturvedi, A. K., Bahuguna, R. N., Pal, M. Phenological sensitivity to high temperature stress determines dry matter partitioning and yield in potato. Indian J Plant Physiol. 22 (1), 63-69 (2017).
- Zandalinas, S. I., Mittler, R., Balfagón, D., Arbona, V., Gómez-Cadenas, A. Plant adaptations to the combination of drought and high temperatures. Physiol Plant. 162 (1), 2-12 (2018).
- Suzuki, N., Rivero, R. M., Shulaev, V., Blumwald, E., Mittler, R. Abiotic and biotic stress combinations. New Phytologist. 203 (1), 32-43 (2014).
- Atkinson, N. J., Jain, R., Urwin, P. E. The Response of Plants to Simultaneous Biotic and Abiotic Stress. Combined Stresses in Plants. , (2015).
- Harris, P. M., Harris, P. M. . The Potato Crop. 2nd ed. , (1992).
- Weisz, R., Kaminski, J., Smilowitz, Z. Water deficit effects on potato leaf growth and transpiration: Utilizing fraction extractable soil water for comparison with other crops. Am Potato J. 71 (12), 829-840 (1994).
- Wang, X., Vignjevic, M., Jiang, D., Jacobsen, S., Wollenweber, B. Improved tolerance to drought stress after anthesis due to priming before anthesis in wheat (Triticum aestivum L.) var. Vinjett. J Exp Bot. 65 (22), 6441-6456 (2014).
- Junker, A., et al. Optimizing experimental procedures for quantitative evaluation of crop plant performance in high throughput phenotyping systems. Front Plant Sci. 5, 770 (2015).
- Smith, S. M., et al. Diurnal changes in the transcriptome encoding enzymes of starch metabolism provide evidence for both transcriptional and posttranscriptional regulation of starch metabolism in arabidopsis leaves. Plant Physiol. 136 (1), 2687-2699 (2004).
- Findurová, H., Veselá, B., Panzarová, K., Pytela, J., Trtílek, M., Klem, K. Phenotyping drought tolerance and yield performance of barley using a combination of imaging methods. Environ Exp Bot. 209, 105314 (2023).
- Klukas, C., Chen, D., Pape, J. M. Integrated analysis platform: an open-source information system for high-throughput plant phenotyping. Plant Physiol. 165 (2), 506-518 (2014).
- Paul, K., et al. Understanding the biostimulant action of vegetal-derived protein hydrolysates by high-throughput plant phenotyping and metabolomics: A case study on tomato. Front Plant Sci. 10, 47 (2019).
- Awlia, M., et al. High-throughput non-destructive phenotyping of traits that contribute to salinity tolerance in Arabidopsis thaliana. Front Plant Sci. 7, 1414 (2016).
- Li, Z., Guo, R., Li, M., Chen, Y., Li, G. A review of computer vision technologies for plant phenotyping. Comput Electron Agric. 176, 105672 (2020).
- Li, L., Zhang, Q., Huang, D. A review of imaging techniques for plant phenotyping. Sensors (Switzerland). 14 (11), 20078-20111 (2014).
- Obidiegwu, J. E., Bryan, G. J., Jones, H. G., Prashar, A. Coping with drought: Stress and adaptive responses in potato and perspectives for improvement. Front Plant Sci. 6, 542 (2015).
- Zhang, H., Zhao, Y., Zhu, J. K. Thriving under stress: How plants balance growth and the stress response. Dev Cell. 55 (5), 529-543 (2020).
- Bandurska, H. Drought stress responses: Coping strategy and resistance. Plants. 11 (7), 922 (2022).
- Wingler, A., Lea, P. J., Quick, W. P., Leegood, R. C. Photorespiration: metabolic pathways and their role in stress protection. Philos Trans R Soc Lond B Biol Sci. 355 (1402), 1517-1529 (2000).
- Baker, N. R., Rosenqvist, E. Applications of chlorophyll fluorescence can improve crop production strategies: an examination of future possibilities. J Exp Bot. 55 (403), 1607-1621 (2004).
- Georgieva, M., Vassileva, V. Stress management in plants: Examining Provisional and Unique Dose-Dependent Responses. Int J Mol Sci. 24 (6), 5105 (2023).
- Leeggangers, H. A. C. F., Rodriguez-Granados, N. Y., Macias-Honti, M. G., Sasidharan, R. A helping hand when drowning: The versatile role of ethylene in root flooding resilience. Environ Exp Bot. 213, 105422 (2023).
- Baker, N. R. Chlorophyll fluorescence: a probe of photosynthesis in vivo. Annu Rev Plant Biol. 59 (1), 89-113 (2008).
- Murchie, E. H., Lawson, T. Chlorophyll fluorescence analysis: a guide to good practice and understanding some new applications. J Exp Bot. 64 (13), 3983-3998 (2013).
- Maxwell, K., Johnson, G. N. Chlorophyll fluorescence-a practical guide. J Exp Bot. 51 (345), 659-668 (2000).
- Yokoyama, G., Ono, S., Yasutake, D., Hidaka, K., Hirota, T. Diurnal changes in the stomatal, mesophyll, and biochemical limitations of photosynthesis in well-watered greenhouse-grown strawberries. Photosynthetica. 61 (1), 1-12 (2023).
- Jones, H. G. Application of thermal imaging and infrared sensing in plant physiology and ecophysiology. Advances in Botanical Research. 41, 107-163 (2004).
- Brainard, S. H., Bustamante, J. A., Dawson, J. C., Spalding, E. P., Goldman, I. L. A digital image-based phenotyping platform for analyzing root shape attributes in carrot. Front Plant Sci. 12, 690031 (2021).
- Huber, S., Tagesson, T., Fensholt, R. An automated field spectrometer system for studying VIS, NIR and SWIR anisotropy for semi-arid savanna. Remote Sens Environ. 152, 547-556 (2014).
- Mertens, S., et al. Proximal hyperspectral imaging detects diurnal and drought-induced changes in maize physiology. Front Plant Sci. 12, 640914 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon