Method Article
Mise au point d’un modèle de choc hémorragique cliniquement pertinent chez le rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le choc hémorragique tue 1,9 million de personnes dans le monde chaque année. Les petits animaux sont fréquemment utilisés comme modèles de choc hémorragique, mais sont associés à des problèmes de standardisation, de reproductibilité et de signification clinique, ce qui limite leur pertinence. Cet article décrit le développement d’un nouveau modèle de choc hémorragique cliniquement pertinent chez le rat.
Résumé
Au cours des dernières décennies, le développement de modèles animaux nous a permis de mieux comprendre diverses pathologies et d’identifier de nouveaux traitements. Le choc hémorragique, c’est-à-dire la défaillance d’un organe due à la perte rapide d’un grand volume de sang, est associé à une physiopathologie très complexe impliquant plusieurs voies. De nombreux modèles animaux existants de choc hémorragique s’efforcent de reproduire ce qui se passe chez l’homme, mais ces modèles ont des limites en termes de pertinence clinique, de reproductibilité ou de standardisation. Le but de cette étude était d’affiner ces modèles pour développer un nouveau modèle de choc hémorragique. Brièvement, le choc hémorragique a été induit chez des rats Wistar Han mâles (âgés de 11 à 13 semaines) par une exsanguination contrôlée responsable d’une baisse de la pression artérielle moyenne. La phase suivante de 75 minutes a consisté à maintenir une pression artérielle moyenne basse, entre 32 mmHg et 38 mmHg, pour déclencher les voies physiopathologiques du choc hémorragique. La phase finale du protocole a imité les soins aux patients avec l’administration de liquides intraveineux, la solution de Ringer Lactate, pour élever la pression artérielle. Les scores de lactate et de comportement ont été évalués 16 h après le début du protocole, tandis que les paramètres hémodynamiques et les marqueurs plasmatiques ont été évalués 24 h après la blessure. Vingt-quatre heures après l’induction du choc hémorragique, la pression artérielle et diastolique moyenne a diminué dans le groupe de choc hémorragique (p < 0,05). La fréquence cardiaque et la pression artérielle systolique sont restées inchangées. Tous les marqueurs de lésions organiques ont été augmentés avec le choc hémorragique (p < 0,05). Les scores de lactatémie et de comportement ont augmenté par rapport au groupe placebo (p < 0,05). En conclusion, nous avons démontré que le protocole décrit ici est un modèle pertinent de choc hémorragique qui peut être utilisé dans des études ultérieures, notamment pour évaluer le potentiel thérapeutique de nouvelles molécules.
Introduction
Le choc hémorragique (HS) est un état de choc caractérisé par une perte importante de volume sanguin, entraînant une dysoxie tissulaire. L’HS est une pathologie complexe qui associe des modifications hémodynamiques et métaboliques ainsi que des réponses pro- et anti-inflammatoires. Environ 1,9 million de décès dans le monde sont attribués à l’hémorragie et à ses conséquences chaque année1. Les directives actuelles en matière de soins concernent principalement l’administration de liquide par voie intraveineuse (complétée ou non par des molécules vasoactives) et l’oxygénothérapie. Cependant, ces traitements sont symptomatiques et peuvent être inefficaces, ce qui explique que la mortalité associée à l’HS reste élevée2. D’où l’importance d’identifier de nouveaux mécanismes moléculaires et cellulaires et, par conséquent, des traitements pour réduire la mortalité.
Les modèles animaux permettent de décrypter les mécanismes physiopathologiques impliqués dans les maladies et de tester de nouvelles stratégies thérapeutiques. De nombreux modèles animaux de choc hémorragique existent dans la littérature. Ces modèles diffèrent non seulement par l’espèce utilisée, mais aussi par les moyens d’induire le HS (p. ex., pression fixe par rapport à volume fixe) (tableau 1, tableau 2)3,4,5,6,7,8,9,10,11,12,13 . De plus, les protocoles varient au sein d’un même type de modèle (p. ex., temps de l’hémorragie, pression artérielle moyenne ciblée) (Tableau 3)14,15,16,17,18,19,20. Compte tenu de la grande variété de modèles de choc hémorragique existants et de la complexité de la réplication de la situation clinique, l’étude préclinique de cette pathologie reste limitée. Le développement d’un modèle de choc hémorragique reproductible, standardisable et facile à mettre en œuvre est dans l’intérêt de tous. Cela faciliterait la comparaison entre les différentes études et permettrait ainsi de démêler la physiopathologie complexe du choc hémorragique. L’objectif de ce protocole était de développer un nouveau modèle cliniquement pertinent de choc hémorragique chez le rat en utilisant deux phases successives d’hémorragie avec un volume fixe suivies d’une phase fixe d’hypotension artérielle.
Tableau 1 : Espèces utilisées comme modèle pour le choc hémorragique 3,4,5,6,7,8,9,10,11,12,13. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Les différents types de choc hémorragique13. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Exemple de la diversité des modèles expérimentaux de choc hémorragique chez le rat induit par un protocole de pression fixe. Résumé des paramètres pour différents modèles expérimentaux de choc hémorragique. Les vaisseaux indiqués en rouge sont des artères, et ceux indiqués en bleu sont des veines. Pour la réanimation, le volume de sang prélevé sert de référence (sang : réanimation avec un volume identique à celui du sang prélevé lors du choc ; x2 : réanimation avec un volume deux fois supérieur à celui du sang prélevé lors du choc ; x4 : réanimation avec un volume quatre fois supérieur à celui du sang prélevé lors du choc). MAP : Pression artérielle moyenne ; RL : Lactate de Ringer 14,15,16,17,18,19,20. Veuillez cliquer ici pour télécharger ce tableau.
Protocole
Toutes les procédures ont été approuvées et réalisées dans le respect du comité régional d’éthique (protocole (#17858 et #32499, CEEA-Pays de la Loire, France) conformément à la Directive 2010/63/UE de l’Union européenne. La déclaration est conforme aux lignes directrices actuelles d’ARRIVE et au Guide for the Care and Use of Laboratory Animals des National Institutes of Health (NIH Pub. No. 85-23, révisé en 2011).
1. Statut éthique et informations générales sur les rats
- Des rats Wistar Han mâles (Charles River, Saint-Germain-Nuelles, France) ont été livrés à l’Unité Thérapeutique Expérimentale à l’âge de 10 semaines. Hébergez les rats pendant au moins 1 semaine à une température standard (21-24 °C), une humidité (40%-60%) et un cycle lumière/obscurité de 12 h avec une période de lumière commençant à 07h30.
- Fournir de la nourriture et de l’eau à volonté. Utilisez des rats âgés de 11 à 13 semaines pesant 300 à 400 g pour le protocole.
2. Étapes d’aménagement et de préparation de la salle
- Allumez la station d’anesthésie, réglez le tapis chauffant à 37,5 °C et couvrez-le d’un champ non stérile.
- Stérilisez les instruments chirurgicaux nécessaires au protocole : pince atraumatique DeBakey (1), ciseaux ou scalpel fins et tranchants (1), pince à motif standard (2), porte-aiguilles (1), micro-ciseaux de dissection Vannas (1), pince (1).
- Préparez des cathéters pour la veine jugulaire et l’artère fémorale.
- Pour le cathéter de la veine jugulaire, montez un tube en polyéthylène (PE) (PE50) sur une aiguille de 23 G avec l’extrémité de l’embout.
- Pour le cathéter de l’artère fémorale, préparez celui décrit à l’étape 2.3.1 et fixez un tube PE10 à l’extrémité du tube PE50.
- Préparez le transducteur de pression et les cathéters pour l’artère fémorale et la veine jugulaire en les remplissant d’une solution de Ringer lactée héparinée à 100 UI/mL. Placez une seringue de 2 mL contenant une solution de Ringer lactée héparinée à 100 UI/mL à l’extrémité des cathéters et du transducteur de pression. Veillez à ne pas avoir de bulles, car elles provoquent des défauts de signal.
- Allumez le logiciel associé au transducteur de pression et calibrez-le selon les instructions du fournisseur.
3. Préparation du rat à la chirurgie
- Anesthésier le rat à l’aide d’une boîte à induction (paramètres : sévoflurane 8%, débit d’air : 1 L/min). Après avoir vérifié la profondeur de l’anesthésie par réflexe de pédale, maintenir l’anesthésie à 4% de sévoflurane avec un débit d’air de 0,6 L/min. L’utilisation d’antalgiques en préopératoire a été évitée en raison des effets hémodynamiques de ces molécules.
REMARQUE : À partir de cette étape, la profondeur de l’anesthésie est évaluée toutes les 20 minutes par réflexe de pédale. - Pesez le rat, placez-le en position de décubitus dorsal sur un tapis chauffant et épilez-le au niveau de l’inguine et du cou.
- Désinfectez les zones épilées avec des solutions de povidone iodée à 10 % et à 4 % (3 fois chacune) à l’aide de compresses de gaze non stériles.
- Appliquez une goutte de pommade ophtalmique sur les yeux de l’animal pour éviter le dessèchement.
- Placez le rat sur un tapis chauffant sur la table d’opération (décubitus dorsal). Placez la sonde rectale lubrifiée pour contrôler la température du rat. Maintenir l’anesthésie à 4 % de sévoflurane avec un débit d’air de 0,6 L/min.
- Remplacez les gants par des gants stériles, placez le drap stérile sur le rat et coupez-le dans les régions inguinale et cervicale.
4. Canulation de la veine jugulaire
- Localisez la région jugulaire dans la région inférieure droite du cou, au-dessus de la clavicule, par pulsation visible. À l’aide de la pince atraumatique DeBakey, saisissez doucement la peau, puis faites une incision précise à l’aide de ciseaux fins et tranchants ou d’un scalpel.
- Appliquez une goutte d’anesthésique local (lidocaïne 2%) sur la zone incisée. Coupez doucement le tissu avec une pince à motif standard.
- Localisez la veine jugulaire et libérez-la doucement de son compartiment musculaire avec une pince à motif standard. Placez un fil de suture en soie 4/0 et ligaturez solidement le côté distal (vers la tête). Utilisez la suture avec les porte-aiguilles pour tendre la veine jugulaire.
- Placez une suture 4/0 sur le côté proximal (vers le cœur) et préparez un nœud de chirurgien sans le resserrer. Faites une petite incision dans la veine jugulaire à l’aide de ciseaux de micro-dissection Vannas.
- Après avoir soigneusement saisi la paroi veineuse à l’aide d’une petite pince, insérez le cathéter PE50 dans la veine jugulaire à la main ou à l’aide d’une pince à motif standard. À ce stade, utilisez un tampon de gaze stérile pour essuyer les éventuelles gouttes de sang, qui peuvent s’écouler de la veine.
- Avancez légèrement le cathéter (0,5 cm) et vérifiez son bon placement dans la veine en prélevant une petite quantité de sang, puis en le réinjectant (le sang dans la canule indique qu’il se trouve dans la veine). Serrez le nœud préalablement préparé pour fixer le cathéter.
- Laissez le cathéter en place, attaché à une seringue pré-remplie de solution de Ringer lactate, et couvrez la zone incisée avec un tampon de gaze stérile humidifié.
5. Canulation de l’artère fémorale
- Utilisez une pince atraumatique DeBakey pour saisir la peau du triangle de Scarpa de la jambe gauche et faites une incision avec des ciseaux fins et tranchants ou un scalpel. Appliquez une goutte d’anesthésique local (lidocaïne 2%) sur la zone incisée. Dilacérez doucement le tissu à l’aide d’une pince à motif standard.
- Localisez la triade fémorale (artère, veine et nerf). Passez une pince sous la triade et, à l’aide de la deuxième pince standard, séparez très doucement l’artère du nerf et de la veine fémorale.
REMARQUE : L’artère est plus petite, rose et pulsée. Il s’agit d’une étape cruciale ; La veine et l’artère sont fragiles et peuvent facilement se rompre. - Placez une suture 4/0 et ligaturez l’artère fémorale distalement (côté jambe). Prenez la suture avec les porte-aiguilles pour mettre en tension l’artère fémorale. Placez une suture 4/0 sur le côté proximal (côté cœur) et préparez un nœud sans le fermer. Clamper l’artère (placer la pince en amont de la suture latérale proximale).
- Incisez l’artère fémorale transversalement avec des ciseaux de micro-dissection Vannas (un petit volume de sang doit s’écouler de l’artère). À l’aide d’une pince à motif standard, saisissez doucement la paroi de l’artère et canulez l’artère fémorale avec le cathéter (PE10 terminé), en la tenant avec une pince.
- Desserrez doucement pour vérifier s’il n’y a pas de fuites, puis vérifiez le signal de pression (confirme que le cathéter est dans l’artère fémorale) et vérifiez que le sang ne retourne pas dans le cathéter (signe de fuite des valves/transducteur de pression).
- Si le signal est bon (valeurs attendues : pression artérielle systolique : 120 mmHg, pression artérielle diastolique : 80 mmHg) et qu’il n’y a aucun signe de fuite, avancez légèrement le cathéter (0,5 cm) et resserrez le nœud du chirurgien préalablement préparé.
- Héparinisez l’animal à 100 UI/kg et appliquez un tampon de gaze stérile humidifié sur la zone incisée. Après la chirurgie, maintenir l’anesthésie à 3 % de sévoflurane à un débit d’air de 0,6 L/min.
6. Protocole de choc hémorragique (Figure 1)
- Phase 1 : Stabilisation (5 min).
- Après l’héparinisation, attendez 10 min que les valeurs de pression se stabilisent. Faites un enregistrement de 5 minutes pour les valeurs hémodynamiques basales.
- Phase 2 : Exsanguination (5 min) :
REMARQUE : Cette phase correspond à la phase de volume fixe du modèle.- Prélever 5 mL de sang dans l’artère fémorale pendant 5 min (500 μL/30 s) à l’aide d’une seringue de 1 mL (valeurs attendues : pression artérielle systolique : 45 mmHg, pression artérielle diastolique : 30 mmHg).
- Préparez un mélange de solution de Ringer à 50 % de lactate avec 50 % de sang prélevé à température ambiante. Placez le mélange dans une seringue de 2 mL et placez-le à l’extrémité de la canule de la veine jugulaire.
- Phase 3 : Choc hémorragique (75 min)
REMARQUE : Cette phase est la phase à pression fixe du modèle.- Maintenir la pression artérielle moyenne à une moyenne de 35 mmHg. Lorsque la pression artérielle moyenne est supérieure ou égale à 38 mmHg, prélever 200 μL de sang par l’artère fémorale (moyenne sur n = 12 rats : 10,2 mL).
- Si la pression artérielle moyenne descend en dessous de 32 mmHg, injecter 200 μL d’une solution de Ringer à 50 % de sang et à 50 % de lactate par la veine jugulaire (moyenne sur n = 12 rats : 0,90 mL).
- Mesurer le lactate sanguin périphérique sur une goutte de sang à partir de l’extrémité de la queue à l’aide de la pointe d’une aiguille (26 G) après préparation stérile de la queue avec un tampon de gaze à la fin de la phase de choc hémorragique.
- Phase 4 : Réanimation liquidienne intraveineuse (20 min)
- Réanimer avec une solution de Ringer lactate à température ambiante (RT) à 10 mL/kg pendant 20 min (débit de 10,5 mL/h pour un rat de 350 g) avec une seringue de 20 mL à travers le cathéter jugulaire à l’aide d’un pousse-seringue.
7. Fin de l’intervention chirurgicale et convalescence et suivi post-opératoire
- Clampez la veine jugulaire et l’artère fémorale et retirez le cathéter. Navires de ligature. Vérifiez soigneusement qu’il n’y a pas de fuite de sang.
- Ajoutez une goutte d’anesthésique local dans les zones incisées. Suturez les zones incisées avec des points sous-cutanés et cutanés à l’aide d’une suture stérile 5-0. Désinfecter avec une solution de povidone iodée à 10 %.
- Injecter par voie sous-cutanée de la buprénorphine (0,05 mg/kg, 0,3 mL/kg) à l’aide d’une seringue de 1 mL avec une aiguille de 26 g.
- Attendez que le rat soit sevré de l’anesthésie tout en surveillant la température. Lorsqu’il montre des signes de réveil (vibrisses qui bougent, mouvements des pattes), retirez la sonde rectale et placez le rat dans sa cage sur un tapis chauffant. 10 min plus tard, ramenez le rat dans sa chambre d’hébergement.
- Administrer la buprénorphine par voie sous-cutanée (0,05 mg/kg, 0,3 mL/kg) toutes les 8 h.
- Évaluer la fréquence respiratoire, le comportement, la température et le lactate sanguin 16 h après l’induction du choc hémorragique, comme décrit à l’étape 6.3.
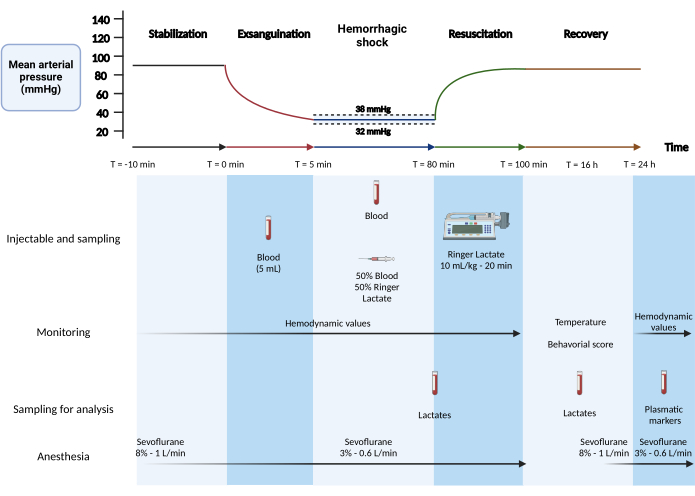
Figure 1 : Modèle de choc hémorragique mixte chez le rat. Créé avec BioRender.com Cliquez ici pour voir une version agrandie de cette figure.
8. 24 h après l’induction du choc hémorragique
- Anesthésie l’animal comme décrit à l’étape 3.1. Placez l’animal sur la table chirurgicale et insérez la sonde rectale comme décrit à l’étape 3.5. Préparez le cathéter pour la canulation de l’artère carotide comme décrit pour la veine jugulaire aux étapes 2.3 et 2.4.
- Utilisez la pince atraumatique DeBakey pour saisir la peau et faire une incision au milieu du cou avec des ciseaux fins et tranchants ou un scalpel. Appliquez une goutte d’anesthésique local (lidocaïne 2%).
- Dilacérez doucement le tissu à l’aide d’une pince à motif standard. Séparez les glandes salivaires, puis ouvrez le muscle trachéal pour révéler les anneaux trachéaux.
- Prenez l’artère carotide gauche et séparez-la du nerf à l’aide d’une pince standard (il est fort probable que la respiration de l’animal s’accélère). Lister l’artère carotide distalement (côté tête) avec du fil de soie 4/0.
- Placez un fil de suture sur la face proximale (côté cœur) et préparez un nœud de chirurgien sans le fermer. Clamper l’artère (placer la pince en amont de la suture latérale proximale).
- Incisez l’artère carotide avec des ciseaux de micro-dissection Vannas (un petit volume de sang doit s’écouler de l’artère). À l’aide d’une pince à motif standard, saisissez doucement la paroi de l’artère pour agrandir l’ouverture et canulez l’artère carotide avec le cathéter fourni, en la tenant avec une pince.
- Desserrez et vérifiez le signal de pression pour confirmer l’emplacement du cathéter, et vérifiez que le sang ne retourne pas dans le cathéter (signe de fuite des valves/transducteur de pression).
- Si le signal est bon et qu’il n’y a pas de fuite, avancez légèrement le cathéter (0,5 cm) et serrez et fixez le nœud du chirurgien préalablement préparé.
- Héparinisez l’animal à 100 UI/kg et appliquez une compresse stérile humidifiée sur l’incision.
- Après la chirurgie, maintenez l’anesthésie à l’aide de sévoflurane à 3 % à un débit d’air de 0,6 L/min.
- Attendre 10 min pour enregistrer les valeurs hémodynamiques sur 24 h (valeurs attendues : pression artérielle systolique : 120 mmHg, pression artérielle diastolique : 60 mmHg).
- Pour évaluer les marqueurs plasmatiques de lésions aux organes, prélevez 1 mL de sang de l’artère carotide et centrifugez à 1600 x g pendant 10 min. Aliquote et conservez le plasma pour une analyse plus approfondie.
- Sacrifiez le rat immédiatement après avoir mesuré les valeurs hémodynamiques à 24 h et prélevez du sang.
REMARQUE : La méthode d’euthanasie doit être adaptée aux paramètres spécifiques ou aux échantillons qui seront prélevés par la suite. Le groupe fictif subit une intervention chirurgicale uniquement (sections 1-5, 7 et 8) sans procédure de choc hémorragique (section 6). Les animaux ont été répartis au hasard par l’expérimentateur entre les groupes de choc simulé et hémorragique. Seul l’expérimentateur était au courant de l’affectation des groupes aux différentes étapes de l’expérience.
Résultats
En suivant le protocole décrit ci-dessus, nous avons évalué plusieurs paramètres hémodynamiques 24 heures après l’induction du choc hémorragique. La pression artérielle moyenne basale (avant le début du protocole de choc hémorragique) est similaire entre les groupes de choc simulé et de choc hémorragique (Figure 2A). Comme prévu, la pression artérielle moyenne est significativement diminuée avec le protocole de choc hémorragique, ce qui peut s’expliquer par la baisse de la pression artérielle diastolique (Pression artérielle moyenne : Simulacre : 92 mmHg ± 3 mmHg ; HS : 82 mmHg ± 2 mmHg ; Pression artérielle diastolique : 73 mmHg ± 3 mmHg ; HS : 61 mmHg ± 2 mmHg) (figures 2B et C). Le choc hémorragique n’a pas d’impact sur la pression artérielle systolique, le pouls et la fréquence cardiaque (Figure 2D-F). L’indice de choc (rapport fréquence cardiaque/pression artérielle systolique) et l’indice de choc modifié (MSI) (rapport fréquence cardiaque/pression artérielle moyenne) sont deux prédicteurs de mortalité chez les patients sévères14,15. Plus les valeurs sont élevées, plus le risque de mortalité est élevé. Dans ce modèle, l’indice de choc n’est pas modifié entre les deux groupes, tandis que l’indice de choc modifié a tendance à augmenter dans le choc hémorragique (MSI : Simulacre : 4,24 ± 0,11 ; HS : 4,70 ± 0,15) (Figure 2G, H).
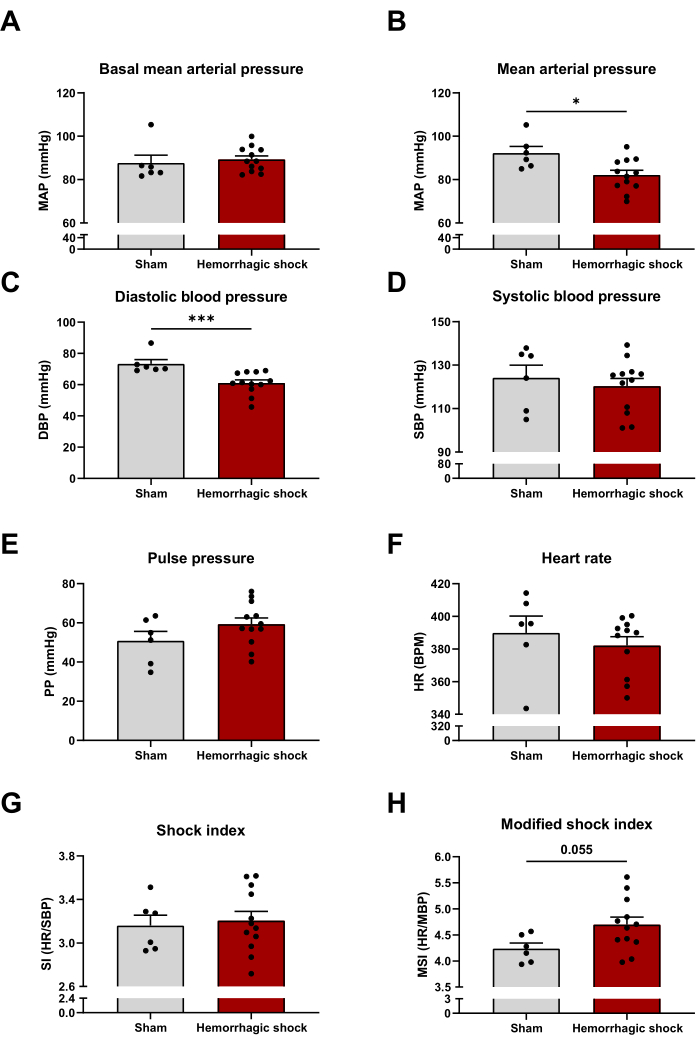
Figure 2 : Impact du choc hémorragique sur les paramètres hémodynamiques. (A) pression artérielle moyenne basale, (B) pression artérielle moyenne, (C) pression artérielle diastolique, (D) pression artérielle systolique, (E) pression du pouls, (F) fréquence cardiaque, (G) indice de choc et (H) indice de choc modifié entre les animaux de choc simulés et hémorragiques. Les résultats sont représentés sous forme de moyenne ± SEM. La signification statistique a été évaluée par un test t non apparié. * : p < 0,05 ; : p < 0,001. n = 6 à 12. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’altération métabolique globale pendant le choc hémorragique peut être évaluée par la lactatémie. Comme prévu, la lactatémie a augmenté après le protocole de choc hémorragique et 16 h après (Fin du protocole : Simulacre : 1,13 mmol/L ± 0,14 mmol/L ; HS : 5,98 mmol/L ± 0,39 mmol/L ; H+16 : Placebo : 1,95 mmol/L ± 0,23 mmol/L ; HS : 2,95 mmol/L ± 0,19 mmol/L) (figures 3A et B). La température et la fréquence respiratoire sont deux composantes du syndrome de réponse inflammatoire systémique (SIRS), une réponse pro-inflammatoire caractéristique de l’état de choc. Ni la température ni le rythme respiratoire ne sont modifiés entre les deux groupes 16 h après l’induction du choc hémorragique (Figure 3C,D). Nous avons évalué l’impact du choc hémorragique sur quelques paramètres comportementaux tels que la posture, l’activité, etc. (Fichier supplémentaire 1). Le score comportemental est augmenté dans le groupe de choc hémorragique 16 h après le protocole (Simulacre : 0,33 ± 0,21 ; HS : 2,27 ± 0,69) (figure 3E).
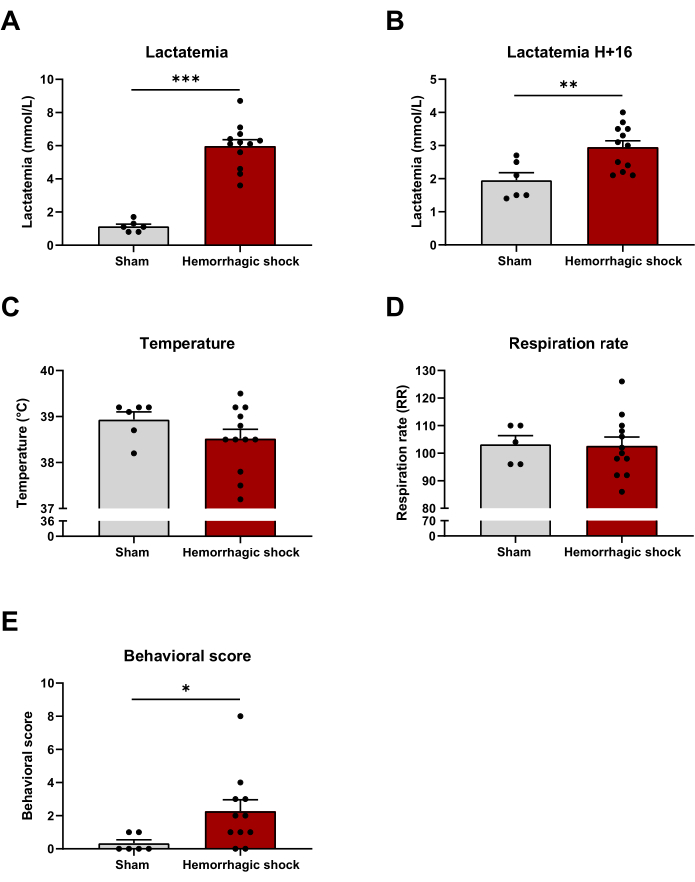
Figure 3 : Impact du choc hémorragique sur la lactatémie, la température, la fréquence respiratoire et le score comportemental. (A) Lactatémie à la fin du protocole de choc hémorragique, (B) lactatémie, (C) température, (D) fréquence respiratoire et (E) score comportemental 16 h après l’induction du choc hémorragique entre les animaux Sham et les animaux de choc hémorragique. Les résultats sont représentés sous forme de moyenne ± SEM. La signification statistique a été évaluée par un test t non apparié. * : p < 0,05 ; ** : p < 0,01 ; : p < 0,001. n = 6 à 12. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le choc hémorragique est associé à un dysfonctionnement d’un organe. Afin d’évaluer si le modèle pouvait être cliniquement pertinent, nous avons évalué les marqueurs plasmatiques des lésions organiques 24 h après le protocole. La créatininemie (simulacre : 19,13 μmol/L ± 0,33 μmol/L ; HS : 28,88 μmol/L ± 2,69 μmol/L), la troponine cardiaque T (placebo : 9,38 ng/L ± 1,87 ng/L ; HS : 35,62 ng/L ± 2,28 ng/L), et l’aspartate et l’alanine aminotransférase (ASAT : Placebo : 221 UI/L ± 48 UI/L ; HS : 963 UI/L ± 144 UI/L ; ALAT : Simulacre : 36 UI/L ± 4 UI/L ; HS : 323 UI/L ± 13 UI/L) qui reflètent des lésions rénales, cardiaques et hépatiques respectivement sont toutes significativement augmentées avec le choc hémorragique (Figure 4).
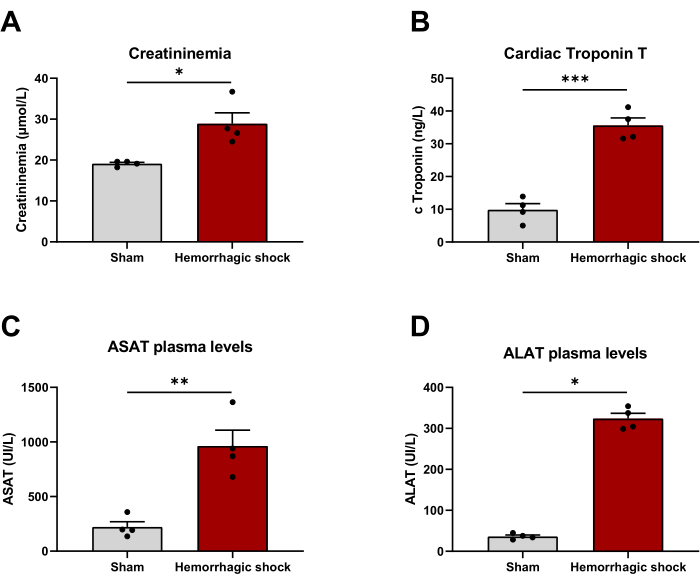
Figure 4 : Le modèle de choc hémorragique est associé à un dysfonctionnement d’organe. (A) créatininémie, (B) troponine cardiaque T, (C) aspartate aminotransférase et (D) taux d’alanine aminotransférase 24 h après l’induction du choc hémorragique entre les animaux Sham et les animaux de choc hémorragique. Les résultats sont représentés sous forme de moyenne ± SEM. La signification statistique a été évaluée par un test t non apparié. * : p < 0,05 ; ** : p < 0,01 ; : p < 0,001. n = 4 Cliquez ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1 : Détails du score comportemental Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans cet article, nous avons décrit pour la première fois un modèle représentatif de choc hémorragique chez le rat basé sur un mélange entre les modèles à pression fixe et à volume fixe. Nous avons démontré que 24 h après l’induction du choc, notre modèle est associé à une altération des paramètres hémodynamiques et du métabolisme.
En raison de sa physiopathologie complexe, l’étude du choc hémorragique nécessite l’utilisation de modèles animaux intégrés. En effet, les approches in vitro ne peuvent pas imiter toutes les voies impliquées dans cette maladie. Le réveil des animaux après le protocole de choc hémorragique est une étape qui assure une meilleure réplication de la situation clinique. En raison de la difficulté à réveiller les animaux, très peu d’études ont inclus cette étape. Les rares études qui réveillent les animaux les sacrifient à de courtes périodes (2 h ou 6 h), ce qui ne reflète pas tout à fait ce qui se passe pour les patients 16,18,23,24. Malgré le développement de modèles de choc hémorragique, seules quelques études ont évalué des paramètres (inflammation, apoptose, dysfonctionnement d’organe) 24 h après l’induction du choc, mettant ainsi en évidence la difficulté de ce type de protocole 25,26,27. Le développement de modèles informatiques et mathématiques a révolutionné la recherche. De nombreux modèles mathématiques de choc hémorragique ont été développés, mais la plupart de ces modèles ne prennent pas en compte toute la gamme des échanges de fluides corporels pendant le choc hémorragique et nécessitent une amélioration avant une applicabilité clinique potentielle28. À ce jour, l’un des principaux défis est le développement d’un modèle animal qui imite au plus près la pathologie chez l’homme.
Un grand nombre de modèles de choc hémorragique sont décrits dans la littérature et diffèrent par des approches vasculaires, des volumes de sang prélevés ou la pression ciblée13. Plus généralement, les modèles de choc hémorragique peuvent être classés en 3 groupes : l’hémorragie à volume fixe, l’hémorragie à pression fixe et l’hémorragie incontrôlée. La standardisation et la reproductibilité avec l’hémorragie à volume fixe sont difficiles et s’expliquent par le rapport volume sanguin/poids corporel, qui diminue linéairement avec le poids du rat. L’hémorragie à pression fixe est largement utilisée, expliquant ainsi que les réglages (pression ciblée, durée du choc) sont très variables d’une étude à l’autre, rendant difficile la transposition des résultats d’un modèle à l’autre. Il est également important de souligner que l’atteinte hémodynamique, qui joue un rôle central dans la physiopathologie du choc hémorragique, n’est pas systématiquement évaluée, ce qui pourrait augmenter l’écart de résultats entre les études. Enfin, le modèle de l’hémorragie non contrôlée, bien que cliniquement pertinent, soulève des questions de reproductibilité et d’éthique. Afin de concilier autant que possible pertinence clinique, standardisation et reproductibilité, nous avons développé un modèle mixte avec des phases à volume fixe et à pression fixe.
Dans le modèle décrit ici, la température et le rythme respiratoire ne sont pas modifiés 24 heures après l’opération. Cela peut s’expliquer par le fait que la chirurgie est réalisée dans des conditions stériles, limitant ainsi la réponse pro-inflammatoire. Le choc hémorragique est défini comme une insuffisance circulatoire aiguë due à une perte de sang associée à une chute de la pression artérielle. Comme chez l’homme, ce modèle de choc hémorragique provoque une diminution de la pression artérielle moyenne, notamment due à une diminution de la pression artérielle diastolique. Fait intéressant, et comme décrit précédemment, la fréquence cardiaque est inchangée après la phase de réanimation dans ce modèle de choc hémorragique 29,30,31. La baisse de la pression artérielle moyenne est probablement associée à une réduction de la perfusion des organes, conduisant à un dysfonctionnement multiviscéral, qui peut être illustré par l’augmentation de divers marqueurs plasmatiques dans notre modèle (créatinémie, troponine cardiaque T, ASAT et ALAT). La perturbation de l’approvisionnement en oxygène entraîne un métabolisme anaérobie, ce qui provoque une augmentation de la lactatémie32. Comme décrit précédemment, ce modèle de choc hémorragique entraîne une augmentation du taux de lactate dans le sangde 30. Cette augmentation pourrait être associée à l’ischémie provoquée au niveau de l’artère fémorale. Cependant, si l’on considère que les animaux du groupe placebo présentent une lactatémie physiologique et ont subi la même intervention chirurgicale que le groupe choc hémorragique, il semblerait que cette augmentation soit liée au protocole de choc hémorragique. L’ensemble de ces données confirme que le protocole décrit dans cette étude permet de développer un nouveau modèle pertinent de choc hémorragique chez le rat.
La limite de ce modèle est l’utilisation de l’héparine, qui est essentielle pour réduire la coagulation naturelle du sang lorsqu’il entre en contact avec des matériaux plastiques tels que les canules. Cependant, l’utilisation de l’héparine peut avoir un impact sur la coagulopathie associée au choc hémorragique traumatique33. Cette étude porte sur des animaux mâles en bonne santé âgés de 11 à 13 semaines. Considérant que le sexe, l’âge et les comorbidités (hypertension, diabète, etc.) peuvent impacter les résultats, il serait pertinent d’évaluer leur impact dans notre modèle. Dans le protocole, l’étape de réanimation est réalisée via une injection de Ringer Lactate, un cristalloïde qui pourrait favoriser la coagulopathie et l’œdème tissulaire34. Bien que l’utilisation des produits sanguins soit optimale, ceux-ci sont rares et périssables, et il pourrait être difficile d’avoir un stock suffisant de sang de rat pour l’ensemble du protocole. Les modèles de choc hémorragique de réanimation basés sur les produits sanguins et les cristalloïdes/colloïdes sont deux approches complémentaires.
Les points forts de ce modèle sont 1) sa grande reproductibilité (illustrée par la faible variabilité des résultats), 2) sa facilité d’application (la plupart des instruments sont classiques et les approches vasculaires sont connues) et 3) sa pertinence clinique, notamment due à l’éveil animal et à la dysfonction multiviscérale. Sur la base du score comportemental décrit dans le fichier supplémentaire 1, des points limites ont été mis en place. Le sacrifice sera discuté si un score supérieur à 9 est atteint, selon le tableau ci-joint. Si un score de 11 est atteint, l’animal sera systématiquement euthanasié. Dans cette étude, aucun des animaux n’a atteint un score supérieur à 8 et, par conséquent, aucun n’a été exclu de l’étude. Cela peut expliquer pourquoi le modèle décrit ici est associé à un taux de mortalité 3 fois inférieur à celui de l’autre étude de 24 h (16 % contre 47 %)25.
L’étape critique du modèle est la phase de choc hémorragique. Il est important de respecter la plage de pression de 32-38 mmHg. En fait, nous avons observé que le maintien de pressions artérielles moyennes inférieures à 32 mmHg entraînait une chute rapide et brutale de la pression. À l’inverse, le maintien d’une pression supérieure à 38 mmHg ne fournit pas un modèle suffisamment proche de la réalité clinique. Ces observations sont conformes à l’intervalle de pression artérielle moyenne visé dans d’autres modèles13.
En conclusion, nous avons démontré que le modèle de choc hémorragique chez le rat détaillé dans cette étude est cliniquement pertinent et pourrait être utile à la fois pour comprendre les mécanismes physiopathologiques en identifiant de nouveaux acteurs/voies biologiques et pour identifier de nouvelles stratégies thérapeutiques en testant différentes molécules candidates.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents connus ou de relations personnelles qui auraient pu influencer les travaux rapportés dans cet article. Les données à l’appui des résultats de cette étude sont disponibles auprès des auteurs correspondants sur demande raisonnable.
Remerciements
Ce travail a été soutenu par la Société Française d’Anesthésie et de Réanimation (Paris, France), la Fondation d’entreprises Genavie (Nantes, France), la Fédération française de cardiologie (France), l’Agence nationale de la recherche (20-ASTC-0032-01-hErOiSmE) (Paris, France) et la Direction Générale de l’Armement (Paris, France). Thomas Dupas a bénéficié de subventions de la Direction Générale de l’Armement (DGA) (France) et de la Région des Pays de la Loire pendant son doctorat. Antoine Persello a bénéficié de subventions d’InFlectis BioScience (France) pendant sa thèse. Nous remercions l’Agence Nationale de la Recherche (Paris, France), la Direction Générale de l’Armement (Paris, France) et l’association Sauve ton cœur (France) de soutenir ce travail. Nous remercions la plateforme UTE IRS-UN (SFR Bonamy, Nantes Université, Nantes, France) et la plateforme IBISA Therassay (Nantes, France) pour leur assistance et leur soutien technique.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | TERUMO | MDSS01SE | |
| 2.5 mL syringe | TERUMO | SS*02SE1 | |
| 20 mL syringe | TERUMO | MDSS20ESE | |
| Anesthesia induction chamber | TEMSEGA | HUBBIV4 | |
| BD Microlance 3 23 G needle | Becton Dickinson | 300800 | |
| BD Microlance 3 26 G needle | Becton Dickinson | 304300 | |
| Blood pressure transducer | emka TECHNOLOGIES | BP_T | |
| Buprecare | Axience | N/A | 1 mL vial, buprenorphine 0.3 mg/mL |
| DE BAKEY, Atraumatic Vascular Forceps | ALLGAIER instrumente medical | 09-543-150 | |
| Dermal Betadine 10% | Mylan | N/A | 125 mL bottle |
| Fine Forceps - Curved / Serrated | Fine Science Tools | 11065-07 | |
| GraphPad Prism 8 | GraphPad by Dotmatics | - | |
| Heating mats | TEMSEGA | OPT/THERM_MATELASSTEREORATS | |
| Heparin sodium | PANPHARMA | N/A | 5 mL bottle, 5,000 UI/mL |
| IOX2 software | emka TECHNOLOGIES | IOX_BASE_4c + IOX_FULLCARDIO_4a | |
| Iris Scissors - ToughCut | Fine Science Tools | 14058-11 | |
| Lidocaine | Fresenius | N/A | 10 mL bootle, 8.11 mg, lidocaine hydrochloride |
| MiniHub-V3.2 | TEMSEGA | PF006 | |
| Moria 201/A Vessel Clamp - Straight | Fine Science Tools | 18320-11 | |
| Non sterile compresses | Raffin | 70189 | |
| Non sterile drape | Dutscher | 30786 | |
| Olsen-Hegar Needle Holder with Scissors | Fine Science Tools | 12002-12 | |
| Polyethylene tubing PE10 | PHYMEP | BTPE-10 | |
| Polyethylene tubing PE50 | PHYMEP | BTPE-50 | |
| Rats | Charles Rivers | - | Male WISTAR HAN (10 weeks) |
| Rectal probe | TEMSEGA | SONDE_TEMP_RATS | |
| Ringer Lactates | Fresenius Kabi | 964175 | |
| Scrub Betadine 4% | Mylan | N/A | 125 mL bottle |
| Sevoflurane | Abbott | N/A | 250 mL bottle, gas 100% |
| Sevoflurane Vaporizer | TEMSEGA | SEVOTEC3NSELEC | |
| StatStrip lactate test strips | Nova Biomedical | 47486 | |
| StatStrip Xpress lactate Meter | Nova Biomedical | 47486 | |
| Sterile compresses | Laboratoire SYLAMED | 211S05-50 | |
| Sterile drape | Mölnlycke | 800330 | |
| Steriles gloves | MEDLINE | MSG7275 | |
| Suture | Optilene | 3097141 | |
| Suture for vessels | SMI | 8150046 | |
| Syringe pump | Vial médical | 16010 | |
| usbAMP | emka TECHNOLOGIES | - | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | |
| Vaseline | Cooper | N/A | 10 mL vial |
| Vitamin A Dulcis (ALLERGAN) | Allergan | N/A | 10 g tube, Retinol |
Références
- Cannon, J. W. Hemorrhagic Shock. New Eng J Med. 378 (4), 370-379 (2018).
- Fox, E. E., Holcomb, J. B., Wade, C. E., Bulger, E. M., Tilley, B. C. Earlier endpoints are required for hemorrhagic shock trials among severely injured patients. Shock. 47 (5), 567-573 (2017).
- Frink, M., Andruszkow, H., Zeckey, C., Krettek, C., Hildebrand, F. Experimental trauma models: an update. J Biomed Biotechnol. 2011, 797383 (2011).
- Hauser, C. J. Preclinical models of traumatic, hemorrhagic shock. Shock. 24, 24-32 (2005).
- Kemming, G., et al. Can we continue research in splenectomized dogs? Mycoplasma haemocanis: Old problem - new insight. Eur Sur Res. 36 (4), 198-205 (2004).
- Carroll, R. G., Iamsa, S. G., Pryor, W. H., Allison, E. J. Single hemorrhage: A clinically relevant canine model of hemorrhagic shock. Resuscitation. 16 (2), 119-126 (1988).
- Cheung, A. T., Duong, P. L., Driessen, B., Chen, P. C., Jahr, J. S., Gunther, R. A. Systemic function, oxygenation and microvascular correlation during treatment of hemorrhagic shock with blood substitutes. Clin Hemorheol Microcirc. 34 (1-2), 325-334 (2006).
- . Hemorrhage and hemorrhagic shock in swine: A review Available from: https://apps.dtic.mil/sti/citations/ADA221297 (1990)
- Lomas-Niera, J. L., Perl, M., Chung, C. -. S., Ayala, A. Shock and hemorrhage: an overview of animal models. Shock. 24, 33-39 (2005).
- Redl, H., Bahrami, S. Large animal models: baboons for trauma, shock, and sepsis studies. Shock. 24, 88-93 (2005).
- Marques-Bonet, T., Cheng, Z., She, X., Eichler, E. E., Navarro, A. The genomic distribution of intraspecific and interspecific sequence divergence of human segmental duplications relative to human/chimpanzee chromosomal rearrangements. BMC Genom. 9, 384 (2008).
- Schlag, G., Redl, H. R., Till, G. O., Davies, J., Martin, U., Dumont, L. Anti-L-selectin antibody treatment of hemorrhagic-traumatic shock in baboons. Crit Care Med. 27 (9), 1900 (1999).
- Fülöp, A., Turóczi, Z., Garbaisz, D., Harsányi, L., Szijártó, A. Experimental models of hemorrhagic shock: A review. Eur Surg Res. 50 (2), 57-70 (2013).
- Zingarelli, B., Ischiropoulos, H., Salzman, A. L., Szabó, C. Amelioration by mercaptoethylguanidine of the vascular and energetic failure in haemorrhagic shock in the anesthetised rat. Eur J Pharmacol. 338 (1), 55-65 (1997).
- Gonzalez, R. J., Moore, E. E., Ciesla, D. J., Nieto, J. R., Johnson, J. L., Silliman, C. C. Post-hemorrhagic shock mesenteric lymph activates human pulmonary microvascular endothelium for in vitro neutrophil-mediated injury: the role of intercellular adhesion molecule-1. J Trauma. 54 (2), 219-223 (2003).
- Hoppen, R. A., Corso, C. O., Grezzana, T. J. M., Severino, A., Dal-Pizzol, F., Ritter, C. Hypertonic saline and hemorrhagic shock: hepatocellular function and integrity after six hours of treatment. Acta Cir Bras. 20 (6), 414-417 (2005).
- Rupani, B., et al. Relationship between disruption of the unstirred mucus layer and intestinal restitution in loss of gut barrier function after trauma hemorrhagic shock. Surgery. 141 (4), 481-489 (2007).
- Cai, B., Dong, W., Sharpe, S., Deitch, E. A., Ulloa, L. Survival and inflammatory responses in experimental models of hemorrhage. J Surg Res. 169 (2), 257-266 (2011).
- Esiobu, P., Childs, E. W. A rat model of hemorrhagic shock for studying vascular hyperpermeability. Methods Mol Biol. 1717, 53-60 (2018).
- Sordi, R., Chiazza, F., Patel, N. S. A., Doyle, R. A., Collino, M., Thiemermann, C. Preconditioning' with low dose lipopolysaccharide aggravates the organ injury / dysfunction caused by hemorrhagic shock in rats. PLoS One. 10 (4), 0122096 (2015).
- Liu, Y., et al. Modified shock index and mortality rate of emergency patients. World J Emerg Med. 3 (2), 114-117 (2012).
- Sahu, N., et al. Shock index as a marker for mortality rates in those admitted to the medical intensive care unit from the emergency department. Cureus. 12 (4), e7903 (2020).
- Zou, L., et al. Glucosamine improves cardiac function following trauma-hemorrhage by increased protein O-GlcNAcylation and attenuation of NF-κB signaling. Am J Physiol Heart Circ Phy. 296 (2), H515-H523 (2009).
- Nöt, L. G., Marchase, R. B., Fülöp, N., Brocks, C. A., Chatham, J. C. Glucosamine administration improves survival rate after severe hemorrhagic shock combined with trauma in rats. Shock. 28 (3), 345 (2007).
- Nöt, L. G., Brocks, C. A., Vámhidy, L., Marchase, R. B., Chatham, J. C. Increased O-linked β-N-acetylglucosamine levels on proteins improves survival, reduces inflammation and organ damage 24 hours after trauma-hemorrhage in rats. Crit Care Med. 38 (2), 562-571 (2010).
- Patel, N. M., et al. Inhibition of macrophage migration inhibitory factor activity attenuates haemorrhagic shock-induced multiple organ dysfunction in rats. Front Immunol. 13, 886421 (2022).
- Patel, N. M., et al. Inhibition of Bruton's tyrosine kinase activity attenuates hemorrhagic shock-induced multiple organ dysfunction in rats. Ann Surg. 277 (3), e624-e633 (2023).
- Curcio, L., D'Orsi, L., De Gaetano, A. Seven mathematical models of hemorrhagic shock. Comput Math Methods Med. 2021, e6640638 (2021).
- Rönn, T., Lendemans, S., de Groot, H., Petrat, F. A new model of severe hemorrhagic shock in rats. Comp Med. 61 (5), 419-426 (2011).
- Hussmann, B., Lendemans, S., de Groot, H., Rohrig, R. Volume replacement with Ringer-lactate is detrimental in severe hemorrhagic shock but protective in moderate hemorrhagic shock: studies in a rat model. Crit Care. 18 (1), 5 (2014).
- Mihara, R., Takasu, A., Maemura, K., Minami, T. Prolonged severe hemorrhagic shock at a mean arterial pressure of 40 mmHg does not lead to brain damage in rats. Acute Med Surg. 5 (4), 350-357 (2018).
- Vincent, J. -. L., De Backer, D. Circulatory shock. N Engl J Med. 369 (18), 1726-1734 (2013).
- Halbgebauer, R., et al. Hemorrhagic shock drives glycocalyx, barrier and organ dysfunction early after polytrauma. J Crit Care. 44, 229-237 (2018).
- Chipman, A. M., Jenne, C., Wu, F., Kozar, R. A. Contemporary resuscitation of hemorrhagic shock: What will the future hold. Am J Surg. 220, 580-588 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon