Method Article
쥐에서 임상적으로 관련된 출혈성 쇼크 모델 개발
* 이 저자들은 동등하게 기여했습니다
요약
출혈성 쇼크는 매년 전 세계적으로 190만 명의 목숨을 앗아갑니다. 소동물은 출혈성 쇼크 모델로 자주 사용되지만 표준화, 재현성 및 임상적 중요성 문제와 관련이 있어 관련성이 제한적입니다. 이 논문은 쥐에서 임상적으로 유의미한 새로운 출혈성 쇼크 모델을 개발하는 방법에 대해 설명합니다.
초록
최근 수십 년 동안 동물 모델의 개발을 통해 다양한 병리학을 더 잘 이해하고 새로운 치료법을 식별할 수 있었습니다. 출혈성 쇼크, 즉 많은 양의 혈액이 급격히 손실되어 장기 부전이 발생하는 것은 여러 경로를 포함하는 매우 복잡한 병태생리학과 관련이 있습니다. 출혈성 쇼크에 대한 기존의 수많은 동물 모델은 인간에서 일어나는 일을 복제하기 위해 노력하고 있지만 이러한 모델은 임상적 관련성, 재현성 또는 표준화 측면에서 한계가 있습니다. 이 연구의 목적은 이러한 모델을 개선하여 출혈성 쇼크의 새로운 모델을 개발하는 것입니다. 간단히 말해서, 출혈성 쇼크는 수컷 Wistar Han 쥐(11-13주령)에서 평균 동맥압의 강하를 담당하는 통제된 배출에 의해 유발되었습니다. 75분의 다음 단계는 출혈성 쇼크의 병태생리학적 경로를 유발하기 위해 32mmHg에서 38mmHg 사이의 낮은 평균 동맥 혈압을 유지하는 것이었습니다. 프로토콜의 마지막 단계는 혈압을 높이기 위해 정맥 주사액인 링거 젖산 용액을 투여하여 환자 치료를 모방했습니다. 젖산 및 행동 점수는 프로토콜 시작 후 16시간 후에 평가되었으며, 혈류역학 매개변수 및 혈장 마커는 부상 후 24시간 후에 평가되었습니다. 출혈성 쇼크 유도 후 24시간 후, 출혈성 쇼크 그룹에서 평균 동맥 및 이완기 혈압이 감소하였다(p < 0.05). 심박수와 수축기 혈압은 변하지 않았다. 출혈성 쇼크에 따라 모든 장기 손상 지표가 증가하였다(p < 0.05). 젖산혈증 및 행동 점수는 가짜 그룹에 비해 증가했다(p < 0.05). 결론적으로, 우리는 여기에 설명된 프로토콜이 후속 연구, 특히 새로운 분자의 치료 잠재력을 평가하기 위해 사용할 수 있는 출혈성 쇼크의 관련 모델임을 입증했습니다.
서문
출혈성 쇼크(HS)는 상당한 혈액량 손실을 특징으로 하는 쇼크 상태로, 이로 인해 조직 산소 결핍증이 발생합니다. HS는 혈역학적 및 대사적 변화와 함께 전염증 및 항염증 반응을 연관시키는 복잡한 병리학입니다. 매년 전 세계적으로 약 190만 명이 출혈과 그 결과로 사망합니다1. 현재 치료 지침에는 주로 정맥 수액 투여(혈관 활성 분자가 보충되거나 보충되지 않음)와 산소 요법이 포함됩니다. 그러나 이러한 치료법은 증상이 있고 효과가 없을 수 있기 때문에 HS 관련 사망률이 높게 유지되는 이유를 알 수 있습니다2. 이는 새로운 분자 및 세포 메커니즘을 규명하는 것의 중요성을 정당화하며, 따라서 사망률을 줄이기 위한 치료법을 규명합니다.
동물 모델을 통해 질병과 관련된 병태생리학적 메커니즘을 해독하고 새로운 치료 전략을 테스트할 수 있습니다. 출혈성 쇼크의 수많은 동물 모델이 문헌에 존재합니다. 이러한 모델은 사용되는 종뿐만 아니라 HS를 유도하는 수단(예: 고정 압력 대 고정 부피)에서도 다릅니다(표 1, 표 2)3,4,5,6,7,8,9,10,11,12,13 . 또한, 프로토콜은 동일한 유형의 모델(예: 출혈 시간, 목표 평균 동맥압) 내에서 다양하다(표 3)14,15,16,17,18,19,20. 기존의 출혈성 쇼크 모델의 다양성과 임상 상황을 복제하는 복잡성을 고려할 때 이 병리학에 대한 전임상 연구는 여전히 제한적입니다. 재현 가능하고 표준화 가능하며 구현하기 쉬운 출혈성 쇼크 모델의 개발은 모든 사람의 관심사입니다. 이것은 다양한 연구 간의 비교를 용이하게 하고 출혈성 쇼크의 복잡한 병태생리학을 밝힐 것입니다. 이 프로토콜의 목적은 고정된 양의 출혈 단계와 고정된 저혈압 단계를 따르는 두 개의 연속적인 출혈 단계를 사용하여 쥐에서 출혈성 쇼크의 새로운 임상적으로 관련된 모델을 개발하는 것이었습니다.
표 1: 출혈성 쇼크 3,4,5,6,7,8,9,10,11,12,13의 모델로 사용된 종. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 출혈성 쇼크의 다양한 유형13. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: 고정 압력 프로토콜에 의해 유도된 쥐의 출혈성 쇼크에 대한 다양한 실험 모델의 예. 출혈성 쇼크의 다양한 실험 모델에 대한 매개변수 요약. 빨간색으로 표시된 혈관은 동맥이고 파란색으로 표시된 혈관은 정맥입니다. 소생술의 경우 채취한 혈액의 부피를 기준으로 사용합니다(혈액: 쇼크 시 샘플링된 혈액과 동일한 부피의 소생술, x2: 쇼크 시 샘플링된 혈액의 2배에 달하는 소생술, x4: 쇼크 시 샘플링된 혈액의 4배에 달하는 소생). MAP: 평균 동맥압; RL : 링거 젖산 14,15,16,17,18,19,20. 이 표를 다운로드하려면 여기를 클릭하십시오.
프로토콜
모든 절차는 유럽 연합의 지침 2010/63/EU에 따라 지역 윤리 위원회(프로토콜(#17858 및 #32499, CEEA-Pays de la Loire, France))에 따라 승인 및 수행되었습니다. 이 보고는 현행 ARRIVE 가이드라인 및 미국 국립보건원(NIH) 실험실 동물의 관리 및 사용 가이드(NIH Pub. No. 85-23, 2011년 개정)에 따른 것입니다.
1. 쥐에 대한 윤리적 지위와 일반 정보
- 수컷 Wistar Han rats (Charles River, Saint-Germain-Nuelles, France)는 생후 10 주에 Unité Thérapeutique Expérimentale에 전달되었습니다. 표준 온도(21-24°C), 습도(40%-60%) 및 오전 07시 30분부터 시작하는 조명 기간으로 12시간 밝음/어두운 주기에서 최소 1주일 동안 쥐를 수용합니다.
- 음식과 물을 즉시 제공 하십시오. 프로토콜에는 300-400g 무게의 11-13주 된 쥐를 사용하십시오.
2. 객실 설정 및 준비 단계
- 마취 스테이션을 켜고 가열 매트를 37.5 °C로 설정하고 멸균되지 않은 드레이프로 덮습니다.
- 프로토콜에 필요한 수술 기구를 멸균합니다: DeBakey 비외상성 겸자(1), 가늘고 날카로운 가위 또는 메스(1), 표준 패턴 겸자(2), 바늘 홀더(1), Vannas 미세 절개 가위(1), 클램프(1).
- 경정맥과 대퇴 동맥을 위한 카테터를 준비합니다.
- 경정맥 카테터의 경우 끝이 잘린 23G 바늘에 폴리에틸렌(PE) 튜브(PE50)를 장착합니다.
- 대퇴 동맥 카테터의 경우 2.3.1단계에서 설명한 카테터를 준비하고 PE10 튜브를 PE50 튜브 끝에 부착합니다.
- 대퇴 동맥 및 경정맥에 대한 압력 변환기와 카테터를 100 UI/mL에서 헤파린화된 젖산 링거 용액으로 채웁니다. 100 UI/mL에서 헤파린화된 젖산 링거 용액이 들어 있는 2mL 주사기를 카테터와 압력 변환기 끝에 놓습니다. 신호 결함을 유발할 수 있는 기포가 생기지 않도록 주의하십시오.
- 압력 변환기와 관련된 소프트웨어를 켜고 공급업체의 지침에 따라 교정합니다.
3. 수술을 위해 쥐를 준비합니다.
- 인덕션 박스로 쥐를 마취합니다(매개변수: sevoflurane 8%, 공기 유량: 1L/min). 페달 리플렉스를 통해 마취 깊이를 확인한 후 세보플루란 4%에서 마취를 유지하고 기류 속도 0.6L/min으로 합니다. 수술 전에 진통제를 사용하는 것은 이러한 분자의 혈역학적 효과 때문에 피했습니다.
알림: 이 단계에서 페달 반사를 통해 20분마다 마취 깊이를 평가합니다. - 쥐의 무게를 잰 다음 가열 매트 위의 등쪽 욕창 위치에 놓고 서혜부와 목 부위에서 제모합니다.
- 비멸균 거즈 패드를 사용하여 10% 및 4% 포비돈-요오드 용액(각 3회)으로 제모된 부위를 소독합니다.
- 건조를 방지하기 위해 동물의 눈에 안과 연고 한 방울을 바르십시오.
- 수술 테이블의 가열 매트에 쥐를 놓습니다(등쪽 욕창). 윤활된 직장 프로브를 놓아 쥐의 온도를 조절합니다. 세보플루란 4%에서 마취를 유지하고 0.6L/min의 공기 흐름 속도로 유지합니다.
- 장갑을 멸균 장갑으로 교체하고 멸균 드레이프를 쥐에게 놓고 서혜부와 목 부위를 자릅니다.
4. 경정맥 캐뉼레이션
- 눈에 보이는 맥동에 의해 쇄골 위의 오른쪽 아래 목 영역에서 경정맥 영역을 찾습니다. DeBakey 비외상성 겸자를 사용하여 피부를 부드럽게 잡은 다음 가늘고 날카로운 가위나 메스를 사용하여 정밀하게 절개합니다.
- 절개 부위에 국소 마취제(리도카인 2%) 한 방울을 바릅니다. 표준 패턴 집게로 조직을 부드럽게 깎습니다.
- 경정맥을 찾아 표준 패턴 집게로 근육 구획에서 부드럽게 분리합니다. 4/0 실크 봉합사를 놓고 원위부(머리 쪽)를 단단히 결찰합니다. 바늘 홀더가 있는 봉합사를 사용하여 경정맥을 긴장시킵니다.
- 근위부(심장 쪽)에 4/0 봉합사를 놓고 조이지 않고 외과 매듭을 준비합니다. Vannas 미세 절개 가위를 사용하여 경정맥을 작게 절개합니다.
- 작은 집게로 정맥 벽을 조심스럽게 잡은 후 PE50 카테터를 손으로 또는 표준 패턴 겸자로 경정맥에 삽입합니다. 이 단계에서 멸균 거즈 패드를 사용하여 정맥에서 누출될 수 있는 최종 혈액 방울을 닦아내십시오.
- 카테터를 약간 전진(0.5cm)하고 소량의 혈액을 뽑은 다음 다시 주입하여 정맥에 올바른 위치를 확인합니다(캐뉼라의 혈액은 정맥에 있음을 나타냄). 카테터를 고정하기 위해 미리 준비한 매듭을 조입니다.
- 카테터를 제자리에 두고 젖산 링거 용액으로 미리 채워진 주사기에 부착하고 절개 부위를 축축한 멸균 거즈 패드로 덮습니다.
5. 대퇴 동맥 캐뉼레이션
- DeBakey 비외상성 집게를 사용하여 왼쪽 다리의 스카르파 삼각형 피부를 잡고 가늘고 날카로운 가위나 메스로 절개합니다. 절개 부위에 국소 마취제(리도카인 2%) 한 방울을 바릅니다. 표준 패턴 겸자로 조직을 부드럽게 희석시킵니다.
- 대퇴골 삼합체(동맥, 정맥 및 신경)를 찾습니다. 하나의 집게를 트라이어드 아래로 통과시키고 두 번째 표준 패턴 집게를 사용하여 동맥을 신경 및 대퇴 정맥에서 매우 부드럽게 분리합니다.
참고: 동맥은 더 작고 분홍색이며 맥동합니다. 이것은 중요한 단계입니다. 정맥과 동맥은 약하기 쉬우며 쉽게 파열될 수 있습니다. - 4/0 봉합사를 놓고 대퇴 동맥을 원위(다리 쪽)로 결찰합니다. 바늘 홀더로 봉합사를 사용하여 대퇴 동맥에 긴장을 가합니다. 근위부(심장 쪽)에 4/0 봉합사를 놓고 닫지 않고 매듭을 준비합니다. 동맥을 클램프(클램프를 근위 측면 봉합사의 상류에 배치).
- Vannas 마이크로 해부 가위로 대퇴 동맥을 가로로 절개합니다(동맥에서 소량의 혈액이 흘러야 함). 표준 패턴 겸자를 사용하여 동맥벽을 부드럽게 잡고 카테터(PE10 끝)로 대퇴 동맥을 캐뉼레이팅하고 겸자로 고정합니다.
- 부드럽게 클램프를 풀어 누출을 확인한 다음 압력 신호를 확인하고(카테터가 대퇴 동맥에 있는지 확인) 혈액이 카테터로 역류하지 않는지 확인합니다(밸브/압력 변환기에서 누출 징후).
- 신호가 양호하고(예상치: 수축기 혈압: 120mmHg, 이완기 혈압: 80mmHg) 누출의 징후가 없으면 카테터를 약간 전진(0.5cm)하고 미리 준비한 외과 의사의 매듭을 조입니다.
- 동물을 100 UI/kg으로 헤파린화하고 절개 부위에 축축한 멸균 거즈 패드를 바릅니다. 수술 후 3L/min의 풍량으로 sevoflurane 0.6%로 마취를 유지합니다.
6. 출혈성 쇼크 프로토콜(그림 1)
- 1단계: 안정화(5분).
- 헤파린화 후 압력 값이 안정화될 때까지 10분 동안 기다립니다. 기초 혈류역학 수치에 대해 5분 동안 기록합니다.
- 2단계: 출혈(5분):
참고: 이 단계는 모델의 고정 볼륨 단계에 해당합니다.- 1mL 주사기를 사용하여 5분(500μL/30초)에 걸쳐 대퇴 동맥에서 5mL의 혈액을 채취합니다(예상 값: 수축기 혈압: 45mmHg, 이완기 혈압: 30mmHg).
- 실온에서 50% 젖산 링거 용액과 50% 수집된 혈액의 혼합물을 준비합니다. 혼합물을 2mL 주사기에 넣고 경정맥 캐뉼라 끝에 놓습니다.
- 3단계: 출혈성 쇼크(75분)
참고: 이 단계는 모델의 고정 압력 단계입니다.- 평균 동맥압을 평균 35mmHg로 유지합니다. 평균 동맥압이 38mmHg 이상일 경우 대퇴 동맥을 통해 200μL의 혈액을 빼냅니다(n = 12마리 쥐의 평균: 10.2mL).
- 평균 동맥압이 32mmHg 이하로 떨어지면 경정맥을 통해 50% 혈액-50% 젖산 링거 용액 혼합물 200μL를 주입합니다(n = 12마리 쥐의 평균: 0.90mL).
- 출혈성 쇼크 단계가 끝날 때 거즈 패드로 꼬리를 멸균 준비 한 후 바늘 끝 (26g)을 사용하여 꼬리 끝에서 떨어지는 혈액 방울에 대한 말초 혈액 젖산을 측정합니다.
- 4단계: 정맥 수액 소생술(20분)
- 주사기 펌프가 있는 경정맥 카테터를 통해 20mL 주사기로 20분 동안 10mL/kg의 실온(RT)에서 젖산 링거 용액으로 소생시킵니다(350g 쥐의 경우 10.5mL/h의 유속).
7. 수술 종료 및 회복 및 수술 후 후속 조치
- 경정맥과 대퇴 동맥을 클램프로 고정하고 카테터를 제거합니다. 결찰 용기. 피가 새지 않는지 주의 깊게 확인하십시오.
- 절개 부위에 국소 마취제 한 방울을 넣으십시오. 5-0 멸균 봉합사를 사용하여 피하 및 피부 봉합으로 절개 부위를 봉합합니다. 10% 포비돈-요오드 용액으로 소독합니다.
- 1mL 주사기에 26G 바늘을 사용하여 부프레노르핀(0.05mg/kg, 0.3mL/kg)을 피하 주사합니다.
- 쥐가 마취에서 벗어날 때까지 기다리면서 온도를 모니터링합니다. 깨어날 기미가 보이면(vibrissae 움직임, 발 움직임) 직장 프로브를 제거하고 쥐를 가열 매트 위에 올려 놓습니다. 10분 후에 쥐를 숙소로 돌려보냅니다.
- 8시간마다 부프레노르핀을 피하(0.05mg/kg, 0.3mL/kg)로 투여합니다.
- 6.3단계에 설명된 대로 출혈성 쇼크 유도 16시간 후 호흡수, 행동, 온도 및 혈액 젖산염을 평가합니다.
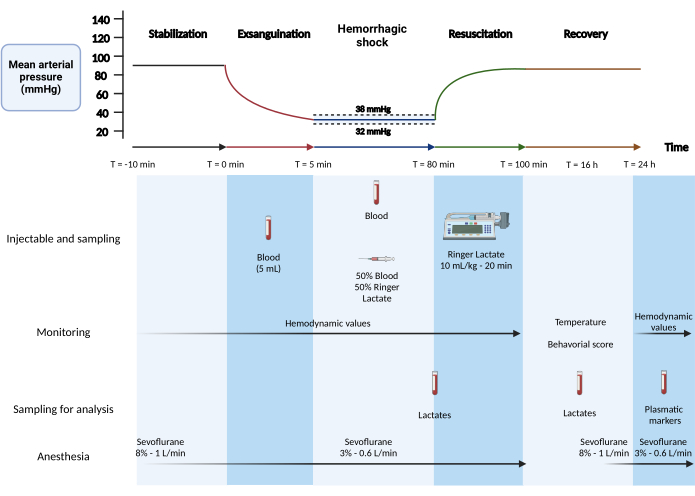
그림 1: 혼합 쥐 출혈성 쇼크 모델. Created with BioRender.com 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 출혈성 쇼크 유도 후 24시간
- 3.1단계에서 설명한 대로 동물을 마취합니다. 동물을 수술 테이블에 놓고 3.5단계에 설명된 대로 직장 프로브를 삽입합니다. 2.3단계 및 2.4단계에서 경정맥에 대해 설명한 대로 경동맥 캐뉼레이션을 위한 카테터를 준비합니다.
- DeBakey 비외상성 집게를 사용하여 피부를 잡고 가늘고 날카로운 가위나 메스로 목 중앙을 절개합니다. 국소 마취제(리도카인 2%) 한 방울을 바릅니다.
- 표준 패턴 겸자로 조직을 부드럽게 희석시킵니다. 타액선을 분리한 다음 기관 근육을 열어 기관 고리를 드러냅니다.
- 왼쪽 경동맥을 표준 패턴 겸자로 신경에서 분리하십시오 (동물의 호흡이 가속화 될 가능성이 높습니다). 경동맥을 원위(머리 쪽)로 4/0 명주실로 결찰합니다.
- 근위 쪽 (심장 쪽)에 봉합사 실을 놓고 닫지 않고 외과 매듭을 준비합니다. 동맥을 클램프(클램프를 근위 측면 봉합사의 상류에 배치).
- Vannas 마이크로 절개 가위로 경동맥을 절개합니다(동맥에서 소량의 혈액이 흘러야 함). 표준 패턴 겸자를 사용하여 동맥 벽을 부드럽게 잡고 개구부를 확대하고 제공된 카테터로 경동맥을 캐뉼레이팅하고 집게로 고정합니다.
- 클램프를 풀고 압력 신호를 확인하여 카테터 배치를 확인하고 혈액이 카테터로 역류하지 않는지 확인합니다(밸브/압력 변환기에서 누출의 징후).
- 신호가 양호하고 누출이 없으면 카테터를 약간 (0.5cm) 전진시키고 미리 준비한 외과 의사의 매듭을 조여 고정합니다.
- 동물을 100 UI/kg으로 헤파린화하고 절개 부위에 축축한 멸균 압박을 가합니다.
- 수술 후 세보플루란 3%를 사용하여 0.6L/min의 풍량으로 마취를 유지합니다.
- 10시간 혈류역학적 값(예상 값: 수축기 혈압: 120mmHg, 이완기 혈압: 60mmHg)을 기록할 때까지 기다립니다.
- 장기 손상의 혈장 마커를 평가하려면 경동맥과 원심분리기에서 1600 x g 에서 10분 동안 1mL의 혈액을 채취합니다. 추가 분석을 위해 혈장을 분취 및 저장합니다.
- 24 시간에서 혈류역학 수치를 측정 한 직후 쥐를 희생시키고 혈액을 수집하십시오.
참고: 안락사 방법은 나중에 수집될 특정 매개변수 또는 샘플에 맞게 조정해야 합니다. 가짜 그룹은 출혈성 쇼크 절차(섹션 6) 없이 수술만 받습니다(섹션 1-5, 7, 8). 실험자는 동물을 가짜 쇼크 그룹과 출혈성 쇼크 그룹 사이에 무작위로 할당했습니다. 실험자만이 실험의 여러 단계에서 그룹 할당을 알고 있었습니다.
결과
위에서 설명한 프로토콜에 따라 출혈성 쇼크 유도 후 24시간 후에 여러 혈류역학 매개변수를 평가했습니다. 출혈성 쇼크 프로토콜이 시작되기 전의 기초 평균 동맥압은 가짜 쇼크 그룹과 출혈성 쇼크 그룹 간에 유사합니다(그림 2A). 예상대로 출혈성 쇼크 프로토콜로 평균 동맥압이 현저히 감소하며, 이는 이완기 혈압의 강하로 설명할 수 있습니다(평균 동맥압: Sham: 92mmHg ± 3mmHg; HS: 82mmHg ± 2mmHg; 이완기 혈압 : 73 mmHg ± 3 mmHg; HS: 61mmHg ± 2mmHg)(그림 2B, C). 출혈성 쇼크는 수축기 혈압, 맥압 및 심박수에 영향을 미치지 않습니다(그림 2D-F). 쇼크 지수(심박수/수축기 혈압 비율)와 수정된 쇼크 지수(MSI)(심박수/평균 혈압 비율)는 중증 환자의 사망률을 예측하는 두 가지 변수이다14,15. 값이 높을수록 사망 위험이 커집니다. 이 모델에서 쇼크 지수는 두 그룹 간에 수정되지 않은 반면, 수정된 쇼크 지수는 출혈성 쇼크에서 증가하는 경향이 있습니다(MSI: Sham: 4.24 ± 0.11; HS : 4.70 ± 0.15) (그림 2G, H).
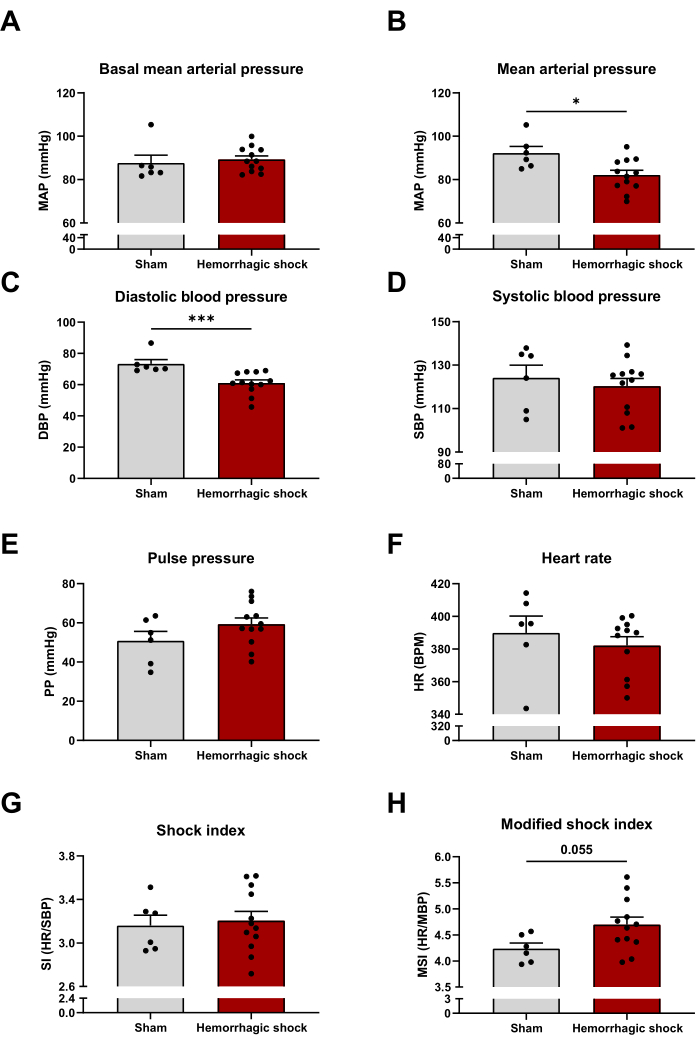
그림 2: 출혈성 쇼크가 혈류역학 매개변수에 미치는 영향. (A) 기초 평균 동맥압, (B) 평균 동맥압, (C) 이완기 혈압, (D) 수축기 혈압, (E) 맥압, (F) 심박수, (G) 충격 지수, (H) 샴과 출혈성 쇼크 동물 간의 수정된 충격 지수. 결과는 SEM± 평균으로 표시되며, 통계적 유의성은 쌍을 이루지 않은 t-검정으로 평가되었습니다. *: p < 0.05; : 피 < 0.001. n = 6-12입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
출혈성 쇼크 중 전반적인 대사 장애는 젖산혈증으로 평가할 수 있습니다. 예상대로, 출혈성 쇼크 프로토콜 후 젖산혈증이 증가하였고 16시간 후에 증가하였다(프로토콜 종료: Sham: 1.13 mmol/L ± 0.14 mmol/L; HS: 5.98 mmol/L ± 0.39 mmol/L; H+16: 가짜: 1.95 mmol/L ± 0.23 mmol/L; HS: 2.95mmol/L± 0.19mmol/L)(그림 3A,B). 체온과 호흡수는 전신 염증 반응 증후군(SIRS)의 두 가지 구성 요소로, 쇼크 상태의 특징인 전염증 반응입니다. 출혈성 쇼크 유도 후 16시간 동안 두 그룹 간에 온도나 호흡수가 수정되지 않습니다(그림 3C,D). 우리는 출혈성 쇼크가 자세, 활동 등과 같은 몇 가지 행동 매개변수에 미치는 영향을 평가했다(보충 파일 1). 행동 점수는 프로토콜 후 16시간 후에 출혈성 쇼크 그룹에서 증가합니다(Sham: 0.33 ± 0.21; HS: 2.27 ± 0.69)(그림 3E).
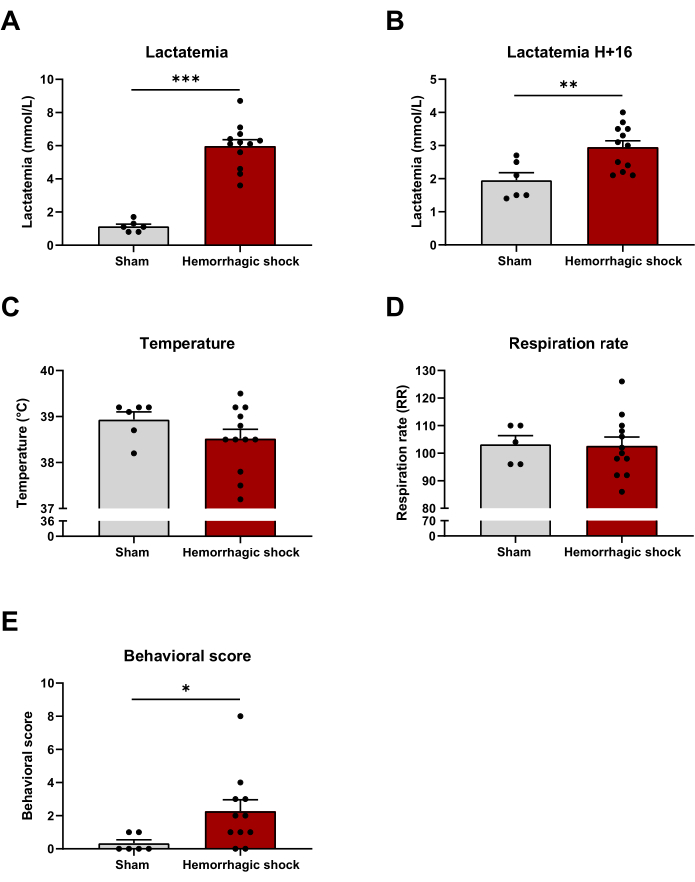
그림 3: 출혈성 쇼크가 젖산혈증, 체온, 호흡수 및 행동 점수에 미치는 영향. (A) 출혈성 쇼크 프로토콜 종료 시 젖산혈증, (B) 젖산혈증, (C) 체온, (D) 호흡수 및 (E) 샴과 출혈성 쇼크 동물 간의 출혈성 쇼크 유도 후 16시간 후 행동 점수. 결과는 SEM± 평균으로 표시되며, 통계적 유의성은 쌍을 이루지 않은 t-검정으로 평가되었습니다. *: p < 0.05; **: p < 0.01; : 피 < 0.001. n = 6-12입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
출혈성 쇼크는 장기 기능 장애와 관련이 있습니다. 이 모델이 임상적으로 타당할 수 있는지 평가하기 위해, 프로토콜 24시간 후에 장기 손상의 혈장 마커를 평가했다. 크레아티닌혈증(가짜: 19.13 μmol/L ± 0.33 μmol/L; HS: 28.88 μmol/L ± 2.69 μmol/L), 심장 트로포닌 T(Sham: 9.38 ng/L ± 1.87 ng/L; HS: 35.62 ng/L ± 2.28 ng/L), 아스파르테이트 및 알라닌 아미노 전이효소(ASAT: Sham: 221 UI/L ± 48 UI/L; HS: 963 UI/L ± 144 UI/L; ALAT: 가짜: 36 UI/L ± 4 UI/L; HS: 323 UI/L ± 13 UI/L)는 각각 신장, 심장 및 간의 손상을 반영하며, 출혈성 쇼크에 의해 모두 유의하게 증가한다(그림 4).
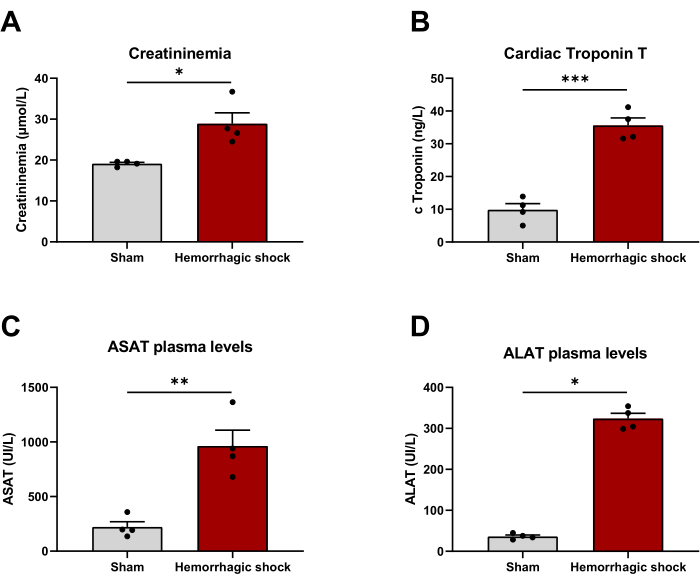
그림 4: 출혈성 쇼크 모델은 장기 기능 장애와 관련이 있습니다. (A) 크레아티닌혈증, (B) 심장 트로포닌 T, (C) 아스파르테이트 아미노전이효소 및 (D) 알라닌 아미노전이효소 수치는 샴과 출혈성 쇼크 동물 사이에서 출혈성 쇼크 유도 후 24시간 후에 발생합니다. 결과는 SEM± 평균으로 표시되며, 통계적 유의성은 쌍을 이루지 않은 t-검정으로 평가되었습니다. *: p < 0.05; **: p < 0.01; : 피 < 0.001. n = 4 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 행동 점수 세부 정보 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 논문에서 우리는 처음으로 고정 압력 모델과 고정 부피 모델 간의 혼합을 기반으로 한 출혈성 쇼크의 대표적인 쥐 모델을 설명했습니다. 우리는 충격 유도 후 24시간 후에 우리의 모델이 혈류역학적 매개변수 및 신진대사의 변화와 관련이 있음을 입증했습니다.
복잡한 병태생리학으로 인해 출혈성 쇼크 연구는 통합 동물 모델의 활용을 필요로 합니다. 실제로, 체외 접근법은 이 질병과 관련된 모든 경로를 모방할 수 없습니다. 출혈성 쇼크 프로토콜 후 동물을 깨우는 것은 임상 상황을 더 잘 재현하기 위한 단계입니다. 동물을 깨우는 것이 어렵기 때문에 이 단계를 포함한 연구는 거의 없습니다. 동물을 깨우는 희귀한 연구는 짧은 시간(2시간 또는 6시간)에 동물을 희생시키는데, 이는 환자에게 무슨 일이 일어나고 있는지 완전히 반영하지 못한다 16,18,23,24. 출혈성 쇼크 모델의 개발에도 불구하고, 쇼크 유도 후 24시간 동안 매개변수(염증, 세포사멸, 장기 기능 장애)를 평가한 연구는 소수에 불과하며, 따라서 이러한 종류의 프로토콜의 어려움이 강조되고있다 25,26,27. 컴퓨터 및 수학적 모델의 개발은 연구에 혁명을 일으켰습니다. 출혈성 쇼크에 대한 수많은 수학적 모델이 개발되었지만, 이러한 모델의 대부분은 출혈성 쇼크 중 체액 교환의 전체 범위를 고려하지 않았으며 잠재적인 임상적 적용에 앞서 개선이 필요하다28. 현재까지 주요 과제 중 하나는 인간의 병리학을 가능한 한 가깝게 모방하는 동물 모델을 개발하는 것입니다.
많은 수의 출혈성 쇼크 모델이 문헌에 기술되어 있으며, 혈관 접근법, 채혈된 혈액의 양 또는 목표 압력(targeted pressure13)에 따라 다르다. 보다 일반적으로, 출혈성 쇼크 모델은 고정 부피 출혈, 고정 압력 출혈 및 조절되지 않는 출혈의 3 그룹으로 분류 할 수 있습니다. 고정형 출혈에 대한 표준화 및 재현성은 어렵고 쥐의 체중에 따라 선형적으로 감소하는 혈액량/체중 비율로 설명됩니다. 고정 압력 출혈은 널리 사용되며, 따라서 설정(목표 압력, 충격 지속 시간)이 연구마다 매우 다양하여 한 모델에서 다른 모델로 결과를 전환하기가 어렵다는 것을 설명합니다. 또한 출혈성 쇼크의 병태생리학에서 중추적인 역할을 하는 혈역학적 손상이 체계적으로 평가되지 않아 연구 간 결과의 불일치가 증가할 수 있다는 점을 지적하는 것이 중요합니다. 마지막으로, 통제되지 않는 출혈 모델은 임상적으로 관련성이 있지만 재현 가능성과 윤리에 대한 질문을 제기합니다. 임상적 타당성, 표준화 및 재현성을 최대한 조화시키기 위해 우리는 고정 부피 단계와 고정 압력 단계를 모두 가진 혼합 모델을 개발했습니다.
여기에 설명된 모델에서 온도와 호흡수는 수술 후 24시간 동안 수정되지 않습니다. 이는 수술이 무균 상태에서 수행되어 전염증 반응을 제한한다는 사실로 설명할 수 있습니다. 출혈성 쇼크는 혈압 강하와 관련된 출혈로 인한 급성 순환 부전으로 정의됩니다. 인간에서와 마찬가지로 이 출혈성 쇼크 모델은 평균 동맥압의 감소를 유발하며, 특히 이완기 혈압의 감소로 인해 발생합니다. 흥미롭게도, 그리고 앞서 설명한 바와 같이, 이 출혈성 쇼크 모델에서 심박수는 소생 단계 후에도 변하지 않는다 29,30,31. 평균 동맥압의 하락은 아마도 장기 관류 감소와 관련이 있을 수 있으며, 이는 우리 모델에서 다양한 플라즈마 마커(크레아티닌혈증, 심장 트로포닌 T, ASAT 및 ALAT)의 증가로 설명할 수 있습니다. 산소 공급의 중단은 혐기성 대사로 이어져 젖산혈증을 증가시킨다32. 앞서 설명한 바와 같이, 이 출혈성 쇼크 모델은 혈중 젖산 수치30의 증가를 초래한다. 이러한 증가는 대퇴 동맥 수준에서 발생하는 허혈과 관련이 있을 수 있습니다. 그러나 가짜 그룹의 동물이 생리적 젖산혈증을 앓고 있고 출혈성 쇼크 그룹과 동일한 수술을 받은 것을 고려하면 이러한 증가는 출혈성 쇼크 프로토콜과 관련이 있는 것으로 보입니다. 종합하면, 이러한 모든 데이터는 이 연구에서 설명된 프로토콜이 쥐에서 출혈성 쇼크의 새로운 관련 모델을 개발할 수 있음을 확인합니다.
이 모델의 한계는 헤파린을 사용한다는 것인데, 이는 캐뉼라와 같은 플라스틱 재료와 접촉할 때 혈액의 자연적인 응고를 줄이는 데 필수적입니다. 그러나, 헤파린의 사용은 외상성 출혈성 쇼크와 관련된 응고 장애에 영향을 미칠 수 있다33. 이 연구는 생후 11-13주 된 건강한 수컷 동물을 대상으로 합니다. 성별, 연령 및 동반 질환(고혈압, 당뇨병 등)이 결과에 영향을 미칠 수 있다는 점을 고려할 때 모델에서 그 영향을 평가하는 것이 적절할 것입니다. 프로토콜에서 소생술 단계는 응고 장애와 조직 부종을 촉진할 수 있는 결정체인 링거 젖산(Ringer Lactate)의 주입을 통해 수행됩니다34. 혈액 제제를 사용하는 것이 최적이기는 하지만, 혈액 제제는 부족하고 부패하기 쉬우며, 전체 프로토콜에 대해 충분한 양의 쥐 혈액을 비축하기 어려울 수 있습니다. 혈액 제제와 결정질/콜로이드 기반 소생술 출혈성 쇼크 모델은 두 가지 상호 보완적인 접근 방식입니다.
이 모델의 강점은 1) 높은 재현성(결과의 낮은 변동성으로 설명됨), 2) 적용 용이성(대부분의 기구는 고전적 및 혈관 접근법으로 알려져 있음), 3) 특히 동물 각성 및 다중 내장 기능 장애로 인한 임상적 관련성입니다. 보충 파일 1에 설명된 행동 점수에 따라 한계 포인트가 설정되었습니다. 첨부된 표에 따라 9점 이상의 점수에 도달하면 희생에 대해 논의할 것입니다. 점수가 11점이면 해당 동물은 체계적으로 안락사됩니다. 이 연구에서 어떤 동물도 8점 이상의 점수에 도달하지 않았으므로 연구에서 제외된 동물은 없습니다. 이는 여기에 설명된 모델이 다른 24시간 연구보다 3배 낮은 사망률(16% 대 47%)과 관련이 있는 이유를 설명할 수 있습니다25.
이 모델의 중요한 단계는 출혈성 쇼크 단계입니다. 32-38mmHg의 압력 범위를 준수하는 것이 중요합니다. 실제로 평균 동맥압을 32mmHg 미만으로 유지하면 동맥압이 빠르고 갑작스럽게 떨어지는 것을 관찰했습니다. 반대로, 압력을 38mmHg 이상으로 유지하는 것은 임상 현실에 충분히 가까운 모델을 제공하지 않습니다. 이러한 관찰은 다른 모델(13)에서 목표로 하는 평균 동맥압의 간격에 따른 것이다.
결론적으로, 우리는 이 연구에서 자세히 설명한 쥐 출혈성 쇼크 모델이 임상적으로 관련성이 있으며 새로운 생물학적 행위자/경로를 식별하여 병태생리학적 메커니즘을 이해하고 다양한 후보 분자를 테스트하여 새로운 치료 전략을 식별하는 데 유용할 수 있음을 입증했습니다.
공개
저자들은 이 논문에 보고된 연구에 영향을 미칠 수 있는 경쟁적인 재정적 이해관계나 개인적 관계를 알지 못한다고 선언합니다. 이 연구의 결과를 뒷받침하는 데이터는 합당한 요청에 따라 교신 저자가 사용할 수 있습니다.
감사의 말
이 연구는 "Société Française d'Anesthésie et de Réanimation"(파리, 프랑스), "Fondation d'entreprises Genavie"(낭트, 프랑스), "Fédération française de cardiologie"(프랑스), "Agence nationale de la recherche"(20-ASTC-0032-01-hErOiSmE)(파리, 프랑스) 및 "Direction Générale de l'Armement"(파리, 프랑스)의 지원을 받았습니다. 토마스 뒤파스(Thomas Dupas)는 박사 과정 동안 프랑스 DGA(Direction Générale de l'Armement)와 루아르 대학(Région des Pays de la Loire)의 장학금을 지원받았으며, 앙투안 페르셀로(Antoine Persello)는 박사 과정 동안 프랑스의 InFlectis BioScience에서 장학금을 받았습니다. 이 작업을 지원해 준 "Agence Nationale de la Recherche"(파리, 프랑스), "Direction Générale de l'Armement"(파리, 프랑스) 및 "Sauve ton coeur" 협회(프랑스)에 감사드립니다. UTE IRS-UN 핵심 시설(SFR Bonamy, Nantes Université, Nantes, France)과 IBISA 핵심 시설 Therassay(Nantes, France)의 도움과 기술 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | TERUMO | MDSS01SE | |
| 2.5 mL syringe | TERUMO | SS*02SE1 | |
| 20 mL syringe | TERUMO | MDSS20ESE | |
| Anesthesia induction chamber | TEMSEGA | HUBBIV4 | |
| BD Microlance 3 23 G needle | Becton Dickinson | 300800 | |
| BD Microlance 3 26 G needle | Becton Dickinson | 304300 | |
| Blood pressure transducer | emka TECHNOLOGIES | BP_T | |
| Buprecare | Axience | N/A | 1 mL vial, buprenorphine 0.3 mg/mL |
| DE BAKEY, Atraumatic Vascular Forceps | ALLGAIER instrumente medical | 09-543-150 | |
| Dermal Betadine 10% | Mylan | N/A | 125 mL bottle |
| Fine Forceps - Curved / Serrated | Fine Science Tools | 11065-07 | |
| GraphPad Prism 8 | GraphPad by Dotmatics | - | |
| Heating mats | TEMSEGA | OPT/THERM_MATELASSTEREORATS | |
| Heparin sodium | PANPHARMA | N/A | 5 mL bottle, 5,000 UI/mL |
| IOX2 software | emka TECHNOLOGIES | IOX_BASE_4c + IOX_FULLCARDIO_4a | |
| Iris Scissors - ToughCut | Fine Science Tools | 14058-11 | |
| Lidocaine | Fresenius | N/A | 10 mL bootle, 8.11 mg, lidocaine hydrochloride |
| MiniHub-V3.2 | TEMSEGA | PF006 | |
| Moria 201/A Vessel Clamp - Straight | Fine Science Tools | 18320-11 | |
| Non sterile compresses | Raffin | 70189 | |
| Non sterile drape | Dutscher | 30786 | |
| Olsen-Hegar Needle Holder with Scissors | Fine Science Tools | 12002-12 | |
| Polyethylene tubing PE10 | PHYMEP | BTPE-10 | |
| Polyethylene tubing PE50 | PHYMEP | BTPE-50 | |
| Rats | Charles Rivers | - | Male WISTAR HAN (10 weeks) |
| Rectal probe | TEMSEGA | SONDE_TEMP_RATS | |
| Ringer Lactates | Fresenius Kabi | 964175 | |
| Scrub Betadine 4% | Mylan | N/A | 125 mL bottle |
| Sevoflurane | Abbott | N/A | 250 mL bottle, gas 100% |
| Sevoflurane Vaporizer | TEMSEGA | SEVOTEC3NSELEC | |
| StatStrip lactate test strips | Nova Biomedical | 47486 | |
| StatStrip Xpress lactate Meter | Nova Biomedical | 47486 | |
| Sterile compresses | Laboratoire SYLAMED | 211S05-50 | |
| Sterile drape | Mölnlycke | 800330 | |
| Steriles gloves | MEDLINE | MSG7275 | |
| Suture | Optilene | 3097141 | |
| Suture for vessels | SMI | 8150046 | |
| Syringe pump | Vial médical | 16010 | |
| usbAMP | emka TECHNOLOGIES | - | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | |
| Vaseline | Cooper | N/A | 10 mL vial |
| Vitamin A Dulcis (ALLERGAN) | Allergan | N/A | 10 g tube, Retinol |
참고문헌
- Cannon, J. W. Hemorrhagic Shock. New Eng J Med. 378 (4), 370-379 (2018).
- Fox, E. E., Holcomb, J. B., Wade, C. E., Bulger, E. M., Tilley, B. C. Earlier endpoints are required for hemorrhagic shock trials among severely injured patients. Shock. 47 (5), 567-573 (2017).
- Frink, M., Andruszkow, H., Zeckey, C., Krettek, C., Hildebrand, F. Experimental trauma models: an update. J Biomed Biotechnol. 2011, 797383(2011).
- Hauser, C. J. Preclinical models of traumatic, hemorrhagic shock. Shock. 24, Suppl 1 24-32 (2005).
- Kemming, G., et al. Can we continue research in splenectomized dogs? Mycoplasma haemocanis: Old problem - new insight. Eur Sur Res. 36 (4), 198-205 (2004).
- Carroll, R. G., Iamsa, S. G., Pryor, W. H., Allison, E. J. Single hemorrhage: A clinically relevant canine model of hemorrhagic shock. Resuscitation. 16 (2), 119-126 (1988).
- Cheung, A. T., Duong, P. L., Driessen, B., Chen, P. C., Jahr, J. S., Gunther, R. A. Systemic function, oxygenation and microvascular correlation during treatment of hemorrhagic shock with blood substitutes. Clin Hemorheol Microcirc. 34 (1-2), 325-334 (2006).
- Hannon, J. P. Hemorrhage and hemorrhagic shock in swine: A review. , Available from: https://apps.dtic.mil/sti/citations/ADA221297 (1990).
- Lomas-Niera, J. L., Perl, M., Chung, C. -S., Ayala, A. Shock and hemorrhage: an overview of animal models. Shock. 24, Suppl 1 33-39 (2005).
- Redl, H., Bahrami, S. Large animal models: baboons for trauma, shock, and sepsis studies. Shock. 24, Suppl 1 88-93 (2005).
- Marques-Bonet, T., Cheng, Z., She, X., Eichler, E. E., Navarro, A. The genomic distribution of intraspecific and interspecific sequence divergence of human segmental duplications relative to human/chimpanzee chromosomal rearrangements. BMC Genom. 9, 384(2008).
- Schlag, G., Redl, H. R., Till, G. O., Davies, J., Martin, U., Dumont, L. Anti-L-selectin antibody treatment of hemorrhagic-traumatic shock in baboons. Crit Care Med. 27 (9), 1900(1999).
- Fülöp, A., Turóczi, Z., Garbaisz, D., Harsányi, L., Szijártó, A. Experimental models of hemorrhagic shock: A review. Eur Surg Res. 50 (2), 57-70 (2013).
- Zingarelli, B., Ischiropoulos, H., Salzman, A. L., Szabó, C. Amelioration by mercaptoethylguanidine of the vascular and energetic failure in haemorrhagic shock in the anesthetised rat. Eur J Pharmacol. 338 (1), 55-65 (1997).
- Gonzalez, R. J., Moore, E. E., Ciesla, D. J., Nieto, J. R., Johnson, J. L., Silliman, C. C. Post-hemorrhagic shock mesenteric lymph activates human pulmonary microvascular endothelium for in vitro neutrophil-mediated injury: the role of intercellular adhesion molecule-1. J Trauma. 54 (2), 219-223 (2003).
- Hoppen, R. A., Corso, C. O., Grezzana, T. J. M., Severino, A., Dal-Pizzol, F., Ritter, C. Hypertonic saline and hemorrhagic shock: hepatocellular function and integrity after six hours of treatment. Acta Cir Bras. 20 (6), 414-417 (2005).
- Rupani, B., et al. Relationship between disruption of the unstirred mucus layer and intestinal restitution in loss of gut barrier function after trauma hemorrhagic shock. Surgery. 141 (4), 481-489 (2007).
- Cai, B., Dong, W., Sharpe, S., Deitch, E. A., Ulloa, L. Survival and inflammatory responses in experimental models of hemorrhage. J Surg Res. 169 (2), 257-266 (2011).
- Esiobu, P., Childs, E. W. A rat model of hemorrhagic shock for studying vascular hyperpermeability. Methods Mol Biol. 1717, 53-60 (2018).
- Sordi, R., Chiazza, F., Patel, N. S. A., Doyle, R. A., Collino, M., Thiemermann, C. Preconditioning' with low dose lipopolysaccharide aggravates the organ injury / dysfunction caused by hemorrhagic shock in rats. PLoS One. 10 (4), 0122096(2015).
- Liu, Y., et al. Modified shock index and mortality rate of emergency patients. World J Emerg Med. 3 (2), 114-117 (2012).
- Sahu, N., et al. Shock index as a marker for mortality rates in those admitted to the medical intensive care unit from the emergency department. Cureus. 12 (4), e7903(2020).
- Zou, L., et al. Glucosamine improves cardiac function following trauma-hemorrhage by increased protein O-GlcNAcylation and attenuation of NF-κB signaling. Am J Physiol Heart Circ Phy. 296 (2), H515-H523 (2009).
- Nöt, L. G., Marchase, R. B., Fülöp, N., Brocks, C. A., Chatham, J. C. Glucosamine administration improves survival rate after severe hemorrhagic shock combined with trauma in rats. Shock. 28 (3), 345(2007).
- Nöt, L. G., Brocks, C. A., Vámhidy, L., Marchase, R. B., Chatham, J. C. Increased O-linked β-N-acetylglucosamine levels on proteins improves survival, reduces inflammation and organ damage 24 hours after trauma-hemorrhage in rats. Crit Care Med. 38 (2), 562-571 (2010).
- Patel, N. M., et al. Inhibition of macrophage migration inhibitory factor activity attenuates haemorrhagic shock-induced multiple organ dysfunction in rats. Front Immunol. 13, 886421(2022).
- Patel, N. M., et al. Inhibition of Bruton's tyrosine kinase activity attenuates hemorrhagic shock-induced multiple organ dysfunction in rats. Ann Surg. 277 (3), e624-e633 (2023).
- Curcio, L., D'Orsi, L., De Gaetano, A. Seven mathematical models of hemorrhagic shock. Comput Math Methods Med. 2021, e6640638(2021).
- Rönn, T., Lendemans, S., de Groot, H., Petrat, F. A new model of severe hemorrhagic shock in rats. Comp Med. 61 (5), 419-426 (2011).
- Hussmann, B., Lendemans, S., de Groot, H., Rohrig, R. Volume replacement with Ringer-lactate is detrimental in severe hemorrhagic shock but protective in moderate hemorrhagic shock: studies in a rat model. Crit Care. 18 (1), 5(2014).
- Mihara, R., Takasu, A., Maemura, K., Minami, T. Prolonged severe hemorrhagic shock at a mean arterial pressure of 40 mmHg does not lead to brain damage in rats. Acute Med Surg. 5 (4), 350-357 (2018).
- Vincent, J. -L., De Backer, D. Circulatory shock. N Engl J Med. 369 (18), 1726-1734 (2013).
- Halbgebauer, R., et al. Hemorrhagic shock drives glycocalyx, barrier and organ dysfunction early after polytrauma. J Crit Care. 44, 229-237 (2018).
- Chipman, A. M., Jenne, C., Wu, F., Kozar, R. A. Contemporary resuscitation of hemorrhagic shock: What will the future hold. Am J Surg. 220, 580-588 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유