Method Article
Spectroscopie Raman à cellules fluides pour l’étude operando des phénomènes de réaction et de transport lors de la corrosion du verre silicaté
Dans cet article
Résumé
La spectroscopie Raman à cellules fluides (FCRS) permet d’observer in operando les phénomènes de réaction et de transport lors de la corrosion aqueuse des verres de silicate à un niveau microscopique, à des températures élevées et en temps réel. Sans interrompre les processus en cours, le FCRS fournit des informations sur les mécanismes de réaction, la cinétique et les processus de transport.
Résumé
La spectroscopie Raman à cellules fluides (FCRS) permet l’étude en temps réel et résolue dans l’espace (operando) des mécanismes de réaction, de la cinétique et de leurs interactions mutuelles avec les processus de transport lors de la corrosion du verre de silicate à l’échelle micrométrique et à des températures élevées. Ce manuscrit fournit un protocole détaillé pour la mise en place d’une expérience FCRS, illustrée par une expérience de corrosion avec un verre borosilicate de Na ternaire et une solution de NaHCO3 0,5 M à une température de 86 ± 1 °C. Le protocole implique (i) la préparation de l’échantillon, (ii) l’assemblage de la cellule de fluide et (iii) le réglage des paramètres de mesure Raman pour la collecte de spectres Raman à travers l’interface échantillon/solution à intervalles de temps réguliers. Les résultats de l’expérience montrent la formation d’une zone riche en eau entre une couche d’altération de surface (SAL) à base de silice et le verre vierge, ce qui est une caractéristique intrinsèque d’un modèle de dissolution-précipitation couplé à l’interface pour la formation d’un SAL lors de la corrosion du verre silicaté. La capacité de suivre les processus de réaction et de transport pendant la corrosion des verres de silicate et potentiellement d’autres matériaux transparents, résolue spatialement et en temps réel, représente une force unique de cette technique, surmontant les inconvénients de l’analyse conventionnelle des expériences de trempe en plusieurs étapes. La corrosion de la face supérieure de l’échantillon de verre représente un problème actuel, réduisant la résolution spatiale en profondeur en raison des précipitations dans la trajectoire du laser. Cela est dû à un espace rempli de solution entre la fenêtre en saphir du couvercle de la cellule fluide et la face supérieure du monolithe, ce qui est difficile à éviter pendant le dispositif expérimental. Il faut en tenir compte lors du choix de la profondeur à laquelle la mesure doit être effectuée. Dans quelques cas, la formation de bulles d’air a été observée, ce qui a perturbé ou même conduit à la fin de l’expérience. Cependant, cela peut être évité en mettant soigneusement en place l’expérience, ce qui nécessite peu de pratique.
Introduction
Les verres de silicate représentent des matériaux métastables sensibles à la corrosion aqueuse par la vapeur d’eau atmosphérique ou l’eau liquide dans des environnements artificiels et des applications technologiques telles que les systèmes de conversion de l’énergie solaire1, l’utilisation pharmaceutique2 et l’immobilisation des déchets nucléaires de haute activité provenant du combustible nucléaire usé 3,4,5. Outre son rôle dans les domaines d’application technologiques, les verres volcaniques naturels représentent une composante majeure de la surface exposée de la Terre et sont donc impliqués dans les cycles biogéochimiques mondiaux et l’évolution du climat à long terme 6,7. L’altération atmosphérique par la vapeur d’eau est un facteur clé à la fois dans les applications technologiques et dans les environnements naturels. Il est important de distinguer cet effet de celui de l’altération par l’eau liquide, car le rapport surface/volume (S/V) du verre à la solution est significativement différent 8,9. Le présent travail se concentre toutefois sur le comportement à la corrosion du verre de silicate dans l’eau liquide. Lorsqu’un verre entre en contact avec une solution aqueuse, un certain nombre de processus de réaction et de transport couplés se produisent à l’interface verre/eau, formant généralement une couche d’altération de surface (SAL) structurellement complexe. Cependant, les mécanismes, la cinétique et les facteurs limitant la vitesse de corrosion du verre de silicate font encore l’objet d’un débat intensif, comme en témoigne l’existence de divers modèles de corrosion 5,10,11,12,13. Par conséquent, la compréhension de l’interaction complexe entre les processus de réaction et de transport à l’interface verre/eau dans le temps et l’espace et à un niveau microscopique est fondamentale pour le développement de modèles analytiques et numériques prédisant la corrosion à long terme du verre silicaté14.
Un modèle largement accepté suppose que le SAL forme par interdiffusion volumique de l’hydronium de la solution dans le verre et des modificateurs de réseau du verre dans la solution (lixiviation), par lequel les groupes silanol se forment par échange avec les cations15,16. Au cours de la réaction, on suppose que les groupes silanol se recombinent, libérant de l’eau moléculaire en formant de nouvelles liaisons siloxanes et laissant finalement derrière eux un SAL résiduel poreux riche en silice (Figure 1A). Cependant, les résultats expérimentaux obtenus par tomographie par sonde atomique et microscopie électronique à transmission ont révélé une interface atomiquement nette entre le verre et le SAL 14,17,18, ce qui contredit un processus contrôlé par diffusion. De plus, les nouveaux résultats des expériences de traçage isotopique ne sont pas compatibles avec un modèle de lixiviation19,20. Au lieu de cela, de telles observations peuvent être expliquées par le modèle de dissolution-précipitation couplé à l’interface (ICDP) qui est basé sur une dissolution stœchiométrique du verre couplée spatialement et temporellement à la précipitation de la silice amorphe une fois qu’une couche limite de solution à la surface du verre est sursaturée par rapport à la silice 5,21,22. Récemment, le modèle ICDP a été élargi pour inclure une zone d’échange d’ions qui peut évoluer avant un front ICDP si le taux de dissolution-précipitation ralentit considérablement23 (Figure 1B). Pour un examen plus détaillé d’autres modèles considérant la formation de SAL, se référer à la thèse de doctorat de M. Fritzsche24.
Les expériences de corrosion couramment réalisées suivent un flux de travail en plusieurs étapes, y compris l’expérience d’altération elle-même, la trempe (refroidissement rapide), le séchage, le sciage et le polissage de l’échantillon de verre altéré pour l’analyse post-mortem 15,19. Cependant, cela est essentiel car cela peut modifier les propriétés structurelles et chimiques du principal produit de corrosion, c’est-à-dire le SAL amorphe amorphe à base de silice, en raison de la condensation et/ou de la polymérisation, de la perte d’eau (déshydratation) et/ou de la fissuration et de la fusion 15,19,25. Dans les systèmes chimiquement complexes (verres et solutions à plusieurs composants), la trempe et le séchage de l’échantillon peuvent également induire la précipitation de minéraux secondaires qui ne sont pas impliqués dans la réaction elle-même. En outre, un échantillon trempé ne représente qu’un seul point dans le temps du processus de corrosion du verre, ce qui nécessite un effort élevé pour calculer les taux de dissolution du verre et des informations sur le(s) mécanisme(s) de réaction à partir de plusieurs expériences de trempe26. Par conséquent, la plupart des données cinétiques sur la corrosion du verre obtenues lors d’expériences de corrosion du verre à partir d’analyses aliquotes de la solution en vrac sont moins informatives pour l’étude des mécanismes de réaction et des processus de transport qui l’accompagnent lors de la corrosion du verre silicaté.
Pour surmonter les inconvénients des expériences ex situ, y compris la préparation d’échantillons et l’analyse post mortem, les techniques in situ ont suscité un intérêt croissant au cours des dernières années27,28. Par exemple, la microscopie à force atomique (AFM) et l’interférométrie à balayage vertical (VSI) sont devenues des outils essentiels pour étudier les surfaces minérales qui sont en contact direct avec une solution aqueuse27,29. Cependant, les deux approches se limitent à l’étude des toutes premières étapes d’un processus de corrosion, c’est-à-dire jusqu’à ce qu’une couche secondaire se forme qui entrave l’étude de l’interface verre/SAL28,30. La spectroscopie Raman à cellules fluides (FCRS) surmonte les lacunes susmentionnées en fournissant des observations en temps réel et résolues dans l’espace (operando) des processus de réaction et de transport aux interfaces solide/solution à l’échelle microscopique et à des températures élevées si la ou les phases d’origine et de produit sont transparentes à la lumière visible (Figure 2). Les premières études FCRS ont été menées par Geisler et al.5, qui ont étudié le comportement à la corrosion aqueuse du verre borosilicaté ternaire (TBG) dans une solution de NaHCO3 de 0,5 M, c’est-à-dire dans des conditions de pH presque neutres à 85 °C. La formation d’une zone riche en eau entre le SAL et le verre vierge a été observée, une caractéristique intrinsèque du modèle ICDP. En utilisant une solution de bicarbonate, les gradients de pH à la surface du verre et à l’intérieur du SAL ont également pu être détectés en estimant le pH local à partir du rapport d’intensité de la bande carbonate et bicarbonate (c.f.5). De plus, sans perturber le processus de corrosion en cours, un échange avec une solution deutérée a montré que le transport de l’eau à travers le SAL n’était pas une étape limitant le débit du processus de corrosion. En résumé, ce travail a mis en évidence la capacité du FCRS à identifier les principaux mécanismes de réaction et la rétroaction sur les phénomènes de transport au sein d’une seule expérience dans des conditions bien contrôlées.
Des expériences ultérieures du FCRS ont démontré que cette méthode convient à une utilisation courante, produisant des résultats cohérents et reproductibles 24,31,32. Par exemple, le FCRS a été appliqué pour étudier l’effet de l’irradiation ionique lourde sur le taux de dissolution directe des verres borosilicatés, montrant une augmentation significative du taux de dissolution directe d’un facteur de 3,7 ± 0,531. De plus, des expériences FCRS menées avec un verre boroaluminosilicate sodocalcique contenant du Ba dans une solution hyperalcaline ont documenté la transformation directe du verre en argile Mg, en zéolithe et en carbonates. Ces auteurs ont constaté une diminution du taux initial de dissolution du verre, dont l’ampleur semble être liée à la composition et à la structure de la couche d’altération33. De plus, les changements de forme de la bande d’eau alvéolée ont été utilisés pour surveiller la force ionique operando, révélant des fluctuations rythmiques32. Sulzbach et Geisler34 ont réalisé des expériences FCRS pour étudier le remplacement de la célestine (SrSO4) par de la strontianite (SrCO3), toutes deux transparentes à la lumière visible, dans une solution carbonatée, ce qui a fourni de nouveaux détails sur un mécanisme ICDP et a fourni la première preuve de trois régimes cinétiques. Récemment, dans le cadre d’une thèse de doctorat24, le dispositif expérimental a été élargi pour inclure une station de chauffage externe, facilitant des études à long terme sur plusieurs mois avec des verres de plus grande durabilité, tels que l’International Simple Glass (ISG)14,24 à six composants. Pour cela, la cellule de fluide a été stockée sur la station de chauffage entre des mesures Raman consécutives afin d’éviter de bloquer le spectromètre Raman pendant plusieurs mois. De plus, des expériences d’écoulement continu ont été menées en connectant la cellule de fluide à un pousse-seringue. Cette approche a permis d’empêcher efficacement la précipitation de la silice, ce qui a permis de mesurer les taux de dissolution directe dans des conditions d’écoulement turbulentes (Fritzsche24).
En général, le FCRS propose une nouvelle approche pour étudier les mécanismes couplés de réactions et de transfert de masse se produisant aux interfaces solide-eau, en surmontant les lacunes des expériences ex situ couramment appliquées. Il est facilement extensible pour s’adapter à un large éventail d’échantillons et de conditions. L’objectif de cet article est de partager les détails techniques et expérimentaux de la spectroscopie Raman à cellules fluides, illustrée par une expérience de corrosion avec un verre borosilicaté ternaire (TBG) et une solution de NaHCO3 0,5 M à une température nominale de 90 °C. Le protocole couvrira la préparation de l’échantillon, l’assemblage de la cellule de fluide et le réglage des conditions de mesure au spectromètre Raman. Pour déterminer le taux de retrait du verre, le gradient de pH potentiel et la température locale, les auteurs se réfèrent à l’étude de Geisler et al.5 et Sulzbach et Geisler34 ainsi qu’à des matériaux supplémentaires et à la thèse de doctorat de Dohmen35 et Fritzsche24. Les étapes critiques de la mise en place de l’expérience, telles que le remplissage et la fermeture de la cellule, seront couvertes par des conseils supplémentaires sur la façon d’éviter de répéter les pièges des travaux précédents. Cet article donne un aperçu complet de la technique, facilitant sa mise en œuvre par les nouveaux venus dans le domaine et contribuant à l’avancement de la recherche sur l’interaction solide-fluide.
Protocole
1. Préparation de l’échantillon
REMARQUE : Les expériences FCRS peuvent être menées avec des matériaux cristallins ou amorphes à condition que la phase mère et la ou les phases du produit soient transparentes à la lumière visible et que la réaction ait lieu à une température de solution inférieure à environ 100 °C dans des échelles de temps allant de quelques jours à5 mois, 24, 30, 31, 33, 35. L’échantillon doit être préparé sous la forme d’un monolithe poli d’environ 10 x 10 x 0,9 mm3. La taille de l’échantillon peut varier jusqu’à quelques mm. Le porte-échantillon en polytétrafluoroéthylène (PTFE), qui doit être fabriqué pour chaque expérience, peut être réglé en conséquence (Figure 3A). Un dessin technique du support en PTFE utilisé est présenté à la figure supplémentaire 1. Dans ce qui suit, un échantillon de verre borosilicaté Na ternaire (TBG) est préparé.
- Broyez le coupon d’échantillon de verre avec du papier en carbure de silicium (SiC) de grain 600 sur deux côtés opposés jusqu’à ce qu’il s’insère dans le porte-échantillon en PTFE. Assurez-vous que l’échantillon est maintenu fermement et aussi verticalement que possible dans le support, et retirez soigneusement le matériau PTFE abrasé.
REMARQUE : En insérant soigneusement le coupon d’échantillon dans le support, l’abrasion du PTFE est possible, mais cela garantit également une position stable et serrée de l’échantillon. - Montez le support en PTFE avec l’échantillon dans un porte-échantillon métallique plus grand en préparation du meulage de la face supérieure du coupon en verre au même niveau que le support en PTFE.
- Une fois que l’échantillon, le PTFE et le porte-échantillon métallique sont presque dans un seul plan, broyez la surface avec un papier SiC plus fin de grain 1000.
- Nettoyez l’échantillon à l’intérieur du support d’abord avec de l’éthanol, puis avec de l’eau (manuellement avec des flacons pulvérisateurs) et séchez-le à l’aide d’un pistolet à air comprimé pour éliminer tous les débris de broyage (SiC).
REMARQUE : La présence de particules de SiC peut endommager le chiffon de polissage et peut perturber l’analyse Raman ultérieure. Il est recommandé d’utiliser des mouchoirs non pelucheux pour le nettoyage à l’eau afin d’essuyer les résidus. - Polissez la face supérieure de l’échantillon à l’intérieur du support PTFE avec une pâte diamantée de 3 μm et 1 μm pendant au moins 20 min. Assurez-vous que la surface de l’échantillon de verre et le support en PTFE forment un plan bien poli afin de permettre un contact direct avec le disque de saphir (Figure 3A,D).
REMARQUE : Ceci est essentiel pour minimiser autant que possible la surface réactive et l’espace entre la fenêtre saphir et l’échantillon afin de réduire les processus de corrosion sur la face supérieure de l’échantillon. De plus, une surface supérieure bien polie de l’échantillon réduit la réfraction de la lumière laser 36,37,38. - Nettoyez l’échantillon et le support en PTFE comme décrit à l’étape 1.4 et utilisez en outre un bain à ultrasons pendant une durée d’environ 30 s avec une fréquence de 50-60 Hz.
- Vérifiez la surface supérieure polie du verre et du support sous un microscope stéréoscopique avec un grossissement de 10 fois.
2. Préparation de la solution souhaitée
- Mesurer le pH de la solution de NaHCO3 0,5 M après l’équilibrage de la solution avec l’air ambiant à l’aide d’un pH-mètre. Pour éliminer les particules solides potentielles, filtrez la solution à l’aide d’un filtre à seringue stérile (pores de 0,22 μm) juste avant l’injection.
REMARQUE : La solution est généralement préparée un jour avant le début de l’expérience. Avant le début de l’expérience, la valeur du pH et la température de la solution sont mesurées afin de s’assurer que la valeur du pH est cohérente avec la valeur de pH théoriquement calculée pour la solution équilibrée. - Assurez-vous que la solution est visuellement exempte de bulles d’air. Déterminez le volume de solution en fonction de la taille de la cellule de fluide et assurez-vous qu’il est suffisant pour récupérer suffisamment de solution pour l’analyse chimique à la fin de l’expérience.
3. Configuration des paramètres de mesure Raman
- Assurez-vous que le spectromètre Raman est étalonné avec une norme de fréquence appropriée (par exemple, la bande de phonons optiques de premier ordre d’un monocristal de silicium avec un maximum de 520,7 cm-1). Pour les expériences FCRS, utilisez un spectromètre Raman équipé d’un laser de 532 nm avec une puissance de sortie élevée (> 1 W), un microscope avec une platine x-y-z automatisée d’une taille de pas de ≤ 1 μm, un objectif à longue distance de travail (LWD) 100x avec une grande ouverture numérique, un réseau moins dispersif (par exemple, avec 600 rainures par mm) pour couvrir une large gamme spectrale, Une lampe au néon pour la correction du décalage du spectromètre pendant les mesures à long terme et des fentes d’entrée confocales et spectrométriques réglables pour optimiser indépendamment la résolution spatiale et spectrale.
ATTENTION : Le port de lunettes de sécurité laser est obligatoire lors des mesures spectroscopiques Raman (vérifiez la classe laser). Avec une puissance de sortie de 1 W ou plus, l’effet de diffusion de la lumière est intense. Cependant, la puissance de sortie laser élevée est une condition préalable à la réalisation d’expériences FCRS de haute qualité, car une grande partie de la lumière primaire est absorbée le long du trajet du faisceau à travers la fenêtre en saphir, la solution et les solides. - Configurez les paramètres de mesure Raman dans le logiciel.
- Définir les plages de fenêtres spectrales pour mesurer les modes Raman caractéristiques de l’échantillon et de la solution étudiés. Pour l’échantillon de verre borosilicaté, la fenêtre spectrale varie de 200 à 1735 cm-1. La deuxième fenêtre varie de 2800 à 4000 cm-1 pour mesurer les modes Raman respectifs des groupes moléculaires de l’eau et du silanol.
- Si possible, fermez le trou confocal à 600 μm et ouvrez la largeur de la fente d’entrée du spectromètre à 200 μm pour optimiser la résolution en profondeur au détriment de la résolution spectrale (non critique pour les bandes Raman relativement larges typiques des matériaux et solutions amorphes).
- Sélectionnez le temps d’acquisition qui permet d’obtenir le meilleur rapport signal/bruit possible pour la résolution temporelle souhaitée. Pour un signal d’intensité suffisante du verre et de l’eau, mesurez les fenêtres spectrales pendant 7 s et 2 s, respectivement, et accumulez-les sur 5 tours.
REMARQUE : Il peut être nécessaire de prévoir le temps d’acquisition pour tenir compte des changements dans l’expérience, en adaptant aux changements la géométrie de l’interface échantillon/solide/eau en évolution avec l’augmentation du temps de réaction. - Placez le néon le long du trajet du faisceau de la lumière diffusée.
REMARQUE : La lampe au néon est facultative mais recommandée comme norme interne pour corriger les données pour les décalages potentiels du spectromètre dus aux fluctuations inévitables de la température ambiante, qui, cependant, doivent être mieux contrôlées à ± 0,5 °C (provoquant des fluctuations du spectromètre allant jusqu’à ~ 0,2 cm-1). De plus, les raies Ne peuvent être utilisées pour déterminer empiriquement la résolution spectrale24.
4. Assemblage de la cellule de fluide
REMARQUE : Les dessins techniques des composants de la cellule de fluide en polyéther éther cétone (PEEK) sont présentés à la figure supplémentaire 2 et à la figure supplémentaire 3.
- Placez la rondelle en silicone sur le couvercle inversé de la cellule de fluide, puis placez la fenêtre en saphir et le porte-échantillon en PTFE avec la face supérieure de l’échantillon face à la fenêtre en saphir (Figure 3B-D). Fixez la position de la rondelle en silicone, de la fenêtre en saphir et de l’échantillon à l’aide du capuchon à vis (Figure 3E-F).
- Avant d’injecter la solution réactive, nettoyez les tubes et les vannes de chaque côté avec de l’eau déminéralisée. Ensuite, injectez de l’air pour évacuer l’eau à l’intérieur des tubes et videz la cuve du réacteur.
- Insérez le joint torique dans la rainure fournie.
- Injectez la solution des deux côtés du réacteur jusqu’à ce que la sortie du tube à l’intérieur du réacteur soit entièrement couverte. Fermez les valves avant de retirer la seringue afin d’éviter l’accumulation d’air à l’intérieur de la tubulure ou des valves.
- Ajouter le reste de la solution par le haut de la cuve du réacteur jusqu’à ce que la solution forme une surface convexe (ménisque).
- Remplissez les espaces libres du couvercle de rétention de l’échantillon en faisant couler soigneusement la solution le long des côtés droit et gauche du coupon d’échantillon. Vérifiez que le couvercle rempli ne contient pas de poches d’air.
- Retournez le couvercle pour le placer sur le dessus de la cuve du réacteur et fermez la cellule le plus rapidement possible à l’aide des 6 vis. Serrez les vis en croix.
REMARQUE : En cas d’enceinte d’air, retirez le couvercle et remplissez la cellule et le couvercle. La cellule de fluide fermée représente un système statique et fournit un régime de transport purement diffusif en solution. Pour les expériences en flux continu, il est possible de connecter la cellule à un pousse-seringue24. - La solution devrait fuir sur le bord de la cellule. Nettoyez la cellule de l’extérieur pour éliminer la solution qui s’est échappée sur les bords.
- Montez la cellule de fluide sur l’étage x-y-z et connectez la cellule à l’étage de chauffage. Allumez l’étape de chauffage et réglez la température nominale souhaitée (ici 90 °C). Le chauffage prend, par exemple, environ 14 minutes pour atteindre une température nominale de 90 °C.
REMARQUE : Une description détaillée de l’électronique de l’appareil de chauffage est donnée dans la figure supplémentaire 4. Notons également qu’en raison d’un gradient de température dans la cellule de fluide, la température réelle à la profondeur des mesures est plus faible. Lors de l’utilisation d’une solution de bicarbonate, la température à n’importe quelle profondeur de la mesure peut être déterminée à partir de la position de la bande de bicarbonate près de 1016 cm-1 (cf., Geisler et al.5). Pour d’autres compositions de solutions sans carbonate, nous estimons la température au point de mesure en utilisant le gradient de température déterminé empiriquement à l’intérieur de la cellulede fluide 24.
5. Détermination de la taille de l’espace entre la fenêtre saphir et la face supérieure de l’échantillon et de la position de l’interface échantillon/solution
- Une fois la température nominale atteinte, focalisez le faisceau laser sur la fenêtre saphir à travers le microscope optique en mode vidéo.
REMARQUE : Une défocalisation du spot laser se produit inévitablement lors du chauffage jusqu’à la température nominale souhaitée en raison de la légère dilatation thermique de l’échantillon et des matériaux des cellules fluides. Une fois la température nominale atteinte, la mise au point se stabilise au bout de quelques minutes. Cela peut être contrôlé en utilisant le mode vidéo. - Déplacez le foyer laser sur le haut de la fenêtre saphir au centre de la surface dans les directions x et y pour vous assurer qu’il se trouve au-dessus de l’échantillon. Définissez la position z (profondeur) sur zéro comme référence.
- Déplacez la focalisation laser dans la direction z jusqu’à ce que les premiers signaux Raman d’espèces d’eau ou de solution, telles que, par exemple, HCO3- et CO32-, apparaissent (Figure 4).
REMARQUE : Si elle est disponible, une fonction de mesure de point répétitive en continu (par exemple, la fonction d’affichage en temps réel dans le logiciel LabSpec 6) peut être un outil très utile pour déterminer rapidement la taille de l’espace entre la surface supérieure de l’échantillon et la fenêtre saphir. - Déplacez la focale laser vers le bas jusqu’à ce qu’un spectre pur de l’échantillon de verre soit détecté à l’aide de la fonction d’affichage en temps réel. Cette position est appelée la face supérieure de l’échantillon.
- Déplacez le foyer laser plus loin dans la direction z dans l’échantillon (> 50 μm pour nos taux de corrosion du verre observés).
REMARQUE : L’étape 5.5 est importante pour éviter les signaux perturbateurs provenant de la corrosion attendue sur la face supérieure de l’échantillon. Néanmoins, la profondeur de la focalisation laser peut devoir être augmentée avec le temps en raison de la corrosion du haut de l’échantillon. La profondeur réelle est plus grande, de l’ordre de quelques dizaines de μm, en raison des multiples effets de réfraction le long du trajet du faisceau37. - Déplacez l’étage dans la direction x pour déterminer l’interface échantillon/solution en fonction de l’intensité décroissante et croissante du signal Raman de l’échantillon et de la solution, respectivement. Répétez cette étape en surveillant le signal d’intensité des modes Raman H2O dans la direction x.
REMARQUE : L’expérience a montré que lorsque la surface de l’échantillon est parfaitement perpendiculaire à la fenêtre saphir, un changement du signal d’intensité est observé sur ~ 10 μm dans la direction x, ce qui correspond à la résolution latérale. - Définissez la position de l’interface échantillon/solution sur x = 0. Réglez la taille totale du balayage linéaire à 100 μm, allant de -70 à 30 μm dans la direction x, de sorte que la direction de balayage soit réglée de l’échantillon à la solution en vrac. En tenant compte de la progression attendue de la réaction, la taille du pas est fixée à 1 ou 2 μm et la
REMARQUE : Le balayage linéaire présente des mesures en un seul point dans la direction x pour surveiller l’interface verre mobile/solution au fil du temps à une position constante en profondeur (z) et dans les directions y. Le temps nécessaire par balayage linéaire est la somme (1) du temps de comptage, (2) du temps nécessaire pour se déplacer vers un nouvel endroit et (3) du temps dont le spectromètre a besoin pour se déplacer vers différentes fenêtres de fréquences si une large gamme de fréquences doit être mesurée, par exemple, une région de basses fréquences (100 à 1735 cm-1) et une région de hautes fréquences (2800 à 4000 cm-1). Il peut être nécessaire d’étendre la longueur du balayage linéaire dans l’échantillon en fonction de la progression de la réaction. - Démarrez les mesures de balayage linéaire. Pour l’interface verre/solution, définissez un balayage linéaire de 100 μm avec une taille de pas de 2 μm, en prenant 51 mesures en points dans la direction x. En chaque point, la première et la deuxième fenêtre spectrale sont mesurées pendant 7 s et 2 s, respectivement, et 5 fois accumulées. Le balayage linéaire est automatiquement répété sur l’interface verre/solution en mouvement pendant plusieurs jours à plusieurs semaines, en surveillant la dissolution du verre et la précipitation de la couche d’altération de surface (SAL) à base de silice.
Résultats
Les principales caractéristiques de la méthodologie sont illustrées ci-dessous par les résultats d’une expérience de corrosion avec un échantillon de verre borosilicaté de Na ternaire (TBG) et une solution de NaHCO3 0,5 M à une température nominale de 90 °C, c’est-à-dire dans les mêmes conditions que pour les expériences de Geisler et al.4. La température réelle à la profondeur de mesure était de 86 ± 1 °C, déterminée à partir du décalage de fréquence dépendant de la température de la bande de bicarbonate près de 1016 cm-1 (à température ambiante)4. Le TBG a déjà été utilisé dans des expériences précédentes du FCRS 24,30,31,35. L’expérience a été menée avec un spectromètre Raman confocal Horiba Scientific HR800 à l’Institut de géosciences de l’Université de Bonn, en Allemagne. Le système est équipé d’un laser Nd : YVO4 (532,11 nm) à fréquence doublée d’une puissance de sortie de 2,2 W et d’un dispositif couplé à la charge d’un multiplicateur d’électrons (Figure 3B). Un objectif à longue distance de travail (LWD) 100x avec une ouverture numérique de 0,8, un réseau de spectromètre avec 600 rainures par mm, un trou confocal de 600 μm et une largeur de fente d’entrée de spectromètre de 200 μm a été utilisé. Le spectromètre a d’abord été calibré avec un monocristal de silicium doté d’une bande Raman de premier ordre à 520,7 cm-1. Le signal Raman a été mesuré dans les gammes de numéros d’onde de 200 à 1735 et de 2800 à 4000 cm-1. La première gamme de numéros d’onde comprend une raie Ne à 1707,36 cm-1 qui a été enregistrée comme un étalon de numéro d’onde interne pour corriger chaque spectre pour tout décalage du spectromètre lors de mesures à long terme pouvant durer jusqu’à plusieurs jours (résultant de ± variations de température de 0,5 °C en laboratoire). Les données Raman présentées ici n’ont été corrigées, sauf indication contraire, pour tenir compte d’éventuelles fluctuations de fréquence qu’en ajustant une fonction gaussienne à la raie Ne24,39 enregistrée. De plus, la raie Ne a été utilisée pour déterminer empiriquement la résolution spectrale, donnée par la largeur totale à mi-maximum (FWHM), qui était de 5,1 cm-1.
La figure 5A montre l’évolution temporelle de la distribution spatiale du verre, de la solution et du SAL telle qu’affichée par le logiciel à l’aide des spectres bruts enregistrés. Cette image en fausses couleurs en fonction du temps en fonction de la position a été générée à partir de balayages linéaires, c’est-à-dire à partir de mesures point par point dans la direction x à travers l’interface verre/solution. L’image montre une interface verre/solution en retrait continu au cours des 4,0 premières heures, indiquant la dissolution congruente du verre. Les premiers signaux de silice amorphe ont été détectés après 8,3 h, capturant la précipitation du SAL. La figure 5B montre des spectres Raman bruts représentatifs enregistrés à partir d’un seul point (pixel) de la solution, du SAL et du verre, ainsi que les fenêtres de fréquence individuelles utilisées pour l’intégration de l’intensité afin de visualiser leur distribution spatiale, comme le montrent les figures 5A et 6A. L’observation clé de cette expérience à souligner ici est la formation d’une zone riche en eau entre le SAL et le verre sous-jacent. Cette zone riche en eau a commencé à se former après environ 80 h et, à partir de ce moment, s’est ensuite transformée en une couche d’eau interfaciale claire d’une largeur d’environ 6 à 8 μm (Figure 6A). La figure 6B montre des spectres Raman moyens représentatifs dans la gamme de fréquences des vibrations de l’eau provenant de la solution en vrac, du SAL, de la solution d’interface et du verre nominal sans eau. Les spectres mettent en évidence la différence d’intensitéH2O entre la solution en vrac et la solution d’interface, mais aussi que le spectre du SAL implique un nouveau signal proche de 3600 cm-1 qui peut être attribué à des vibrations Si-OH35. Cette bande OH supplémentaire n’est pas visible dans le spectre de la couche d’eau interfaciale et de la solution en vrac, ce qui est une preuve supplémentaire qu’un espace clair entre le verre vierge et le SAL a lentement évolué au cours de l’expérience qui a été remplie d’eau. La formation d’une telle couche d’eau interfaciale (ou interface riche en eau) pendant que la réaction est en cours est une caractéristique intrinsèque du modèle ICDP et ne peut pas être expliquée par le mécanisme de lixiviation largement accepté 4,17. Le fait que cette observation puisse être reproduite est d’une grande importance car elle doit évidemment être prise en compte dans les approches de modélisation qui visent à simuler de manière réaliste la corrosion du verre silicaté dans des solutions aqueuses.
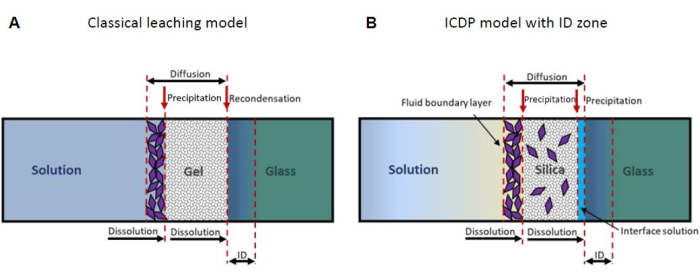
Figure 1 : Représentation schématique des deux modèles mécanistes de corrosion du verre les plus importants. (A) Le modèle classique de lixiviation13,16 et (B) le modèle de dissolution-précipitation couplée à l’interface (ICDP)19,20 avec zone d’interdiffusion (ID)23. Ce chiffre a été modifié au lieu de24. Veuillez cliquer ici pour voir une version agrandie de cette figure.
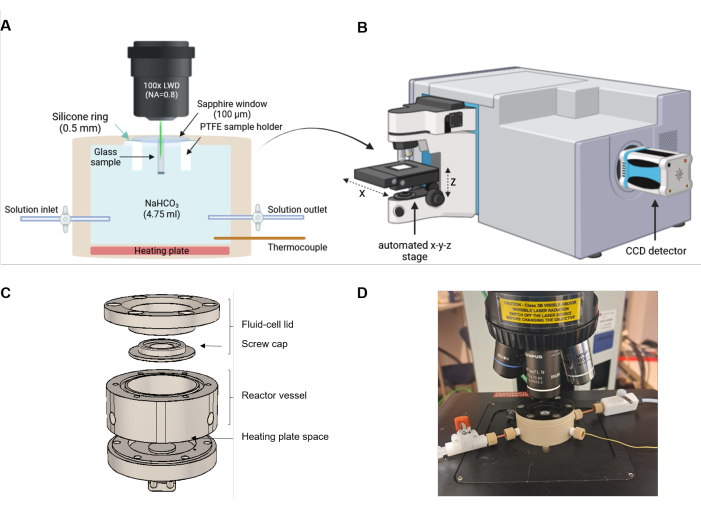
Figure 2 : Configuration expérimentale de la spectroscopie Raman à cellules fluides. (A) Le faisceau laser est aligné parallèlement à la direction du front de réaction. La cellule de réaction est équipée d’une plaque chauffante au fond et d’une entrée et d’une sortie pour des expériences optionnelles d’échange de solution ou d’écoulement. (B) Croquis d’un spectromètre Raman équipé d’un microscope, d’une platine x-y-z automatisée et d’un dispositif à couplage de charge (CCD) pour détecter la lumière diffusée. (C) Dessin technique schématique des composants PEEK de la cellule de fluide. (D) Photo d’une cellule de fluide remplie montée sur la platine automatisée du microscope Raman. La configuration n’est pas à l’échelle. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Assemblage du couvercle de la cellule de fluide. (A) Échantillon poli et support en PTFE (B) Rondelle en silicone placée sur le couvercle de la cellule de fluide. (C) La fenêtre en saphir est positionnée avec précision sur le dessus de la rondelle. (D) Support en PTFE avec l’échantillon face à la fenêtre en saphir placée sur la fenêtre. (E) Capuchon PEEK vissé fixant la position de l’échantillon. (F) Vue latérale du capuchon vissé fermement sur le couvercle. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Graphique d’empilement des spectres Raman bruts à différentes profondeurs. Graphique d’empilement de l’expérience présentée avec un verre borosilicaté Na et une solution de NaHCO3 de 0,5 M. La surface de la fenêtre en saphir est réglée sur z = 0. Compte tenu de l’épaisseur de 100 μm de la fenêtre en saphir, la distance entre le bas de la fenêtre et la face supérieure du monolithe de verre à -150 μm est d’environ 50 μm. Les spectres bleus affichent des spectres mixtes de saphir, de la solution NaHCO3 0,5 M et du verre borosilicate Na. Veuillez cliquer ici pour voir une version agrandie de cette figure.
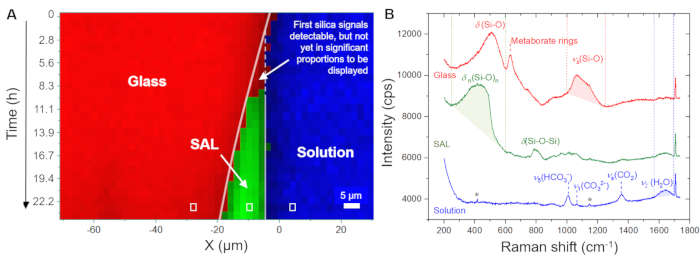
Figure 5 : Distribution du verre, de la solution et du SAL à base de silice en fonction du temps et de l’espace à 86 °C. (A) Profils de raies Raman hyperspectrales à travers l’interface verre/solution en fonction du temps pendant les premières 24 heures de l’expérience avec un verre borosilicaté Na et une solution de NaHCO3 0,5 M. (B) Graphique d’empilement des spectres Raman bruts rendus à partir d’une mesure en un seul point (rectangles blancs en (A)). Les lignes pointillées rouges, vertes et bleues indiquent les plages de numéros d’onde qui ont été utilisées pour visualiser le verre (1000 - 1250 cm-1), la solution de bicarbonate (1560 - 1700 cm-1) et le SAL à base de silice (250 - 600 cm-1), respectivement. L’intensité Raman à l’intérieur de ces limites a été intégrée après soustraction d’un arrière-plan linéaire défini par l’intensité aux limites de la fenêtre de nombre d’onde. Le symbole de l’étoile marque les signaux faibles de la fenêtre en saphir. Veuillez cliquer ici pour voir une version agrandie de cette figure.
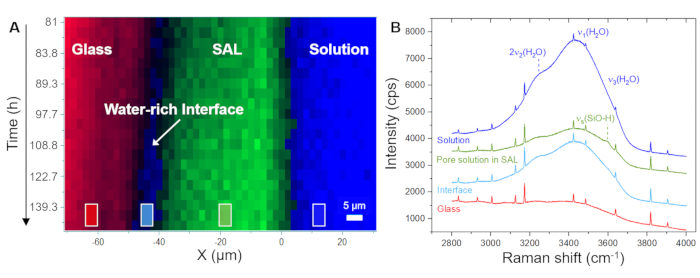
Figure 6 : Distribution du verre, d’une interface riche en eau et du SAL en fonction de l’espace-temps avec des spectres Raman représentatifs. (A) Profils de raies Raman hyperspectrales à travers l’interface verre/solution en fonction du temps pour la période comprise entre 81 h et 140 h de l’expérience avec un verre borosilicaté Na et une solution de NaHCO3 0,5 M, montrant la formation d’une couche d’eau d’interface entre le verre et le SAL. (B) Spectres Raman bruts empilés moyennés sur la région marquée par des carrés en (A), montrant une diminution du signal d’intensité des modes Raman respectifs de l’eau à l’intérieur de la SAL et une augmentation entre la SAL et le verre en dissolution. Au sein du SAL, on note une intensité de signal supplémentaire d’environ 3600 cm-1 qui peut être attribuée au mode d’étirement des groupes silanols (liés H à Si-O-)40. Le faible signal d’eau visible de la région du verre résulte de la couche de solution entre la fenêtre en saphir et la surface de l’échantillon de verre. Les pics aigus sont des lignes Ne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
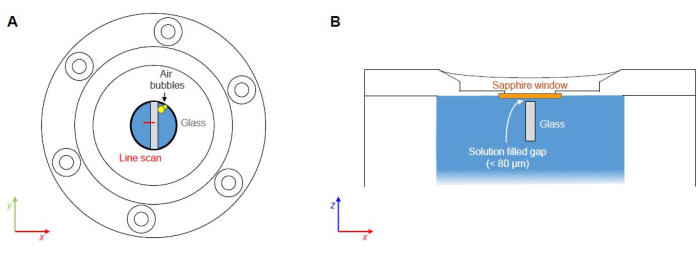
Figure 7 : Points critiques des expériences FCRS. (A) Piégeage et nucléation potentiels des poches d’air le long des interfaces des matériaux (sans mise à l’échelle). (B) Espace rempli de solution entre le bas de la fenêtre en saphir et la face supérieure de l’échantillon de verre (non à l’échelle). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Dessin technique du porte-échantillon en PTFE. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Dessin technique des composants des cellules de fluide en PEEK. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Dessin technique en vue éclatée des composants des cellules de fluide en PEEK. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 4 : Description détaillée de l’élément chauffant de la cellule du réacteur. L’élément chauffant de la cellule du réacteur est un disque chauffant métallo-céramique (MCH), tolérant des températures allant jusqu’à 400 °C. Il a un diamètre de 30 mm et une épaisseur de 1,5 mm. L’élément chauffant est relié à un régulateur de température au moyen d’un petit circuit électronique. La connexion entre le chauffage et le contrôleur est réalisée par des fils de silicium flexibles et tolérants à la chaleur. Le régulateur de température est logé avec le circuit électronique et une alimentation 5 V dans une petite boîte en plastique. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le présent protocole porte sur la mise en place d’une expérience FCRS pour l’étude operando des phénomènes de réaction et de transport lors de la corrosion aqueuse du verre borosilicaté en présentant des données Raman telles que mesurées issues d’une expérience avec un verre borosilicaté Na ternaire simple dans une solution de NaHCO3 0,5 M à 86 ± 1 °C. Les étapes critiques représentent (1) l’éventuel piégeage des poches d’air lors de la fermeture de la cellule de fluide et (2) les processus de corrosion de la face supérieure en raison de l’espace entre le bas de la fenêtre en saphir et la face supérieure de l’échantillon de verre (Figure 7). La corrosion sur la face supérieure représente un problème, en particulier lors d’expériences à long terme, car les produits de corrosion absorbent et diffusent la lumière incidente et diffusée, réduisant ainsi le rapport qualité (signal sur bruit) des spectres et la résolution spatiale avec le temps. Cette question est actuellement abordée par des expériences ex situ avec des verres qui ont été finement pulvérisés avec une couche de nitrure de silicium (SiN) afin de tester la stabilité de la couche de SiN contre des solutions aqueuses. Les signaux Raman de la couche superficielle de SiN ne sont détectables qu’à une profondeur de quelques micromètres et, par conséquent, ne devraient pas avoir d’effet perturbateur lors d’une expérience FCRS. Le piégeage de l’air est toujours un problème potentiel qui dépend de la façon dont la solution est versée dans la cellule, mais il peut être évité avec un peu de pratique et en éliminant les bulles d’air de la solution de départ.
Pour un traitement quantitatif, les données Raman doivent être correctement corrigées pour les signaux de fond, les effets de température et la dépendance de la longueur d’onde du processus de diffusion24,41. Un protocole détaillé pour le traitement des données est donné en24. De plus, il est important de noter que la profondeur focale réelle et apparente diffère en raison des effets de réfraction multiples. Cependant, la résolution en profondeur et la profondeur réelle à partir desquelles un signal Raman est enregistré peuvent être calculées avec une précision raisonnable à partir de considérations géométriques et optiques d’un système multicouche24. La résolution spatiale peut également être déterminée empiriquement 4,27,28. En général, la résolution en profondeur augmente linéairement avec la profondeur apparente, en fonction de l’ouverture numérique de l’objectif et des indices de réfraction des matériaux traversés par le faisceau laser, c’est-à-dire la fenêtre saphir, la solution et les produits d’échantillon/réaction24,37.
Le FCRS fournit des informations en temps réel et in situ sur les processus de réaction et de transport couplés qui se produisent à l’interface solide-eau à l’échelle microscopique. Sans interrompre les processus en cours, les FCRS peuvent capturer les principaux processus de réaction et de transport, ce qui est important, par exemple, pour le débat actuel sur les mécanismes de corrosion du verre utilisés pour décrire la performance à long terme des verres de déchets nucléaires. Les données exemplaires présentées ici montrent la formation d’une zone riche en eau (couche d’eau interfaciale/film fluide) entre le SAL et le verre sous-jacent, ce qui est une caractéristique intrinsèque du modèle ICDP. Les résultats confirment les études précédentesdu FCRS 5,24,30,33 et démontrent ainsi la reproductibilité de la méthodologie expérimentale. La méthode présentée surmonte les inconvénients des expériences ex situ en plusieurs étapes impliquant la trempe, le séchage et la section mécanique des produits de réaction et fournit des informations sur plusieurs expériences de trempe par une seule expérience tout en évitant le risque de modifier les produits d’altération pour l’analyse post-mortem.
Étant donné que la fréquence des vibrations moléculaires dépend de la masse des isotopes vibrants, les processus de réaction et de transport peuvent même être suivis par spectroscopie Raman à l’aide de 2H et 18O qui peuvent être ajoutés au système en tant que traceurs d’isotopes stables4. La mesure Raman peut également être étendue à trois dimensions, c’est-à-dire par des mesures séquentielles en deux dimensions, ce qui peut fournir des informations supplémentaires sur la texture27,28. Cependant, il convient de noter que le temps d’exposition augmentera considérablement. Les vitesses des processus à imager peuvent donc être un facteur limitant car elles doivent être plus lentes que le temps d’exposition, qui, bien sûr, doit également être pris en compte pour les mesures de balayage linéaire.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions G. Paulus (Schott AG) pour la synthèse et la caractérisation du verre borosilicaté. Nous remercions tout particulièrement D. Lülsdorf et H. Blanchard (Université de Bonn) ainsi que W. Bauer (Schott AG) pour leur aide dans la conception et la construction de la ou des cellules de fluide. Nous reconnaissons Schott AG Mainz, Allemagne, la Fondation allemande pour la recherche (subventions n° GE1094/21-1 et GE1094/27-1 à T.G.), et le ministère fédéral allemand de l’Éducation et de la Recherche (BMBF) (subvention n° 02NUK019F à T.G.) pour le soutien financier. T.G. et M.B.K.F. sont également reconnaissants du soutien financier apporté par Otto-Schott-Fond.
matériels
| Name | Company | Catalog Number | Comments |
| Cross screws (6 pieces) | --- | --- | |
| Blue silicone wire | Reichelt Elektronik | cross-section: 1.5 mm², length: 2 m | |
| Capacitor | Reichelt Elektronik | capacity: 100 nF | |
| Connectors according to user‘s choice | Reichelt Elektronik | ||
| Eurotherm Controller 3216 | Eurotherm/Emerson | Order Code 3216 CC VH LXXX X XXX G ENG XXXXX | |
| Flangeless Ferrules ETFE | Darwin Microfluidics | SKU: ID-P-200X | 1/4"-28 for 1/16" OD |
| Fluid Cell (container + lid) | home made | --- | technical drawing provided in the appendix (S1-S2) |
| Heating element, metal-ceramic heater (MCH) disc | Alibaba | D: 30 mm, H: 1.5 mm; https://german.alibaba.com/product-detail/DC-Power-Supply-30mm-MCH-Round-1600118228465.html?spm=a 2700.7724857.0.0.7cde5nqq5nqq2n | |
| Horiba HR800 Raman spectrometer | HORIBA | ||
| LabSpec 6.5.1.24 Spectroscopy Suite | |||
| Mains Cable with plug, load+neutral (L+N) | Reichelt Elektronik | length: 2 m | |
| Mains Fuse 1A | Reichelt Elektronik | 5x20 mm² | |
| Mains Fuse Holder | Reichelt Elektronik | 5x20 mm² | |
| Mains rocker switch | Reichelt Elektronik | 230VAC 2A | |
| Microfluidic Fittings Adapter Female Luer to 1/4-28 Male | Darwin Microfluidics | SKU: ID-P-618 | |
| Millex Syringe filters | Merck | SLGPR33RS | |
| NaHCO3 | Merck | CAS-144-55-8 | |
| NMOS Mosfet F1010N | Reichelt Elektronik | ||
| Plastic Enclosure | Reichelt Elektronik | TEKO KL22 | Enclosure 178x128x72 |
| PTFE sample holder | home made | --- | |
| PTFE Tubing | Darwin Microfluidics | BL-PTFE-1608-20 | 1/16" OD |
| Red silicone wire | Reichelt Elektronik | cross-section: 1.5 mm², length: 2 m | |
| Resistor | Reichelt Elektronik | 1/4W, 10kOhm | |
| Resistor | Reichelt Elektronik | 1/4W, 2.2kOhm | |
| Sapphire Window | Edmund Optics GmbH | #71-225 | D: 15 mm H: 100 µm |
| Shut-Off Valve 1/4-28 | Darwin Microfluidics | SKU: ID-P-782 | |
| Silicone washer | ART Elektromechanik | customized for institute | OD: 15mm, ID: 8 mm; H: 0.5 mm |
| Switching-mode power supply | Reichelt Elektronik | SNT RS 25 5 | 5V, 5A |
| Thermocouple Extension Cable, Plug/Socket, Type K | RS Components GmbH | 2 m | |
| Thermocouple Socket, Type K, Case Mount | RS Components GmbH | ||
| Thermocouple, Type K | TC Direct | D: 1 mm, L: 50-100mm | |
| Various cables for in-box wiring | Reichelt Elektronik |
Références
- Belançon, M. P., Sandrini, M., Zanuto, V. S., Muniz, R. F. Glassy materials for Silicon-based solar panels: Present and future. J Non-Crystalline Solids. 619, 122548(2023).
- Iacocca, R., et al. Factors affecting the chemical durability of glass used in the pharmaceutical industry. AAPS PharmSciTech. 11 (3), 1340-1349 (2010).
- Grambow, B. A general rate equation for nuclear waste glass corrosion. MRS Online Proc Lib. 44, 15-27 (1984).
- Gin, S., Taron, M., Arena, H., Delaye, J. M. Effect of structural disorder induced by external irradiation with heavy ions on the alteration of a four oxide borosilicate glass. NPJ Mater Degrad. 8, 64(2024).
- Geisler, T., Dohmen, L., Lenting, C., Fritzsche, M. B. K. Real-time in situ observations of reaction and transport phenomena during silicate glass corrosion by fluid-cell Raman spectroscopy. Nat Mater. 18, 342-348 (2019).
- Stroncik, N. A., Schmincke, H. U. Evolution of palagonite: Crystallization, chemical changes, and element budget. Geochem Geophys Geosyst. 2 (7), 1017(2001).
- Staudigel, H., Hart, S. R. Alteration of basaltic glass: Mechanisms and significance for the oceanic crust-seawater budget. Geochim Cosmochim Acta. 47, 337-350 (1983).
- Udi, U. J., Yussof, M. M., Ayagi, K. M., Bedon, C., Kamarudin, M. K. Environmental degradation of structural glass systems: A review of experimental research and main influencing parameters. Ain Shams Eng J. 14, 101970(2023).
- Majérus, O., et al. Glass alteration in atmospheric conditions: crossing perspectives from cultural heritage, glass industry, and nuclear waste management. NPJMater Degrad. 4, 27(2020).
- Grambow, B. Nuclear waste glasses - How durable. Elements. 2, 357-364 (2006).
- Hellmann, R., et al. Nanometre-scale evidence for interfacial dissolution-reprecipitation control of silicate glass corrosion. Nat Mater. 14, 307-311 (2015).
- Gin, S., et al. Origin and consequences of silicate glass passivation by surface layers. Nat Comm. 6, 6360-6360 (2015).
- Gin, S., et al. The controversial role of inter-diffusion in glass alteration. Chem Geol. 440, 115-123 (2016).
- Gin, S., et al. An international initiative on long-term behavior of high-level nuclear waste glass. Mater Today. 16, 243-248 (2013).
- Frugier, P., et al. SON68 Nuclear glass dissolution kinetics: Current state of knowledge and basis of the new GRAAL model. J Nuclear Mater. 380, 8-21 (2008).
- Bunker, B. C. Molecular mechanisms for corrosion of silica and silicate glasses. J Non-Crystalline Solids. 179, 300-308 (1994).
- Cailleteau, C., et al. Insight into silicate-glass corrosion mechanisms. Nat Mater. 7, 978-983 (2008).
- Gin, S., Ryan, J. V., Schreiber, D. K., Neeway, J., Cabié, M. Contribution of atom-probe tomography to a better understanding of glass alteration mechanisms: Application to a nuclear glass specimen altered 25years in a granitic environment. Chem Geol. 349 - 350, 99-109 (2013).
- Geisler, T., et al. The mechanism of borosilicate glass corrosion revisited. Geochim Cosmochim Acta. 158, 112-129 (2015).
- Geisler, T., et al. Aqueous corrosion of borosilicate glass under acidic conditions: A new corrosion mechanism. J Non-Crystalline Solids. 356, 1458-1465 (2010).
- Putnis, A. Why mineral interfaces matter. Science. 343, 1441-1442 (2014).
- Putnis, A. Mineral replacement reactions: from macroscopic observations to microscopic mechanisms. Mineralogical Magazine. 66, 689-708 (2002).
- Lenting, C., et al. Towards a unifying mechanistic model for silicate glass corrosion. NPJ Mater Degrad. 2, 28(2018).
- Fritzsche, M. B. K. The aqueous corrosion of borosilicate glasses studied in operando by in situ fluid-cell Raman spectroscopy. Dissertation. , University of Bonn. Germany. https://hdl.handle.net/20.500.11811/10602 (2023).
- Iler, K. R. The chemistry of silica: Solubility, polymerization, colloid and surface properties and biochemistry of silica. , Wiley. (1979).
- Gin, S., et al. The fate of silicon during glass corrosion under alkaline conditions: A mechanistic and kinetic study with the International Simple Glass. Geochim Cosmochim Acta. 151, 68-85 (2015).
- Putnis, C., Ruiz-Agudo, E. The mineral-water interface: Where minerals react with the environment. Elements. 9, 177-182 (2013).
- Icenhower, J. P., Steefel, C. I. Dissolution rate of borosilicate glass SON68: A method of quantification based upon interferometry and implications for experimental and natural weathering rates of glass. Geochim Cosmochim Acta. 157, 147-163 (2015).
- Icenhower, J. P., Steefel, C. I. Experimentally determined dissolution kinetics of SON68 glass at 90°C over a silica saturation interval: Evidence against a linear rate law. J Nuc Mater. 439, 137-147 (2013).
- Lenting, C., Geisler, T. Corrosion of ternary borosilicate glass in acidic solution studied in operando by fluid-cell Raman spectroscopy. NPJ Mater Degrad. 5, 37(2021).
- Lönartz, M. I., et al. The effect of heavy ion irradiation on the forward dissolution rate of borosilicate glasses studied in situ and real time by fluid-cell raman spectroscopy. Materials. 12 (9), 1480(2019).
- Müller, G., Fritzsche, M. B. K., Dohmen, L., Geisler, T. Feedbacks and non-linearity of silicate glass alteration in hyperalkaline solution studied by in operando fluid-cell Raman spectroscopy. Geochim Cosmochim Acta. 329, 1-21 (2022).
- Müller, G. Raman spectroscopic ex situ and in situ. investigations of the aqueous corrosion of soda-lime silicate glasses. , University of Bonn. Bonn. (2019).
- Sulzbach, M., Geisler, T. The replacement of celestine (SrSO4) by strontianite (SrCO3) in aqueous solution studied in situ and in real time using fluid-cell Raman spectroscopy. Minerals. 14 (2), 164(2024).
- Dohmen, L. In situ .observations of reaction and transport phenomena during silicate glass corrosion by fluid-cell Raman spectroscopy: Method development and applications. Unpubl. PhD thesis. , University of Bonn. Germany. (2019).
- Everall, N. Confocal Raman microscopy: Why the depth resolution and spatial accuracy can be much worse than you think. Appl Spectrosc. 54, 1515-1520 (2000).
- Everall, N. Depth profiling with confocal raman microscopy, part II. Spectroscopy. 19, 22-27 (2004).
- Everall, N. The influence of out-of-focus sample regions on the surface specificity of confocal Raman microscopy. Appl Spectrosc. 62, 591-598 (2008).
- Hauke, K., Kehren, J., Böhme, N., Zimmer, S., Geisler-Wierwille, T. In situ hyperspectral Raman Imaging: A new method to investigate sintering processes of ceramic material at high-temperature. Appl Sci. 9, 1310(2019).
- Davis, K. M., Tomozawa, M. An infrared spectroscopic study of water-related species in silica glasses. J Non-Crystalline Solids. 201, 177-198 (1996).
- Long, D. A. Raman spectroscopy. , McGraw Hill International Book Company. Great Britain. (1977).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon