Method Article
Espectroscopia Raman de célula fluida para estudos operacionais de fenômenos de reação e transporte durante a corrosão de vidro de silicato
Neste Artigo
Resumo
A Espectroscopia Raman de Célula Fluida (FCRS) permite observações em operação de fenômenos de reação e transporte durante a corrosão aquosa de vidros de silicato em nível microscópico, em temperaturas elevadas e em tempo real. Sem interromper os processos em andamento, o FCRS fornece informações sobre mecanismos de reação, cinética e processos de transporte.
Resumo
A espectroscopia Raman de célula fluida (FCRS) permite o estudo em tempo real e resolvido no espaço (operando) dos mecanismos de reação, cinética e suas interações mútuas com os processos de transporte durante a corrosão do vidro de silicato na escala micrométrica e em temperaturas elevadas. Este manuscrito fornece um protocolo detalhado para a criação de um experimento FCRS, exemplificado por um experimento de corrosão com um vidro ternário de borossilicato de Na e uma solução de NaHCO3 0,5 M a uma temperatura de 86 ± 1 °C. O protocolo envolve (i) preparação da amostra, (ii) montagem da célula fluida e (iii) configuração dos parâmetros de medição Raman para coleta de espectros Raman na interface amostra/solução em intervalos de tempo regulares. Os resultados do experimento mostram a formação de uma zona rica em água entre uma camada de alteração superficial (SAL) à base de sílica e o vidro puro, que é uma característica intrínseca de um modelo de dissolução-precipitação acoplado à interface para a formação de um SAL durante a corrosão do vidro de silicato. A capacidade de rastrear os processos de reação e transporte durante a corrosão de vidros de silicato e potencialmente de outros materiais transparentes, espacialmente resolvidos e em tempo real, representa uma força única desta técnica, superando as desvantagens da análise convencional de experimentos de têmpera em várias etapas. A corrosão da parte superior da amostra de vidro representa um problema atual, reduzindo a resolução espacial em profundidade devido à precipitação dentro do caminho do laser. Isso é causado por uma lacuna preenchida com solução entre a janela de safira da tampa da célula de fluido e a parte superior do monólito, o que é difícil de evitar durante a configuração experimental. Isso deve ser levado em consideração ao escolher a profundidade na qual a medição deve ser feita. Em alguns casos, foi observada a formação de bolhas de ar, que interromperam ou até levaram ao término do experimento. No entanto, isso pode ser evitado configurando cuidadosamente o experimento, o que requer pouca prática.
Introdução
Os vidros de silicato representam materiais metaestáveis que são suscetíveis à corrosão aquosa por vapor de água atmosférico ou água líquida em ambientes projetados e aplicações tecnológicas, como sistemas de conversão de energia solar1, uso farmacêutico2 e imobilização de resíduos nucleares de alto nível de combustível nuclear irradiado 3,4,5. Além de seu papel nos campos tecnológicos de aplicação, os vidros vulcânicos naturais representam um componente importante da superfície exposta da Terra e, portanto, estão envolvidos nos ciclos biogeoquímicos globais e na evolução do clima de longo prazo 6,7. A alteração atmosférica pelo vapor d'água é um fator chave tanto em aplicações tecnológicas quanto em ambientes naturais. Distinguir esse efeito da alteração pela água líquida é importante, pois a relação superfície-volume (S/V) do vidro para a solução é significativamente diferente 8,9. O presente trabalho, no entanto, enfoca o comportamento de corrosão do vidro de silicato em água líquida. Quando um vidro entra em contato com uma solução aquosa, vários processos de reação e transporte acoplados ocorrem na interface vidro/água, geralmente formando uma camada de alteração superficial (SAL) estruturalmente complexa. No entanto, os mecanismos, cinética e fatores limitantes da taxa de corrosão do vidro de silicato ainda são uma questão de intenso debate, refletida pela existência de vários modelos de corrosão 5,10,11,12,13. Portanto, entender a complexa interação entre os processos de reação e transporte na interface vidro/água no tempo e no espaço e em nível microscópico é fundamental para o desenvolvimento de modelos analíticos e numéricos que prevejam a corrosão do vidro de silicato a longo prazo14.
Um modelo amplamente aceito presume que o SAL forma por interdifusão de volume de hidrônio da solução para o vidro e modificadores de rede do vidro para a solução (lixiviação), por meio dos quais os grupos silanol se formam pela troca com os cátions15,16. No decorrer da reação, supõe-se que os grupos silanol se recombinem, liberando água molecular formando novas ligações de siloxano e, eventualmente, deixando para trás um SAL residual poroso rico em sílica ( Figura 1A ). No entanto, resultados experimentais obtidos por tomografia por sonda atômica e microscopia eletrônica de transmissão revelaram uma interface atomicamente nítida entre o vidro e o SAL 14,17,18, o que contradiz um processo controlado por difusão. Além disso, novos resultados de experimentos com traçadores de isótopos não são consistentes com um modelo de lixiviação19,20. Em vez disso, tais observações podem ser explicadas pelo modelo de dissolução-precipitação acoplada à interface (ICDP) que se baseia em uma dissolução estequiométrica do vidro espacial e temporalmente acoplada à precipitação de sílica amorfa, uma vez que uma camada limite da solução na superfície do vidro é supersaturada em relação à sílica 5,21,22. Recentemente, o modelo ICDP foi expandido para incluir uma zona de troca iônica que pode evoluir antes de uma frente ICDP se a taxa de dissolução-precipitação diminuir drasticamente23 (Figura 1B). Para uma revisão mais detalhada de outros modelos considerando a formação de SAL, consulte a tese de doutorado de M. Fritzsche24.
Os experimentos de corrosão comumente realizados seguem um fluxo de trabalho de várias etapas, incluindo o próprio experimento de alteração, têmpera (resfriamento rápido), secagem, serragem e polimento da amostra de vidro alterada para análise post-mortem 15,19. Isso, no entanto, é crítico, pois pode alterar as propriedades estruturais e químicas do principal produto de corrosão, ou seja, o SAL à base de sílica amorfa hidratada, devido à condensação e/ou polimerização, perda de água (desidratação) e/ou rachaduras e flack 15,19,25. Em sistemas quimicamente complexos (vidros e soluções multicomponentes), a têmpera e a secagem da amostra também podem induzir a precipitação de minerais secundários que não estão envolvidos na reação em si. Além disso, uma amostra temperada representa apenas um ponto no tempo do processo de corrosão do vidro, exigindo um alto esforço para derivar as taxas de dissolução do vidro e informações sobre o(s) mecanismo(s) de reação de vários experimentos de têmpera26. Portanto, a maioria dos dados cinéticos de corrosão do vidro obtidos durante os experimentos de corrosão do vidro a partir de análises de alíquotas da solução a granel são menos informativos para estudar os mecanismos de reação e os processos de transporte que acompanham durante a corrosão do vidro de silicato.
Para superar as desvantagens dos experimentos ex situ, incluindo preparação de amostras e análise post mortem, as técnicas in situ ganharam interesse crescente nos últimos anos27,28. Por exemplo, a microscopia de força atômica (AFM) e a interferometria de varredura vertical (VSI) tornaram-se ferramentas vitais para estudar superfícies minerais que estão em contato direto com a solução aquosa27,29. No entanto, ambas as abordagens limitam-se a estudar as primeiras etapas de um processo de corrosão, ou seja, até que se forme uma camada secundária que impeça a investigação da interface vidro/SAL28,30. A espectroscopia Raman de célula fluida (FCRS) supera as deficiências acima mencionadas, fornecendo observações em tempo real e resolvidas no espaço (operando) dos processos de reação e transporte em interfaces sólido/solução em escala microscópica e em temperaturas elevadas se a(s) fase(s) original(is) e produto(s) for(em) transparente(s) à luz visível (Figura 2). Os primeiros estudos de FCRS foram conduzidos por Geisler et al.5, que investigaram o comportamento de corrosão aquosa do vidro borossilicato ternário (TBG) em uma solução de NaHCO3 0,5 M, ou seja, sob condições de pH quase neutro a 85 °C. Foi observada a formação de uma zona rica em água entre o SAL e o vidro puro, uma característica intrínseca do modelo ICDP. Usando uma solução de bicarbonato, gradientes de pH na superfície do vidro e dentro do SAL também podem ser detectados estimando o pH local a partir da razão de intensidade da banda de carbonato e bicarbonato (cf5). Além disso, sem perturbar o processo de corrosão em curso, uma troca com uma solução deuterada mostrou que o transporte de água através do SAL não era uma etapa limitante da taxa para o processo de corrosão. Em resumo, este trabalho mostrou a força do FCRS para identificar os principais mecanismos de reação e feedback sobre os fenômenos de transporte em um único experimento sob condições bem controladas.
Experimentos subsequentes de FCRS demonstraram ainda que esse método é adequado para uso rotineiro, produzindo resultados consistentes e reprodutíveis 24,31,32. Por exemplo, o FCRS foi aplicado para estudar o efeito da irradiação de íons pesados na taxa de dissolução direta de vidros de borossilicato, mostrando um aumento significativo na taxa de dissolução direta por um fator de 3,7 ± 0,531. Além disso, experimentos FCRS conduzidos com um vidro de boroaluminossilicato soda-cal com rolamento Ba em uma solução hiperalcalina documentaram a transformação direta do vidro em argila de Mg, zeólita e carbonatos. Esses autores encontraram uma diminuição na taxa inicial de dissolução do vidro, cuja magnitude parece estar relacionada à composição e estrutura da camada de alteração33. Além disso, mudanças na forma da faixa de água contorcida foram usadas para monitorar a força iônica operando, revelando flutuações rítmicas32. Sulzbach e Geisler34 realizaram experimentos FCRS para estudar a substituição da celestina (SrSO4) por estronicita (SrCO3), ambos transparentes à luz visível, em uma solução carbonática, que forneceu novos detalhes sobre um mecanismo ICDP e deu a primeira evidência para três regimes cinéticos. Recentemente, como parte de uma tese de doutorado24, a configuração experimental foi estendida para incluir uma estação de aquecimento externa, facilitando estudos de longo prazo ao longo de vários meses com vidros de maior durabilidade, como o International Simple Glass (ISG) de seis componentes 14 , 24 . Para isso, a célula de fluido foi armazenada na estação de aquecimento entre medições Raman consecutivas para evitar o bloqueio do espectrômetro Raman por vários meses. Além disso, experimentos de fluxo foram conduzidos conectando a célula de fluido a uma bomba de seringa. Essa abordagem evitou efetivamente a precipitação de sílica, o que permitiu a medição das taxas de dissolução direta sob condições de fluxo turbulento (Fritzsche24).
Em geral, o FCRS fornece uma nova abordagem para estudar mecanismos acoplados de reações e transferência de massa que ocorrem em interfaces sólido-água, superando as deficiências dos experimentos ex situ comumente aplicados. É facilmente expansível para acomodar uma ampla gama de amostras e condições. O objetivo deste artigo é compartilhar os detalhes técnicos e experimentais da espectroscopia Raman de células fluidas, exemplificada por um experimento de corrosão com um vidro borossilicato ternário (TBG) e uma solução de NaHCO3 0,5 M a uma temperatura nominal de 90 °C. O protocolo cobrirá a preparação da amostra, a montagem da célula de fluido e a configuração das condições de medição no espectrômetro Raman. Para determinar a taxa de recuo do vidro, o gradiente de pH potencial e a temperatura local, os autores referem-se ao estudo de Geisler et al.5 e Sulzbach e Geisler34 mais material suplementar e às teses de doutorado de Dohmen35 e Fritzsche24. Etapas críticas na configuração do experimento, como preencher e fechar a célula, serão abordadas com conselhos adicionais sobre como evitar a repetição das armadilhas do trabalho anterior. Este artigo fornece uma visão abrangente da técnica, facilitando sua implementação por recém-chegados ao campo e contribuindo para o avanço da pesquisa em interação sólido-fluido.
Protocolo
1. Preparação da amostra
NOTA: Os experimentos FCRS podem ser conduzidos com materiais cristalinos ou amorfos, desde que a(s) fase(s) original(is) e produto(s) seja(m) transparente(s) à luz visível e a reação ocorra a uma temperatura de solução abaixo de cerca de 100 °C em escalas de tempo de dias a meses 5,24,30,31,33,35. A amostra deve ser preparada como um monólito polido com cerca de 10 x 10 x 0,9 mm3. O tamanho da amostra pode variar em até alguns mm. O porta-amostras de politetrafluoretileno (PTFE), que deve ser fabricado para cada experiência, pode ser ajustado em conformidade (figura 3A). Um desenho técnico do suporte de PTFE usado é fornecido na Figura Suplementar 1. A seguir, uma amostra de vidro de borossilicato de Na ternário (TBG) é preparada.
- Triture o copo de amostra de vidro com papel de carboneto de silício (SiC) de grão 600 em dois lados opostos até que ele caiba no suporte de amostra de PTFE. Certifique-se de que a amostra seja mantida firme e o mais verticalmente possível no suporte e remova cuidadosamente o material de PTFE desgastado.
NOTA: Ao inserir o cupom de amostra cuidadosamente no suporte, a abrasão do PTFE é possível, mas também garante uma posição estável e firme da amostra. - Monte o suporte de PTFE com a amostra em um suporte de amostra metálico maior em preparação para moer o lado superior do cupom de vidro no mesmo nível que o suporte de PTFE.
- Quando a amostra, o PTFE e o suporte de amostra metálico estiverem quase em um plano, triture a superfície com um papel SiC de grão 1000 mais fino.
- Limpar a amostra dentro do suporte primeiro com etanol e depois com água (manualmente com borrifadores) e secá-la com o auxílio de uma pistola de ar comprimido para remover quaisquer restos de trituração (SiC).
NOTA: A presença de partículas de SiC pode danificar potencialmente o pano de polimento e pode perturbar a análise Raman subsequente. Recomenda-se o uso adicional de lenços de papel sem fiapos para limpeza com água para limpar os resíduos. - Polir a parte superior da amostra dentro do suporte de PTFE com uma pasta de diamante de 3 μm e 1 μm por pelo menos 20 min. Certifique-se de que a superfície da amostra de vidro e o suporte de PTFE formem um plano completamente polido para permitir o contato direto com o disco de safira (Figura 3A,D).
NOTA: Isso é essencial para minimizar ao máximo a área de superfície reativa e a lacuna entre a janela de safira e a amostra, a fim de reduzir os processos de corrosão na parte superior da amostra. Além disso, uma superfície superior bem polida da amostra reduz a refração da luz laser 36,37,38. - Limpe o sample e o suporte de PTFE conforme descrito na etapa 1.4 e, adicionalmente, use um banho ultrassônico por um período de aproximadamente 30 s com uma frequência de 50-60 Hz.
- Verifique a superfície superior polida do vidro e do suporte sob um microscópio estereoscópico com uma ampliação de 10 vezes.
2. Preparação da solução desejada
- Meça o pH da solução de NaHCO0,5 M 3 após o equilíbrio da solução com o ar ambiente por um medidor de pH. Para remover possíveis partículas sólidas, filtre a solução com um filtro de seringa estéril (tamanho de poro de 0,22 μm) imediatamente antes da injeção.
NOTA: A solução é comumente preparada um dia antes do início do experimento. Antes do início do experimento, o valor do pH e a temperatura da solução são medidos para garantir que o valor do pH seja consistente com o valor do pH calculado teoricamente para a solução equilibrada. - Certifique-se de que a solução esteja visualmente livre de bolhas de ar. Determine o volume da solução com base no tamanho da célula de fluido e certifique-se de que seja suficiente para recuperar solução suficiente para análise química no final do experimento.
3. Configuração dos parâmetros de medição Raman
- Certifique-se de que o espectrômetro Raman esteja calibrado com um padrão de frequência adequado (por exemplo, a banda de fônon óptico de primeira ordem de um monocristal de silício com um máximo de 520.7 cm-1). Para experimentos FCRS, use um espectrômetro Raman equipado com um laser de 532 nm com alta potência de saída (> 1 W), um microscópio com um estágio x-y-z automatizado com um tamanho de passo de ≤ 1 μm, uma objetiva de longa distância de trabalho (LWD) de 100x com uma abertura numérica alta, uma grade menos dispersiva (por exemplo, com 600 ranhuras por mm) para cobrir uma ampla faixa espectral, uma lâmpada de néon para correção de deslocamento do espectrômetro durante medições de longo prazo e fendas de entrada confocais e espectrômetros ajustáveis para otimizar independentemente a resolução espacial e espectral.
CUIDADO: Óculos de segurança a laser devem ser usados ao realizar medições espectroscópicas Raman (verifique a classe do laser). Com uma potência de saída de 1 W ou superior, o efeito de dispersão da luz é intenso. No entanto, a alta potência de saída do laser é um pré-requisito para a realização de experimentos FCRS de alta qualidade, uma vez que muita luz primária é absorvida ao longo do caminho do feixe através da janela de safira, da solução e dos sólidos. - Configure os parâmetros de medição Raman no software.
- Defina os intervalos das janelas espectrais para medir os modos Raman característicos da amostra e da solução sob investigação. Para a amostra de vidro borossilicato, a janela espectral varia de 200 a 1735 cm-1. A segunda janela varia de 2800 a 4000 cm-1 para medir os respectivos modos Raman de grupos moleculares água e silanol.
- Se possível, feche o orifício confocal a 600 μm e abra a largura da fenda de entrada do espectrômetro a 200 μm para otimizar a resolução de profundidade em detrimento da resolução espectral (não crítica para bandas Raman relativamente largas típicas de materiais e soluções amorfas).
- Selecione o tempo de aquisição que atinge a melhor relação sinal-ruído possível para a resolução de tempo desejada. Para um sinal de intensidade suficiente do vidro e da água, meça as janelas espectrais por 7 s e 2 s, respectivamente, e acumule ao longo de 5 rodadas.
NOTA: O tempo de aquisição pode precisar ser para acomodar mudanças no experimento, ajustando às mudanças a geometria da interface de mudança de amostra / sólido / água em evolução com o aumento do tempo de reação. - Coloque a lâmpada de néon ao longo do caminho do feixe da luz espalhada.
NOTA: A lâmpada de néon é opcional, mas recomendada como um padrão interno para corrigir os dados para possíveis deslocamentos do espectrômetro devido a flutuações inevitáveis da temperatura ambiente, que, no entanto, devem ser melhor controladas dentro de ± 0,5 °C (causando flutuações do espectrômetro de até ~ 0,2 cm-1). Além disso, as linhas Ne podem ser usadas para determinar empiricamente a resolução espectral24.
4. Montagem da célula de fluido
NOTA: Os desenhos técnicos dos componentes da célula de fluido feitos de poliéter éter cetona (PEEK) são fornecidos na Figura Suplementar 2 e na Figura Suplementar 3.
- Coloque a arruela de silicone na tampa da célula de fluido invertida e, em seguida, coloque a janela de safira e o suporte de amostra de PTFE com a parte superior da amostra voltada para a janela de safira (Figura 3B-D). Fixe a posição da arruela de silicone, janela de safira e sample com a tampa de rosca (Figura 3E-F).
- Antes de injetar a solução reativa, limpe os tubos e válvulas de cada lado com água deionizada. Em seguida, injete ar para remover a água de dentro dos tubos e esvazie o vaso do reator.
- Insira o O-ring na ranhura fornecida.
- Injete a solução de ambos os lados do reator até que a saída da tubulação dentro do reator esteja totalmente coberta. Feche as válvulas antes de remover a seringa para evitar o acúmulo de ar dentro da tubulação ou válvulas.
- Adicionar a solução restante do topo do vaso do reator até que a solução forme uma superfície convexa (menisco).
- Preencha os espaços livres da tampa de retenção da amostra pingando cuidadosamente a solução ao longo dos lados direito e esquerdo do cupom de amostra. Verifique a tampa cheia quanto a possíveis bolsas de ar.
- Gire a tampa para colocá-la em cima do vaso do reator e feche a célula o mais rápido possível usando os 6 parafusos. Aperte os parafusos transversalmente.
NOTA: No caso de caixa de ar, remova a tampa e reabasteça a célula e a tampa. A célula de fluido fechada representa um sistema estático e fornece um regime de transporte puramente difusivo em solução. Para experimentos de fluxo, é possível conectar a célula a uma bomba de seringa24. - Espera-se que a solução vaze pela borda da célula. Limpe a célula do lado de fora para remover a solução que vazou pelas bordas.
- Monte a célula de fluido no estágio xyz e conecte a célula ao aquecimento stage. Ligue o aquecimento stage e defina a temperatura nominal desejada (aqui 90 °C). O aquecimento leva, por exemplo, cerca de 14 minutos para atingir uma temperatura nominal de 90 °C.
NOTA: Uma descrição detalhada dos componentes eletrônicos do aquecedor é fornecida na Figura Suplementar 4. Observe também que, devido a um gradiente de temperatura na célula de fluido, a temperatura real na profundidade das medições é menor. Ao usar uma solução de bicarbonato, a temperatura em qualquer profundidade da medição pode ser determinada a partir da posição da banda de bicarbonato próxima a 1016 cm-1 (cf, Geisler et al.5). Para outras composições de solução sem carbonato, estimamos a temperatura no ponto de medição usando o gradiente de temperatura determinado empiricamente dentro da célula de fluido24.
5. Determinando o tamanho da lacuna entre a janela de safira e a parte superior da amostra e a posição da interface amostra/solução
- Quando a temperatura nominal for atingida, focalize o feixe de laser na janela de safira através do microscópio óptico no modo de vídeo.
NOTA: Uma desfocagem do ponto de laser ocorre inevitavelmente durante o aquecimento até a temperatura nominal desejada devido à ligeira expansão térmica da amostra e dos materiais da célula de fluido. Uma vez atingida a temperatura nominal, o foco se estabiliza após alguns minutos. Isso pode ser controlado usando o modo de vídeo. - Mova o foco do laser na parte superior da janela de safira central para a superfície nas direções x e y para garantir que esteja acima da amostra. Defina a posição z (profundidade) como zero como referência.
- Mova o foco do laser na direção z até que os primeiros sinais Raman de água ou espécies de solução, como, por exemplo, HCO3- e CO32-, apareçam (Figura 4).
NOTA: Se disponível, uma função de medição de ponto de repetição contínua (por exemplo, a função de exibição em tempo real no software LabSpec 6) pode ser uma ferramenta muito útil para determinar rapidamente o tamanho da lacuna entre a superfície superior da amostra e a janela de safira. - Mova o foco do laser mais para baixo até que um espectro puro da amostra de vidro seja detectado usando a função de exibição em tempo real. Esta posição é referida como o lado superior da amostra.
- Mova o foco do laser mais na direção z para dentro da amostra (> 50 μm para nossas taxas de corrosão de vidro observadas).
NOTA: A etapa 5.5 é importante para evitar sinais perturbadores da corrosão esperada da parte superior da amostra. A profundidade do foco do laser, no entanto, pode ter que ser aumentada com o tempo devido à corrosão do topo da amostra. A profundidade real é maior na ordem de dezenas de μm devido aos múltiplos efeitos de refração ao longo do caminho do feixe37. - Mova o stage na direção x para determinar a interface sample/solução com base na intensidade decrescente e crescente do sinal Raman da sample e da solução, respectivamente. Repita esta etapa monitorando o sinal de intensidade dos modos H2O Raman na direção x.
NOTA: A experiência mostrou que quando a superfície da amostra está em um ângulo reto perfeito com a janela de safira, uma mudança no sinal de intensidade é observada acima de ~ 10 μm na direção x, que corresponde à resolução lateral. - Defina a posição da interface de amostra/solução para x = 0. Defina o tamanho total da varredura de linha para 100 μm, variando de -70 a 30 μm na direção x para que a direção de varredura seja definida da amostra para a solução em massa. Em consideração ao progresso esperado da reação, o tamanho do passo é definido como 1 ou 2 μm e o
NOTA: A varredura de linha apresenta medições de ponto único na direção x para monitorar a interface vidro/solução em movimento ao longo do tempo em uma posição constante em profundidade (z) e direção y. O tempo necessário por varredura de linha é a soma de (1) o tempo de contagem, (2) o tempo para se mover para um novo ponto e (3) o tempo que o espectrômetro precisa para se mover para diferentes janelas de frequência se uma ampla faixa de frequência tiver que ser medida, por exemplo, região de baixa frequência (100 a 1735 cm-1) e região de alta frequência (2800 a 4000 cm-1). O comprimento da varredura da linha pode ter que ser estendido para a amostra, dependendo do progresso da reação. - Inicie as medições de varredura de linha. Para a interface vidro/solução, defina uma varredura de linha de 100 μm com um tamanho de passo de 2 μm, fazendo medições de 51 pontos na direção x. Em cada ponto, a primeira e a segunda janela espectral são medidas por 7 s e 2 s, respectivamente, e 5 vezes acumuladas. A varredura de linha é repetida automaticamente na interface vidro/solução móvel por vários dias a semanas, monitorando a dissolução do vidro e a precipitação da camada de alteração superficial (SAL) à base de sílica.
Resultados
A seguir, as principais características da metodologia são ilustradas pelos resultados de um experimento de corrosão com uma amostra ternária de vidro borossilicato de Na (TBG) e uma solução de NaHCO3 0,5 M a uma temperatura nominal de 90 °C, ou seja, as mesmas condições dos experimentos de Geisler et al.4. A temperatura real na profundidade da medição foi de 86 ± 1 ° C, conforme determinado a partir da mudança de frequência dependente da temperatura da banda de bicarbonato perto de 1016 cm-1 (à temperatura ambiente) 4 . O TBG já foi usado em experimentos anteriores de FCRS 24,30,31,35. O experimento foi conduzido com um espectrômetro Raman confocal Horiba Scientific HR800 no Instituto de Geociências da Universidade de Bonn, Alemanha. O sistema está equipado com um laser Nd:YVO4 (532,11 nm) com uma potência de saída de 2,2 W e um dispositivo acoplado carregado multiplicador de elétrons (Figura 3B). Foi utilizada uma objetiva de longa distância de trabalho (LWD) de 100x com abertura numérica de 0,8, grade de espectrômetro com 600 ranhuras por mm, orifício confocal de 600 μm e largura de fenda de entrada do espectrômetro de 200 μm. O espectrômetro foi inicialmente calibrado com um monocristal de silício que possui uma banda Raman de primeira ordem a 520,7 cm-1. O sinal Raman foi medido nas faixas de número de onda de 200 a 1735 e 2800 a 4000 cm-1. A primeira faixa de número de onda inclui uma linha Ne a 1707,36 cm-1 que foi registrada como um padrão interno de número de onda para corrigir cada espectro para qualquer deslocamento do espectrômetro durante medições de longo prazo de até vários dias (resultante de variações de temperatura de ± 0,5 ° C no laboratório). Os dados Raman apresentados aqui foram corrigidos apenas para possíveis flutuações de frequência, ajustando uma função gaussiana à linha Ne registrada24,39. Além disso, a linha Ne foi usada para determinar empiricamente a resolução espectral, dada pela largura total na metade do máximo (FWHM), que foi de 5,1 cm-1.
A Figura 5A mostra a evolução temporal da distribuição espacial do vidro, solução e SAL conforme exibido pelo software usando os espectros brutos registrados. Essa imagem de tempo versus posição em cores falsas foi gerada a partir de varreduras de linha, ou seja, a partir de medições ponto a ponto na direção x na interface vidro/solução. A imagem mostra uma interface vidro/solução em recuo contínuo nas primeiras 4,0 h, indicando a dissolução congruente do vidro. Os primeiros sinais de sílica amorfa foram detectados após 8,3 h, capturando a precipitação do SAL. A Figura 5B mostra espectros Raman brutos representativos registrados a partir de um único ponto (pixel) da solução, o SAL e o vidro, juntamente com as janelas de frequência individuais usadas para integração de intensidade para visualizar sua distribuição espacial, conforme mostrado na Figura 5A e na Figura 6A. A principal observação deste experimento a ser destacada aqui é a formação de uma zona rica em água entre o SAL e o vidro subjacente. Esta zona rica em água começou a se formar após aproximadamente 80 h e, a partir deste momento, posteriormente cresceu para uma camada de água interfacial clara com uma largura de cerca de 6 a 8 μm (Figura 6A). Na Figura 6B, são mostrados os espectros Raman médios representativos na faixa de frequência das vibrações da água da solução a granel, do SAL, da solução de interface e do vidro nominal sem água. Os espectros destacam a diferença de intensidade de H2O entre a solução em massa e a solução de interface, mas também que o espectro do SAL envolve um novo sinal próximo a 3600 cm-1 que pode ser atribuído a vibrações Si-OH35. Essa banda OH adicional não é visível no espectro da camada de água interfacial e da solução a granel, o que é mais uma evidência de que uma lacuna clara entre o vidro puro e o SAL evoluiu lentamente durante o experimento que foi preenchido com água. A formação de tal camada de água interfacial (ou interface rica em água) enquanto a reação está em andamento é uma característica intrínseca do modelo ICDP e não pode ser explicada pelo mecanismo de lixiviação amplamente aceito 4,17. O fato de essa observação poder ser reproduzida é de grande importância, pois obviamente precisa ser considerada em abordagens de modelagem que visam simular realisticamente a corrosão do vidro de silicato em soluções aquosas.
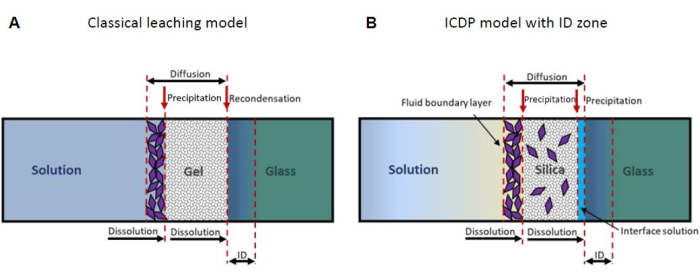
Figura 1: Representação esquemática dos dois modelos mecanicistas de corrosão do vidro mais importantes. (A) O modelo clássico de lixiviação13,16 e (B) o modelo de dissolução-precipitação acoplada à interface (ICDP)19,20 com zona de interdifusão (ID)23. Este número foi modificado de24. Clique aqui para ver uma versão maior desta figura.
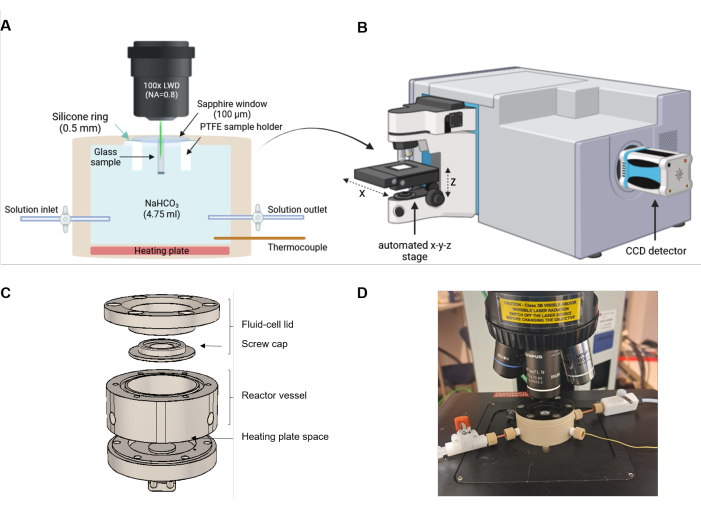
Figura 2: Configuração experimental da espectroscopia Raman de célula fluida. (A) O feixe de laser é alinhado paralelamente à direção da frente de reação. A célula de reação é equipada com uma placa de aquecimento na parte inferior e uma entrada e saída para troca de solução opcional ou experimentos de fluxo. (B) Esboço de um espectrômetro Raman equipado com um microscópio, um estágio xyz automatizado e um dispositivo de carga acoplada (CCD) para detectar a luz espalhada. (C) Desenho técnico esquemático dos componentes PEEK da célula de fluido. (D) Foto de uma célula de fluido preenchida montada no estágio automatizado do microscópio Raman. A configuração não é para escalar. Clique aqui para ver uma versão maior desta figura.

Figura 3: Montagem da tampa da célula de fluido. (A) Amostra polida e suporte de PTFE (B) Arruela de silicone colocada na tampa da célula de fluido. (C) A janela de safira está posicionada com precisão na parte superior da arruela. (D) Suporte de PTFE com a amostra voltada para a janela de safira colocada na janela. (E) Tampa PEEK aparafusada fixando a posição da amostra. (F) Vista lateral da tampa aparafusada firmemente na tampa. Clique aqui para ver uma versão maior desta figura.

Figura 4: Gráfico de pilha de espectros Raman brutos em diferentes profundidades. Gráfico de pilha do experimento apresentado com um vidro de borossilicato de Na e uma solução de NaHCO3 0,5 M. A superfície da janela de safira é definida como z = 0. Dada a espessura de 100 μm da janela de safira, a distância entre a parte inferior da janela e a parte superior do monólito de vidro a -150 μm é de aproximadamente 50 μm. Os espectros azuis exibem espectros mistos de safira, a solução de NaHCO3 0,5 M e o vidro de borossilicato de Na. Clique aqui para ver uma versão maior desta figura.
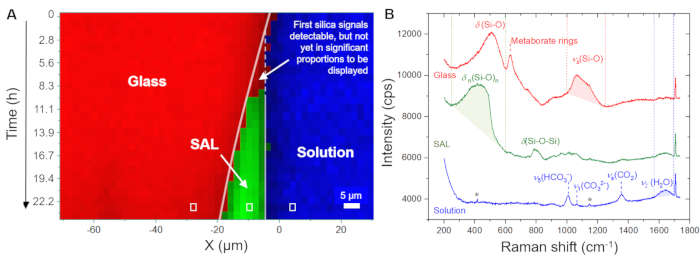
Figura 5: Distribuição do vidro, solução e SAL à base de sílica em função do tempo e do espaço a 86 °C. (A) Perfis de linha Raman hiperespectrais na interface vidro/solução em função do tempo para as primeiras 24 h do experimento com um vidro de borossilicato de Na e uma solução de NaHCO3 0,5 M. (B) Gráfico de pilha de espectros Raman brutos renderizados a partir de medição de ponto único (retângulos brancos em (A)). As linhas tracejadas vermelhas, verdes e azuis indicam os intervalos de números de onda que foram usados para visualizar o vidro (1000 - 1250 cm-1), a solução de bicarbonato (1560 - 1700 cm-1) e o SAL à base de sílica (250 - 600 cm-1), respectivamente. A intensidade Raman dentro desses limites foi integrada após a subtração de um fundo linear que foi definido pela intensidade nos limites da janela do número de onda. O símbolo da estrela marca sinais fracos da janela de safira. Clique aqui para ver uma versão maior desta figura.
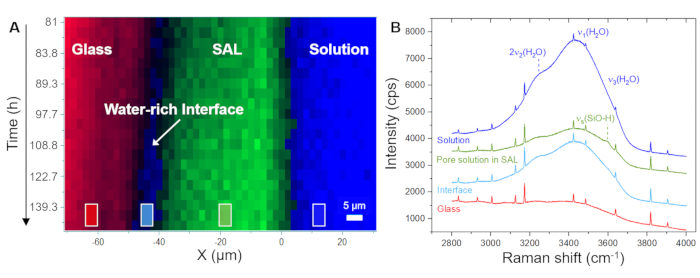
Figura 6: Distribuição do vidro, uma interface rica em água e o SAL em função do tempo-espaço junto com espectros Raman representativos. (A) Perfis de linha Raman hiperespectrais na interface vidro/solução em função do tempo para o período entre 81 h e 140 h do experimento com um vidro de borossilicato de Na e uma solução de NaHCO3 0,5 M, mostrando a formação de uma camada de água de interface entre o vidro e o SAL. (B) Espectros Raman brutos empilhados calculados em média sobre a região marcada por quadrados em (A), mostrando uma diminuição no sinal de intensidade dos respectivos modos Raman de água dentro do SAL e um aumento entre o SAL e o vidro de dissolução. Dentro do SAL, observa-se uma intensidade de sinal adicional em torno de 3600 cm-1 que pode ser atribuída ao modo de alongamento de grupos silanol (ligado a Si-O-)40. O sinal de água fraco visível da região do vidro resulta da camada de solução entre a janela de safira e a superfície da amostra de vidro. Os picos agudos são linhas Ne. Clique aqui para ver uma versão maior desta figura.
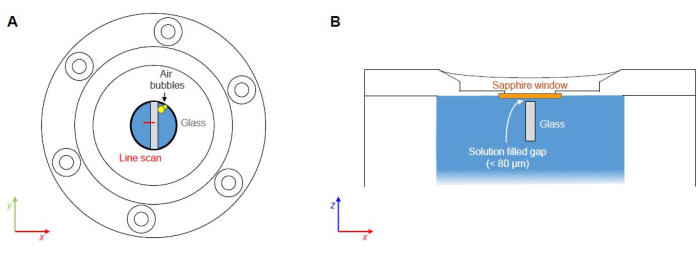
Figura 7: Pontos críticos dos experimentos FCRS. (A) Potencial aprisionamento e nucleação de bolsas de ar ao longo das interfaces de materiais (sem escala). (B) Lacuna preenchida com solução entre a parte inferior da janela de safira e a parte superior da amostra de vidro (sem escala). Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Desenho técnico do porta-amostras feito de PTFE. Clique aqui para baixar este arquivo.
Figura suplementar 2: Desenho técnico dos componentes da célula fluida feitos de PEEK. Clique aqui para baixar este arquivo.
Figura 3 suplementar: Desenho técnico explodido view dos componentes da célula de fluido feitos de PEEK. Clique aqui para baixar este arquivo.
Figura suplementar 4: Descrição detalhada do aquecedor da célula do reator. O elemento de aquecimento da célula do reator é um disco aquecedor metalocerâmico (MCH), tolerando temperaturas de até 400 °C. Tem um diâmetro de 30 mm e uma espessura de 1,5 mm. O elemento de aquecimento é conectado a um controlador de temperatura por meio de um pequeno circuito eletrônico. A conexão entre o aquecedor e o controlador é realizada por fios de silicone flexíveis e tolerantes ao calor. O controlador de temperatura está alojado junto com o circuito eletrônico e uma fonte de alimentação de 5 V em uma pequena caixa de plástico. Clique aqui para baixar este arquivo.
Discussão
O presente protocolo se concentra na criação de um experimento FCRS para o estudo operacional de fenômenos de reação e transporte durante a corrosão aquosa de vidro borossilicato, apresentando dados Raman medidos de um experimento com um vidro de borossilicato de Na ternário simples em uma solução de NaHCO3 0,5 M a 86 ± 1 ° C. As etapas críticas representam (1) o possível aprisionamento de bolsas de ar durante o fechamento da célula de fluido e (2) processos de corrosão do lado superior devido ao espaço entre a parte inferior da janela de safira e o lado superior da amostra de vidro (Figura 7). A corrosão do lado superior representa um problema, particularmente durante experimentos de longo prazo, pois os produtos de corrosão absorvem e espalham a luz incidente e espalhada, reduzindo a relação qualidade (sinal-ruído) dos espectros e a resolução espacial com o tempo. Esta questão é atualmente abordada por experimentos ex situ com vidros que foram finamente pulverizados com uma camada de nitreto de silício (SiN) para testar a estabilidade da camada de SiN contra soluções aquosas. Os sinais Raman da camada superficial de SiN são detectáveis a uma profundidade de apenas alguns micrômetros e, portanto, não se espera que tenham um efeito perturbador durante um experimento FCRS. O aprisionamento de ar é sempre um problema potencial que depende de como a solução é preenchida na célula, mas pode ser evitado com um pouco de prática e removendo as bolhas de ar da solução inicial.
Para um tratamento quantitativo, os dados Raman devem ser devidamente corrigidos para sinais de fundo, efeitos de temperatura e dependência do comprimento de onda do processo de espalhamento24,41. Um protocolo detalhado para o tratamento de dados é fornecido em24. Além disso, é importante notar que a profundidade focal real e aparente diferem devido a múltiplos efeitos de refração. No entanto, a resolução de profundidade e a profundidade real a partir da qual um sinal Raman é registrado podem ser calculadas com precisão razoável a partir de considerações geométricas e ópticas de um sistema multicamada24. A resolução espacial também pode ser determinada empiricamente 4,27,28. Em geral, a resolução da profundidade aumenta linearmente com a profundidade aparente, dependendo da abertura numérica da objetiva e dos índices de refração dos materiais atravessados pelo feixe de laser, ou seja, a janela de safira, a solução e os produtos da amostra/reação24,37.
O FCRS fornece informações em tempo real e in situ sobre os processos de reação e transporte acoplados que ocorrem na interface sólido-água em escala microscópica. Sem interromper os processos em andamento, o FCRS pode capturar os principais processos de reação e transporte, o que é importante, por exemplo, para o debate atual sobre os mecanismos de corrosão do vidro usados para descrever o desempenho de longo prazo dos vidros de resíduos nucleares. Os dados exemplares apresentados aqui mostram a formação de uma zona rica em água (camada de água interfacial / filme fluido) entre o SAL e o vidro subjacente, que é uma característica intrínseca do modelo ICDP. Os resultados confirmam estudos anteriores do FCRS 5,24,30,33 e, assim, demonstram a reprodutibilidade da metodologia experimental. O método apresentado supera as desvantagens dos experimentos ex situ de várias etapas envolvendo têmpera, secagem e seccionamento mecânico dos produtos da reação e fornece informações sobre vários experimentos de têmpera por um único experimento, evitando o risco de modificar produtos de alteração para análise post-mortem.
Como a frequência de vibração molecular depende da massa dos isótopos vibratórios, os processos de reação e transporte podem até ser rastreados operando por espectroscopia Raman usando 2H e 18O que podem ser adicionados ao sistema como traçadores de isótopos estáveis4. A medida Raman também pode ser estendida para três dimensões, ou seja, por medidas sequenciais em duas dimensões, que podem fornecer informações adicionais de textura27,28. No entanto, deve-se notar que o tempo de exposição aumentará drasticamente. As taxas dos processos a serem fotografados podem, portanto, ser um fator limitante, pois devem ser mais lentas do que o tempo de exposição, o que, é claro, também deve ser considerado para medições de varredura de linha.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Agradecemos a G. Paulus (Schott AG) por sintetizar e caracterizar o vidro borossilicato. Um agradecimento especial vai para D. Lülsdorf e H. Blanchard (Universidade de Bonn), bem como W. Bauer (Schott AG) por ajudar no projeto e construção da(s) célula(s) fluida(s). Agradecemos à Schott AG Mainz, Alemanha, à Fundação Alemã de Pesquisa (subvenção nºs. GE1094/21-1 e GE1094/27-1 para T.G.), e o Ministério Federal Alemão de Educação e Pesquisa (BMBF) (concessão nº 02NUK019F para T.G.) para apoio financeiro. T.G. e M.B.K.F. também agradecem o apoio financeiro fornecido pela Otto-Schott-Fond.
Materiais
| Name | Company | Catalog Number | Comments |
| Cross screws (6 pieces) | --- | --- | |
| Blue silicone wire | Reichelt Elektronik | cross-section: 1.5 mm², length: 2 m | |
| Capacitor | Reichelt Elektronik | capacity: 100 nF | |
| Connectors according to user‘s choice | Reichelt Elektronik | ||
| Eurotherm Controller 3216 | Eurotherm/Emerson | Order Code 3216 CC VH LXXX X XXX G ENG XXXXX | |
| Flangeless Ferrules ETFE | Darwin Microfluidics | SKU: ID-P-200X | 1/4"-28 for 1/16" OD |
| Fluid Cell (container + lid) | home made | --- | technical drawing provided in the appendix (S1-S2) |
| Heating element, metal-ceramic heater (MCH) disc | Alibaba | D: 30 mm, H: 1.5 mm; https://german.alibaba.com/product-detail/DC-Power-Supply-30mm-MCH-Round-1600118228465.html?spm=a 2700.7724857.0.0.7cde5nqq5nqq2n | |
| Horiba HR800 Raman spectrometer | HORIBA | ||
| LabSpec 6.5.1.24 Spectroscopy Suite | |||
| Mains Cable with plug, load+neutral (L+N) | Reichelt Elektronik | length: 2 m | |
| Mains Fuse 1A | Reichelt Elektronik | 5x20 mm² | |
| Mains Fuse Holder | Reichelt Elektronik | 5x20 mm² | |
| Mains rocker switch | Reichelt Elektronik | 230VAC 2A | |
| Microfluidic Fittings Adapter Female Luer to 1/4-28 Male | Darwin Microfluidics | SKU: ID-P-618 | |
| Millex Syringe filters | Merck | SLGPR33RS | |
| NaHCO3 | Merck | CAS-144-55-8 | |
| NMOS Mosfet F1010N | Reichelt Elektronik | ||
| Plastic Enclosure | Reichelt Elektronik | TEKO KL22 | Enclosure 178x128x72 |
| PTFE sample holder | home made | --- | |
| PTFE Tubing | Darwin Microfluidics | BL-PTFE-1608-20 | 1/16" OD |
| Red silicone wire | Reichelt Elektronik | cross-section: 1.5 mm², length: 2 m | |
| Resistor | Reichelt Elektronik | 1/4W, 10kOhm | |
| Resistor | Reichelt Elektronik | 1/4W, 2.2kOhm | |
| Sapphire Window | Edmund Optics GmbH | #71-225 | D: 15 mm H: 100 µm |
| Shut-Off Valve 1/4-28 | Darwin Microfluidics | SKU: ID-P-782 | |
| Silicone washer | ART Elektromechanik | customized for institute | OD: 15mm, ID: 8 mm; H: 0.5 mm |
| Switching-mode power supply | Reichelt Elektronik | SNT RS 25 5 | 5V, 5A |
| Thermocouple Extension Cable, Plug/Socket, Type K | RS Components GmbH | 2 m | |
| Thermocouple Socket, Type K, Case Mount | RS Components GmbH | ||
| Thermocouple, Type K | TC Direct | D: 1 mm, L: 50-100mm | |
| Various cables for in-box wiring | Reichelt Elektronik |
Referências
- Belançon, M. P., Sandrini, M., Zanuto, V. S., Muniz, R. F. Glassy materials for Silicon-based solar panels: Present and future. J Non-Crystalline Solids. 619, 122548(2023).
- Iacocca, R., et al. Factors affecting the chemical durability of glass used in the pharmaceutical industry. AAPS PharmSciTech. 11 (3), 1340-1349 (2010).
- Grambow, B. A general rate equation for nuclear waste glass corrosion. MRS Online Proc Lib. 44, 15-27 (1984).
- Gin, S., Taron, M., Arena, H., Delaye, J. M. Effect of structural disorder induced by external irradiation with heavy ions on the alteration of a four oxide borosilicate glass. NPJ Mater Degrad. 8, 64(2024).
- Geisler, T., Dohmen, L., Lenting, C., Fritzsche, M. B. K. Real-time in situ observations of reaction and transport phenomena during silicate glass corrosion by fluid-cell Raman spectroscopy. Nat Mater. 18, 342-348 (2019).
- Stroncik, N. A., Schmincke, H. U. Evolution of palagonite: Crystallization, chemical changes, and element budget. Geochem Geophys Geosyst. 2 (7), 1017(2001).
- Staudigel, H., Hart, S. R. Alteration of basaltic glass: Mechanisms and significance for the oceanic crust-seawater budget. Geochim Cosmochim Acta. 47, 337-350 (1983).
- Udi, U. J., Yussof, M. M., Ayagi, K. M., Bedon, C., Kamarudin, M. K. Environmental degradation of structural glass systems: A review of experimental research and main influencing parameters. Ain Shams Eng J. 14, 101970(2023).
- Majérus, O., et al. Glass alteration in atmospheric conditions: crossing perspectives from cultural heritage, glass industry, and nuclear waste management. NPJMater Degrad. 4, 27(2020).
- Grambow, B. Nuclear waste glasses - How durable. Elements. 2, 357-364 (2006).
- Hellmann, R., et al. Nanometre-scale evidence for interfacial dissolution-reprecipitation control of silicate glass corrosion. Nat Mater. 14, 307-311 (2015).
- Gin, S., et al. Origin and consequences of silicate glass passivation by surface layers. Nat Comm. 6, 6360-6360 (2015).
- Gin, S., et al. The controversial role of inter-diffusion in glass alteration. Chem Geol. 440, 115-123 (2016).
- Gin, S., et al. An international initiative on long-term behavior of high-level nuclear waste glass. Mater Today. 16, 243-248 (2013).
- Frugier, P., et al. SON68 Nuclear glass dissolution kinetics: Current state of knowledge and basis of the new GRAAL model. J Nuclear Mater. 380, 8-21 (2008).
- Bunker, B. C. Molecular mechanisms for corrosion of silica and silicate glasses. J Non-Crystalline Solids. 179, 300-308 (1994).
- Cailleteau, C., et al. Insight into silicate-glass corrosion mechanisms. Nat Mater. 7, 978-983 (2008).
- Gin, S., Ryan, J. V., Schreiber, D. K., Neeway, J., Cabié, M. Contribution of atom-probe tomography to a better understanding of glass alteration mechanisms: Application to a nuclear glass specimen altered 25years in a granitic environment. Chem Geol. 349 - 350, 99-109 (2013).
- Geisler, T., et al. The mechanism of borosilicate glass corrosion revisited. Geochim Cosmochim Acta. 158, 112-129 (2015).
- Geisler, T., et al. Aqueous corrosion of borosilicate glass under acidic conditions: A new corrosion mechanism. J Non-Crystalline Solids. 356, 1458-1465 (2010).
- Putnis, A. Why mineral interfaces matter. Science. 343, 1441-1442 (2014).
- Putnis, A. Mineral replacement reactions: from macroscopic observations to microscopic mechanisms. Mineralogical Magazine. 66, 689-708 (2002).
- Lenting, C., et al. Towards a unifying mechanistic model for silicate glass corrosion. NPJ Mater Degrad. 2, 28(2018).
- Fritzsche, M. B. K. The aqueous corrosion of borosilicate glasses studied in operando by in situ fluid-cell Raman spectroscopy. Dissertation. , University of Bonn. Germany. https://hdl.handle.net/20.500.11811/10602 (2023).
- Iler, K. R. The chemistry of silica: Solubility, polymerization, colloid and surface properties and biochemistry of silica. , Wiley. (1979).
- Gin, S., et al. The fate of silicon during glass corrosion under alkaline conditions: A mechanistic and kinetic study with the International Simple Glass. Geochim Cosmochim Acta. 151, 68-85 (2015).
- Putnis, C., Ruiz-Agudo, E. The mineral-water interface: Where minerals react with the environment. Elements. 9, 177-182 (2013).
- Icenhower, J. P., Steefel, C. I. Dissolution rate of borosilicate glass SON68: A method of quantification based upon interferometry and implications for experimental and natural weathering rates of glass. Geochim Cosmochim Acta. 157, 147-163 (2015).
- Icenhower, J. P., Steefel, C. I. Experimentally determined dissolution kinetics of SON68 glass at 90°C over a silica saturation interval: Evidence against a linear rate law. J Nuc Mater. 439, 137-147 (2013).
- Lenting, C., Geisler, T. Corrosion of ternary borosilicate glass in acidic solution studied in operando by fluid-cell Raman spectroscopy. NPJ Mater Degrad. 5, 37(2021).
- Lönartz, M. I., et al. The effect of heavy ion irradiation on the forward dissolution rate of borosilicate glasses studied in situ and real time by fluid-cell raman spectroscopy. Materials. 12 (9), 1480(2019).
- Müller, G., Fritzsche, M. B. K., Dohmen, L., Geisler, T. Feedbacks and non-linearity of silicate glass alteration in hyperalkaline solution studied by in operando fluid-cell Raman spectroscopy. Geochim Cosmochim Acta. 329, 1-21 (2022).
- Müller, G. Raman spectroscopic ex situ and in situ. investigations of the aqueous corrosion of soda-lime silicate glasses. , University of Bonn. Bonn. (2019).
- Sulzbach, M., Geisler, T. The replacement of celestine (SrSO4) by strontianite (SrCO3) in aqueous solution studied in situ and in real time using fluid-cell Raman spectroscopy. Minerals. 14 (2), 164(2024).
- Dohmen, L. In situ .observations of reaction and transport phenomena during silicate glass corrosion by fluid-cell Raman spectroscopy: Method development and applications. Unpubl. PhD thesis. , University of Bonn. Germany. (2019).
- Everall, N. Confocal Raman microscopy: Why the depth resolution and spatial accuracy can be much worse than you think. Appl Spectrosc. 54, 1515-1520 (2000).
- Everall, N. Depth profiling with confocal raman microscopy, part II. Spectroscopy. 19, 22-27 (2004).
- Everall, N. The influence of out-of-focus sample regions on the surface specificity of confocal Raman microscopy. Appl Spectrosc. 62, 591-598 (2008).
- Hauke, K., Kehren, J., Böhme, N., Zimmer, S., Geisler-Wierwille, T. In situ hyperspectral Raman Imaging: A new method to investigate sintering processes of ceramic material at high-temperature. Appl Sci. 9, 1310(2019).
- Davis, K. M., Tomozawa, M. An infrared spectroscopic study of water-related species in silica glasses. J Non-Crystalline Solids. 201, 177-198 (1996).
- Long, D. A. Raman spectroscopy. , McGraw Hill International Book Company. Great Britain. (1977).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados