Method Article
Spettroscopia Raman a celle fluide per studi operando di fenomeni di reazione e trasporto durante la corrosione del vetro silicato
In questo articolo
Riepilogo
La spettroscopia Raman a celle fluide (FCRS) consente di osservare in operando fenomeni di reazione e trasporto durante la corrosione acquosa di vetri silicati a livello microscopico, a temperature elevate e in tempo reale. Senza interrompere i processi in corso, l'FCRS fornisce informazioni sui meccanismi di reazione, sulla cinetica e sui processi di trasporto.
Abstract
La spettroscopia Raman a celle fluide (FCRS) consente lo studio in tempo reale e risolto nello spazio (operando) dei meccanismi di reazione, della cinetica e delle loro interazioni reciproche con i processi di trasporto durante la corrosione del vetro silicato su scala micrometrica e a temperature elevate. Questo manoscritto fornisce un protocollo dettagliato per l'impostazione di un esperimento FCRS, esemplificato da un esperimento di corrosione con un vetro borosilicato ternario di Na e una soluzione di NaHCO3 0,5 M a una temperatura di 86 ± 1 °C. Il protocollo prevede (i) la preparazione del campione, (ii) l'assemblaggio della cella fluida e (iii) l'impostazione dei parametri di misura Raman per la raccolta degli spettri Raman attraverso l'interfaccia campione/soluzione a intervalli di tempo regolari. I risultati dell'esperimento mostrano la formazione di una zona ricca d'acqua tra uno strato di alterazione superficiale a base di silice (SAL) e il vetro incontaminato, che è una caratteristica intrinseca di un modello di dissoluzione-precipitazione accoppiato all'interfaccia per la formazione di un SAL durante la corrosione del vetro silicato. La capacità di tracciare i processi di reazione e trasporto durante la corrosione di vetri silicati e potenzialmente di altri materiali trasparenti, risolti spazialmente e in tempo reale, rappresenta un punto di forza unico di questa tecnica, superando gli svantaggi dell'analisi convenzionale di esperimenti di quenching multi-step. La corrosione del lato superiore del campione di vetro rappresenta un problema attuale, che riduce la risoluzione spaziale in profondità a causa delle precipitazioni all'interno del percorso laser. Ciò è causato da uno spazio riempito di soluzione tra la finestra di zaffiro del coperchio della cella fluida e il lato superiore del monolite, che è difficile da evitare durante la configurazione sperimentale. Questo deve essere preso in considerazione quando si sceglie la profondità alla quale effettuare la misurazione. In alcuni casi, è stata osservata la formazione di bolle d'aria, che hanno interrotto o addirittura portato alla conclusione dell'esperimento. Tuttavia, questo può essere evitato impostando attentamente l'esperimento, che richiede poca pratica.
Introduzione
I vetri silicati rappresentano materiali metastabili suscettibili alla corrosione acquosa da parte del vapore acqueo atmosferico o dell'acqua liquida in ambienti ingegnerizzati e applicazioni tecnologiche come i sistemi di conversione dell'energia solare1, l'uso farmaceutico2 e l'immobilizzazione di scorie nucleari di alto livello dal combustibile nucleare esaurito 3,4,5. Oltre al suo ruolo nei campi di applicazione tecnologica, i vetri vulcanici naturali rappresentano una componente importante della superficie esposta della Terra e sono quindi coinvolti nei cicli biogeochimici globali e nell'evoluzione del clima a lungo termine 6,7. L'alterazione atmosferica da parte del vapore acqueo è un fattore chiave sia nelle applicazioni tecnologiche che negli ambienti naturali. Distinguere questo effetto da quello dell'alterazione da parte dell'acqua liquida è importante in quanto il rapporto superficie/volume (S/V) del vetro rispetto alla soluzione è significativamente diverso 8,9. Il presente lavoro, tuttavia, si concentra sul comportamento alla corrosione del vetro silicato in acqua liquida. Quando un vetro entra in contatto con una soluzione acquosa, si verificano una serie di processi di reazione e trasporto accoppiati all'interfaccia vetro/acqua, formando generalmente uno strato di alterazione superficiale (SAL) strutturalmente complesso. Tuttavia, i meccanismi, la cinetica e i fattori limitanti la velocità della corrosione del vetro silicato sono ancora oggetto di un intenso dibattito, riflesso dall'esistenza di vari modelli di corrosione 5,10,11,12,13. Pertanto, la comprensione della complessa interazione tra i processi di reazione e trasporto all'interfaccia vetro/acqua nel tempo e nello spazio e a livello microscopico è fondamentale per lo sviluppo di modelli analitici e numerici che prevedano la corrosione a lungo termine del vetro silicato14.
Un modello ampiamente accettato presume che il SAL formi per interdiffusione in volume di idronio dalla soluzione nel vetro e modificatori di rete dal vetro nella soluzione (lisciviazione), per cui i gruppi silanolici si formano per scambio con i cationi15,16. Nel corso della reazione, si presume che i gruppi silanolo si ricombinino, rilasciando acqua molecolare formando nuovi legami silossanici e lasciando infine un SAL residuo poroso ricco di silice (Figura 1A). Tuttavia, i risultati sperimentali ottenuti dalla tomografia a sonda atomica e dalla microscopia elettronica a trasmissione hanno rivelato un'interfaccia atomicamente nitida tra il vetro e il SAL 14,17,18, che contraddice un processo controllato dalla diffusione. Inoltre, i nuovi risultati degli esperimenti con traccianti isotopici non sono coerenti con un modello di lisciviazione19,20. Invece, tali osservazioni possono essere spiegate dal modello di dissoluzione-precipitazione accoppiato all'interfaccia (ICDP) che si basa su una dissoluzione stechiometrica del vetro accoppiata spazialmente e temporalmente alla precipitazione di silice amorfa una volta che uno strato limite di soluzione sulla superficie del vetro è sovrasaturo rispetto alla silice 5,21,22. Recentemente, il modello ICDP è stato ampliato per includere una zona di scambio ionico che può evolvere prima di un fronte ICDP se il tasso di dissoluzione-precipitazione rallenta drasticamente23 (Figura 1B). Per una rassegna più dettagliata di ulteriori modelli che considerano la formazione di SAL, si rimanda alla tesi di dottorato di M. Fritzsche24.
Gli esperimenti di corrosione comunemente eseguiti seguono un flusso di lavoro in più fasi, tra cui l'esperimento di alterazione stesso, la tempra (raffreddamento rapido), l'essiccazione, la segatura e la lucidatura del campione di vetro alterato per l'analisi post mortem 15,19. Questo, tuttavia, è fondamentale in quanto può modificare le proprietà strutturali e chimiche del principale prodotto di corrosione, cioè il SAL idrato amorfo a base di silice, a causa di condensazione e/o polimerizzazione, perdita di acqua (disidratazione) e/o fessurazioni e sfaldamento 15,19,25. In sistemi chimicamente complessi (vetri e soluzioni multicomponente), la tempra e l'essiccazione del campione possono anche indurre la precipitazione di minerali secondari che non sono coinvolti nella reazione stessa. Oltre a ciò, un campione temprato rappresenta solo un punto nel tempo del processo di corrosione del vetro, richiedendo un elevato sforzo per derivare i tassi di dissoluzione del vetro e le informazioni sui meccanismi di reazione da più esperimenti di quench26. Pertanto, la maggior parte dei dati cinetici sulla corrosione del vetro ottenuti durante gli esperimenti di corrosione del vetro dalle analisi aliquote della soluzione bulk sono meno informativi per lo studio dei meccanismi di reazione e dei processi di trasporto durante la corrosione del vetro silicato.
Per superare gli svantaggi degli esperimenti ex situ, compresa la preparazione dei campioni e l'analisi post mortem, le tecniche in situ hanno guadagnato un crescente interesse negli ultimi anni27,28. Ad esempio, la microscopia a forza atomica (AFM) e l'interferometria a scansione verticale (VSI) sono diventati strumenti vitali per studiare le superfici minerali che sono a diretto contatto con la soluzione acquosa27,29. Tuttavia, entrambi gli approcci si limitano allo studio delle primissime fasi di un processo di corrosione, cioè fino a quando non si è formato uno strato secondario che impedisce l'indagine dell'interfaccia vetro/SAL28,30. La spettroscopia Raman a cella fluida (FCRS) supera le suddette carenze fornendo osservazioni in tempo reale e risolte nello spazio (operando) dei processi di reazione e trasporto alle interfacce solido/soluzione su scala microscopica e a temperature elevate se la fase madre e quella del prodotto sono trasparenti alla luce visibile (Figura 2). I primi studi FCRS sono stati condotti da Geisler et al.5, che hanno studiato il comportamento di corrosione acquosa del vetro borosilicato ternario (TBG) in una soluzione di NaHCO3 0,5 M, cioè in condizioni di pH quasi neutro a 85 °C. È stata osservata la formazione di una zona ricca d'acqua tra il SAL e il vetro incontaminato, una caratteristica intrinseca del modello ICDP. Utilizzando una soluzione di bicarbonato, i gradienti di pH sulla superficie del vetro e all'interno del SAL potrebbero anche essere rilevati stimando il pH locale dal rapporto di intensità del carbonato e della banda del bicarbonato (c.f.5). Inoltre, senza disturbare il processo di corrosione in corso, uno scambio con una soluzione deuterata ha dimostrato che il trasporto di acqua attraverso il SAL non era una fase limitante per il processo di corrosione. In sintesi, questo lavoro ha dimostrato la forza della FCRS nell'identificare i meccanismi di reazione chiave e il feedback sui fenomeni di trasporto all'interno di un singolo esperimento in condizioni ben controllate.
Successivi esperimenti FCRS hanno ulteriormente dimostrato che questo metodo è adatto per l'uso di routine, producendo risultati coerenti e riproducibili 24,31,32. Ad esempio, l'FCRS è stato applicato per studiare l'effetto dell'irradiazione con ioni pesanti sulla velocità di dissoluzione diretta dei vetri borosilicati, mostrando un aumento significativo della velocità di dissoluzione diretta di un fattore di 3,7 ± 0,531. Inoltre, gli esperimenti FCRS condotti con un vetro boroalluminosilicato soda-calcico contenente Ba in una soluzione iperalcalina hanno documentato la trasformazione diretta del vetro in Mg-argilla, zeolite e carbonati. Questi autori hanno riscontrato una diminuzione del tasso di dissoluzione iniziale del vetro, la cui entità sembra essere correlata alla composizione e alla struttura dello strato di alterazione33. Inoltre, i cambiamenti nella forma della banda contorta dell'acqua sono stati utilizzati per monitorare la forza ionica operando, rivelando fluttuazioni ritmiche32. Sulzbach e Geisler34 hanno eseguito esperimenti FCRS per studiare la sostituzione della celestina (SrSO4) con la strontianite (SrCO3), entrambe trasparenti alla luce visibile, in una soluzione di carbonato, che ha fornito nuovi dettagli su un meccanismo ICDP e ha fornito la prima evidenza di tre regimi cinetici. Recentemente, nell'ambito di una tesi di dottorato24, la configurazione sperimentale è stata ampliata per includere una stazione di riscaldamento esterna, facilitando studi a lungo termine per diversi mesi con vetri di maggiore durata, come l'International Simple Glass (ISG) a sei componenti14,24. Per questo, la cella fluida è stata conservata sulla stazione di riscaldamento tra le misurazioni Raman consecutive per evitare di bloccare lo spettrometro Raman per diversi mesi. Inoltre, sono stati condotti esperimenti a flusso continuo collegando la cella fluida a una pompa a siringa. Questo approccio ha impedito efficacemente la precipitazione della silice, il che ha permesso la misurazione dei tassi di dissoluzione diretta in condizioni di flusso turbolento (Fritzsche24).
In generale, la FCRS fornisce un nuovo approccio per lo studio dei meccanismi accoppiati di reazioni e trasferimento di massa che avvengono alle interfacce solido-acqua, superando le carenze degli esperimenti ex situ comunemente applicati. È facilmente espandibile per adattarsi a un'ampia gamma di campioni e condizioni. Lo scopo di questo articolo è quello di condividere i dettagli tecnici e sperimentali della spettroscopia Raman a cella fluida, esemplificati da un esperimento di corrosione con un vetro borosilicato ternario (TBG) e una soluzione di NaHCO3 0.5 M ad una temperatura nominale di 90 °C. Il protocollo riguarderà la preparazione del campione, l'assemblaggio della cella fluida e l'impostazione delle condizioni di misurazione presso lo spettrometro Raman. Per determinare il tasso di ritiro del vetro, il potenziale gradiente di pH e la temperatura locale, gli autori fanno riferimento allo studio di Geisler et al.5 e Sulzbach e Geisler34 più materiale supplementare e la tesi di dottorato di Dohmen35 e Fritzsche24. I passaggi critici nell'impostazione dell'esperimento, come il riempimento e la chiusura della cella, saranno trattati con ulteriori consigli su come evitare di ripetere le insidie del lavoro precedente. Questo articolo fornisce una panoramica completa della tecnica, facilitandone l'implementazione da parte dei nuovi arrivati nel campo e contribuendo al progresso della ricerca sull'interazione solido-fluido.
Protocollo
1. Preparazione del campione
NOTA: Gli esperimenti FCRS possono essere condotti con materiali cristallini o amorfi purché la fase madre e quella del prodotto siano trasparenti alla luce visibile e la reazione avvenga a una temperatura della soluzione inferiore a circa 100 °C entro scale temporali da giorni a mesi 5,24,30,31,33,35. Il campione deve essere preparato come un monolite lucidato di circa 10 x 10 x 0,9 mm3. La dimensione del campione può variare fino a pochi mm. Il supporto del campione di politetrafluoroetilene (PTFE), che deve essere prodotto per ogni esperimento, può essere regolato di conseguenza (Figura 3A). Un disegno tecnico del supporto in PTFE utilizzato è riportato nella Figura 1 supplementare. Di seguito, viene preparato un campione di vetro ternario Na borosilicato (TBG).
- Macinare il tagliando di vetro con carta in carburo di silicio (SiC) a grana 600 su due lati opposti fino a quando non si inserisce nel supporto del campione in PTFE. Assicurarsi che il campione sia tenuto saldamente e il più verticalmente possibile nel supporto e rimuovere con cautela il materiale PTFE abraso.
NOTA: Inserendo con cura il tagliando del campione nel supporto, è possibile l'abrasione del PTFE, ma garantisce anche una posizione stabile e stretta del campione. - Montare il supporto in PTFE con il campione in un portacampioni metallico più grande in preparazione per la molatura del lato superiore del coupon di vetro allo stesso livello del supporto in PTFE.
- Una volta che il campione, il PTFE e il portacampione metallico sono quasi su un piano, macinare la superficie con una carta SiC a grana 1000 più fine.
- Pulire il campione all'interno del supporto prima con etanolo e poi con acqua (manualmente con flaconi spray) e asciugarlo con l'aiuto di una pistola ad aria compressa per rimuovere eventuali detriti di macinazione (SiC).
NOTA: La presenza di particelle di SiC danneggia potenzialmente lo straccio di lucidatura e può disturbare la successiva analisi Raman. Si consiglia l'uso aggiuntivo di fazzoletti privi di lanugine per la pulizia con acqua per rimuovere i residui. - Lucidare il lato superiore del campione all'interno del supporto in PTFE con una pasta diamantata da 3 μm e 1 μm per almeno 20 minuti. Assicurarsi che la superficie del campione di vetro e il supporto in PTFE formino un piano accuratamente lucidato per consentire il contatto diretto con il disco di zaffiro (Figura 3A, D).
NOTA: Questo è essenziale per ridurre al minimo il più possibile la superficie reattiva e lo spazio tra la finestra di zaffiro e il campione, al fine di ridurre i processi di corrosione sul lato superiore del campione. Inoltre, una superficie superiore ben levigata del campione riduce la rifrazione della luce laser 36,37,38. - Pulire il campione e il supporto in PTFE come descritto al punto 1.4 e utilizzare inoltre un bagno a ultrasuoni per una durata di circa 30 s con una frequenza di 50-60 Hz.
- Controllare la superficie laterale superiore lucida del vetro e del supporto al microscopio stereoscopico con un ingrandimento di 10 volte.
2. Preparazione della soluzione desiderata
- Misurare il pH della soluzione di NaHCO3 0,5 M dopo il bilanciamento della soluzione con l'aria ambiente con un pHmetro. Per rimuovere potenziali particelle solide, filtrare la soluzione con un filtro per siringa sterile (dimensione dei pori di 0,22 μm) subito prima dell'iniezione.
NOTA: La soluzione viene comunemente preparata un giorno prima dell'inizio dell'esperimento. Prima dell'inizio dell'esperimento, il valore del pH e la temperatura della soluzione vengono misurati per garantire che il valore del pH sia coerente con il valore del pH teoricamente calcolato per la soluzione equilibrata. - Assicurarsi che la soluzione sia visivamente priva di bolle d'aria. Determinare il volume della soluzione in base alle dimensioni della cella fluida e assicurarsi che sia sufficiente per recuperare una soluzione sufficiente per l'analisi chimica alla fine dell'esperimento.
3. Impostazione dei parametri di misurazione Raman
- Assicurarsi che lo spettrometro Raman sia calibrato con uno standard di frequenza adeguato (ad esempio, la banda fononica ottica del primo ordine di un monocristallo di silicio con un massimo di 520,7 cm-1). Per gli esperimenti FCRS, utilizzare uno spettrometro Raman dotato di un laser da 532 nm con un'elevata potenza di uscita (> 1 W), un microscopio con uno stadio x-y-z automatizzato con una dimensione del passo di ≤ 1 μm, un obiettivo 100x long working distance (LWD) con un'elevata apertura numerica, un reticolo meno dispersivo (ad esempio, con 600 scanalature per mm) per coprire un'ampia gamma spettrale, Una lampada al neon per la correzione dello spostamento dello spettrometro durante le misurazioni a lungo termine e fessure d'ingresso confocali e spettrometriche regolabili per ottimizzare in modo indipendente la risoluzione spaziale e spettrale.
ATTENZIONE: È necessario indossare occhiali di sicurezza laser quando si eseguono misurazioni spettroscopiche Raman (controllare la classe del laser). Con una potenza di uscita di 1 W o superiore, l'effetto di diffusione della luce è intenso. Tuttavia, l'elevata potenza di uscita del laser è un prerequisito per l'esecuzione di esperimenti FCRS di alta qualità, poiché molta luce primaria viene assorbita lungo il percorso del fascio attraverso la finestra di zaffiro, la soluzione e i solidi. - Impostare i parametri di misurazione Raman nel software.
- Definire gli intervalli delle finestre spettrali per misurare le modalità Raman caratteristiche per il campione e la soluzione in esame. Per il campione di vetro borosilicato, la finestra spettrale varia da 200 a 1735 cm-1. La seconda finestra varia da 2800 a 4000 cm-1 per misurare i rispettivi modi Raman dell'acqua molecolare e dei gruppi silanolo.
- Se possibile, chiudere il foro confocale a 600 μm e aprire la larghezza della fessura di ingresso dello spettrometro a 200 μm per ottimizzare la risoluzione della profondità a scapito della risoluzione spettrale (non critica per bande Raman relativamente ampie tipiche di materiali e soluzioni amorfe).
- Selezionare il tempo di acquisizione che consente di ottenere il miglior rapporto segnale/rumore possibile per la risoluzione temporale desiderata. Per un segnale di intensità sufficiente del vetro e dell'acqua, misurare le finestre spettrali rispettivamente per 7 s e 2 s e accumulare su 5 round.
NOTA: Il tempo di acquisizione potrebbe essere necessario per adattarsi ai cambiamenti nell'esperimento, adattando ai cambiamenti la geometria dell'interfaccia campione/solido/acqua in evoluzione con l'aumentare del tempo di reazione. - Posizionare la lampada al neon lungo il percorso del fascio di luce diffusa.
NOTA: La lampada al neon è opzionale ma consigliata come standard interno per correggere i dati per potenziali spostamenti dello spettrometro dovuti a fluttuazioni inevitabili della temperatura ambiente, che, tuttavia, dovrebbero essere controllate al meglio entro ± 0,5 °C (causando fluttuazioni dello spettrometro fino a ~ 0,2 cm-1). Inoltre, le righe Ne possono essere utilizzate per determinare empiricamente la risoluzione spettrale24.
4. Assemblaggio della cella del fluido
NOTA: I disegni tecnici dei componenti della cella fluida realizzati in polietere etere chetone (PEEK) sono riportati nella Figura 2 e nella Figura 3 supplementare.
- Posizionare la rondella in silicone sul coperchio della cella del fluido rovesciata, quindi posizionare la finestra in zaffiro e il portacampione in PTFE con il lato superiore del campione rivolto verso la finestra in zaffiro (Figura 3B-D). Fissare la posizione della rondella in silicone, della finestra in zaffiro e del campione con il tappo a vite (Figura 3E-F).
- Prima di iniettare la soluzione reattiva, pulire i tubi e le valvole su ciascun lato con acqua deionizzata. Quindi, iniettare aria per rimuovere l'acqua all'interno dei tubi e svuotare il recipiente del reattore.
- Inserire l'O-ring nell'apposita scanalatura.
- Iniettare la soluzione da entrambi i lati del reattore fino a quando l'uscita del tubo all'interno del reattore non è completamente coperta. Chiudere le valvole prima di rimuovere la siringa per evitare l'accumulo di aria all'interno del tubo o delle valvole.
- Aggiungere la soluzione rimanente dalla parte superiore del recipiente del reattore fino a formare una superficie convessa (menisco).
- Riempire gli spazi liberi del coperchio di supporto del campione facendo gocciolare accuratamente la soluzione lungo i lati destro e sinistro del tagliando del campione. Controllare il coperchio pieno per eventuali sacche d'aria.
- Girare il coperchio per posizionarlo sopra il recipiente del reattore e chiudere la cella il più rapidamente possibile utilizzando le 6 viti. Serrare le viti a croce.
NOTA: In caso di camera d'aria, rimuovere il coperchio e riempire nuovamente la cella e il coperchio. La cella fluida chiusa rappresenta un sistema statico e fornisce un regime di trasporto puramente diffusivo in soluzione. Per gli esperimenti a flusso continuo, è possibile collegare la cella a una pompa a siringa24. - Si prevede che la soluzione fuoriesca dal bordo della cella. Pulire la cella dall'esterno per rimuovere la soluzione che fuoriusciva dai bordi.
- Montare la cella del fluido sullo stadio x-y-z e collegare la cella allo stadio di riscaldamento. Accendere la fase di riscaldamento e impostare la temperatura nominale desiderata (qui 90 °C). Il riscaldamento, ad esempio, impiega circa 14 minuti per raggiungere una temperatura nominale di 90 °C.
NOTA: Una descrizione dettagliata dell'elettronica del riscaldatore è fornita nella Figura 4 supplementare. Si noti inoltre che, a causa di un gradiente di temperatura nella cella fluida, la temperatura reale alla profondità delle misurazioni è inferiore. Quando si utilizza una soluzione di bicarbonato, la temperatura a qualsiasi profondità della misurazione può essere determinata dalla posizione della banda di bicarbonato vicino a 1016 cm-1 (cf, Geisler et al.5). Per altre composizioni di soluzioni prive di carbonato, stimiamo la temperatura nel punto di misura utilizzando il gradiente di temperatura determinato empiricamente all'interno della cella fluida24.
5. Determinazione della dimensione dello spazio tra la finestra in zaffiro e il lato superiore del campione e la posizione dell'interfaccia campione/soluzione
- Una volta raggiunta la temperatura nominale, focalizzare il raggio laser sulla finestra di zaffiro attraverso il microscopio ottico in modalità video.
NOTA: Durante il riscaldamento fino alla temperatura nominale desiderata si verifica inevitabilmente una defocalizzazione dello spot laser a causa della leggera dilatazione termica del campione e dei materiali della cella fluida. Una volta raggiunta la temperatura nominale, la messa a fuoco si stabilizza dopo pochi minuti. Questo può essere controllato utilizzando la modalità video. - Spostare la messa a fuoco del laser sulla parte superiore della finestra in zaffiro al centro della superficie in direzione x e y per assicurarsi che sia sopra il campione. Impostate la posizione z (profondità) su zero come riferimento.
- Spostare il fuoco laser nella direzione z fino a quando non compaiono i primi segnali Raman di specie di acqua o soluzione, come, ad esempio, HCO3- e CO32- (Figura 4).
NOTA: Se disponibile, una funzione di misurazione del punto a ripetizione continua (ad esempio, la funzione di visualizzazione in tempo reale nel software LabSpec 6) può essere uno strumento molto utile per determinare rapidamente la dimensione dello spazio tra la superficie del campione superiore e la finestra in zaffiro. - Spostare la messa a fuoco del laser più in basso fino a quando non viene rilevato uno spettro puro del campione di vetro utilizzando la funzione di visualizzazione in tempo reale. Questa posizione è indicata come il lato superiore del campione.
- Spostare ulteriormente il fuoco del laser nella direzione z all'interno del campione (> 50 μm per i tassi di corrosione del vetro osservati).
NOTA: Il passaggio 5.5 è importante per evitare segnali di disturbo dovuti alla corrosione prevista dal lato superiore del campione. La profondità del fuoco laser, tuttavia, potrebbe dover essere aumentata con il tempo a causa della corrosione dalla parte superiore del campione. La profondità effettiva è maggiore nell'ordine delle decine di μm a causa di molteplici effetti di rifrazione lungo il percorso del fascio37. - Spostare lo stadio nella direzione x per determinare l'interfaccia campione/soluzione in base alla diminuzione e all'aumento dell'intensità del segnale Raman dal campione e dalla soluzione, rispettivamente. Ripetere questo passaggio monitorando il segnale di intensità delle modalità H2O Raman nella direzione x.
NOTA: L'esperienza ha dimostrato che quando la superficie del campione è ad angolo retto perfetto rispetto alla finestra dello zaffiro, si osserva una variazione del segnale di intensità superiore a ~ 10 μm nella direzione x, che corrisponde alla risoluzione laterale. - Impostare la posizione dell'interfaccia campione/soluzione su x = 0. Impostare la dimensione totale della scansione lineare su 100 μm, da -70 a 30 μm nella direzione x, in modo che la direzione di scansione sia impostata dal campione alla soluzione sfusa. In considerazione dell'avanzamento della reazione previsto, la dimensione del passo è impostata su 1 o 2 μm e il
NOTA: La scansione lineare presenta misurazioni a punto singolo nella direzione x per monitorare l'interfaccia vetro/soluzione in movimento nel tempo in una posizione costante in profondità (z) e direzione y. Il tempo necessario per ogni scansione lineare è la somma di (1) il tempo di conteggio, (2) il tempo necessario per spostarsi in un nuovo punto e (3) il tempo necessario allo spettrometro per spostarsi in diverse finestre di frequenza se è necessario misurare un'ampia gamma di frequenze, ad esempio la regione delle basse frequenze (da 100 a 1735 cm-1) e la regione delle alte frequenze (da 2800 a 4000 cm-1). Potrebbe essere necessario estendere la lunghezza della scansione lineare nel campione a seconda dell'andamento della reazione. - Avviare le misurazioni della scansione lineare. Per l'interfaccia vetro/soluzione, impostare una scansione lineare di 100 μm con un passo di 2 μm, effettuando misurazioni di 51 punti nella direzione x. In ogni punto, la prima e la seconda finestra spettrale vengono misurate rispettivamente per 7 s e 2 s e 5 volte accumulate. La scansione lineare viene ripetuta automaticamente attraverso l'interfaccia vetro/soluzione in movimento per diversi giorni o settimane, monitorando la dissoluzione del vetro e la precipitazione dello strato di alterazione superficiale a base di silice (SAL).
Risultati
Di seguito, le caratteristiche principali della metodologia sono illustrate dai risultati di un esperimento di corrosione con un campione ternario di vetro borosilicato di Na (TBG) e una soluzione di NaHCO3 0,5 M ad una temperatura nominale di 90 °C, ovvero le stesse condizioni degli esperimenti di Geisler et al.4. La temperatura effettiva alla profondità di misurazione era di 86 ± 1 °C, determinata dallo spostamento di frequenza dipendente dalla temperatura della banda del bicarbonato vicino a 1016 cm-1 (a temperatura ambiente)4. Il TBG è già stato utilizzato in precedenti esperimenti FCRS 24,30,31,35. L'esperimento è stato condotto con uno spettrometro Raman confocale HR800 di Horiba Scientific presso l'Istituto di Geoscienze dell'Università di Bonn, in Germania. Il sistema è dotato di un laser Nd:YVO4 (532,11 nm) a frequenza raddoppiata con una potenza di uscita di 2,2 W e di un dispositivo ad accoppiamento di carica con moltiplicatore di elettroni (Figura 3B). È stato utilizzato un obiettivo 100x long working distance (LWD) con un'apertura numerica di 0,8, un reticolo spettrometrico con 600 scanalature per mm, un foro confocale di 600 μm e una larghezza della fessura di ingresso dello spettrometro di 200 μm. Lo spettrometro è stato inizialmente calibrato con un cristallo singolo al silicio che ha una banda Raman di primo ordine a 520,7 cm-1. Il segnale Raman è stato misurato negli intervalli del numero d'onda da 200 a 1735 e da 2800 a 4000 cm-1. Il primo intervallo del numero d'onda include una linea Ne a 1707,36 cm-1 che è stata registrata come standard del numero d'onda interno per correggere ogni spettro per qualsiasi spostamento dello spettrometro durante misurazioni a lungo termine fino a diversi giorni (risultante da variazioni di temperatura di ± 0,5 °C in laboratorio). I dati Raman qui presentati sono stati corretti, se non diversamente specificato, per possibili fluttuazioni di frequenza solo adattando una funzione gaussiana alla linea Ne registrata24,39. Inoltre, la linea Ne è stata utilizzata per determinare empiricamente la risoluzione spettrale, data dalla larghezza completa a metà massimo (FWHM), che era di 5,1 cm-1.
La Figura 5A mostra l'evoluzione temporale della distribuzione spaziale del vetro, della soluzione e del SAL come visualizzata dal software utilizzando gli spettri grezzi registrati. Questa immagine in falsi colori rispetto al tempo rispetto alla posizione è stata generata da scansioni lineari, ovvero da misurazioni punto per punto nella direzione x attraverso l'interfaccia vetro/soluzione. L'immagine mostra un'interfaccia vetro/soluzione in continuo ritiro entro le prime 4,0 ore, indicando la dissoluzione congruente del vetro. I primi segnali di silice amorfa sono stati rilevati dopo 8,3 ore, catturando la precipitazione del SAL. La Figura 5B mostra spettri Raman grezzi rappresentativi registrati da un singolo punto (pixel) della soluzione, il SAL e il vetro, insieme alle singole finestre di frequenza utilizzate per l'integrazione dell'intensità per visualizzare la loro distribuzione spaziale, come mostrato nella Figura 5A e nella Figura 6A. L'osservazione chiave di questo esperimento da evidenziare qui è la formazione di una zona ricca d'acqua tra il SAL e il vetro sottostante. Questa zona ricca d'acqua ha iniziato a formarsi dopo circa 80 ore e, da questo momento, è successivamente cresciuta fino a diventare uno strato d'acqua interfacciale chiaro con una larghezza di circa 6-8 μm (Figura 6A). Nella Figura 6B, sono mostrati gli spettri Raman medi rappresentativi nell'intervallo di frequenza delle vibrazioni dell'acqua dalla soluzione sfusa, dal SAL, dalla soluzione di interfaccia e dal vetro nominale privo di acqua. Gli spettri evidenziano la differenza di intensità di H2O tra la soluzione di massa e la soluzione di interfaccia, ma anche che lo spettro dal SAL coinvolge un nuovo segnale vicino a 3600 cm-1 che può essere assegnato alle vibrazioni Si-OH35. Questa banda OH aggiuntiva non è visibile nello spettro dello strato d'acqua interfacciale e della soluzione di massa, il che è un'ulteriore prova che un chiaro divario tra il vetro incontaminato e il SAL si è lentamente evoluto durante l'esperimento che è stato riempito d'acqua. La formazione di un tale strato d'acqua interfacciale (o interfaccia ricca d'acqua) mentre la reazione è in corso è una caratteristica intrinseca del modello ICDP e non può essere spiegata dal meccanismo di lisciviazione ampiamente accettato 4,17. Il fatto che questa osservazione possa essere riprodotta è di grande importanza in quanto deve ovviamente essere considerata negli approcci di modellazione che mirano a simulare realisticamente la corrosione del vetro silicato in soluzioni acquose.
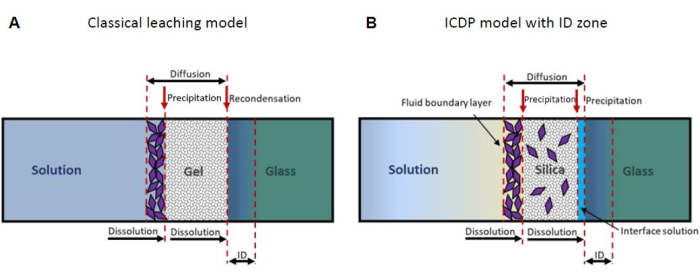
Figura 1: Rappresentazione schematica dei due più importanti modelli meccanicistici di corrosione del vetro. (A) Il classico modello di lisciviazione13,16 e (B) il modello di dissoluzione-precipitazione accoppiato all'interfaccia (ICDP)19,20 con zona di interdiffusione (ID)23. Questa cifra è stata modificata da24. Clicca qui per visualizzare una versione più grande di questa figura.
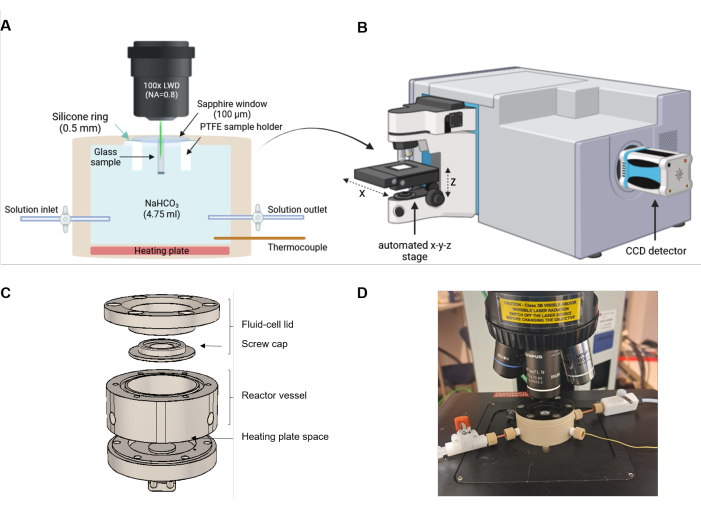
Figura 2: Configurazione sperimentale della spettroscopia Raman a cella fluida. (A) Il raggio laser è allineato parallelamente alla direzione del fronte di reazione. La cella di reazione è dotata di una piastra riscaldante nella parte inferiore e di un ingresso e un'uscita per lo scambio di soluzione opzionale o esperimenti a flusso continuo. (B) Schizzo di uno spettrometro Raman dotato di un microscopio, di uno stadio x-y-z automatizzato e di un dispositivo ad accoppiamento di carica (CCD) per rilevare la luce diffusa. (C) Disegno tecnico schematico dei componenti in PEEK della cella a fluido. (D) Foto di una cella fluida riempita montata sul tavolino automatizzato del microscopio Raman. La configurazione non è in scala. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Assemblaggio del coperchio della cella fluida. (A) Campione lucidato e supporto in PTFE (B) Rondella in silicone posta sul coperchio della cella fluida. (C) La finestra in zaffiro è posizionata con precisione sulla parte superiore della lavatrice. (D) Supporto in PTFE con il campione rivolto verso la finestra in zaffiro posizionata sulla finestra. (E) Tappo in PEEK avvitato che fissa la posizione del campione. (F) Vista laterale del tappo avvitato saldamente sul coperchio. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Stack plot di spettri Raman grezzi a diverse profondità. Stack plot dell'esperimento presentato con un vetro borosilicato di Na e una soluzione di NaHCO3 0,5 M. La superficie della finestra in zaffiro è impostata su z = 0. Dato lo spessore di 100 μm della finestra in zaffiro, la distanza tra la parte inferiore della finestra e il lato superiore del monolite di vetro a -150 μm è di circa 50 μm. Gli spettri blu mostrano spettri misti di zaffiro, la soluzione di NaHCO3 0,5 M e il vetro borosilicato Na. Clicca qui per visualizzare una versione più grande di questa figura.
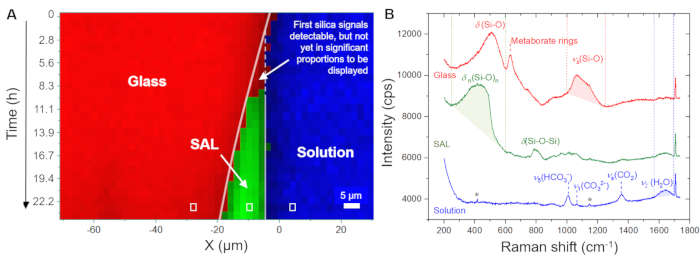
Figura 5: Distribuzione del SAL a base di vetro, soluzione e silice in funzione del tempo e dello spazio a 86 °C. (A) Profili iperspettrali della linea Raman attraverso l'interfaccia vetro/soluzione in funzione del tempo per le prime 24 ore dell'esperimento con un vetro borosilicato di Na e una soluzione di NaHCO3 0.5 M. (B) Grafico a sovrapposizione degli spettri Raman grezzi resi da una misurazione di un singolo punto (rettangoli bianchi in (A)). Le linee tratteggiate rosse, verdi e blu indicano gli intervalli del numero d'onda utilizzati per visualizzare il vetro (1000 - 1250 cm-1), la soluzione di bicarbonato (1560 - 1700 cm-1) e il SAL a base di silice (250 - 600 cm-1), rispettivamente. L'intensità Raman all'interno di questi confini è stata integrata dopo la sottrazione di un fondo lineare che è stato definito dall'intensità ai confini della finestra del numero d'onda. Il simbolo della stella segna i segnali deboli provenienti dalla finestra in zaffiro. Clicca qui per visualizzare una versione più grande di questa figura.
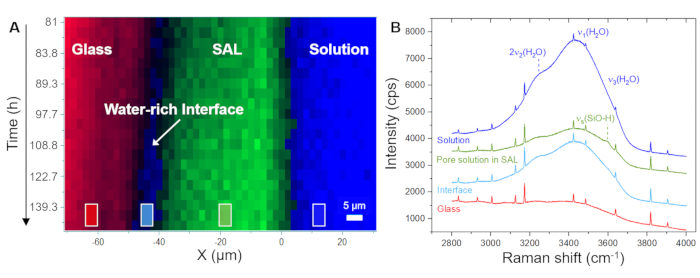
Figura 6: Distribuzione del vetro, di un'interfaccia ricca d'acqua e del SAL in funzione dello spazio-tempo insieme agli spettri Raman rappresentativi. (A) Profili iperspettrali della linea Raman attraverso l'interfaccia vetro/soluzione in funzione del tempo per il periodo compreso tra 81 ore e 140 ore dell'esperimento con un vetro borosilicato di Na e una soluzione di NaHCO3 0,5 M, mostrando la formazione di uno strato d'acqua di interfaccia tra il vetro e il SAL. (B) Spettri Raman grezzi sovrapposti mediati sulla regione contrassegnata dai quadrati in (A), che mostrano una diminuzione del segnale di intensità dei rispettivi modi Raman dell'acqua all'interno del SAL e un aumento tra il SAL e il vetro di dissoluzione. All'interno del SAL, si nota un'intensità del segnale aggiuntiva a circa 3600 cm-1 che può essere assegnata alla modalità di stretching dei gruppi silanolo (H-legato a Si-O-)40. Il debole segnale visibile dell'acqua dalla regione di vetro deriva dallo strato di soluzione tra la finestra di zaffiro e la superficie del campione di vetro. I picchi acuti sono linee Ne. Clicca qui per visualizzare una versione più grande di questa figura.
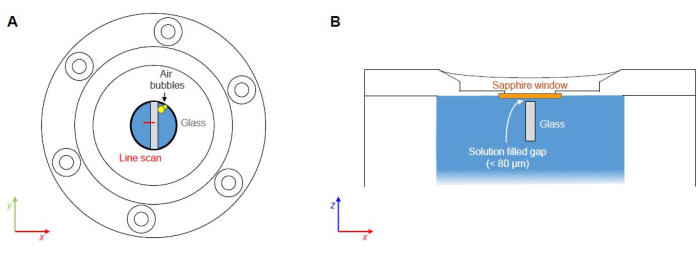
Figura 7: Punti critici degli esperimenti FCRS. (A) Potenziale intrappolamento e nucleazione di sacche d'aria lungo le interfacce dei materiali (non in scala). (B) Spazio riempito di soluzione tra la parte inferiore della finestra di zaffiro e il lato superiore del campione di vetro (non in scala). Clicca qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Disegno tecnico del portacampione in PTFE. Clicca qui per scaricare questo file.
Figura 2 supplementare: Disegno tecnico dei componenti della cella fluida in PEEK. Clicca qui per scaricare questo file.
Figura 3 supplementare: Disegno tecnico esploso dei componenti della cella fluida in PEEK. Clicca qui per scaricare questo file.
Figura supplementare 4: Descrizione dettagliata del riscaldatore della cella del reattore. L'elemento riscaldante della cella del reattore è un disco riscaldante in metallo-ceramica (MCH), che tollera temperature fino a 400 °C. Ha un diametro di 30 mm e uno spessore di 1,5 mm. L'elemento riscaldante è collegato a un regolatore di temperatura per mezzo di un piccolo circuito elettronico. Il collegamento tra il riscaldatore e il controller è realizzato da fili di silicone flessibili e resistenti al calore. Il termoregolatore è alloggiato insieme al circuito elettronico e ad un alimentatore a 5 V in una piccola scatola di plastica. Clicca qui per scaricare questo file.
Discussione
Il presente protocollo si concentra sulla messa a punto di un esperimento FCRS per lo studio operando dei fenomeni di reazione e trasporto durante la corrosione acquosa del vetro borosilicato presentando i dati Raman misurati da un esperimento con un semplice vetro borosilicato ternario di Na in una soluzione di NaHCO3 0.5 M a 86 ± 1 °C. Le fasi critiche rappresentano (1) il possibile intrappolamento di sacche d'aria durante la chiusura della cella del fluido e (2) i processi di corrosione sul lato superiore dovuti allo spazio tra la parte inferiore della finestra in zaffiro e il lato superiore del campione di vetro (Figura 7). La corrosione del lato superiore rappresenta un problema, in particolare durante gli esperimenti a lungo termine, poiché i prodotti di corrosione assorbono e disperdono la luce incidente e diffusa, riducendo il rapporto qualità (segnale/rumore) degli spettri e la risoluzione spaziale nel tempo. Questo problema è attualmente affrontato da esperimenti ex situ con vetri che sono stati spruzzati con uno strato di nitruro di silicio (SiN) al fine di testare la stabilità dello strato di SiN contro soluzioni acquose. I segnali Raman provenienti dallo strato superficiale di SiN sono rilevabili solo a una profondità di pochi micrometri e, quindi, non ci si aspetta che abbiano un effetto di disturbo durante un esperimento FCRS. L'intrappolamento dell'aria è sempre un potenziale problema che dipende da come la soluzione viene riempita nella cella, ma può essere evitato con un po' di pratica e rimuovendo le bolle d'aria dalla soluzione di partenza.
Per un trattamento quantitativo, i dati Raman devono essere corretti correttamente per i segnali di fondo, gli effetti della temperatura e la dipendenza dalla lunghezza d'onda del processo di scattering24,41. Un protocollo dettagliato per il trattamento dei dati è riportato in24. Inoltre, è importante notare che la profondità focale effettiva e apparente differiscono a causa di molteplici effetti di rifrazione. Tuttavia, la risoluzione della profondità e la profondità effettiva da cui viene registrato un segnale Raman possono essere calcolate con ragionevole precisione da considerazioni geometriche e ottiche di un sistema multistrato24. La risoluzione spaziale può anche essere determinata empiricamente 4,27,28. In generale, la risoluzione della profondità aumenta linearmente con la profondità apparente, a seconda dell'apertura numerica dell'obiettivo e degli indici di rifrazione dei materiali attraversati dal raggio laser, ovvero la finestra di zaffiro, la soluzione e i prodotti del campione/reazione24,37.
FCRS fornisce informazioni in tempo reale e in situ sui processi di reazione e trasporto accoppiati che si verificano all'interfaccia solido-acqua su scala microscopica. Senza interrompere i processi in corso, l'FCRS è in grado di catturare i processi chiave di reazione e trasporto, il che è importante, ad esempio, per l'attuale dibattito sui meccanismi di corrosione del vetro utilizzati per descrivere le prestazioni a lungo termine dei vetri per le scorie nucleari. I dati esemplificativi qui presentati mostrano la formazione di una zona ricca d'acqua (strato d'acqua interfacciale/film fluido) tra il SAL e il vetro sottostante, che è una caratteristica intrinseca del modello ICDP. I risultati confermano i precedenti studi FCRS 5,24,30,33 e quindi dimostrano la riproducibilità della metodologia sperimentale. Il metodo presentato supera gli svantaggi degli esperimenti ex situ in più fasi che coinvolgono la tempra, l'essiccazione e il sezionamento meccanico dei prodotti di reazione e fornisce informazioni su diversi esperimenti di quenching con un singolo esperimento, evitando il rischio di modificare i prodotti di alterazione per l'analisi post mortem.
Poiché la frequenza della vibrazione molecolare dipende dalla massa degli isotopi vibranti, i processi di reazione e trasporto possono anche essere tracciati operando mediante spettroscopia Raman utilizzando 2H e 18O che possono essere aggiunti al sistema come traccianti isotopici stabili4. La misurazione Raman può anche essere estesa a tre dimensioni, cioè mediante misurazioni sequenziali in due dimensioni, che possono fornire ulteriori informazioni sulla trama27,28. Tuttavia, va notato che il tempo di esposizione aumenterà notevolmente. Le velocità dei processi da riprendere possono quindi essere un fattore limitante in quanto dovrebbero essere più lente del tempo di esposizione, che, ovviamente, deve essere considerato anche per le misurazioni a scansione lineare.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo G. Paulus (Schott AG) per la sintesi e la caratterizzazione del vetro borosilicato. Un ringraziamento speciale va a D. Lülsdorf e H. Blanchard (Università di Bonn) e a W. Bauer (Schott AG) per l'aiuto nella progettazione e nella costruzione della/e cella/e a fluido/i. Ringraziamo Schott AG Mainz, Germania, la Fondazione tedesca per la ricerca (sovvenzione n. GE1094/21-1 e GE1094/27-1 a T.G.), e il Ministero federale tedesco dell'istruzione e della ricerca (BMBF) (sovvenzione n. 02NUK019F a T.G.) per il sostegno finanziario. T.G. e M.B.K.F. sono inoltre grati per il sostegno finanziario fornito da Otto-Schott-Fond.
Materiali
| Name | Company | Catalog Number | Comments |
| Cross screws (6 pieces) | --- | --- | |
| Blue silicone wire | Reichelt Elektronik | cross-section: 1.5 mm², length: 2 m | |
| Capacitor | Reichelt Elektronik | capacity: 100 nF | |
| Connectors according to user‘s choice | Reichelt Elektronik | ||
| Eurotherm Controller 3216 | Eurotherm/Emerson | Order Code 3216 CC VH LXXX X XXX G ENG XXXXX | |
| Flangeless Ferrules ETFE | Darwin Microfluidics | SKU: ID-P-200X | 1/4"-28 for 1/16" OD |
| Fluid Cell (container + lid) | home made | --- | technical drawing provided in the appendix (S1-S2) |
| Heating element, metal-ceramic heater (MCH) disc | Alibaba | D: 30 mm, H: 1.5 mm; https://german.alibaba.com/product-detail/DC-Power-Supply-30mm-MCH-Round-1600118228465.html?spm=a 2700.7724857.0.0.7cde5nqq5nqq2n | |
| Horiba HR800 Raman spectrometer | HORIBA | ||
| LabSpec 6.5.1.24 Spectroscopy Suite | |||
| Mains Cable with plug, load+neutral (L+N) | Reichelt Elektronik | length: 2 m | |
| Mains Fuse 1A | Reichelt Elektronik | 5x20 mm² | |
| Mains Fuse Holder | Reichelt Elektronik | 5x20 mm² | |
| Mains rocker switch | Reichelt Elektronik | 230VAC 2A | |
| Microfluidic Fittings Adapter Female Luer to 1/4-28 Male | Darwin Microfluidics | SKU: ID-P-618 | |
| Millex Syringe filters | Merck | SLGPR33RS | |
| NaHCO3 | Merck | CAS-144-55-8 | |
| NMOS Mosfet F1010N | Reichelt Elektronik | ||
| Plastic Enclosure | Reichelt Elektronik | TEKO KL22 | Enclosure 178x128x72 |
| PTFE sample holder | home made | --- | |
| PTFE Tubing | Darwin Microfluidics | BL-PTFE-1608-20 | 1/16" OD |
| Red silicone wire | Reichelt Elektronik | cross-section: 1.5 mm², length: 2 m | |
| Resistor | Reichelt Elektronik | 1/4W, 10kOhm | |
| Resistor | Reichelt Elektronik | 1/4W, 2.2kOhm | |
| Sapphire Window | Edmund Optics GmbH | #71-225 | D: 15 mm H: 100 µm |
| Shut-Off Valve 1/4-28 | Darwin Microfluidics | SKU: ID-P-782 | |
| Silicone washer | ART Elektromechanik | customized for institute | OD: 15mm, ID: 8 mm; H: 0.5 mm |
| Switching-mode power supply | Reichelt Elektronik | SNT RS 25 5 | 5V, 5A |
| Thermocouple Extension Cable, Plug/Socket, Type K | RS Components GmbH | 2 m | |
| Thermocouple Socket, Type K, Case Mount | RS Components GmbH | ||
| Thermocouple, Type K | TC Direct | D: 1 mm, L: 50-100mm | |
| Various cables for in-box wiring | Reichelt Elektronik |
Riferimenti
- Belançon, M. P., Sandrini, M., Zanuto, V. S., Muniz, R. F. Glassy materials for Silicon-based solar panels: Present and future. J Non-Crystalline Solids. 619, 122548(2023).
- Iacocca, R., et al. Factors affecting the chemical durability of glass used in the pharmaceutical industry. AAPS PharmSciTech. 11 (3), 1340-1349 (2010).
- Grambow, B. A general rate equation for nuclear waste glass corrosion. MRS Online Proc Lib. 44, 15-27 (1984).
- Gin, S., Taron, M., Arena, H., Delaye, J. M. Effect of structural disorder induced by external irradiation with heavy ions on the alteration of a four oxide borosilicate glass. NPJ Mater Degrad. 8, 64(2024).
- Geisler, T., Dohmen, L., Lenting, C., Fritzsche, M. B. K. Real-time in situ observations of reaction and transport phenomena during silicate glass corrosion by fluid-cell Raman spectroscopy. Nat Mater. 18, 342-348 (2019).
- Stroncik, N. A., Schmincke, H. U. Evolution of palagonite: Crystallization, chemical changes, and element budget. Geochem Geophys Geosyst. 2 (7), 1017(2001).
- Staudigel, H., Hart, S. R. Alteration of basaltic glass: Mechanisms and significance for the oceanic crust-seawater budget. Geochim Cosmochim Acta. 47, 337-350 (1983).
- Udi, U. J., Yussof, M. M., Ayagi, K. M., Bedon, C., Kamarudin, M. K. Environmental degradation of structural glass systems: A review of experimental research and main influencing parameters. Ain Shams Eng J. 14, 101970(2023).
- Majérus, O., et al. Glass alteration in atmospheric conditions: crossing perspectives from cultural heritage, glass industry, and nuclear waste management. NPJMater Degrad. 4, 27(2020).
- Grambow, B. Nuclear waste glasses - How durable. Elements. 2, 357-364 (2006).
- Hellmann, R., et al. Nanometre-scale evidence for interfacial dissolution-reprecipitation control of silicate glass corrosion. Nat Mater. 14, 307-311 (2015).
- Gin, S., et al. Origin and consequences of silicate glass passivation by surface layers. Nat Comm. 6, 6360-6360 (2015).
- Gin, S., et al. The controversial role of inter-diffusion in glass alteration. Chem Geol. 440, 115-123 (2016).
- Gin, S., et al. An international initiative on long-term behavior of high-level nuclear waste glass. Mater Today. 16, 243-248 (2013).
- Frugier, P., et al. SON68 Nuclear glass dissolution kinetics: Current state of knowledge and basis of the new GRAAL model. J Nuclear Mater. 380, 8-21 (2008).
- Bunker, B. C. Molecular mechanisms for corrosion of silica and silicate glasses. J Non-Crystalline Solids. 179, 300-308 (1994).
- Cailleteau, C., et al. Insight into silicate-glass corrosion mechanisms. Nat Mater. 7, 978-983 (2008).
- Gin, S., Ryan, J. V., Schreiber, D. K., Neeway, J., Cabié, M. Contribution of atom-probe tomography to a better understanding of glass alteration mechanisms: Application to a nuclear glass specimen altered 25years in a granitic environment. Chem Geol. 349 - 350, 99-109 (2013).
- Geisler, T., et al. The mechanism of borosilicate glass corrosion revisited. Geochim Cosmochim Acta. 158, 112-129 (2015).
- Geisler, T., et al. Aqueous corrosion of borosilicate glass under acidic conditions: A new corrosion mechanism. J Non-Crystalline Solids. 356, 1458-1465 (2010).
- Putnis, A. Why mineral interfaces matter. Science. 343, 1441-1442 (2014).
- Putnis, A. Mineral replacement reactions: from macroscopic observations to microscopic mechanisms. Mineralogical Magazine. 66, 689-708 (2002).
- Lenting, C., et al. Towards a unifying mechanistic model for silicate glass corrosion. NPJ Mater Degrad. 2, 28(2018).
- Fritzsche, M. B. K. The aqueous corrosion of borosilicate glasses studied in operando by in situ fluid-cell Raman spectroscopy. Dissertation. , University of Bonn. Germany. https://hdl.handle.net/20.500.11811/10602 (2023).
- Iler, K. R. The chemistry of silica: Solubility, polymerization, colloid and surface properties and biochemistry of silica. , Wiley. (1979).
- Gin, S., et al. The fate of silicon during glass corrosion under alkaline conditions: A mechanistic and kinetic study with the International Simple Glass. Geochim Cosmochim Acta. 151, 68-85 (2015).
- Putnis, C., Ruiz-Agudo, E. The mineral-water interface: Where minerals react with the environment. Elements. 9, 177-182 (2013).
- Icenhower, J. P., Steefel, C. I. Dissolution rate of borosilicate glass SON68: A method of quantification based upon interferometry and implications for experimental and natural weathering rates of glass. Geochim Cosmochim Acta. 157, 147-163 (2015).
- Icenhower, J. P., Steefel, C. I. Experimentally determined dissolution kinetics of SON68 glass at 90°C over a silica saturation interval: Evidence against a linear rate law. J Nuc Mater. 439, 137-147 (2013).
- Lenting, C., Geisler, T. Corrosion of ternary borosilicate glass in acidic solution studied in operando by fluid-cell Raman spectroscopy. NPJ Mater Degrad. 5, 37(2021).
- Lönartz, M. I., et al. The effect of heavy ion irradiation on the forward dissolution rate of borosilicate glasses studied in situ and real time by fluid-cell raman spectroscopy. Materials. 12 (9), 1480(2019).
- Müller, G., Fritzsche, M. B. K., Dohmen, L., Geisler, T. Feedbacks and non-linearity of silicate glass alteration in hyperalkaline solution studied by in operando fluid-cell Raman spectroscopy. Geochim Cosmochim Acta. 329, 1-21 (2022).
- Müller, G. Raman spectroscopic ex situ and in situ. investigations of the aqueous corrosion of soda-lime silicate glasses. , University of Bonn. Bonn. (2019).
- Sulzbach, M., Geisler, T. The replacement of celestine (SrSO4) by strontianite (SrCO3) in aqueous solution studied in situ and in real time using fluid-cell Raman spectroscopy. Minerals. 14 (2), 164(2024).
- Dohmen, L. In situ .observations of reaction and transport phenomena during silicate glass corrosion by fluid-cell Raman spectroscopy: Method development and applications. Unpubl. PhD thesis. , University of Bonn. Germany. (2019).
- Everall, N. Confocal Raman microscopy: Why the depth resolution and spatial accuracy can be much worse than you think. Appl Spectrosc. 54, 1515-1520 (2000).
- Everall, N. Depth profiling with confocal raman microscopy, part II. Spectroscopy. 19, 22-27 (2004).
- Everall, N. The influence of out-of-focus sample regions on the surface specificity of confocal Raman microscopy. Appl Spectrosc. 62, 591-598 (2008).
- Hauke, K., Kehren, J., Böhme, N., Zimmer, S., Geisler-Wierwille, T. In situ hyperspectral Raman Imaging: A new method to investigate sintering processes of ceramic material at high-temperature. Appl Sci. 9, 1310(2019).
- Davis, K. M., Tomozawa, M. An infrared spectroscopic study of water-related species in silica glasses. J Non-Crystalline Solids. 201, 177-198 (1996).
- Long, D. A. Raman spectroscopy. , McGraw Hill International Book Company. Great Britain. (1977).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon