Spectroscopie photoélectronique à rayons X
Vue d'ensemble
Source : Faisal Alamgir, School of Materials Science and Engineering, Georgia Institute of Technology, Atlanta, GA
La spectroscopie photoélectronique à rayons X (XPS) est une technique qui mesure la composition élémentaire, la formule empirique, l'état chimique et l'état électronique des éléments qui existent dans un matériau. Les spectres XPS sont obtenus en irradiant un matériau avec un faisceau de rayons X tout en mesurant simultanément l'énergie cinétique et le nombre d'électrons qui s'échappent du haut de plusieurs nanomètres du matériau analysé (dans les 10 premiers nm, pour la cinétique typique énergies des électrons). En raison du fait que les électrons de signal s'échappent principalement des premiers nanomètres du matériau, XPS est considéré comme une technique d'analyse de surface.
La découverte et l'application des principes physiques derrière XPS ou, comme on l'appelait plus tôt, la spectroscopie électronique pour l'analyse chimique (ESCA), ont conduit à deux prix Nobel de physique. Le premier a été attribué en 1921 à Albert Einstein pour son explication de l'effet photoélectrique en 1905. L'effet photoélectrique sous-tend le processus par lequel le signal est généré dans XPS. Beaucoup plus tard, Kai Siegbahn a développé ESCA basé sur certaines des premières œuvres d'Innes, Moseley, Rawlinson et Robinson, et a enregistré, en 1954, le premier spectre XPS à haute résolution énergétique de NaCl. Une nouvelle démonstration de la puissance de l'ESCA/XPS pour l'analyse chimique, ainsi que le développement de l'instrumentation associée à la technique, ont conduit au premier instrument commercial monochrome XPS en 1969 et le prix Nobel de physique en 1981 à Siegbahn en reconnaissance de ses efforts considérables pour développer la technique comme un outil d'analyse.
Principles
Dans XPS, les rayons X incident d'une source, généralement Al-Kô, avec l'énergie du photon de 1486,7 eV, irradient un échantillon et, répondant aux énergies de liaison de seuil de certains (sinon tous) des électrons de base dans les atomes constitutifs dans un matériau, éjecter ces électrons de base au-delà de l'énergie Fermi (E_f). Al KMD est une fluorescence spécifique des rayons X émise lors de la relaxation des atomes d'Al qui ont été emmenés dans des états excités par l'éjection de leurs électrons 1s. Si l'énergie des rayons X sources (Es) est suffisamment élevée, l'électron central peut alors répondre à la fonction de travail de seuil () nécessaire pour dépasser le niveau de vide (E_vac) et émerger avec l'énergie cinétique restante. Ces électrons sont appelés photoélectrons, et à condition qu'ils soient assez proches de la surface, ils peuvent émerger de la surface de l'échantillon et être captés par un détecteur d'électrons discriminant l'énergie. Un tel détecteur mesure l'énergie cinétique du photoélectron (KE), qui peut être utilisé pour calculer l'énergie de liaison (BE) des électrons :
BE = ES-Φ - KE
Parce que la voie libre moyenne inélastique (IMFP) des électrons de signal n'est que de quelques nanomètres (c'est-à-dire la distance moyenne que les électrons voyagent entre les événements de diffusion inélastique est de quelques nanomètres XPS nécessite des conditions de vide ultra-haute (UHV) dans le chambre de mesure. Les limites de détection pour la plupart des éléments sont de l'ordre de pièces par millier de plage (1 000 PPM). Afin d'atteindre de meilleures limites de détection des parties par million (ppm), la technique nécessite soit une forte concentration de l'espèce détectée à la surface supérieure, soit un temps de collecte très long (plusieurs heures). Les données qui en résulteront se feront sous la forme d'un spectre où une intensité (représentant le nombre d'électrons par seconde frappant le détecteur) par rapport à l'énergie de liaison. À condition que la source de rayons X soit suffisamment énergique pour éjecter les électrons de certains états électroniques des atomes dans le matériau, il y aura un ou plusieurs pics correspondants dans le spectre. Le BE d'un certain pic d'un élément dans le spectre peut alors être comparé à ceux des matériaux de référence, ou aux valeurs compilées dans les bases de données, afin de déterminer l'«état chimique» de cet élément dans l'échantillon. L'intensité d'un certain pic élémentaire est, bien sûr, proportionnelle à la concentration de cet élément dans l'échantillon. Cependant, parce que les probabilités d'ionisation de différents états d'électrons varient, la conversion des comptes mesurés sous des pics spectraux en valeurs de concentrations nécessitera la normalisation des comptes par des « facteurs de sensibilité » qui corrigent ces probabilités différentes.
Le système XPS peut accueillir des films minces, des échantillons en vrac jusqu'à 1 cm d'épaisseur et des échantillons de poudre. L'étape de l'échantillon ici est de 60 mm par 60 mm et peut contenir autant d'échantillons que s'adaptera dans cette zone. Les films peuvent être inorganiques ou organiques/biologiques tant qu'ils sont secs.
Procédure
La procédure suivante s'applique à un instrument XPS spécifique et à son logiciel associé, et il peut y avoir quelques variations lorsque d'autres instruments sont utilisés.
- L'échantillon est un mince film de Pt (3 couches atomiques d'épaisseur) cultivé sur une seule couche de graphène, qui est soutenu sur une silice commerciale (SiO2) diapositive en verre. Le graphène (qui est une seule couche de carbone) a été cultivé sur Cu, puis transféré sur le substrat de verre. Les couches atomiques De Pt ont ensuite été déposées par des méthodes d'électrodéposition.
- Pour charger les échantillons, éventez d'abord le verrou pour obtenir le support de l'échantillon. Assurez-vous de suivre les règles de propreté pour les systèmes UHV. Il s'agit notamment: pas de peau nue, les cheveux, ou l'humidité en contact avec des échantillons ou le titulaire de l'échantillon. Utilisez des pinces propres pour manipuler votre échantillon. La porte du chargeur s'ouvrira après que la chambre de chargement se sera ventilée à la pression atmosphérique (environ 5 minutes). Sortez le porte-échantillon.
- L'échantillon est tenu par les clips de ressort qui devraient être sur la scène. Essuyez la surface de la scène et les clips que vous utilisez avec de l'alcool et séchez complètement.
a.Ouvrez la porte du chargeur et remettez le support de l'échantillon sur le bras de transfert. Le support ne s'adaptera correctement qu'à sens unique.
b. Fermez la porte et pompez le verrou de charge pendant environ 10 minutes, bien que vous puissiez avoir besoin de temps de pompage supplémentaire pour certains échantillons (par exemple, s'il est très poreux, une poudre, ou contient un solvant non évaporé) et puis transférer l'échantillon dans la chambre d'analyse. Notez la pression de la chambre d'analyse lorsque le transfert de l'échantillon se produit. Il devrait être dans la gamme de mi-à-bas 10-7 mbar puis tomber rapidement dans la gamme de 10-8 mbar lorsque la valve entre les deux chambres se ferme. - Vérifiez la pression de la chambre d'analyse. Il devrait être dans la gamme mi10-8 mbar ou en dessous quand une expérience est commencée.
- Définir l'énergie de passage. L'énergie de passage est l'énergie avec laquelle tous les photoélectrons entreront dans le spectromètre et s'assureront que toutes les caractéristiques mesurées dans le spectre ont la même résolution d'énergie. C'est parce que la résolution d'énergie du spectromètre, E, échelles avec l'énergie cinétique des photoélectrons, et donc avoir une énergie constante pour tous les électrons entrant dans le détecteur définit une résolution constante pour l'ensemble du spectre. Plus l'énergie du passage est élevée, plus le flux d'électrons entrant dans le détecteur est élevé et, par conséquent, un meilleur rapport signal-bruit (s/n), mais cela a un coût de résolution d'énergie pire (plus grand E). Inversement, une énergie de passage inférieure assure une meilleure résolution d'énergie, mais à un coût de flux plus faible et, par conséquent, un s /n inférieur.
- Recueillir un spectre d'enquête. Ici, votre but est de capturer tous les différents types d'électrons qui sont éjectés de l'échantillon, et être en mesure, par conséquent, d'examiner la teneur élémentaire de votre échantillon. Le détecteur (spectromètre) devra donc être installé pour tenter de capturer le plus grand nombre possible d'électrons. Vous pouvez le faire en définissant la plage d'analyse d'énergie la plus large pour le spectromètre. Les contrôles logiciels spécifiques varient pour les différents systèmes XPS commerciaux. Le spectre d'enquête vous permet d'inspecter toutes les émissions de photoélectrons dans votre échantillon avant de faire une analyse à haute résolution sur des émissions spécifiques.
- Pour notre spectre représentatif, nous avons une architecture SiO2 pris en charge, qui contient également C et Pt. Les pics de base Pt, Si, C et O sont étiquetés dans le spectre des relevés (figure 1). En raison de l'omniprésence des molécules d'eau, d'oxygène et d'hydrocarbures dans l'air, on s'attend toujours à ce qu'une certaine quantité de ces molécules soit adsorbéphysiquement ou chimiquement à la surface de n'importe quel échantillon, de sorte qu'un signal C et O est presque toujours attendu.
- Recueillir les spectres caractéristiques de niveau de noyau de votre matériau. Ici, comme le spectre représentatif, nous montrons les pics de division spin-orbite 4f pour Pt.
Résultats
La figure 1 montre un spectre d'arpentage de l'échantillon, montrant clairement les émissions de Pt, Si, C et O. Dans la figure 2, nous voyons l'analyse à haute résolution des pics Pt 4f7/2 et 4f5/2 de l'échantillon. Les énergies de liaison de chacun des pics de niveau de base peuvent être comparées à celles que l'on trouve dans les bases de données telles que celle maintenue par le National Institute of Standards and Technology (NIST) (à https://srdata.nist.gov/xps/Default.aspx). Les changements subtils dans l'énergie de liaison par rapport à ceux des composés de référence dans la base de données peuvent révéler l'état chimique de chacun des éléments de votre échantillon. Le rapport d'intensité des pics révélera la composition de la surface.

Figure 1: Un spectre d'arpentage de l'échantillon, montrant clairement les émissions de Pt, Si, C et O.
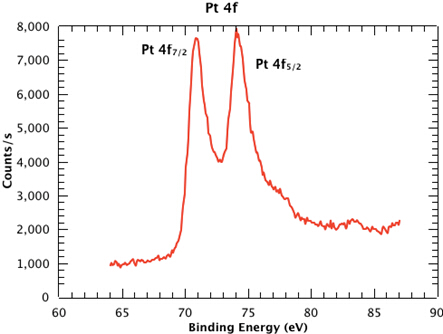
Figure 2: Balayage à haute résolution des picsPt 4f7/2 et 4f5/2 de l'échantillon.
Applications et Résumé
XPS est une technique d'analyse chimique de surface qui est polyvalente dans la gamme d'échantillons qu'il peut être utilisé pour étudier. La technique fournit la quantification de la composition chimique, de l'état chimique et de la structure électronique occupée des atomes dans un matériau.
XPS fournit élémentairement la composition de la surface (dans un délai de 1 à 10 nm habituellement), et peut être utilisé pour déterminer la formule empirique des composés de surface, l'identité des éléments qui contaminent une surface, l'état chimique ou électronique de chaque élément dans le surface, l'uniformité de la composition à travers la surface supérieure et à travers la profondeur (en moudant séquentiellement dans le matériau et en prenant les données XPS de la nouvelle surface exposée).
Régulièrement, XPS est utilisé pour analyser un large éventail de matériaux, par exemple les alliages métalliques, d'autres composés inorganiques tels que la céramique, polymères, semi-conducteurs, catalyseurs, verres, parties de plantes matériaux biologiques tels que les cellules, les os et bien d'autres.
Passer à...
Vidéos de cette collection:

Now Playing
Spectroscopie photoélectronique à rayons X
Materials Engineering
21.9K Vues

Matérialographie optique I : Préparation de l'échantillon
Materials Engineering
15.6K Vues

Matérialographie optique II : Analyse d'image
Materials Engineering
11.1K Vues

Diffraction des rayons X
Materials Engineering
89.6K Vues

Faisceaux d'ions focalisés
Materials Engineering
9.0K Vues

Solidification directionnelle et stabilisation de phase
Materials Engineering
6.7K Vues

Calorimétrie différentielle à balayage
Materials Engineering
38.6K Vues

Diffusivité thermique et méthode du flash laser
Materials Engineering
13.4K Vues

Dépôt électrolytique sur films minces
Materials Engineering
20.2K Vues

Analyse de la dilatation thermique par dilatométrie
Materials Engineering
16.0K Vues

Spectroscopie d'impédance électrochimique
Materials Engineering
23.4K Vues

Matériaux composites à matrice céramique et leurs propriétés de flexion
Materials Engineering
8.4K Vues

Alliages nanocristallins et stabilité de la taille des nano-grains
Materials Engineering
5.2K Vues

Synthèse des hydrogels
Materials Engineering
23.8K Vues