A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי של פנוטיפים עיכוב גדילה מושרה על ידי הבעת effectors סוג חיידקית השלישי שמרים
In This Article
Summary
בסרטון הזה, אנו מתארים הליך הביטוי של effectors סוג החיידק השלישי שמרים זיהוי של מפעיל-Induced פנוטיפים עיכוב צמיחה. פנוטיפים אלו ניתן לנצל לאחר מכן להבהיר פונקציות מפעיל ויעדים.
Abstract
רבים גראם שליליים חיידקים פתוגניים להשתמש במערכת הפרשת סוג השלישי translocate חבילה של חלבונים מפעיל לתוך cytosol של התאים המארחים. בתוך התא, סוג effectors III לחתור לתהליכים מארח הסלולר לדכא תגובות חיסוניות ולקדם צמיחה הפתוגן. רבים סוג effectors השלישי של פתוגנים צמחים ובעלי חיים בקטריאליים זוהו עד כה, אך רק מעטים מהם מאופיינים היטב. הבנת תפקידי effectors אלה כבר ערערו על ידי שילוב של יתירות פונקציונלית ברפרטואר מפעיל של זן חיידקי מסוים, את ההשפעות עדין כי הם עלולים להפעיל להגדיל ארסיות, תפקידים ספציפיים ואולי בשלבים מסוימים זיהום, וקשיים גנטית מניפולציה פתוגנים מסוימים. הביטוי של effectors סוג השלישי השמרים ניצני
Protocol
I. עיצוב מערכת הביטוי שמרים עבור effectors סוג III
כיול מערכת שמרים מתאים ביטוי III סוג מפעיל (ים) של עניין היא משימה חשובה ועשוי לדרוש קצת ניסוי וטעייה. גורמים הרלוונטיות העיקריות שיש לשקול אופטימיזציה בעת תכנון מערכת כזו הם: 1) מקדם נהיגה הביטוי של מפעיל (ים), 2) מספר עותק של הגן מפעיל, 3) את תג epitope להשתמש כדי לאמת את ביטוי חלבון , ו 4) את המתח שמרים.
1) יזם
בגלל חיידקים מסוג effectors III עלולים להיות רעילים לתאי שמרים, האמרגן ועין מתנהלת צריך לשמש כדי לשלוט הביטוי שלהם. האמרגן GAL1 משמש בדרך כלל למטרה זו פעילותה מוסדרת על ידי מקור פחמן הנוכחי במדיום הגידול: היא מודחקת על ידי גלוקוז וגלקטוז המושרה על ידי. עם זאת, מקדם זה היה כפי שדווח דולפים מעט בתנאים מדחיק וכתוצאה מכך רעילות בלתי רצויה. אם הוא נתקל בבעיה דומה, מומלץ לצמצם את מספר עותק של הגן מפעיל כמתואר להלן, או להשתמש היזמים ועין מתנהלת חלופיים, כגון MET3 או CUP1 מקדמי 1. כאן אנו מתארים את נוהלי לביטוי חלבונים מן היזם מפעיל גלקטוז-ועין מתנהלת.
2) ג'ין העתק מספר
פרמטר נוסף המשפיע על רמת ביטוי החלבון הוא מספר עותקים של הגן מפעיל הנוכחי בתא. רמות ביטוי גבוהות מושגות כאשר הגן מפעיל מתבצעת על ידי 2 מיקרון פלסמיד (4-60 עותקים בכל תא). הביטוי ביניים מתקבל באמצעות centromere המכילים פלסמיד (1-3 עותקים לכל תא), ואילו הביטוי נמוך מושגת כאשר הגן מפעיל משולב לתוך הגנום שמרים ידי רקומבינציה הומולוגיים. על ידי שילוב של וקטור centromere המכילים את האמרגן GAL1 שהבענו בהצלחה על 50 effectors של פתוגנים צמח Xanthomonas campestris pv. סיקטור ו Pseudomonas syringae pv. עגבניה ברמות לזיהוי על ידי ניתוח immunoblot עם דליפה אפסית בתנאי דיכוי (סלומון ססה , לא פורסם).
3) epitope תגית
אם נוגדנים נגד מפעיל עניין אינם זמינים, תג epitope מותך לחלבון מפעיל לפקח הביטוי שלה על ידי immunoblot. תגים נפוצים הם myc, hemagglutinin (HA) או דגל, אשר נוגדנים מסחרי אמין זמינים. אנו ממליצים להשתמש רק עותק אחד של התג כדי למזער את השפעות מזיקות בלתי רצויה על מבנה ופעילות של החלבון מפעיל.
4) זן שמרים
דרישה בסיסית עבור זן שמרים לשמש הביטוי auxotrophy את הסמן לבחירה של וקטור ביטוי. חשוב לציין כי זני שמרים שונים עשויים להציג רגישויות שונות לביטוי של effectors מסוימים. לדוגמה, אנו ציין כי BY4741 ו W303 זנים יש רגישויות שונות מספר Xanthomonas campestris pv. סיקטור effectors (סלומון ססה, לא פורסם). לכן, עדיף לבחון את מפעיל (ים) של עניין זני שמרים שונים.
השנייה. הכנת מדיה שמרים
צמיחה של זני שמרים, כי אינם מכילים שום וקטור, להשתמש YPD (10 גר '/ ליטר תמצית שמרים, 20 גרם / L peptone ו -2% [w / v] גלוקוז) כמדיום הגידול. עבור התקשורת מוצק, להוסיף 2% [w / v] אגר לפתרון (אם בינוני מוצק רך מאוד, מוסיפים 0.05% [v / v] מן פתרון 5 מניות NaOH N עד בינוני לפני מעוקר). אנו ממליצים על הכנת בינוני ללא גלוקוז 90% של נפח הסופי מעוקר זה. זמן קצר לפני השימוש, למלא את נפח 100% עם מסנן-מעוקרים 20% פתרון [w / v] גלוקוז (לשמור את הפתרון גלוקוז 20% ב 4 ° C על מנת למנוע זיהום).
צמיחה של זני שמרים המכיל וקטור המספק prototrophy סמן לבחירה (לאוצין, אורציל היסטידין או טריפטופן), שימוש בינוני סינתטי הנשירה ללא לאוצין, אורציל היסטידין ו טריפטופן (6.7 גר '/ ליטר חנקן שמרים ללא בסיס חומצות אמינו , 1.4 גרם / L שמרים סינתטיים הנשירה תוספת בינוני) המכיל 2% [w / v] גלוקוז, או 2% [w / v] גלקטוז ו 1% [w / v] raffinose. עבור התקשורת מוצק, להוסיף 2% [w / v] אגר לפתרון. אנו ממליצים להכין את המדיום 90% של נפח הסופי מעוקר זה. זמן קצר לפני השימוש, למלא את נפח ל -100% פתרון פילטר מעוקרים גלוקוז 20%, או 20% גלקטוז פילטר מעוקר + פתרון raffinose 10%, בהתאם למקור הפחמן הרצוי (לשמור על גלוקוז 20% לבין 20% גלקטוז + פתרונות raffinose 10% ב 4 ° C על מנת למנוע זיהום). בהתאם סמן לבחירה של הביטוי vecטור, להוסיף את חומצות אמינו אחרות או אורציל לפני השימוש (10 מ"ל / L של 1 מ"ל g/100 leucine המניות, 10 מ"ל / L של מלאי mg/100 אורציל 200 מ"ל, 2 מ"ל / L מ 1 g/100 מ"ל מניות היסטידין, או 2 מ"ל / L של מניה 1 g/100 טריפטופן מ"ל). בעת הכנת מניות leucine ו אורציל, לעקר אותם מעוקר לשמור בטמפרטורת החדר. בעת הכנת מניות היסטידין ו טריפטופן, לעקר אותם על ידי סינון, לעטוף את הבקבוק בנייר אלומיניום כדי להגן מפני אור, ולשמור על 4 ° C. בכל ההליכים המתוארים להלן, בינוני סינתטי הנשירה בתוספת לאוצין, אורציל היסטידין ו טריפטופן מיועד כמדיום להשלים סינתטי.
Solid-מדיה צלחות ניתן לאחסן עד שני חודשים 4 ° C. לפני השימוש, לייבש את צלחות עבור 20 דקות בתוך ברדס זרימה למינרית סטרילי בטמפרטורת החדר.
ג. שמרים טרנספורמציה
- לפני תחילת הליך שינוי שמרים, להכין את הדברים הבאים שלושה פתרונות: 50% [w / v] פוליאתילן גליקול (PEG) 3350 פתרון, 1 M-pH = 8.0 LiAc פתרון, ופתרון TE (100 מ"מ טריס pH = 6.85 ו - 10 mM EDTA pH = 8.0). מסנן לעקר את פתרונות ולשמור על 4 ° C.
- באמצעות מוט עץ ארוך או לולאה חיסון סטרילי, לקחת קולוניה שמרים (1-2 מ"מ קוטר) מהצלחת טרי לחסן 3 מ"ל של YPD בתוך צינור פוליפרופילן 15 מ"ל. וורטקס בקצרה. מניחים את הצינור תרבות מכבש ו דגירה לילה בשעה 30 ° C עם רוטציה קבועה.
- בבוקר, להסיר את התרבות מן הגליל, צנטריפוגות ב 800 גרם במשך 5 דקות בטמפרטורת החדר. לאחר צנטריפוגה, להסיר לחלוטין את supernatant.
- Resuspend התאים חיץ 1 מ"ל resuspension (10% [v / v] TE פתרון, 10% [v / v] 1 פתרון M LiAc) ומערבבים על ידי vortexing.
- עבור כל פלסמיד להיות טרנספורמציה שינוי שליטה נוספת, להעביר 100 μl של ההשעיה התא microtube.
- כדי צינור אחד, להוסיף 5 μl של סלמון יחיד גדיל DNA זרע (10 מ"ג / מ"ל) ו - 250-500 ng של DNA פלסמיד להשתנות (למעט הצינור שליטה).
- בזהירות להוסיף μl כל צינור 650 הפתרון שינוי (10% [v / v] TE פתרון, 10% [v / v] 1 פתרון M LiAc, 80% [v / v] 50% [w / v] פתרון PEG ) ו מערבולת.
- לדגור על 30 מעלות צלזיוס למשך 30 דקות על מכבש.
- הסר את הצינורות מן שייקר, הוסף 70 μl של DMSO, ומערבבים על ידי היפוך הצינורות 10-15 פעמים (לא מערבולת כדי למנוע שבירת תאים).
- מניחים את צינורות 42 ° C טרום חימם אמבט מים דגירה במשך 15 דקות.
- הסר את הצינורות מן האמבט במים מיד ומניחים אותם על קרח דק '2.
- לאחר הצינורות יש התקרר, צנטריפוגה אותם 800 גרם 5 דקות בטמפרטורת החדר.
- קח את הצינורות מתוך microcentrifuge ובזהירות להסיר את supernatant צמיג באמצעות pipettor.
- Resuspend התא גלולה של הצינור כל 150 μl של מים מזוקקים סטרילי כפול (DDW), ולהפיץ את ההשעיה תא בצלחת בינוני סינתטי מלא המכיל 2% גלוקוז כמקור פחמן וללא חומצות אמינו או נוקליאוטידים אשר פלסמיד מספקת prototrophy.
- השאירו הצלחות פתוח 2 דקות ולאפשר להם להתייבש במנדף זרימה למינרית. מניחים את הלוחות של 30 ° C חממה 2-3 ימים.
- מושבות פעם (1-2 מ"מ קוטר) הופיעו על הצלחות, לאסוף כ 10 מושבות אחת מן התמורה כל ולהעבירם צלחת טריים. בעת העברת המושבות, לבצע תיקוני 2 ס"מ X 2 ס"מ, כדי לאפשר צמיחה של כמות גדולה של תאים שמרים. דגירה הצלחות באינקובטור ב 30 מעלות צלזיוס במשך יומיים.
- כאשר את התיקונים שמרים גדלו, להסיר את הצלחות מן החממה לאטום אותם עם parafilm. פלטות ניתן לאחסן 4 ° C. העברת מושבות לצלחת טריים כל 10-14 ימים.
IV. הכנת תמצית שמרים חלבון כדי לוודא ביטוי על ידי מפעיל Immunoblot
- פיק מושבה שמרים (1-2 מ"מ קוטר) מהצלחת טריים צינור פוליפרופילן 15 מ"ל המכיל 3 מ"ל של המדיום המתאים להשלים סינתטי בתוספת 2% גלוקוז כמקור פחמן ללא חומצה אמינית נוקלאוטיד או שאליו פלסמיד הבחירה מספק prototrophy. מניחים את הצינור תרבות מכבש ו דגירה לילה בשעה 30 ° C.
- ביום שלאחר מכן, להסיר את התרבות מן הגליל, צנטריפוגות ב 800 גרם במשך 5 דקות בטמפרטורת החדר. הסר את הצינורות מן בצנטריפוגה וזורקים supernatant.
- Resuspend התא גלולה ב 3 מ"ל של DDW סטרילי ומערבבים ידי vortexing.
- צנטריפוגה שוב, להשליך תאים supernatant ו resuspend ב 3 מ"ל של DDW סטרילית.
- העברת 200 μl של השעיה לתא צינור חדש 15 מ"ל המכיל 3 מ"ל של מדיום להשלים סינתטי גלקטוז בתוספת 2% ו 1% raffinose כמקור פחמן, ללא חומצת האמינו או נוקלאוטיד שאליו פלסמיד הבחירה מספק prototrophy.מערבבים על ידי vortexing, מקום מכבש, ו דגירה לילה בשעה 30 ° C.
- בבוקר שלאחר מכן, להעביר 1 מ"ל של התרבות (או יותר עבור תרבויות בצפיפות נמוכה) כדי microtube. קציר התאים על ידי צנטריפוגה ב 800 גרם 5 דקות בטמפרטורת החדר.
- מכאן ואילך, עבודה במנדף קטר להימנע נשימה β-mercaptoethanol אדים רעילים. הסר בזהירות את supernatant באמצעות pipettor ו resuspend התא גלולה ב 100 μl של פתרון קרים כקרח תמוגה (4% [v / v] 5 N NaOH, 0.5% [v / v] β-mercaptoethanol). מערבבים נמרצות על ידי vortexing ו לדגור על קרח למשך 30 דקות.
- במהלך הדגירה, לקבוע את עוצמת הקול של HCl (6 N) נדרש titering 100 μl של חיץ תמוגה ל-pH 9-10. לשם מטרה זו, מקום 10 microtubes ב μl 100 מתלה והעברת למאגר תמוגה לתוך כל אחד מהם. הוסף כרכים שונים (1-10 μl) של HCl (6 N) על צינור אחד ומערבבים ידי vortexing. קחו לדוגמה לבדוק את ה-pH של התמיסה באמצעות רצועת אינדיקטור pH.
- בסוף הדגירה, מוסיפים את נפח HCl נקבע בשלב הקודם כדי lysate ומערבבים ידי vortexing (דיוק טוב יותר, במקום הפתרון HCl בצד של הצינור ללא החדרת קצה לתוך lysate).
- הוסף 50 μl של חיץ מדגם 3x (30% [v / v] גליצרול, 15% [v / v] β-mercaptoethanol, 37.5% [v / v] 500 מ"מ טריס-HCl pH = 6.8, 0.15% [w / v ] נתרן סולפט dodecyl [SDS] ו גרגרי כחול bromophenol) כדי lysate ומערבבים ידי vortexing (אם הפתרון הופך צהוב, זה אומר כי ה-pH נמוך מדי, microliters כמה הפתרון תמוגה יש להוסיף עד הפתרון הופך כחול).
- מרתיחים את הפתרון lysate 5 דקות על בלוק חימום לאחר ניקוב חור השער של microtube עם מחט.
- הסר את microtube מהגוש חימום לאפשר פתרון להתקרר במשך 2 דקות בטמפרטורת החדר.
- וורטקס הפתרון lysate ואז לסובב אותו למשך 10 שניות. טען 30 μl על ג'ל SDS-PAGE לניתוח immunoblot.
V. אכון assay לזהות מפעיל-Induced פנוטיפים עיכוב גדילה
- מתוך צלחת מתוקים לבחור המושבה שמרים (1-2 מ"מ קוטר) נושאת את הביטוי פלסמיד עניין לחסן, בתוך שפופרת 15 מ"ל פוליפרופילן, 3 מ"ל של מדיום להשלים סינתטי בתוספת 2% גלוקוז כמקור פחמן ללא אמינו חומצה או נוקלאוטיד שאליו פלסמיד ביטוי מספק prototrophy. חזור על אותו תהליך עבור זן שמרים השליטה נושאת פלסמיד ריק. מניחים את צינורות תרבות מכבש ו דגירה לילה בשעה 30 ° C עם רוטציה קבועה.
- ביום שלאחר מכן, להסיר את תרבויות מן הגליל, צנטריפוגות ב 800 גרם במשך 5 דקות בטמפרטורת החדר. הסר את הצינורות מן בצנטריפוגה וזורקים supernatant.
- Resuspend התא גלולה ב 3 מ"ל של DDW סטרילי ומערבבים ידי vortexing.
- חזור על השלב צנטריפוגה ותאי resuspend ב 3 מ"ל של DDW סטרילית.
- כדי לקבוע את צפיפות אופטית (OD), להעביר 100 μl של התרבות לכל microtube המכיל 900 μl DDW מערבולת ו. יוצקים את התוכן של החצוצרות לתוך קובט פלסטיק למדוד את ספיגת באורך גל של 600 ננומטר (להשתמש כהפניה קובט מלא 1 מ"ל של DDW). חישוב OD 600 של התרבויות הראשוני על ידי הכפלת OD 600 של תרבויות קובט בפקטור דילול של 10.
- בשלב הבא, המבוסס על OD 600 של התרבויות הראשוני, להכין השעיות התא (1 מ"ל) עם OD 600 = 1.0 microtubes סטרילית.
- באמצעות 3 microtubes סטרילי מלא DDW 900 μl סטרילי, להכין שלושה 10 פי דילולים סדרתי (OD 600 = 0.1, 0.01 ו - 0.001) מ השעיית כל תא (OD 600 = 1.0) מוכן בשלב הקודם.
- הכינו שתי צלחות המכילות בינוני להשלים סינתטי ללא חומצות אמינו או נוקליאוטידים שאליו פלסמיד הבחירה מספק prototrophy. המדיום של צלחת אחד צריך להיות גלוקוז בתוספת 2% וכי הצלחת אחרים עם גלקטוז 2% ו raffinose 1%. יבש את צלחות ברדס זרימה למינרית סטרילי בטמפרטורת החדר למשך 20 דקות ומניחים אותם על רשת.
- עבור כל תרבות, מקום 10 μl מארבע דילולים בשורה על שניהם לדכא ואת גרימת התקשורת.
- לאחר תצפית, השאר את הצלחות לפתוח את מכסה המנוע במשך כמה דקות. כאשר כתמים יבשים, לכסות את צלחות למקם אותם 30 ° C בחממה במשך 2-3 ימים.
- לאחר דגירה, להוציא את צלחות לנתח גידול השמרים. ראשית, ודא כי צפיפות התאים דומים על הצלחת המכיל בינוני הדחקה. לאחר מכן, להשוות את צמיחת התרבות המבטא את החלבון מפעיל עניין עם התרבות נושאת וקטור ריק על הצלחת המכיל גרימת בינוני.
הערה: effectors למקד תהליכים תאיים שאינם הגבלת שיעור הצמיחה שמרים בתנאים צמיחה תקן מעבדה.כדי לאפשר זיהוי של פנוטיפים עיכוב הצמיחה effectors כזה, התקשורת גרימת ניתן להוסיף תרכובות לשנות פונקציות שמרים הסלולר, ובכך להגדיל את רגישותם effectors. לקבלת רשימה של כימיקלים יכולים להשתלב בהליך זה, עיין פרסונס et al. (2004) 2.
VI. נציג תוצאות
שמרים נציג assay באיתור וזיהוי של עיכוב פנוטיפים צמיחה המושרה על ידי ביטוי effectors סוג III מוצגות באיור. 1. בניסוי זה, השלישי סוג effectors AvrPto, HopAA1-1 ו AvrE1 של חיידק גראם שליליים phytopathogenic עגבניות Pseudomonas syringae. Pv (PST) באו לידי ביטוי מתוך pGML10 centromere המכילים פלסמיד ב זן שמרים BY4741, ונבדק על יכולתם כדי לעכב את הצמיחה שמרים. תרבויות שמרים הפרט להביע Pst סוג effectors III תחת שליטה של האמרגן GAL1 ועין מתנהלת גלקטוז או המכיל וקטור ריק היו בדילול סדרתי מצופה על הדחקה (גלוקוז) או גרימת (גלקטוז) מדיה (איור 1). על הדחקה בינוני, זני שמרים נושאים פלסמידים לביטוי של AvrPto ו HopAA1-1 הציג גידול דומה למתח הבקרה המכיל וקטור ריק. זאת על המדיום זהה, שמרים נושאת AvrE1 הציגה צמיחה מופחת מעט, כנראה קשור במידה מסוימת של דליפה של האמרגן GAL1 ו לאפקט ציטוטוקסיות גבוהה של AvrE1. בתנאים גרימת, ביטוי AvrE1 מפעיל גרם צמיחה דרסטית עיכוב פנוטיפ לידי ביטוי חוסר מושבות דילול כלשהו. כפי שנצפה קודם לכן על ידי Munkvold et al. 3, ביטוי HopAA1-1 הביא גם עיכוב חמור של צמיחה, בעוד AvrPto לא הראו כל השפעה.
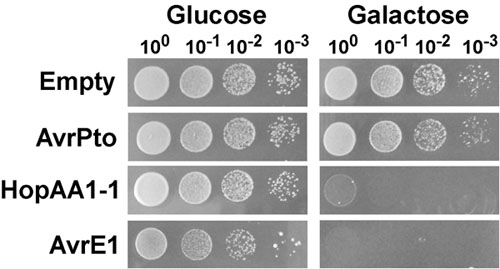
באיור 1. גידול שמרים עיכוב שנגרם על ידי ביטוי של העגבניות syringae Pseudomonas. Pv (PST) סוג III effectors AvrE1 ו HopAA1-1. זני שמרים (BY4741) המכיל את pGML10 פלסמיד, או ריק או נשיאת GAL1 מונחה קלטות לביטוי גלקטוז-ועין מתנהלת של AvrPto , HopAA1-1 או AvrE1, גדלו לילה שלם בינוני סינתטי בתוספת גלוקוז (2%) כמקור פחמן, חסר לאוצין. תרבויות נשטפו, מנורמל ל OD 600 = 1.0 ו - 10 סדרתי פי דילולים נראו על גבי מדיה סינתטי מוצק להשלים חסר לאוצין וגלוקוז המכיל (2%), או גלקטוז (2%) ו raffinose (1%). התמונות צולמו לאחר 2 ו - 3 ימים של צמיחה בקצב של 30 ° C עבור שמרים הגדלים גלוקוז וגלקטוז התקשורת, בהתאמה.
Discussion
במצגת זו, הדגמנו כיצד להשתמש cerevisiae Saccharomyces נבגי שמרים כמערכת Heterologous לביטוי של חלבונים מסוג III מפעיל חיידקים כיצד לזהות מפעיל-Induced עיכוב פנוטיפים צמיחה. חשוב לציין, פנוטיפים אלה יכול להיות מנוצל על מסכי גנטית כדי לזהות מדכאי של ההשפעה השלילית של effectors על צמיחת שמרי...
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדע.
Materials
| Name | Company | Catalog Number | Comments |
| Yeast extract | Difco Laboratories | 212750 | |
| Peptone | Difco Laboratories | 211677 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| Agar | Difco Laboratories | 214010 | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S8045 | |
| Yeast nitrogen base w/o amino acids | Difco Laboratories | 291940 | |
| Yeast synthetic drop-out medium supplement | Sigma-Aldrich | Y2001 | |
| D-galactose | Sigma-Aldrich | G0750 | >99%; <0.1% glucose |
| D-raffinose | Sigma-Aldrich | R0250 | >98% |
| L-leucine | Sigma-Aldrich | L8000 | |
| Uracil | Sigma-Aldrich | U0750 | |
| L-tryptophan | Sigma-Aldrich | T0254 | |
| L-histidine | Sigma-Aldrich | H6034 | |
| DNA, single stranded, from salmon testes | Sigma-Aldrich | D7656 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D5879 | Desiccate |
| Hydrochloric acid (HCl) | Sigma-Aldrich | H1758 | |
| Polyethylene glycol (PEG) 3350 | Sigma-Aldrich | P4338 | |
| Lithium acetate (LiAc) | Sigma-Aldrich | L4958 | |
| Tris (base) | JT Baker | 4109-02 | |
| Ethylenediamine-tetraacetic acid (EDTA) | Sigma-Aldrich | E5134 | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| Bromophenol blue | Sigma-Aldrich | B6131 | |
| Dodecyl sulfate sodium salt (SDS) | Merck & Co., Inc. | 8.22050.1000 | |
| Centrifuge tubes (15 ml) | Corning | 430052 | Sterile |
| Spectrophotometer cuvette (10x4x45 mm) | Sarstedt Ltd | 67.742 | |
| Inoculation loop | Sigma-Aldrich | Z643009 | Sterile |
| Parafilm | Sigma-Aldrich | P7543 | |
| pH indicator strip, pH 6.5-10.0 | Merck & Co., Inc. | 1.09543.0001 |
References
- Siggers, K. A., Lesser, C. F. The yeast Saccharomyces cerevisiae: a versatile model system for the identification and characterization of bacterial virulence proteins. Cell Host Microbe. 4, 8-15 (2008).
- Parsons, A. B. Integration of chemical-genetic and genetic interaction data links bioactive compounds to cellular target pathways. Nat. Biotechnol. 22, 62-69 (2004).
- Munkvold, K. R., Martin, M. E., Bronstein, P. A., Collmer, A. A survey of the Pseudomonas syringae pv. tomato DC3000 type III secretion system effector repertoire reveals several effectors that are deleterious when expressed in Saccharomyces cerevisiae. Mol. Plant-Microbe Interact. 21, 490-502 (2008).
- Curak, J., Rohde, J., Stagljar, I. Yeast as a tool to study bacterial effectors. Curr. Opin. Microbiol. 12, 18-23 (2009).
- Slagowski, N. L., Kramer, R. W., Morrison, M. F., LaBaer, J., Lesser, C. F. A functional genomic yeast screen to identify pathogenic bacterial proteins. PLoS Pathog. 4, e9-e9 (2008).
- Huang, J., Lesser, C. F., Lory, S. The essential role of the CopN protein in Chlamydia pneumoniae intracellular growth. Nature. 456, 112-115 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved